- Радиус атома
- Период, группа и электронная конфигурация
- Длина связи
- Металлические и неметаллические свойства
- Основные и кислотные свойства
- Восстановительные и окислительные свойства
- Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
- Высшие оксиды и летучие водородные соединения (ЛВС)
- Общая характеристика металлов побочных подгрупп (d -металлов)
- Сравнение d -металлов с щел. Me и щел.-зем. Me
- Возможные валентности и степени окисления
- Положение в ПСЭ. Электронное строение атомов
- Способность к комплексообразованию
- Окислительно-восстановительные свойства d-металлов и их соединений
- Кислотно-основные свойства оксидов и гидроксидов d-металлов
- Электроотрицательность. Степень окисления и валентность химических элементов
- Степень окисления химических элементов и ее вычисление
- Валентность. Валентные возможности атомов
- Валентные возможности водорода
- Валентные возможности углерода
- Валентные возможности азота
- Валентные возможности фосфора
- Валентные возможности кислорода
- Валентные возможности серы
- Неорганическая химия: металлы побочных подгрупп
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
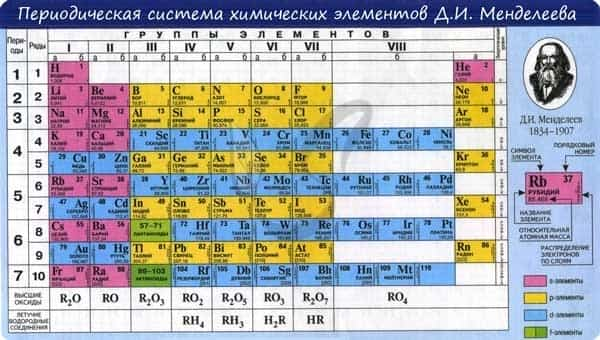
В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в «строки и столбцы» — периоды и группы.
Период — ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов. 4, 5, 6 — называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
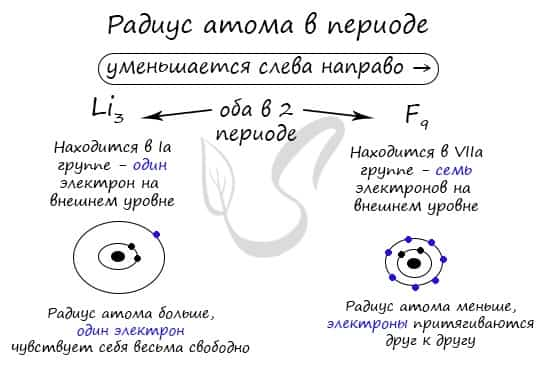
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
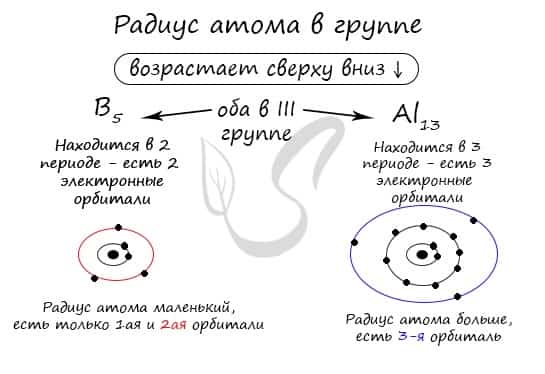
В группе радиус атома увеличивается с увеличением заряда атомных ядер — сверху вниз «↓». Чем больше период, тем больше электронных орбиталей вокруг атома, соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается — снизу вверх «↑». Это связано с уменьшением количества электронных орбиталей вокруг атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.
Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня. Так у бора на внешнем уровне расположены 3 электрона, у алюминия — тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует — там нужно считать электроны «вручную», располагая их на электронных орбиталях.
Раз уж мы повели речь об электронных конфигурациях, давайте запишем их для бора и алюминия, чтобы лучше представлять их внешний уровень и увидеть то самое «сходство»:
- B5 — 1s22s22p1
- Al13 — 1s22s22p63s23p1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns2np1. Это будет работать для бора, внешний уровень которого 2s22p1, алюминия — 3s23p1, галия — 4s24p1, индия — 5s25p1 и таллия — 6s26p1. За «n» мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода — и вот быстро получена конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже ?
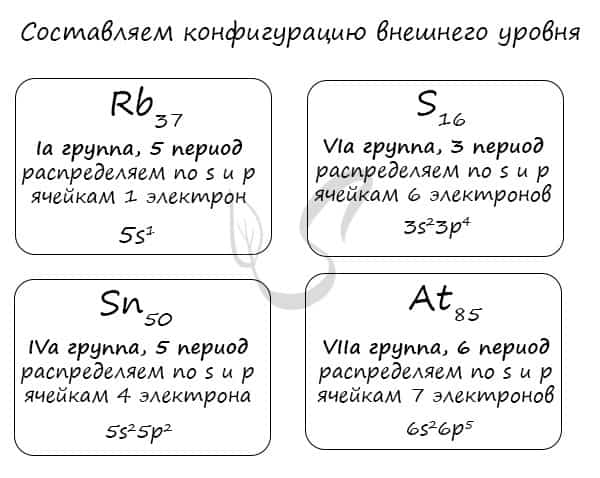
Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен, вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных — только «вручную».
Длина связи
Длина связи — расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую. Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
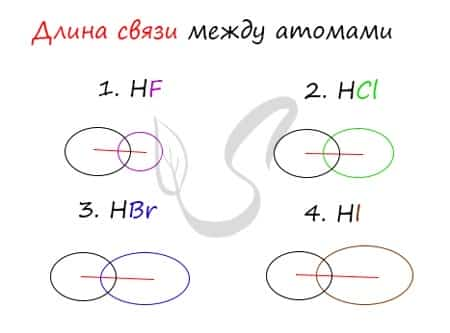
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
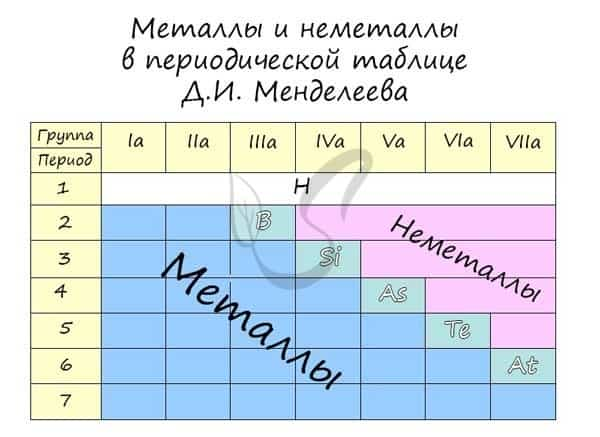
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические — усиливаются (слева направо «→»). В группе с увеличением заряда атома металлические свойства усиливаются, а неметаллические — ослабевают (сверху вниз «↓»).
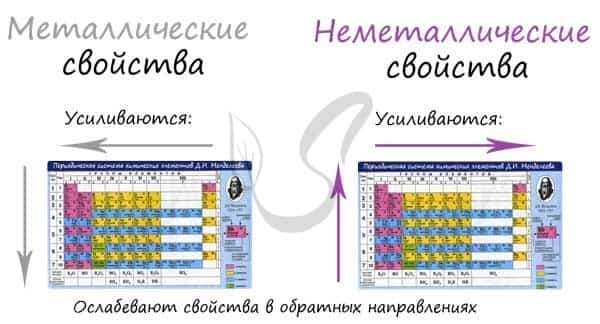
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны — у него самые слабые неметаллические свойства. Сера обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера — самый сильный неметалл.
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева — металлы.
Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные — возрастают. В группе с увеличением заряда атома основные свойства усиливаются, а кислотные — ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются, вторые — убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.
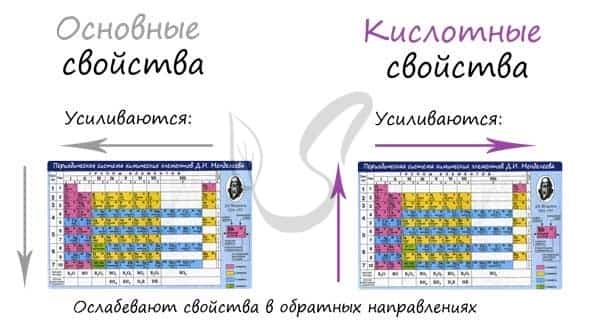
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF — самая слабая из этих кислот, а HI — самая сильная.

Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные — усиливаются. В группе с увеличением заряда атома восстановительные свойства усиливаются, а окислительные — ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные — с неметаллическими и кислотными. Так гораздо проще запомнить ?
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность — способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны). Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает к себе электроны и уходит в отрицательную степень окисления со знаком минус «-«.
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева — это фтор.
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости «синонимичны» также понятия сродства к электрону — энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации — количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы — R2O3. Напишем высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3, Ga2O3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в «-» отрицательную СО. Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы — 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.
Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко найдете формулы других ЛВС VI группы: серы — H2S, H2Se, H2Te, H2Po.
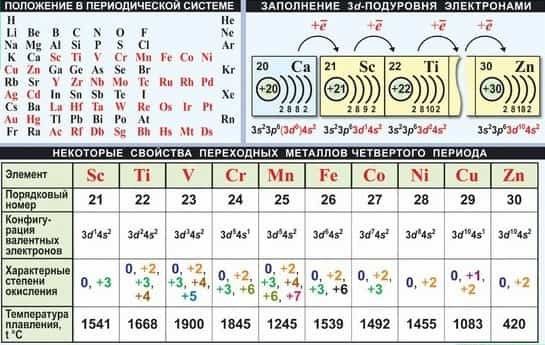
Общая характеристика металлов побочных подгрупп (d -металлов)
Все элементы побочных подгрупп ПСЭ относятся к электронному семейству d-элементови являются металлами.
Находясь только в больших периодах (IV, V, VI), d-элементы образуют «вставные декады» (по 10 элементов) между s- и р- элементами, поэтому имеют общее название — переходные элементы.
Кроме этих 30 d-элементов, имеющих стабильные изотопы, искусственно синтезированы несколько радиоактивных d- элементов, занимающих свои места внезавершенном VII периоде.
В атомах d-элементов содержится от 1 до 10 электронов на d-подуровне предвнешнего электронного слоя и 2 (или 1 в случае проскока е-) электрона на s-подуровне внешнего электронного слоя. Общая формула электронной конфигурации валентных подуровней в атомах d -элементов.
Сравнение d -металлов с щел. Me и щел.-зем. Me
В каждом большом периоде d-элементы располагаются после двух s-элементов, которые являются щелочным и щелочноземельным металлами:
| Щелочные металлы | Щелочно-земельные металлы | d-металлы |
| Радиусы атомов уменьшаются | ||
| Заряды ядер атомов увеличиваются |
Поэтому d-металлы являются менее активными, чем щелочные и щелочноземельные металлы.
Возможные валентности и степени окисления
Вотличие от щелочных и щелочноземельных Me, большинство d-металлов имеют переменную валентность и переменную степень окисления. Это объясняется тем, что валентными в атомах d-элементовявляются не только s-электроны внешнего слоя, но и все или некоторые d -электроны предвнешнего слоя.
Положение в ПСЭ. Электронное строение атомов
Для d-металлов III — VII групп высшая Ви высшая С.О. равны номеру группы, т. е. суммарному числу е- на (n -1)d и ns-подуровнях; например у d -элементов четвертого периода:
| № группы | III | IV | V | VI | VII |
| Элемент | Sc | Ti | V | Cr | Mn |
| Электронная конфигурация | 3d14s2 | 3d24s2 | 3d34s2 | 3d54s2 | 3d54s2 |
| Высшая валентность | III | IV | V | VI | VII |
| Высшая степень окисления | +3 | +4 | +5 | +6 | +7 |
Для d-металлов VIII группы высшая В и высшая с о., как правило, меньше суммарного числа е- на (n — 1)d и ns -подуровнях;
например:
| № группы | VIII | ||
| Элемент | Fe | Co | Ni |
| Электронная конфигурация | 3d64s2 | 3d74s2 | 3d84s2 |
| Высшая валентность | VI | III | III |
| Высшая степень окисления | +6 | +3 | +3 |
d-Металлы II группы, атомы которых имеют завершенную структуру d-подуровня (n -1)d10, проявляют в своих соединениях постоянную В = II и постоянную с.о. = +2.
Наиболее характерными валентностями и степенями окисления для d-металлов I группы являются: Сu — II и +2; Ag — I и +1; Au — III и +3.
Способность к комплексообразованию
Важной особенностью атомов d-металлов является наличие свободных орбиталей (на (n — 1)d -, ns — образованию и nр-подуровнях), что позволяет им образовывать донорно-акцепторные (координационные) связи с различными донорами неподеленных электронных пар (молекулы NH3, Н2O, ионы ОН-, CN- и др.).
- Вследствие этого d-металлы образуют многочисленные и разнообразные комплексные соединения; например:
- [Co(NH3)6]CI3, K4[Fe(CN)6],
- Na2[Zn(OH)4), [Cr(H2O)6](NО3)3
В свободном состоянии d -металлы (как и вообще все металлы) являются восстановителями.
Восстановительная активность различных d — металлов изменяется в широких пределах: среди них есть металлы средней активности, находящиеся в ряду напряжений до водорода (Fe, Cr , Zn , Mn и др.
); малоактивные металлы (Сu, Нg и др.) и благородные металлы (Au , Pt и др.), располагающиеся в ряду напряжений после водорода.
Окислительно-восстановительные свойства d-металлов и их соединений
- Соединения d-элементов могут выполнять как восстановительные, так и окислительные функции. Соединения с невысокими степенями окисления являются восстановителями, а соединения с высокими степенями окисления — окислителями;
- например:
- MnSO4, FeCl2 , CrCl2 — восстановители
- КMnO4, K2FeO4, K2Cr2O7 — сильные окислители
Кислотно-основные свойства оксидов и гидроксидов d-металлов
При увеличении степени окисления металла основной характер оксидов и гидроксидов ослабляется, а кислотный характер усиливается:
| Me+12O | Me+2O | Me+32O3 | Me+4O2 | Me+52O5 | Me+6O3 | Me+72O7 |
| MeOH | Me(OH)2 | Me(OH)3H3MeO3(HMeO2) | Me(OH)4H4MeO4(H2MeO3) |
|
|
HMeO4 |
| основные свойства | амфотерные свойства | кислотные свойства |
Электроотрицательность. Степень окисления и валентность химических элементов
Электроотрицательность (ЭО) – свойство атомов элементов оттягивать на себя электроны от другого атома в соединении.
На ЭО влияет несколько факторов: радиус атома и расстояние между ядром и валентными электронами. Численные значения ЭО приблизительные. Часто используют шкалу определения ЭО по Полингу.
Относительная электроотрицательность атомов элементов по Полингу
Анализируя данную шкалу можно выявить ряд закономерностей, перекликающихся с периодическим законом (ПЗ).
- В периодической системе химических элементов (ПСХЭ) ЭО в периоде увеличивается слева направо и уменьшается в главной подгруппе.
- ЭО связана с окислительно-восстановительными свойствами элементов, поэтому типичные неметаллы характеризуются высокой ЭО, а металлы – низкой. Самая высокая ЭО у фтора, потому что он самый сильный окислитель.
В зависимости от значения электроотрицательности образуются вещества с различным видом химической связей: если между атомами нет разности в электроотрицательности, образуются простые вещества (состоящие из одного вида атомов), чем больше разность, тем полярность молеклы возрастает: образуются молекулы веществ с полярной связью и ионной связью.
Степень окисления химических элементов и ее вычисление
- Степень окисления(СО) – условный заряд атомов химических элементов в соединении на основании того, что все связи ионные.
- Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно помещается над символом элемента в верхней части.
- При определении СО следует руководствоваться следующими правилами:
- Сумма СО в химическом соединении всегда равна нулю, так как молекулы электронейтральны; в сложном ионе соответствует заряду иона.
- СО всех простых веществ соответствует нулю;
- Высшая положительная СО определяется по номеру группы; низшая отрицательная равна восемь минус номер группы;
- Элементы с наибольшей ЭО имеют отрицательную СО, с наименьшей – положительную;
- Постоянную СО имеют фтор (-1), щелочные металлы (+1), щелочноземельные, а также бериллий, магний, цинк (+2), алюминий (+3). У кислорода СО равна -2, исключение пероксиды (+2). У водорода +1, исключение соединения с металлами (гидриды) -1.
Применяя эти правила можно рассчитать степени окисления элементов в сложном веществе.
К примеру, определим степени окисления элементов в фосфорной кислоте H3PO4.
- Найдем и проставим известные степени окисления у водорода и кислорода, а СО фосфора примем за «х». — H+13 PX O-24
- Используя эти значения составим и решим уравнение с одной неизвестной. (+1) * 3 + (x) * 1 + (-2) * 4 = 0 Следовательно, x=5 или +5. Таким образом, СО у фосфора +5.
Рассчитаем степени окисления у элементов в нитрате алюминия Al(NO3)3.
- Проставим известные СО элементов – алюминий и кислород, у азота примем СО за «x». Al+3 (NxO-23)3
- Составим и решим уравнение — (+3) * 1 + 3x + 9 * (-2) = 0. В итоге получаем x=+5, то есть СО у азота в соединении +5.
Валентность. Валентные возможности атомов
Валентность — это способность атома присоединять ряд других атомов для образования химической связи.
Валентность может быть определена числом химических связей, образующих атом, или числом неспаренных электронов.
Валентность обозначается римскими цифрами и указывается над химическим элементом справа вверху и не имеет знака (+ или -). Может быть постоянной или переменной.
Для определения валентности применяются определенные правила:
- У металлов главных подгрупп валентность всегда постоянная и определяется по номеру группы.
- У металлов побочных подгрупп и неметаллов валентность переменная. Высшая валентность = номеру группы, а низшая = 8 — номер группы.
Валентность может совпадать со степенью окисления, но не имеет знака «+» или «-», не может быть равна нулю.
Валентные возможности атомов могут определяться:
- Количеством неспаренных электронов;
- Наличием свободных орбиталей;
- Наличием неподеленных пар электронов.
Валентные возможности водорода
Валентные возможности водорода определяются одним неспаренным электроном на единственной орбитали. Водород обладает слабой способностью отдавать или принимать электроны, поэтому для него характерны в основном ковалентные химические связи. Ионные связи он может создавать с металлами, образуя гидриды. Ковалентные химические связи образуются за счет общих электронных пар. Поскольку у водорода всего один электрон, он способен образовывать только одну связь. По этой причине для него характерна валентность равная I.
Валентные возможности углерода
На внешнем энергетическом уровне у углерода 4 электрона: 2 спаренных и 2 неспаренных. Это состояние атома называется основным. По числу неспаренных электронов можно сказать, что углерод проявляет валентность равную II. Однако такая валентность проявляется только в некоторых соединениях.
В органических соединениях и некоторых органических веществах углерод проявляет валентность равную IV. Эта валентность характерна для возбужденного состояния С. Из основного в возбужденное состояние он может переходить при получении дополнительной энергии. Один электрон с s-подуровня переходит на p-подуровень, где есть свободная орбиталь.
Атом С способен присоединять и отдавать электроны с образованием ковалентных связей. Валентные возможности углерода очень широкие, он может принимать значение степени окисления от +4 до -4.
Валентные возможности азота
У азота на валентном энергетическом уровне находится 5электронов: 3 неспаренных и 2 спаренных. Исходя из этого, валентность азота может быть равна III. В возбужденное состоянии атом азота не может переходить. Однако азот может выступать в качестве донора при образовании ковалентных химических связей, обеспечивая своей электронной паре атом, имеющий свободную орбиталь. В этом случае валентность у азота будет равна IV, причем для азота, как элемента пятой группы, это максимальная валентность. Валентность V он проявлять не способен.
Валентные возможности фосфора
В отличие от азота, фосфор имеет свободные 3d-орбитали, на которые могут переходить электроны. На внешнем энергетическом уровне находятся 3 неспаренных электрона.
Атом фосфора способен переходить из основного состояния в возбужденное. Электроны с p-подуровня переходят на d-подуровень. В этом случае атом Р приобретает валентность, равную V.
Таким образом, строение электронной оболочки атома увеличивает валентные возможности Р, по сравнению с азотом, от I до V.
Валентные возможности кислорода
На последнем энергетическом уровне у кислорода 2 неспаренных электрона. В соединениях чаще всего проявляет валентность II. У кислорода нет d-подуровня, поэтому переход электронов невозможен. Валентные возможности очень ограничены – проявляет II и III валентности.
Валентные возможности серы
Сера, так же, как и кислород, р в VI группе главной подгруппе ПСХЭ. Поэтому на валентном энергетическом уровне у серы 2 неспаренных электрона. Напрашивается вывод, что валентность серы равна II.
Однако у серы есть и d-подуровень, который расширяет ее валентные возможности. Сера способна переходить из основного состояния в возбужденное, при этом может быть либо 4 неспаренных электрона, либо 6.
- Таким образом, сера способна проявлять валентности II, IV, VI.
- Опираясь на этот материал, можно определить все возможные валентности для любого химического элемента.
- Смотри также:
Неорганическая химия: металлы побочных подгрупп
Общая характеристика подгруппы хрома
Элементы подгруппы хрома занимают промежуточное положение в ряду переходных металлов. Имеют высокие температуры плавления и кипения, свободные места на электронных орбиталях.
Элементы хром и молибден обладают нетипичной электронной структурой – на внешней s-орбитали имеют один электрон (как у Nb из подгруппы VB). У этих элементов на внешних d– и s-орбиталях находится 6 электронов, поэтому все орбитали заполнены наполовину, т. е. на каждой находится по одному электрону.
Имея подобную электронную конфигурацию, элемент обладает особенной стабильностью и устойчивостью к окислению. Вольфрам имеет более сильную металлическая связь, нежели молибден. Степень окисления у элементов подгруппы хрома сильно варьирует.
В надлежащих условиях все элементы проявляют положительную степень окисления от 2 до 6, максимальная степень окисления соответствует номеру группы. Не все степени окисления у элементов стабильны, у хрома самая стабильная – +3.
Все элементы образуют оксид MVIO3, известны также оксиды с низшими степенями окисления. Все элементы данной подгруппы амфотерны – образуют комплексные соединения и кислоты.
Хром, молибден и вольфрам востребованы в металлургии и электротехнике. Все рассматриваемые металлы покрываются пассивирующей оксидной пленкой при хранении на воздухе или в среде кислоты-окислителя. Удалив пленку химическим или механическим способом, можно повысить химическую активность металлов.
Хром. Элемент получают из хромитной руды (Fe(CrO_2)_2), восстанавливая углем: (Fe(CrO_2)_2+4C=(Fe+2Cr)+4CO).
Чистый хром получают восстановлением (Cr_2O_3) с помощью алюминия или электролиза раствора, содержащего ионы хрома. Выделяя хром с помощью электролиза, можно получить хромовое покрытие, используемое в качестве декоративных и защитных пленок.
Из хрома получают феррохром, применяемый при производстве стали.
Молибден. Получают из сульфидной руды. Его соединения используют при производстве стали. Сам металл получают при восстановлении его оксида. Прокаливая оксид молибдена с железом, можно получить ферромолибден. Используют для изготовления нитей и трубок для обмотки печей и электроконтактов. Сталь с добавлением молибдена используют в автомобильном производстве.
Вольфрам. Получают из оксида, добываемого из обогащенной руды. В качестве восстановителя используют алюминий или водород. Получившийся вольфрам в идее порошка впоследствии формуют при высоком давлении и термической обработке (порошковая металлургия). В таком виде вольфрам используют для изготовления нитей накаливания, добавляют к стали.
Хром
Хром (Cr) – d-элемент расположенный в 4-м периоде, в VI группе побочной подгруппы. Высшая степень окисления – +6. В соединениях может проявлять степень окисления от + до +6, но наиболее характерными для хрома является степень окисления +3 и +6. В остальных степенях окисления соединения хрома неустойчивы.
Физические свойства: хром – серовато-белый металл с характерным металлическим блеском. Природный хром состоит из смеси 5 изотопов: 50, 52, 53, 54, 56. Это самый твердый из всех известных металлов, его плотность (7,2~г/см^3). Температура плавления – 1855°C, температура кипения – 2642°C. При обычной температуре хром устойчив к воздействию воды и воздуха.
Химические свойства: электронная конфигурация: (1s^22s^22p^23s^23p^63d^54s^1). В образовании химических связей хрома участвуют не только электроны внешнего 4 уровня, но и электроны предпоследнего уровня – 3d-подуровня.
- При высокой температуре хром горит в кислороде: (4Cr+3O_2=2Cr_2O_3).
- Раскаленный хром реагирует с парами воды, вытесняя из нее кислород: (2Cr+3H_2O=Cr_2O_3+3H_2)
- При нагревании реагирует с галогеноводородами, (S,~N_2,~P_4,~C,~Si,~B)
- С галогенами реагирует не одинаково:
- а) со фтором взаимодействует даже на холоде: (Cr+3F_2=CrF_6);
- б) с хлором реагирует при нагревании: (2Cr+3Cl_2=2CrCl_3).
Разбавленная соляная и серная кислоты растворяют хром с выделением водорода, а в холодной азотной он пассивируется. Хром образует три оксида: (CrO,~Cr_2O_3 ) и (CrO_3).
Получение: В чистом виде хром получают двумя способами:
1) металлотермический – восстановление металла из его оксида с помощью другого металла;
2) электролитический – электролиз водного раствора хромовых кислот. При этом одновременно с хромом на катоде выделяется водород. Поэтому получаемый хром содержит включения водорода. Для получения чистого хрома его переплавляют в вакууме.
Металлический хром получают алюмотермическим способом (способ Бекетова) из оксида (Cr_2O_3:Cr_2O_3+2Al=Al_2O_3+2Cr).
Нахождение в природе: в природе хром встречается только в виде соединений, важнейшим из которых является хромистый железняк (FeCrO_4) или (Fe(CrO)_2), из которого путем восстановления углеродом в электропечах получают сплав – феррохром. Используется хром в инструментальной и автомобильной промышленности: хромирование – покрытие хромом других металлов; в металлургии – при производстве легированной стали.
Оксиды и гидроксиды хрома
Хром образует три оксида: (CrO), (Cr_2O_3) и (CrO_3). Оксид хрома II (CrО) – основный оксид – черный порошок. Сильный восстановитель. CrО растворяется в разбавленной соляной кислоте: (CrO+2HCl=CrCl_2+H_2O).
При нагревании на воздухе выше 100°C CrО превращается в (Cr_2O_3:4CrO+O_2=2Cr_2O_3).
Оксид хрома III ((Cr_2O_3)) – тугоплавкий порошок зеленого цвета (температура плавления – 2265°C).
Твердость кристаллов близка к корунду, поэтому его вводят в состав полирующих средств. Получают из хромистого железняка ((FeCr_2O_4)).
При окислительно-щелочном сплавлении последнего с содой образуются хромат натрия (NaCrO_4:2Fe(CrO_2)_2+4Na_2CO_3+1/2O_2=4Na_2CrO_4+Fe_2O_3+4CO_2).
- Затем (Na_2CrO_4) переводят в (Na_2Cr_2O_7) – дихромат: (Na_2CrO_4+H_2SO_4=) (Na_2Cr_2O_7+H_2O+Na_2SO_4).
- Далее дихромат восстанавливают углем и получают (Cr_2O_3:Na_2Cr_2O_7+2C=) (Na_2CO_3+Cr_2O_3+CO)
- В лаборатории (Cr_2O_3) получают термическим разложением дихромата аммония: ((NH_4)_2Cr_2O_7 cdot Cr_2O_3+N_2+4H_2O).
- (Cr_2O_3) – амфотерный оксид: реагирует с основаниями и кислотами при сплавлении его со щелочами образует хромиты: (Cr_2O_3+NaOH=2NaCrO_2+H_2O).
Оксид хрома VI ((CrO_3)) – темно-красные кристаллы, хорошо растворимые в воде. (CrO_3) – кислотный оксид, с избытком воды образует хромовую кислоту: (CrO_3+H_2O cdot H_2CrO_4).
(CrO_3) – ангидрид хромовой кислоты. При большой концентрации (CrO_3) образуются дихромовая кислота: (2CrO_3+H_2O cdot H_2CrO_7).
(CrO_3) при нагревании до 250°C разлагается: (4CrO_3 cdot 2Cr_2O_3+3O_2).
Получение: взаимодействием дихромата калия с концентрированной (H_2SO_4): (K_2CrO_7+H_2SO_4=CrO_3+K_2SO_4+H_2O). (CrO_3) – сильный окислитель – окисляет йод, серу, уголь, фосфор, превращаясь при этом в (Cr_2O_3).
- Гидроксид хрома II (Cr(OH)_2) желтого цвета, в воде не растворим, обладает основными свойствами, является восстановителем, получается действием щелочи на хлорид хрома (CrCl_2), получаемого при взаимодействии Cr c НСl
- Соединения Cr II неустойчивы и легко окисляются кислородом воздуха
- Гидроксид хрома III ((Cr(OH)_3)_n) – это сложный полимер зеленого цвета, не растворимый в воде, обладает амфотерными свойствами – растворяется в кислотах и в щелочах; реагирует с кислотами с образованием солей хрома (III).
- со щелочами – с образованием сине-фиолетовых растворов – гидроксохромитов.
- При сплавлении (Cr(OH)_3) со щелочами получают хромиты, а с избытком – метахромиты.
- Хроматы и дихроматы
Хроматы – соли хромовой кислоты (H_2CrO_4), существующей лишь водных растворах с концентрацией не выше 75%. Валентность хрома в хроматах – 6.
Хроматы щелочных металлов и магния имеют хорошую растворимость в воде, а растворимость щелочноземельных металлов очень резко снижается в ряду (CaCrO_4) – (SrCrO_4) – (BaCrO_4) – (RaCrO_4). Хроматы – желтые кристаллические вещества – желтую окраску обеспечивает хромат-ион (CrO_4^2-).
Дихроматы – соли дихромовой кислоты (H_2CrO_7). В отличие от хроматов, почти все соли-дихроматы хорошо растворимы в воде. Дихроматы имеют ярко-оранжевую окраску, обеспеченную дихромат-ионом: (CrO_7^2-).
Хроматы получают взаимодействием оксида хрома (VI) или раствора хромовой кислоты (H_2CrO_4) с оксидами, гидроксидами, карбонатами металлов или при обменной реакции с участием растворимых солей-хроматов, или путем окисления комплексных солей – гидроксохроматов в избыточном растворе щелочи.
Хромат калия (K_2CrO_4) – кристаллы желтого цвета, при нагревании краснеют. Кристаллогидратов не образует. Дихроматы – сильные окислители.
Получают дихроматы из соединений Cr (III) в кислой среде.
Дихромат аммония ((NH_4)_2Cr_2O_7) – оранжевые кристаллы, не образует кристаллогидратов. При слабом нагревании он самовоспламеняется с выбросом искр – раскаленных частиц (Cr_2O_3), (N_2) и паров воды – «химический вулкан».
Дихромат калия (K_2Cr_2O_7 cdot 2H_2O) и (Na_2Cr_2O_7) – хромпики, оранжево-красные кристаллы, кристаллогидратов не образует. Используется в пиротехнике, в хроматометрии, в производстве спичек.
Смесь равных объемов раствора (K_2Cr_2O_7) и концентрированной серной кислоты – хромовая смесь – является очень сильным окислителем, в лабораториях применяется для мытья стеклянной посуды.
Хроматы применяются для протравы семян, при крашении, в лакокрасочной, кожевенной (в качестве дубящих реагентов кожи), текстильной промышленности; используются в лабораторном способе разделения хрома-тов кальция, стронция и бария.
Наиболее распространенным в природе, минералом является минерал (PbCrO_4) – крокоит. Хромат – тарапакаит и дихромат калия – лопецит – также являются природными минералами.
Общая характеристика семейства железа
Семейство железа входит в состав побочной подгруппы восьмой группы и является в ней первой триадой, включающей в себя железо, кобальт и никель. Эти элементы имеют два электрона на наружном слое атома, все они являются металлами. По свойствам все три элемента похожи между собой.
Для них характерна степень окисления 2, 3, 4. Реже проявляются более высокие степени окисления. Ни один элемент из семейства железа не проявляет максимальной степени окисления +8. Все металлы триады образуют разнообразные соединения, проявляя степени окисления +2 и +3.
Проявление высокой степени окисления и амфотерных свойств характерно для железа.
Температуры плавления элементов триады железа высокие, тем не менее, ниже, чем у элементов, находящихся в серединах серий переходных металлов.
Железо – первый элемент в переходных рядах, имеющий спаренный электрон на внутренней d-орбитали. Спаренные электроны с такой орбитали труднее участвуют в образовании химической связи, чем неспаренные.
У триады железа существуют особенности орбитального строения, проявляющиеся в виде магнитных и ферромагнитных свойств. В результате ориентированности атомов металлы образуют постоянные магниты. Все металлы семейства железа проявляют электроположительное поведение.
Инертны в среде окислителя, даже кислорода, так как образуют оксидные пленки.
- Химические свойства железа:
- 1) взаимодействует с кислородом при высоких температурах;
- 2) оксиды в низшей степени окисления MO;
- 3) при взаимодействии с галогенами образует галогениды, дигалогениды;
- 4) образует комплексные соединения;
- 5) образует карбонилы – соединения, в которых переходный металл образует связь с ионом металла или водорода и координированными карбониловыми группами (пентакарбонил кобальта ([Co(CO)_5]));
- 6) взаимодействуют с серой и сероводородом при нагревании, образуя сульфиды.
Железо – второй (после алюминия) по распространенности металл, встречается в виде различных руд, пригодных для переработки. Из них получают почти чистый (Fe_3O_4), который вместе с известняком и коксом используется для выплавки чугуна в доменной печи.
Кобальт выделяют из руд, содержащих много мышьяка и некоторой доли серебра, достаточной для промышленной переработки.
Никель – в руде много примесей: сульфиды никеля, меди и железа. Половина получаемого никеля расходуется в производстве стали для повышения ее коррозионной стойкости и твердости. Он используется также для создания прочных покрытий на стальных изделиях.
Железо
Железо занимает второе место после алюминия по распространенности в земной коре (~4 %). Содержится в виде соединений (оксиды, сульфиды и силикаты).
Руды, из которых получают железо – магнитный, красный, бурый и шпатовый железняки, реже – железный колчедан или пирит. Последний используют для получения серной кислоты.
Физические свойства. Температура плавления – (1539 pm5^circ C). Является пластичным металлом серебристого цвета. Хорошо поддается механической обработке. От чистоты железа зависят его механические свойства, а оно в твердой фазе способно растворять в себе элементы.
Такому раствору отвечает соединение цементит или карбид железа – вещество со сложной кристаллической структурой, большой твердостью и хрупкостью, имеет температуру плавления 1600°C. Свойства таких растворов зависят от содержания в них углерода.
Но, несмотря на концентрацию углерода, феррит и аустенит имеют меньшую твердость и пластичность, чем цементит.
Получение. Железо без примесей можно получить при восстановлении оксида железа (III) водородом при повышенной температуре. Сейчас существует немало методов, позволяющих получить железо, содержащее 10-6% примесей, но в практических целях используется железо в виде сплавов.
Черная металлургия занимается производством сплавов железа – чугунов и сталей, перерабатывающая – железных руд и сплавов. Обрабатывая руду, в первую очередь получают чугун, из которого потом получают сталь.
Стали – железоуглеродные сплавы, содержащие меньше 2,14% углерода.
Чугуны – железоуглеродные сплавы, содержащие больше 2,14% углерода.
Для того, чтобы получить чугун, используют руды, содержащие серу (гематит, магнетит, сидерит). Для доменных процессов не используют руду с малым содержанием серы (0,3%), так как сера, переходя в железо, делает его ломким и хрупким.
Получаемый чугун содержит 93% Fe, 7% составляют C, Si, P и газовые включения (азот, кислород и др.). Для удаления примесей проводят обжиг в отражательных печах.
Добавление определенных металлов придает сплаву твердость, вязкость, механическую прочность и другие физические свойства, необходимые для сталей.
Затем полученный сплав подвергают операциям отжига и закалки для создания хорошей кристаллической структуры и распределения фаз.
- Полученный чугун используют для:
- 1) переплавки в сталь в конвертерах, мартеновских или электрических дуговых печах;
- 2) литейный чугун используется в машиностроении для чугунного литья.