- Реагентная очистка сточных вод от ионов тяжелых металлов в гальваническом производстве
- 2. Организация отстойников
- 3. Метод ферритизации
- 4. Образование ферритов
- 5. Способы ферритизации
- 6. Преимущества ферритной очистки
- Главными преимуществами ферритной очистки стоков являются:
- Очистка воды от тяжелых металлов
- Очистка питьевой воды от тяжелых металлов
- Влияют ли тяжелые металлы на живые организмы
- Основные способы и методы очистки воды от тяжелых металлов
- Почему клиенты доверяют нам
- Очистка сточных вод от тяжелых металлов
- Реагентные методы
- Ионный обмен
- Нанофильтрация
- Очистка сточных вод от ионов тяжелых металлов

Промышленные сточные воды часто содержат опасные соединения со значительной атомной массой. Этим соединениям присущи свойства металлов, а сами вещества называются тяжелыми металлами – ценными в производстве и опасными для окружающей среды. Процесс выделения данных веществ из очищаемой воды – это и есть очистка стоков от тяжелых металлов. Она может осуществляться разными методами – мембранным, ионным, сорбционным и путем электролиза, в статье мастер сантехник подробно разобрал каждый из методов.
Основы очистки сточных вод
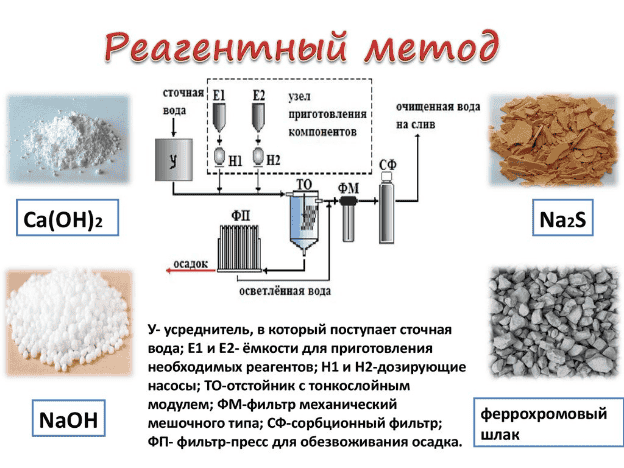
Очистка стоков от ионов тяжелых металлов производится за счет перевода ионов тяжелых металлов в нерастворимые соединения в ходе нейтрализации сточных вод с применением различных щелочных реагентов.
Так при нейтрализации кислых стоков известковым молоком с высоким содержанием известняка, растворами соды ионы тяжелых металлов начинают осаждаться в виде карбонатов. Последние в воде менее растворимы, чем соответствующие гидроксиды.
Кроме того, все основные карбонаты осаждаются при сравнительно невысоких значениях рН (более низких, чем соответствующие гидроксиды).
Как происходит очистка сточных вод от тяжелых металлов

При одновременно осаждении гидроксидов нескольких металлов при равной величине рН достигаются более высокие результаты, чем при раздельном осаждении каждого металла по отдельности.
При локальном обезвреживании никель, цинк, кадмий содержащих потоков в роли щелочного реагента желательно использовать известь. Расход извести при этом составляет на 1 весовую часть кадмия — 0,5 в.ч. СаО, никеля — 0,8 в.ч. СаО, а также цинка — 1,2 в.ч. СаО.
При небольшом объеме стоков обычно используется периодическая схема очистки, а при значительных – непрерывная либо смешанная.
Осаждение нерастворимых соединений происходит в отстойниках (предпочтительно вертикальных). Число отстойников – минимум два, оба должны быть рабочими. Продолжительность отстаивания – от двух часов. Для ускорения осветления прошедших нейтрализацию сточных вод к ним рекомендуется добавлять синтетический флокулянт полиакриламид.
Влажность осадка после прохождения отстойников составляет 98-99,5%. Для ее снижения рекомендуется дополнительное отстаивание веществ в шламоуплотнителе в течение нескольких дней. После шламоуплотнителя влажность падает до 95-97%.
В некоторых случаях до сброса очищенных стоков в канализацию либо при их дальнейшем обессоливании с применением ионного обмена, электродиализа производится снижение концентрации взвешенных частиц в очищенной воде.
Осветление будет осуществляться путем фильтрования через устройства с песчаной, двухслойной или плавающей загрузкой ФПЗ.
Методы очистки сточных вод от ионов тяжелых металлов

Для удаления ионов тяжелых металлов, кроме реагентного (самый популярный вариант), могут применяться и другие решения.
Реагентная очистка сточных воды от ионов тяжелых металлов
Самое широкое распространение в практике водоочистки от ионов тяжелых металлов имеет реагентный метод.
Он включает процессы нейтрализации, окислительные и восстановительные реакции, осаждение, обезвоживание осадка, позволяет удалять ИТМ.
Ионы тяжелых металлов в данном случае переводятся в гидроксидные соединения за счет повышения рН усредненных стоков до показателей их гидратообразования с осаждением и фильтрацией.
Главное достоинство реагентного метода – эффективное обезвреживание кислотно-щелочных стоков разных объемов с любой заданной концентрацией ионов тяжелых металлов.
Недостатки – значительный расход реагентов, получение неутилизируемого осадка, повышение солесодержания стоков, очищенных от ИТМ, значительные эксплуатационные расходы, необходимость организации системы содержания реагентного хозяйства.
Ионнообменный метод
Ионообменный метод используется для удаления ионов металлов, прочих примесей, обессоливания. Его суть состоит в способности ионообменных материалов убирать из растворов электролита ионы, а давать эквивалентное количество ионов ионита.
Для очистки используются синтетические ионообменные смолы в виде гранул – иониты.
Они состоят из полимерных веществ, нерастворимых в воде, имеют на поверхности подвижные ионы, которые при соблюдении определенных условий вступают в реакции обмена с ионами аналогичного знака, которые есть в воде.
Существуют слабо- и сильнокислые катиониты с анионитами, в отдельную категорию выделяются иониты смешанного действия. Избирательное поглощение молекул загрязняющих веществ поверхностью твердого адсорбента происходит в результате воздействия на них поверхностных неуравновешенных сил адсорбента.
Ионообменные смолы способны к регенерации, которая осуществляется насыщенными растворами. Процессы восстановления протекают автоматически, время регенерации составляет в среднем 2 часа.
Умягчение катионированием
Умягчение катионированием – еще один часто используемый способ обессоливания. Он предполагает обработку воды методом ионного обмена, в результате которой начинается катионный обмен. В зависимости от типа ионов различается два вида процесса – Н и Na.
Натрий-катионитовый метод эффективно умягчает воду в том случае, если содержание взвешенных частиц в ней составляет до 8 мг/л. Жесткость снижается при одноступенчатом натрий-катионировании до 0,05-0,1 мг-экв/л, а при двухступенчатом максимально до 0,01 мг-экв/л. Достоинства данного варианта – простая утилизация продуктов регенерации, дешевизна.
Водород-катионитовый метод используется для глубокого умягчения. В его основе лежит фильтрация стоков через слой катионита. рН фильтрата снижается за счет кислот, образующихся в процессе очистки.
Ионный обмен
Для очистки стоков от анионов сильных кислот применяется технологическая схема одноступенчатого Н-кати и ОН-анионирования с применением сильнокислотного катионита, слабоосновного анионита.
Для глубокой очистки сточных вод применяется одно-или двухступенчатое Н-катионирование с последующим двухступенчатым ОН-анионированием. Если в стоках много диоксида углерода и его солей, то емкость сильноосновного анионита быстро истощается.
Для уменьшения истощения стоки после катионитового фильтра дегазируют в специальных приборах.
Цеолиты
Цеолиты – это алюмосиликаты, которые имеют пористую регулярную структуру. Из мелких кристалликов синтетических или природных цеолитов с помощью связующего либо без него формируются мелкие гранулы.
Цеолиты широко используются для улавливания паров воды, в нефтеперерабатывающей промышленности в целях очистки и регенерации масел, увеличения степени очистки, качества жидких топлив.
Как и многие другие адсорбенты, цеолиты подходят для очистки отходов пищевой промышленности, стоков промышленных газовых выбросов от органики. Цеолиты обладают ионообменными свойствами – на данный момент они широко используются в промышленности, сельском хозяйстве.
Сфера применения веществ вообще очень широкая – они могут выполнять роль катализатора, улучшающего качество почв компонента, удобрения и так далее. Промышленные адсорбенты имеют пористую структуру и развитые внутренние поверхности, за счет чего поглощают значительные объемы адсорбируемого компонента.
Электродиализ
Электpодиализ – это пpоцесс пеpеноса ионов чеpез мембpаны под воздействием электpического поля. Для очистки стоков методов электpодиализа используются электpохимически активные мембpаны ионитового типа.
Метод электpодиализа может использоваться для удаления малоконцентpиpованных стоков минеpальных солей для повтоpного использования обессоленных водных масс в пpоизводстве либо переработки высококонцентpиpованных вод в целях регенерации из них ценных веществ.
Удаление солей происходит в многокамерных аппаратах, где плоские мембраны располагаются параллельно.
Внутренний электролиз
Под внутренним электролизом подразумевается выделение из растворов металлов в ходе гальванического процесса. Электролиз начинается при соединении электродной пары внешним проводником либо муфтой и длится до тех пор, пока металл полностью не осядет.
Когда гальваническая пара погружается в раствор, возникает требуемая разность потенциалов. На менее активном металле (это катод) начинаются процессы восстановления с выделением определенного металла из раствора. Более легкоотрицаемые металлы растворяются (формула химического процесса – Me + m*H O — Me *m*H O + z*e).
Затем ионы металла под воздействием электрического поля начинают разряжаться (Me * l*H O + ze — Me + l*H O).
Цементация
Цементация – отдельная разновидность внутреннего электролиза, в ходе которой менее активный металл проходит процесс восстановления на более активном. Речь идет об аноде, который в результате сложных химических реакций растворяется.
Электрохимический метод
Электролиз – еще один широко применяемый для выделения из растворов металлов метод. Сложнее всего с применением электролиза выделять частицы, которые содержатся в стоках в небольших концентрациях. Процесс осуществляется в двух режимах – либо при постоянном потенциале, либо при неизменной плотности.
При постоянной силе тока электролиз для очистки растворов с разными сортами ионов использовать нежелательно, чтобы в течение заданного срока времени плотность тока предельных значений не превышала.
В противном случае еще до окончательного завершения процесса выделения данного металла потенциал электрода может достичь той вершины, при которой начнется выделения уже другого металла, и состав осадка получится неопределенным.
Раздельное выделение металлов обеспечивается за счет достаточного различия в потенциалах ионного разряда определяемых металлов (данный показатель обуславливается разницей в нормальных потенциалах, перенапряжении или и тем, и другим показателем).
Общая характеристика гальванического производства
Производства, деятельность которых связана с электрохимической или химической обработкой металлов, считаются самыми вредными для среды.
Особую опасность несут тяжелые металлы, под воздействием которых у человека развиваются опасные патологии сердца, печени, сосудов, нервной системы. Кроме того, тяжелые металлы имеют мутагенное действие.
Именно по этим причинам вопросы эффективной очистки стоков в процессе обработки металлов на производствах на данный момент являются актуальными.
Состав сточных вод гальванических цехов
Металлообрабатывающие заводы цветной металлургической промышленности потребляют значительные объемы воды в ходе реализации основных технологических процессов. Только при промывке изделий после химических, гальванических покрытий ежегодно вымывается от 3300 т цинка, 2400 т никеля, 125 т олова, 460 т меди, 500 т хpома, 135 т кадмия.
Очистка сточных вод гальванических цехов от тяжелых металлов: все существующие способы
Для снижения уровня экологической опасности производств используются разные способы извлечения металлических примесей из вод промывки. Процессы очистки стоков базируются на химических, физических и биологических процессах.
Потребность в значительных капитальных затратах на строительство очистных сооружений, экономическая целесообразность которых в большинстве случаев проявляется только в рамках рассмотрения экологических задач народно-хозяйственного, регионального масштаба, затрудняет расширение сфер их применения.
Сдерживается процесс внедрения передового оборудования и из-за дефицита определенных химикатов, материалов, устройств. Главными задачами в этой связи является разработка новых способов очистки и усовершенствование старых.
В комплексе это должно уменьшить капитальные расходы на очистку воды и массово внедрить автоматические передовые системы, что в итоге приведет к снижению эксплуатационных расходов.
Глубокая очистка стоков способна не только улучшить экологию окружающей среды, открыть источники для получения ценных металлов.
Применение аппараты вихревого слоя в процессах очистки сточных вод гальванических цехов
В ходе очистки стоков гальванических цехов широко применяются аппараты вихревого слоя. Они предназначены для ускорения химических и физических процессов. АВС – это герметичная установка, которая оснащается системой охлаждения, рабочей камерой, электромагнитным устройством, пультом управления.
Внутри камеры находятся ферромагнитные частички, которые приводятся в хаотичное движение за счет действия электромагнитного поля. Эффективность всех рабочих процессов установки зависит от скорости перемещения и частоты соударения частичек внутри камеры.
На данные показатели оказывают влияние изменения напряжения поля.
Обработка воды в аппаратах АВС позволяет удалять кишечные палочки, протеи, бактероиды, гельминты, другие анаэробные микроорганизмы.
Степень дезинвазии определяется с учетом продолжительности обработки воды электромагнитным полем и вихревым слоем ферромагнитных частиц. АВС способствует повышению скорости процесса дезинвазии, позволяет экономить электроэнергию.
Аппараты вихревого слоя могут использоваться в комплексе с другими видами очистки, что позволяет достигать максимально эффективных результатов водообработки.
Видео
В сюжете — Очистка промышленных сточных вод
Выводы
Проблема утилизации стоков с примесями тяжелых металлов сегодня стоит особенно остро. Для удаления железа используются разные методики, которые делятся на регенеративные и деструктивные. Самым популярным является реагентный метод – дешевый, простой и эффективный.
В продолжение темы посмотрите также наш обзор Флотатор для очистки сточных вод — технология, виды, плюсы и минусы использования
Источник
https://santekhnik-moskva.blogspot.com/2019/07/Reagentnyy-metod-ochistki-stochnykh-vod.html
Реагентная очистка сточных вод от ионов тяжелых металлов в гальваническом производстве

Очистка сточных вод от ионов тяжелых металлов осуществляется путем перевода ионов тяжелых металлов в малорастворимые соединения (гидроксиды или основные карбонаты) при нейтрализации сточных вод с помощью различных щелочных реагентов (гидроксидов кальция, натрия, магния, оксидов кальция, карбонатов натрия, кальция, магния). В табл. 1 представлены значения pH осаждения гидроксидов металлов и остаточные концентрации ионов металлов в сточной воде.
При нейтрализации кислых сточных вод известковым молоком, содержащим значительное количество известняка, а также растворами соды, некоторые ионы тяжелых металлов (например, цинк, медь и др.) осаждаются в виде соответствующих основных карбонатов.
Последние менее растворимы в воде, чем соответствующие гидроксиды, поэтому при образовании основных карбонатов происходит более полный переход ионов тяжелых металлов в малорастворимую форму.
Кроме того, основные карбонаты большинства металлов начинают осаждаться при более низких значениях pH, чем соответствующие гидроксиды.
Таблица 1
Значения величины pH осаждения гидроксидов металлов и остаточная концентрация ионов металлов
|
Практикой очистки сточных вод установлено также, что при совместном осаждении гидроксидов двух или нескольких металлов при одной и той же величине pH достигаются лучшие результаты, чем при раздельном осаждении каждого из металлов.
При локальном обезвреживании кадмий-, никель-, цинксодержащих потоков в качестве щелочного реагента рекомендуется использовать известь (лучше третьего сорта, содержащую СаСОз). При этом расход извести составляет на 1 весовую часть(в.ч.) кадмия – 0,5 в.ч. СаО, никеля – 0,8 в.ч. СаО, цинка – 1,2 в.ч. СаО. На рис.
1 представлена принципиальная схема реагентной очистки сточных вод от ионов тяжелых металлов. При объемах сточных вод до 30 м3/ч обычно рекомендуется периодическая схема очистки, а при больших – смешанная или непрерывная.
2. Организация отстойников
Осаждение образующихся в процессе реагентной обработки нерастворимых соединений осуществляется в отстойниках (предпочтительно вертикальных с нисходяще-восходящим движением воды, можно в тонкослойных полочных отстойниках). Число отстойников принимается не менее двух, оба рабочие. Продолжительность отстаивания составляет не менее 2-х часов.
Для ускорения осветления нейтрализованных сточных вод рекомендуется добавлять к ним синтетический флокулянт – полиакриламид (в виде 0,1 %-ного раствора) в количестве 2-5 г на 1 м3 сточных вод в зависимости от содержания ионов металлов (чем меньше суммарная концентрация ионов металлов, тем больше доза флокулянта). Добавление полиакриламида к сточным водам рекомендуется проводить перед их поступлением в отстойник (после их выхода из камеры реакции).
Влажность осадка после отстойников 98-99,5%. Для снижения влажности осадка рекомендуется дополнительное отстаивание в шламоуплотнителе в течение 3-5 суток. Влажность осадка после шламоуплопгнителя 95-97%.
Осадок из шламоуплотнителя подается на узел обезвоживания (вакуум- фильтрация, фильтр-прессование, центрифугирование).
Влажность осадка после вакуум-фильтра типа БОУ и БсхОУ составляет 80-85%, после центрифуги типа ОГШ – 72-79%, после фильтр-пресса типа ФПАКМ – 65-70%.
В отдельных случаях перед, сбросом очищенных сточных вод в канализацию или при последующем их обессоливании методами ионного обмена или электродиализа требуется снижение концентрации взвешенных веществ в очищенной воде. Осветление стока в данном случае осуществляется путем фильтрования через фильтры с песчаной или двухслойной загрузкой (песок, керамзит), а также через фильтры с плавающей загрузкой типа ФПЗ.
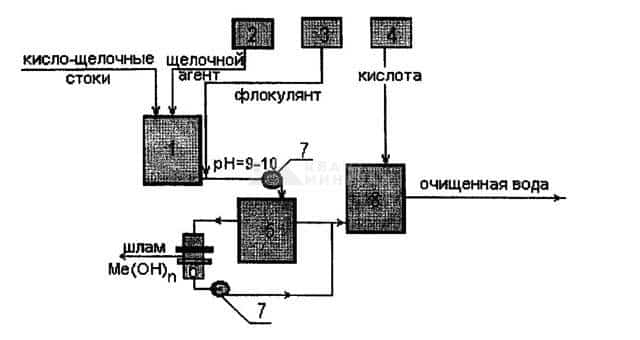
Рис.1. Принципиальная схема реагентной очистки сточных вод от ионов тяжелых
металлов: 1-реактор-нейтрализатор кисло-щелочных стоков, 2-дозатор щелочного
агента, 3-дозатор флокулянта, 4-дозатор раствора кислоты, 5-отстойник, 6-механический фильтр, 7-насос, 8-нейтрализатор очищенной воды.
3. Метод ферритизации
В последнее время находит практическое применение ферритный метод (метод ферритизации), как модификация реагентного метода очистки сточных вод от ионов тяжелых металлов с помощью железосодержащих реагентов.
Железо, будучи элементом побочной подгруппы VIII группы, проявляет значительную химическую активность, обладает высокой приверженностью к аллотропическим модификациям и пространственно-фазовым превращениям.
Железо образует множество соединений как стехиометрического состава, так и бертоллидного характера.
Последние играют важную роль при проявлении железосодержащими реагентами коагулирующего и адсорбционного действия.
Очистка сточных вод методом ферритизации заключается в сорбции примесей (в т.ч. ионов тяжелых металлов) магнитными гидроокисями железа, образовании ферритов с последующей топохимической реакцией захвата сорбированных веществ кристаллической решеткой феррита. Ферриты – это производные гипотетической железистой кислоты HFeCh, в которой ионы водорода замещены ионами металлов.
Основным реагентом ферритизационной обработки сточных вод служит гидрат сернокислого закисного железа FeS04-7H20, являющийся отходом производства двуокиси титана или травления стали.
При добавлении щелочи к водному раствору железного купороса, начиная с pH 7,7, образуется хлопьевидный желтовато-белый осадок. Под воздействием воздуха он приобретает коричневатый оттенок, обусловленный возникновением аддукта Fe(OH)2-Fe(OH)3. Последний чрезвычайно активен, может превращаться в зависимости от состава раствора, pH и температуры в следующие соединения:
- парамагнитный метагидроксид FeO(OH) со структурой минерала гётита;
- ферромагнитный метагидроксид FeO(OH) со структурой минерала лепидокрокита;
- неферромагнитный метагидроксид FeO(OH);
- черно-коричневый магнетит Fe3О4;
- ферромагнитный ржаво-коричневый полигидрат Fe2О3nH2O
Названные соединения, формируясь индивидуально и в смеси, отражают многообразие, сложность реакций, лежащих в основе их образования.
При низких концентрациях железа в широком диапазоне pH организуются соединения с выраженными магнитными свойствами.
С увеличением концентрации железа возрастают требования к pH, при котором оптимально проходят процессы ферритообразования: возникновения зародышей
- магнетита – феррита железа FeII(FeIIIО2)2 по реакции:
- Fe(OH)3– + 2Fe(OH)4– -> Fe304 + 4Н20 + ЗОН-, или в общем виде:
- FeS04 + 12NaOH + О2 -> 2Fe3О4 + 6Н2О + 6Na2SО4, а также образование ферритов цветных металлов MeFe2О4:
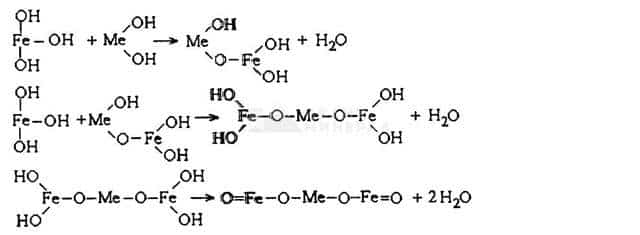
4. Образование ферритов
Образование ферритов – сложный процесс, включающий реакции твердофазного координирования и кристаллографического структурирования.
Возникающие при этом твердые комплексные соединения имеют туннельную структуру, благоприятствующую дополнительному клатратированию тяжелых металлов.
Повышение температуры нивелирует влияние pH, в результате при температуре 80 °С область ферритообразования в районе повышенных концентраций железа (а также ионов тяжелых металлов) значительно расширяется. Необходимо отметить, что наблюдаемое расширение более заметно при пониженной pH, когда возрастает роль твердофазных превращений.
Способность металлов к совместному осаждению с гидрозакисью железа и ферритообразованию усиливается в ряду Cd < Zn < Со < Ni < Си.
Кадмий и цинк проявляют малую активность в формировании ферромагнитных композиций, поэтому они менее всего клатратируются при ферритном обезвреживании сточных вод.
Степень очистки с образованием магнитных продуктов повышается при обработке стоков, содержащих одновременно ионы нескольких металлов по сравнению с обработкой индивидуальных стоков, а также при повышении pH.
Наивысшую активность в ферритной очистке проявляет медь. При рН>9 она эффективно удаляется в виде кристаллического продукта с высокой магнитной восприимчивостью.
Никель и кобальт по способности к ферритной очистке занимают промежуточное положение между медью и цинком. Высокий эффект очистки достигается при рН>10, а ферромагнитный характер формируемых осадков обеспечивается лишь при дозировке железа в очищаемую воду в количестве до 1 г/л.
5. Способы ферритизации
Очистку сточных вод от ионов тяжелых металлов методом ферритизации можно проводить двумя способами.
Первый способ заключается в добавлении в сборник со сточными водами железного купороса, едкого натра (в виде 40 % водного раствора) и азотнокислого натрия: при суммарной концентрации ионов тяжелых металлов 30 мг/л в стоки дозируются 450 г/м3 железного купороса (90 г-ион/м3 в пересчете на железо), 322 г/м3 раствора каустика и 45,6 г/м3 нитрата натрия.
После этого сточная вода нагревается острым паром до 60 °С (100 кг пара на 1 м3 стоков) и выдерживается при барботировании воздухом в течение 1 часа (расход воздуха 100 м3/м3 стоков в час). Затем стоки сбрасываются в отстойник. Время выдержки в отстойнике 15-20 мин.
После чего осветленная часть стоков направляется на фильтрацию и далее в хозяйственно-бытовую канализацию.
По второму способу очистка стоков проводится в две стадии. На первой стадии формируется железосодержащая суспензия таким образом, чтобы она обладала развитой поверхностью, высокой химической активностью и адсорбционной способностью.
На приготовление 1 м3 железосодержащей суспензии необходимо 208,5 кг железного купороса, 60 кг едкого натра и 21,3 кг азотнокислого натрия. Время выдержки составляет 20 минут.
Чем дольше суспензия выдерживается до прибавления её в очищаемые стоки, тем завершеннее, полнее реализуется способность её к ферритообразованию. На второй стадии сформированная суспензия дозируется в очищаемые сточные воды.
Специфику ферритизационной обработки иногда связывают с адсорбционными явлениями, обусловленными дефектами кристаллической решетки ферритов.
Для полноты реализации адсорбционных явлений осуществляют предварительный специальный синтез активированных ферритов, предусматривающий обработку нитритами гидроокисей двух- и трехвалентного железа, взятых в определенном соотношении.
Полученные таким образом ферриты хорошо сорбируют ионы хрома, кадмия, свинца, меди, никеля, кобальта, ртути, марганца и бериллия, они имеют емкость по тяжелым металлам в 1000 – 10000 раз большую, чем магнетит.
При ферритной обработке сточных вод, особенно первым способом, происходящие процессы гидратообразования железа способствуют коагуляционной очистке тонкодиспергированных взвесей и эмульгированных загрязнений за счет формирования железосодержащих мицелл, способных к некоторым реакциям включения.
6. Преимущества ферритной очистки
Главными преимуществами ферритной очистки стоков являются:
- возможность одновременного удаления различных ионов тяжелых металлов в одну стадию;
- ионы тяжелых металлов клатратируются в виде кристаллических не выщелачиваемых продуктов;
- наряду с растворенными тяжелыми металлами эффективно удаляются диспергированные взвеси и эмульгированные загрязнения;
- процесс не чувствителен к влиянию других солей, которые могут присутствовать в стоках в больших концентрациях.
Аппаратурное оформление ферритной очистки отличается простотой, в основе его лежит принцип магнитного осаждения продуктов клатратирования загрязнений (в т.ч. ионов тяжелых металлов). Главным рабочим узлом установки ферритной очистки является резервуар-накопитель, снабженный мешалкой и магнитными клапанами для спуска обработанной воды.
Очистка воды от тяжелых металлов
Каждый из нас на уроках химии проходил тему тяжелых металлов и немного знаком с ним. Микроэлементы, такие как кадмий, алюминий, барий, свинец, ртуть, медь, цинк, необходимы для нормальной работы организма. Однако повышенное содержание солей тяжелых металлов в питьевой воде приводит к их накапливанию в живых организмах.
Очистка питьевой воды от тяжелых металлов
Тяжелые металлы попадают в воду двумя способами:
- Природным. Земная кора содержит огромное количество химических элементов. Их концентрация в верхних слоях зависит от географического и геологического факторов. Грунтовые воды, проходящие через различные горные породы, растворяют в себе эти соединения.
 В воздухе также присутствуют вредные взвешенные вещества, которые при определенных погодных явлениях (дождь, снегопад, гроза) попадают в верхние слои литосферы и гидросферы.
В воздухе также присутствуют вредные взвешенные вещества, которые при определенных погодных явлениях (дождь, снегопад, гроза) попадают в верхние слои литосферы и гидросферы. - Антропогенным. Открытие нефти, появление первых фабрик и заводов, развитие промышленности быстрыми темпами привели к увеличению стоков, насыщенных загрязняющими веществами, в том числе и тяжелыми металлами. Пищевая промышленность, ТЭЦ, химические предприятия, гальваническое производство, переработка и добыча нефтепродуктов, использование удобрений в аграрном хозяйстве — все это наносит непоправимый вред живым организмам. Каждый год человечество отравляет природу продуктами своей жизнедеятельности. Но сказывается ли это на жизни людей?
Влияют ли тяжелые металлы на живые организмы
Человек не может прожить без воды более 3-х суток. Каждый день необходимо выпивать до 2 литров воды в день. Но какой будет эффект, если ежедневно употреблять воду, насыщенную разными загрязнителями?
Тяжелые металлы, растворенные в воде, попадает в организм человека через пищевые цепи или путем попадания внутрь с питьевой водой. Каждый элемент аккумулируется в определенном органе (печень, почки, костные ткани и т.п.
) и приводит к нарушению его работы, а значит и функционированию всего организма. Токсичный эффект ксенобиотиков сохраняется на протяжении долгого времени.
Поэтому очень важно не допустить накапливание ионов тяжелых металлов в своем организме.
Основные способы и методы очистки воды от тяжелых металлов
Развитие области водоподготовки не стоит на месте, появляются новые технологии очистки воды от ионов тяжелых металлов.
Для того, чтобы правильно подобрать оборудование для удаления тяжелых металлов из воды нужно провести химический анализ воды. Как самостоятельно отобрать пробы Вы можете узнать здесь.
Наиболее доступные и эффективными являются следующие методы удаления из воды ионов тяжелых металлов:
Обратноосмотическая установка. Очистка воды от солей тяжелых металлов происходит на специальных мембранах, которые задерживают ионы различных солей.  С помощью этой системы очистки воды от сульфатов и тяжелых металлов происходит разделение исходной воды на очищенную и загрязненную. Чистая вода подается потребителю, а концентрированный раствор уходит в дренаж.
С помощью этой системы очистки воды от сульфатов и тяжелых металлов происходит разделение исходной воды на очищенную и загрязненную. Чистая вода подается потребителю, а концентрированный раствор уходит в дренаж.
- Для очистки воды в промышленности от тяжелых металлов, Мы разрабатываем промышленный обратный осмос различной производительности (до 50 м3/ч). Такая установка очистки природных вод от тяжелых металлов позволяет получать очищенную воду в непрерывном режиме и удаляет весь комплекс загрязняющих веществ.
- Если Вы обнаружили тяжелые металлы в воде из своей скважины или колодца и вам необходима очистка воды от них, Мы советуем приобретать бытовую установку очистки воды от ртути, свинца и кадмия на основе обратного осмоса AP-600. Эта 5-ступенчатая установка прекрасно справляется с проблемой грязной воды в доме.
Фильтры для очистки воды от солей тяжелых металлов на основе ионообменных смол. Вода поступает на систему фильтрации, где прогоняется через фильтрующую среду.
Однако, если в вашей воде растворено большое количество разных тяжелых металлов, такой способ реагентной очистки воды от тяжелых металлов будет не эффективным.
Ионообменная смола подбирается индивидуально под каждый тип загрязняющего вещества и очищает воду только от него.
Установка электродиализа. Принцип работы основан на прохождение потока воды через мембраны под действием электрического тока.
В процессе химической реакции токсичные вещества оседают на стенках мембран, которые способны пропускать только положительно или отрицательно заряженные элементы (анионы уходят к аноду, катионы к катоду).
Такой способ очень дорогой и используется в редких случаях.
Почему клиенты доверяют нам
Компания Diasel Engineering на рынке с 2013 года. За это время мы изучили эту отрасль и можем Вам гарантировать качественное и надежное обслуживание при очистке воды от тяжелых металлов.
Уже сегодня Вы можете оставить заявку на нашем сайте или написать нам на электронную почту info@diasel.ru, а также связаться со специалистами по телефону 8-499-391-39-59.
Мы подберем различные варианты сорбентов для очистки воды от тяжелых металлов, которые будут наиболее эффективны для решения Вашей проблемы, а уже завтра Вы сможете наслаждаться чистой водой в своем доме или на промышленном предприятии.
В наличии большой выбор установок обратного осмоса и ионообменных фильтров для очистки промышленных вод от тяжелых металлов.
Заявка на подбор оборудования
Очистка сточных вод от тяжелых металлов
На выбор определенного метода очистки влияют концентрация и компоненты стоков с содержанием тяжелых металлов, вид производства, возможность применения той или иной технологии очистки. На разных этапах извлечения ионов применяется тот метод, который является наиболее эффективным и экономически менее затратным. Такими являются:
- реагентный;
- сорбционный;
- ионообменный;
- электрохимический;
- обратный осмос и нанофильтрация.
Реагентные методы
Реагентный метод очистки сточных вод от тяжелых металлов предполагает химическое превращение высокотоксичных растворов в нетоксичные соединения. Реагентами могут выступать гидроксиды K и Na, карбонат Na, сульфиды Na.
Если в растворе содержатся вещества, которые способны легко восстанавливаться, тогда прибегают к методу восстановительной очистки. Для этих целей используют сульфат железа, диоксид серы, гидросульфит натрия.
4H₂CrO₄ + 6NaHSO₃ + 3H₂SO₄ = 2Cr₂ (SO₄)₃ + 3Na₂SO₄ +10H₂O 2CrO₃ + 3H₂SO₃ = Cr₂(SO₄) + 3H₂O
Осаждение ионов тяжелых металлов осуществляют с помощью известкового молока, раствора едкого натра и соды. При применении NaOH необходимо строго контролировать величину рН и подбирать оптимальную дозировку.
Использование соды в случае, когда стоки загрязнены такими металлами, как Zn, Pb, Cu и Cd, приводит к образованию основных карбонатов, состав которых зависит от условий реакции: температуры, концентрации раствора, рН и пр.
ZnCl₂ + 2Na₂CO₃ = 2ZnCO₃ + 4NaCl 2ZnCO₃ + H₂O = (ZnOH)₂CO₃ + CO₂
2ZnCl₂ + 2Na₂CO3 + H₂O = 4NaCl + CO₃+ (ZnOH)₂CO₃
Для повышения результатов очистки металлосодержащих стоков целесообразно использовать коагулянты и флокулянты. Коагулянтами могут выступать соли Fe, Al или их смеси.
Наибольшее распространение среди солей Al получили Al₂(SO₄)₃ и NaAlO₂. Сульфат алюминия экономически выгоден, кроме того легко растворяется в воде и дает хороший результат при рН 5 — 7,5.
Алюминат натрия при рН 9,3 — 9,8 образует хлопья, способные к быстрому осаждению.
Чаще всего применяют смесь солей алюминия, что позволяет расширить диапазон значений рН, повысить скорость образования хлопьев и увеличить их плотность.
Из солей железа чаще всего применяют сульфат железа, хлорное железо, соли трехвалентного железа. Но из-за высокой коррозионной способности и меньшего эффекта хлопьеобразования, соли железа имеют не такое широкое распространение или их используют в смеси с солями алюминия.
- Применение титанового коагулянта позволяет довести степень очистки стоков от тяжелых металлов до 50 — 67%.
- Флокулянтами могут выступать природные (крахмал, декстрин, эфиры), неорганические (диоксид кремния), синтетические (полиакриламид) вещества.
- Недостатками реагентного метода являются:
- высокая стоимость реагентов при их большом расходе;
- повторное загрязнение очищенных вод, что исключает ее возврат в цикл оборотного водопользования;
- утрата ценных веществ и затруднение их переработки;
- образование большого количества осадков.
Хотя исходный состав металлосодержащих стоков не играет существенной роли для качества их очистки реагентным методом, все же требуется доочистка на электродиализаторах или ионообменных фильтрах перед сбросом в водоемы хозяйственно-бытового назначения.
Ионный обмен
При использовании метода ионного обмена получаемое качество очистки позволяет использовать очищенные воды от тяжелых металлов в оборотном цикле водопользования. Метод предполагает обмен между ионами в растворе и ионами на поверхности твердой фазы — ионита. В качестве ионитов чаще всего используют синтетические ионообменные смолы.
С помощью ионного обмена производится глубокая очистка загрязненных стоков от ионов тяжелых металлов: Zn, Cu, Cr, Ni, Pb, Hg, Cd и цианидов.
Основным недостатком метода ионного обмена является вторичное загрязнение сточных вод после восстановления, когда возникает необходимость их обезвреживания.
Нанофильтрация
При нанофильтрации используются мембраны с отверстиями в несколько нм. Для таких мембран используют пористые материалы: ароматические полиамиды, ацетат целлюлозы, керамику.
Способ очистки металлосодержащих сточных вод на нанофильтрационных мембранах заключается в движении воды вдоль мембранной поверхности и смывании загрязнений. Такие мембраны имеют сниженную селективность и большую проницаемость.
Нанофильтрация дает хороший результат на заключительном этапе очистки стоков от загрязнений ионами тяжелых металлов.
Очистка сточных вод от ионов тяжелых металлов
Библиографическая ссылка на статью:
Клименко Т.В. Очистка сточных вод от ионов тяжелых металлов // Современные научные исследования и инновации. 2013. № 11 [Электронный ресурс]. URL: https://web.snauka.ru/issues/2013/11/28484 (дата обращения: 22.06.2022).
К тяжелым металлам относится больше 40 химических элементов периодической системы Д. И. Менделеева.
Тяжелыми металлами являются хром, марганец, железо, кобальт, никель, медь, цинк, галлий, германий, молибден, кадмий, олово, сурьма, теллур, вольфрам, ртуть, таллий, свинец, висмут и другие.[1]
Сточные воды, содержащие тяжелые металлы (промышленные сточные воды), образуются в автомобильной и химической промышленности, при производстве гальванических элементов и обработке металлических поверхностей, в электронной промышленности, в типографии, на кожаных фабриках и других. Они представляют большую опасность для окружающей среды и для человека.[1]
Проблема удаления тяжелых металлов из сточных вод сейчас особенно актуальная. Плохо очищенные сточные воды поступают в природные водоемы, где тяжелые металлы накапливаются в воде и донных отложениях, становясь таким образом источником вторичного загрязнения. Соединения тяжелых металлов сравнительно быстро распространяются по объему водного объекта.
Частично они выпадают в осадок в виде карбонатов, сульфатов, частично адсорбируются на минеральных и органических осадках. Вследствие чего содержание тяжелых металлов в отложениях постоянно увеличивается, и когда адсорбционная способность осадков исчерпывается, тяжелые металлы поступают в воду, что и приводит к экологическому кризису.
Штрафные санкции за сброс тяжелых металлов в воду становятся все жестче, но это не решает проблемы.[1]
Тяжелые металлы поступают в организм человека с едой и водой, накапливаются там, поскольку не выводятся из организма, и вызывают различные заболевания.
В небольших дозах железо, цинк и другие металлы жизненно необходимые, потому что участвуют в разных формах метаболизма, переносе, синтезе веществ.
Но в концентрациях превышающих предельно допустимые эти металлы становятся вредными, поэтому сточные воды необхио очищать от тяжелых металлов.
Была проведена работа по очистке искусственных образцов сточной воды от железа (Fe) и хрома Cr (VI), которые относятся к 3 классу опасности (опасные). Предельно – допустимая концентрация хрома общего (Cr) в питьевой воде не должна превышать 0,05 мг/дм3, а железа общего (Fe) – 0,2 мг/дм3 [2, приложение 2].
Соединения хрома Cr (VI) в больших концентрациях являются канцерогенными и могут вызывать онкологические заболевания, разные заболевания кожи [3].
Повышенное содержание железа в организме человека приводит к нарушению обмена веществ за счет того, что будучи биологически активным элементом образует хелатоподобные комплексы с обычными метаболитами; взаимодействует с клеточными мембранами, изменяя их проницаемость.
Существует много методов очистки воды от тяжелых металлов, к которым относятся химические, электрохимические, адсорбционные, ионообменные методы и другие. Важной задачей очистки сточных вод является применение наиболее энергосберегающих методов, а также возвращения извлеченных из сточных вод металлов обратно в производство.
Очистка искусственных образцов сточной воды от хрома Cr (VI) проводилась методами ультрафильтрации, адсорбции и ионного обмена, тога как очистка от железа (Fe) проводилась методом ультрафильтрации.
Метод мембранного разделения, а именно ультрафильтрация, является простым и энергосберегающим. Метод заключается в пропускании раствора под давлением через полупроницаемую мембрану. Вследствие чего над мембраной образуется концентрат, содержащий тяжелые металлы, а под мембраной – очищенный раствор (пермеат) [4, с. 326].
Работа по очистке искусственных образцов сточной воды от железа (Fe) и хрома Cr (VI) проводилась на мембранной установке типа УСФ-293.
В процессе работы использовались обратноосмотические ацетатцеллюлозные мембраны типа МГА-90, МГА-100 с анизотропной структурой.
В результате мембранного разделения был получен пермеат сточных вод, содержащий незначительную концентрацию железа (Fe) и хрома Cr (VI).
- Определение концентрации железа (Fe) и хрома Cr (VI) проводилось по стандартным методикам.
- Результаты проведенных опытов занесены в таблицы 1, 2.
- Очистка искусственных образцов сточной воды от хрома Cr (VI) проводилась также на природных сорбентах, в качестве которых использовалась активированная глина Черкасского месторождения, и на катионите КУ – 2 – 8.
- Результаты проведенных опытов занесены в таблицы 3, 4.
- Таблица 1 – Результаты очистки сточных вод от железа (Fe) методом ультрафильтрации
| Рабочее давление, МПа | Тип мембран | Содержание железа (Fe), | Степень очистки, % | |
| Исходный раствор | Пермеат | |||
| 0,5 | МГА 90 | 5 |
|
|
| 6 |
|
|
||
| 7 |
|
|
||
| 8 |
|
|
||
| 9 |
|
|
||
| 10 |
|
|
Таблица 2 – Результаты очистки сточных вод от хрома Cr (VI) методом ультрафильтрации
| Рабочее давление, МПа | Тип мембран | Содержание хрома Cr (VI), | Степень очистки, % | |
| Исходный раствор | Пермеат | |||
| 3,5 | МГА100 | 5 |
|
|
| 2,5 | 5 |
|
|
|
| 3 | 6 |
|
|
|
| 1,8 | 6 |
|
|
|
| 10 |
0,1208 0,1072 |
98,78 98,93 |
Таблица 3 – Результаты очистки сточных вод от хрома Cr (VI) на активированных бентонитовых глинах
| Высота слоя глины,см | Масса глины, г | Содержание хрома Cr (VI) в исходном растворе, мг/дм3 | Остаточная концентрация хрома Cr (VI), мг/дм3 |
Степень очистки, % |
| 10 | 30 | 5 |
|
|
| 6 | 20 | 4 |
|
|
| 6 | 20 | 3 |
|
|
| 6 | 20 | 2 |
|
|
Таблица 4 – Результаты очистки сточных вод от хрома Cr (VI) на катионите КУ – 2 – 8
|
Содержание хрома Cr (VI) в исходном растворе , мг/дм3 |
Остаточная концентрация хрома Cr (VI), мг/дм3 |
Объем пробы для анализа, см3 |
Степень очистки, % |
| 5 |
|
2 |
|
| 6 |
|
2 |
|
В результате проведенной работы установлено, что самая лучшая очистка сточных вод методом ультрафильтрации от хрома Cr (VI) проходила при пропускании раствора под давлением 3,5 МПа, степень очистки при этом составила 99,97%; самая лучшая очистка от железа (Fe) проходила при пропускании раствора под давлением 0,5 МПа, а степень очистки составила 97,3%.
При очистке сточных вод от хрома Cr (VI) на активированных бентонитовых глинах и катионите КУ – 2 – 8 было установлено, что самая лучшая очистка проходила на активированных бентонитовых глинах, средняя степень очистки которых составляет 99,89 %. Это позволяет предложить активированную бентонитовую глину в качестве промышленного сорбента, поскольку она дешевле, чем катионит КУ – 2 – 8.
Библиографический список
- Тяжелые металлы. Электронный ресурс. www. t-water.ru/index.php/ochistka-stochnykh-vod/91-tyazhelye-metally.
- Государственные санитарные нормы и правила ДСаНПиН 2.2.4 – 171 – 10 (ДСаНПиН 2.2.4 – 400 – 10) Гигиенические требования к воде питьевой, предназначенной для употребления человеком.
- Что такое тяжелые металлы? Про хром, сурьму и цинк. Электронный ресурс. http://www.net-bolezniam.ru/publ/1-1-0-13.
- Родионов А.И., Клушин В.Н., Систер В.Г. Технологические процессы экологической безопасности. Калуга: Издательство Н. Бочкаревой, 2000. 801 с.
Количество просмотров публикации: Please wait






