- Из четырех процентов
- Свойства лития
- Месторождения
- Добыча
- Производство
- Применение
- Плюсы и минусы литиевых батарей ?
- Стоимость
- Литий – металл XXI века
- Что представляет собой
- Как был открыт
- Физико-химические характеристики
- Нахождение в природе
- Места и способы добычи
- Технология получения
- Где используется
- Традиционные отрасли
- Новые сферы
- Значение для человека
- Предостережение
- Цены
- Литий, свойства атома, химические и физические свойства
- Общие сведения:
- Свойства атома лития:
- Химические свойства лития:
- Физические свойства лития:
- Кристаллическая решётка лития:
- Дополнительные сведения:
- Примечание:
- Источники:
- § 35. Характеристика химического элемента по его положению в периодической системе
- Литий
Главная › Металлы
10.10.2020
«По значимости в современной технике литий является одним из важнейших редких элементов».
Краткая химическая энциклопедия.
Из четырех процентов
История открытия лития началась с …математики. Химик Арфведсон анализировал минерал с рудника Уто.
Ученый определил, что это обычный алюмосиликат, и содержание в нем алюминия, кремния и кислорода составляет 96%. Настырный химик задумался — что с оставшимися 4%.
Отделив основные составляющие и растворив остаток, он получил раствор со щелочными свойствами. Логично было предположить, что открыт новый элемент.

Описанием минерала, из которого извлекли новый элемент, служат слова: «обычный булыжник». Потому и назвали новый металл литием (litos по латыни камень).
Свойства лития
Характеристики:
- относится к пластичным и мягким металлам (легко режется ножом);
- его легко отличить от других металлов — он самый легкий на Земле, не тонет даже в керосине (плотность почти в 2 раза меньше плотности воды);
- структура кристаллической решетки объемноцентрированная, кубическая;
- в ряду щелочных металлов у лития самые высокие температуры плавления и кипения.
Химические свойства:
- В условиях повышенной влажности реагирует с газами воздуха. Образуются соединения с литием — нитриды, карбонаты, гидроксиды.
- Постоянная валентность лития 1+.
- С водой реагирует по формуле 2Li + 2H₂O → 2LiOH + H₂↑.
- Охотно реагирует с галогенами (кроме йода), образует галогениды.
- При температуре от 100 до 300 градусов образует на поверхности оксидную пленку.
| Ли́тий / Lithium (Li), 3 |
| [6,938; 6,997][комм 1][1] а. е. м. (г/моль) |
| [He] 2s1, 1s22s1 |
| 145[2] пм |
| 134[2] пм |
| 76 (+1e)[3] пм |
| 0,98 (шкала Полинга) |
| -3,06 В |
| +1 |
| 519,9 (5,39) кДж/моль (эВ) |
| 0,534 г/см³ |
| 453,69 K (180,54 °C, 356,97 °F) |
| 1613 K (1339,85 °C, 2443,73 °F) |
| 2,89 кДж/моль |
| 148 кДж/моль |
| 24,86[4] Дж/(K·моль) |
| 13,1 см³/моль |
| кубическая объёмноцентрированная |
| 3,490 Å |
| 400 K |
| (300 K) 84,8 Вт/(м·К) |
| 7439-93-2 |
Рекомендуем: ВОЛЬФРАМ — самый тугоплавкий металл
Месторождения
В природе литий содержится в солевых растворах (подземных водах). Твердые источники часто расположены в пегматитовых рудах. Минералы: сподумен, лепидолит, эльбаит, ядарит.
В России 16 месторождений, но добыча не производится.
Мировые месторождения:
- Боливия;
- Аргентина;
- Чили;
- Китай.
Добыча
В добыче литиевого рассола есть пара проблем — география и надежность.
Рассол выкачивают в «бассейны» — специальные пруды, где естественным выпариванием концентрируется содержание элемента. Нужна постоянно высокая температура (география) и время — процесс занимает до года. Дальше концентрированная рапа (1-2% Li) отправляют на обработку на химзавод.

Твердые источники разрабатываются традиционными методами бурения и переработки.
В мире четыре производителя контролируют 85% добычи (основные — Аргентина и Чили).
Производство
Способы получения лития зависит от исходного материала.
Солевые растворы (рапа) выпаривают, затем осаждают литиевое соединение.
Твердые минералы вначале обогащают (с помощью магнитной сепарации, гравитационных методов, а при добыче крупных кристаллов сподумена просто вручную). Производство происходит в основном гидрометаллургическим способом.
Применение
Литий и его соединения используют:
- В производстве аккумуляторов и батарей.
- В качестве лигатуры в сплавах.
- В ядерной энергетике, радиоэлектронике.
- В медицине (соединения лития используют в лечении подагры, как психотропные, антидепрессанты).
- В пиротехнике (LiNO3 даст фейерверку красный цвет).
Рекомендуем: РУТЕНИЙ — загадочный, как русская душа
Мировое применение легкого металла распределяется так:
- 56% производство батарей и аккумуляторов;
- 23% керамика и стекло;
- 6% консистентные смазки;
- 2% воздухоочистка;
- 13% прочие.
Плюсы и минусы литиевых батарей ?
Эти аккумуляторы и батареи просты в эксплуатации, они постоянно готовы к эксплуатации.

| Достоинства | Недостатки |
| Хороший ресурс эксплуатации (до 10 лет) | Взрывоопасны при нарушении герметичности корпуса |
| Запас циклов зарядки-разрядки более 1000 | Срок службы зависит от времени работы (не от количества циклов зарядка-разрядка) |
| Нет «эффекта памяти» (батареи можно регулярно подзаряжать) | Работает в ограниченном температурном диапазоне (от -20 до +50оС) |
| Легкий вес | Высокая цена |
Стоимость
Цена лития марки ЛЭ-1 (99,9%) за килограмм 15 000 рублей.
Литий — в космосе, на земле, под водой Ссылка на основную публикацию 
Литий – металл XXI века
Этот элемент традиционно используют ядерщики и металлурги. Сегодня месторождения для его извлечения скупает Илон Маск. Без данного вещества невозможна революция в автопроме – переход с бензиновых на электромобили. Это дает основания рассматривать литий как металл третьего тысячелетия.

Что представляет собой
Литий – элемент таблицы Менделеева №3. Международное обозначение и формула – Li (Lithium).
Мягкий серебристый литий относится к металлам щелочной группы. По твердости располагается между натрием и свинцом.
При описании металла упоминают наличие двух стабильных изотопов в составе: Литий-6 и Литий-7.
Как был открыт
История металла начинается в 19 веке:
- Новый элемент обнаружил в местном минерале петалите шведский ученый Юхан Арфведсон.
- Через год, в 1817-м, его английский коллега Генри Дэви выделил металлический литий.
Название элемента восходит к древнегреческому «литос» (камень). Его предложил гуру европейской химии Иенс Берцелиус. Обосновал свой выбор тем, что литий нашелся в «камне».
Физико-химические характеристики
Это едва ли не самый химически малоактивный металл: в обычных условиях соединения с литием не образуются.
 Щелочной металл Литий
Щелочной металл Литий
Отличить литий от других щелочных металлов позволяют его характеристики:
- Самый легкий металл группы.
- Самый «неплотный» из металлов.
По плотности литий вдвое уступает воде, поэтому не тонет в ней и керосине.
- Взаимодействует с другими элементами группы только в особых условиях.
- На воздух реагирует при повышенной влажности, на другие газы и вещества (аммиак, галогены, кремний, серу) – при повышенной температуре.
- Горит пурпурным пламенем.
- Бурно реагирует с водой. Этот недостаток нейтрализуют, исключая контакт между ними при использовании.
Особые химические свойства металла обусловлены структурой и микроскопическими габаритами его атома.
| Ли́тий / Lithium (Li), 3 |
| [6,938; 6,997] а. е. м. (г/моль) |
| [He] 2s1, 1s22s1 |
| 145 пм |
| 134 пм |
| 76 (+1e) пм |
| 0,98 (шкала Полинга) |
| -3,06 В |
| +1 |
| 519,9 (5,39) кДж/моль (эВ) |
| 0,534 г/см³ |
| 453,69 K (180,54 °C, 356,97 °F) |
| 1613 K (1339,85 °C, 2443,73 °F) |
| 2,89 кДж/моль |
| 148 кДж/моль |
| 24,86 Дж/(K·моль) |
| 13,1 см³/моль |
| кубическая объёмноцентрированная |
| 3,490 Å |
| 400 K |
| (300 K) 84,8 Вт/(м·К) |
| 7439-93-2 |
Подобно большинству металлов, на воздухе литий покрывается оксидной пленкой.
Среди достоинств – пластичность, легкость обработки. Литий без проблем прокатывается, прессуется.
Нахождение в природе
- Чистый литий в природе не встречается, только как часть минералов (три десятка) и соляных озер.

- Самые распространенные минералы – амблигонит, лепидолит, петалит, сподумен.
Тонна земной коры содержит 21 г лития, литр морской воды – 0,00017 г.
Глобальные подтвержденные запасы металла – 17 млн. тонн (из них почти миллион у России). С учетом потенциала солончаков – 62 млн. тонн.
Содержание лития зашкаливает в космических объектах – звездах-гигантах и звездных скоплениях с солнцем-красным гигантом и нейтронной звездой внутри.
Места и способы добычи
Кладезь литиевого сырья – обе Америки (США, Чили, Перу, Аргентина, Боливия).
Рудой богаты месторождения Австралии и России. Половина российских запасов сосредоточена в Мурманской области.

- Добыча ведется не всегда обычными способами.
- Источника сырья два:
- Пегматитовые минералы со слюдой, кварцем, полевым шпатом, другими минералами в составе. Особенно щедр на литий сподумен – руда лития из группы пироксенов. Используется добыча традиционным карьерным способом.
- Глины солончаков. Из них раствор выкачивают.
Ежегодно в мире добывается 40-50 тыс. тонн литиевого сырья.
Потенциальным лидером может стать Боливия, на территории которой обнаружены богатейшие запасы в солончаковой пустыне.
Технология получения
Способ получения металлического лития определяется сырьем:
- Руду преобразуют методом электролиза. Обработка расплава смеси хлоридов лития и калия происходит при 410-455°С. Затем удаляются примеси – методом вакуумной дистилляции, ректификации либо плавкой.
- Концентрацию в рассолах повышают выпариванием. Затем литий осаждают карбонатом натрия и гидроксидом кальция. Процесс длится полтора-два года.
У второго способа получения есть недостатки: медленность обработки и загрязненность конечного продукта трудноудаляемыми примесями. Но солончаки богаты, поэтому метод считается рентабельным. Именно его рассматривает как базовый для нужд своей корпорации Илон Маск.
Ученые пытаются извлечь литий из рассолов с помощью металл-органических мембран-каркасов.
В основе лежит воспроизведение функции аналогичных структур живых клеток. Ценный побочный продукт производства – пресная вода.
Третий источник лития – использованные литиевые аккумуляторы. Пока их переработка нерентабельна.
Где используется
Использование металла отражает тенденции развития технологий.
Традиционные отрасли
До недавнего времени главными сферами применения металла были ядерная отрасль и металлургия:
- Литий идет на стержни для реакторов. Жидкий изотоп служит теплоносителем в ядерных реакторах. Из него получают тритий.
- Металлургией используются сплавы, улучшающие характеристики продукта: прочность, устойчивость к коррозии, пластичность.
- Это также стекла, задерживающие часть ультрафиолета, керамика, пигмент для окрашивания тканей, ингредиент косметических препаратов.
Нитрат лития создает огни салюта красного цвета.
Литий в сплавах с другими металлами – новое поколение материалов для авиации, космонавтики, оборонпрома.
Новые сферы
Сегодня главные потребители сырья – IT-сфера и автопром нового поколения. Речь о литиевых аккумуляторах для гаджетов (айфоны, ноутбуки, планшеты) и электрокаров. В первую очередь автомобилей корпорации Илона Маска Tesla.
 Литий-ионный аккумулятор
Литий-ионный аккумулятор
Для создания батареи на одну Tesla требуется 63 кг чистого (99,5%) лития.
К 2023 году поставить производство электромобилей на поток намерены автогиганты США, Японии, Европы (Audi, Ford, Honda, Mercedes, BMW, другие). Годовая потребность в металле составит 96-98 тысяч тонн.
Значение для человека
Микродозы вещества присутствуют в организме человека:
- Литий распределен по организму: легкие, печень, ЖКТ, сердце, надпочечники, щитовидная железа, кровь.
- Без него невозможна работа иммунной системы, углеводный, жировой обмен.
- Вещество ставит щит аллергии, действует как седатив для нервной системы.
Суточная норма вещества для взрослого человека – 0,1-0,2 мг. Литий поступает с продуктами.
Литием богаты помидоры, картофель, мед, свекла, морковь, салат, морская рыба, пророщенная пшеница.
Излишек выводится из организма через почки.
Предостережение
Опасно проникновение вещества извне: человек чувствует себя разбитым, теряет аппетит, ощущает головокружение.
Литий самовоспламеняется при 280-290°C. Продуктами горения легко отравиться, они раздражают дыхательные пути. На влажной коже, слизистых оболочках от металла появляются ожоги.
Цены
В отличие от других металлов, эталонная цена на литий отсутствует. Это беспокоит инвесторов, создавая хаос на глобальном рынке.
На международных биржах литий чистоты 99% торгуют по $16-18 за кг. С 2008 года она выросла втрое.
Проверить совместимость мужчины и женщины по Знаку Зодиака
Литий, свойства атома, химические и физические свойства
Li 3 Литий
6,938-6,997 1s2 2s1
Литий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 3. Расположен в 1-й группе (по старой классификации — главной подгруппе первой группы), втором периоде периодической системы.
- Общие сведения
- Свойства атома лития
- Химические свойства лития
- Физические свойства лития
- Кристаллическая решётка лития
- Дополнительные сведения
Таблица химических элементов Д.И. Менделеева
Общие сведения:
| 100 | Общие сведения | |
| 101 | Название | Литий |
| 102 | Прежнее название | |
| 103 | Латинское название | Lithium |
| 104 | Английское название | Lithium |
| 105 | Символ | Li |
| 106 | Атомный номер (номер в таблице) | 3 |
| 107 | Тип | Металл |
| 108 | Группа | Щелочной металл |
| 109 | Открыт | Иоганн Аугуст Арфведсон, Швеция, 1817 г. |
| 110 | Год открытия | 1817 г. |
| 111 | Внешний вид и пр. | Очень лёгкий, очень мягкий металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 3 аллотропные модификации лития:
|
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | — литий c кубической объемно-центрированной кристаллической решёткой существует выше 70 K и иных стандартных условиях, — литий с гексагональной плотноупакованной кристаллической решёткой в интервале температур от 4,2 до 70 K и иных стандартных условиях, — литий с ромбоэдрической кристаллической решёткой существует ниже 4,2 K и иных стандартных условиях |
| 116 | Конденсат Бозе-Эйнштейна | 7Li |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,0017 % |
| 120 | Содержание в морях и океанах (по массе) | 0,000018 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 6,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | 6,0·10-9 % |
| 123 | Содержание в метеоритах (по массе) | 0,00017 % |
| 124 | Содержание в организме человека (по массе) | 3,0·10-6 % |
Свойства атома лития:
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 6,938-6,997 а.е.м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s1 |
| 203 | Электронная оболочка | K2 L1 M0 N0 O0 P0 Q0 R0  |
| 204 | Радиус атома (вычисленный) | 167 пм |
| 205 | Эмпирический радиус атома* | 145 пм |
| 206 | Ковалентный радиус* | 128 пм |
| 207 | Радиус иона (кристаллический) | Li+
|
| 208 | Радиус Ван-дер-Ваальса | 182 пм |
| 209 | Электроны, Протоны, Нейтроны | 3 электрона, 3 протона, 4 нейтрона |
| 210 | Семейство (блок) | элемент s-семейства |
| 211 | Период в периодической таблице | 2 |
| 212 | Группа в периодической таблице | 1-ая группа (по старой классификации – главная подгруппа 1-ой группы) |
| 213 | Эмиссионный спектр излучения |
Химические свойства лития:
Физические свойства лития:
| 400 | Физические свойства | |
| 401 | Плотность | 0,534 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело),
|
| 402 | Температура плавления* | 180,50 °C (453,65 K, 356,90 °F) |
| 403 | Температура кипения* | 1330 °C (1603 K, 2426 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 3,00 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 136 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 3,4122 Дж/г·K (при 25°C) |
| 410 | Молярная теплоёмкость | 24,86 Дж/(K·моль) |
| 411 | Молярный объём | 12,97383 см³/моль |
| 412 | Теплопроводность | 84,8 Вт/(м·К) (при стандартных условиях), 84,8 Вт/(м·К) (при 300 K) |
| 413 | Коэффициент теплового расширения | 46 мкм/(М·К) |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура | 2946,85 °C (3220 К, 5336,33 °F) – предположительно |
| 416 | Критическое давление | 67 МПа – предположительно |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм.рт.ст.) | 0,00776 мм.рт.ст. (при 527°C), 1 мм.рт.ст. (при 732°C), 5 мм.рт.ст. (при 828°C), 20 мм.рт.ст. (при 940°C), 40 мм.рт.ст. (при 1003°C), 60 мм.рт.ст. (при 1042°C), 100 мм.рт.ст. (при 1097°C), 200 мм.рт.ст. (при 1178°C), 400 мм.рт.ст. (при 1232°C) |
| 420 | Давление паров (Па) | 1 Па (при 797 K),
|
| 421 | Стандартная энтальпия образования ΔH | 0 кДж/моль (при 298 К, для состояния вещества – твердое тело), 2,4 кДж/моль (при 298 К, для состояния вещества – жидкость), 159,3 кДж/моль (при 298 К, для состояния вещества – газ) |
| 422 | Стандартная энергия Гиббса образования ΔG | 0 кДж/моль (при 298 К, для состояния вещества – твердое тело) |
| 423 | Стандартная энтропия вещества S | 29,1 Дж/(моль·K) (при 298 К, для состояния вещества – твердое тело), 34 Дж/(моль·K) (при 298 К, для состояния вещества – жидкость), 138,7 Дж/(моль·K) (при 298 К, для состояния вещества – газ) |
| 424 | Стандартная мольная теплоемкость Cp | 24,86 Дж/(моль·K) (при 298 К, для состояния вещества – твердое тело), 31,3 Дж/(моль·K) (при 298 К, для состояния вещества – жидкость), 20,79 Дж/(моль·K) (при 298 К, для состояния вещества – газ) |
| 425 | Энтальпия диссоциации ΔHдисс | |
| 426 | Диэлектрическая проницаемость | |
| 427 | Магнитный тип | Парамагнитный материал |
| 428 | Точка Кюри | |
| 429 | Объемная магнитная восприимчивость | +3,37·10-7 |
| 430 | Удельная магнитная восприимчивость | +6,3·10-9 |
| 431 | Молярная магнитная восприимчивость | +14,2·10-6 см3/моль (при 298 K) |
| 432 | Электрический тип | Проводник |
| 433 | Электропроводность в твердой фазе | 1,08·107 См/м (при 20 °C) |
| 434 | Удельное электрическое сопротивление | 92,8 нОм·м (при 20 °C) |
| 435 | Сверхпроводимость при температуре | |
| 436 | Критическое магнитное поле разрушения сверхпроводимости | |
| 437 | Запрещенная зона | |
| 438 | Концентрация носителей заряда | |
| 439 | Твёрдость по Моосу | 0,6 |
| 440 | Твёрдость по Бринеллю | 5 МПа |
| 441 | Твёрдость по Виккерсу | |
| 442 | Скорость звука | 6000 м/с (при 20 °C) (в тонком стержне) |
| 443 | Поверхностное натяжение | |
| 444 | Динамическая вязкость газов и жидкостей | |
| 445 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 446 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 446 | Предел прочности на растяжение | |
| 447 | Предел текучести | |
| 448 | Предел удлинения | |
| 449 | Модуль Юнга | 4,9 ГПа |
| 450 | Модуль сдвига | 4,2 ГПа |
| 451 | Объемный модуль упругости | 11 ГПа |
| 452 | Коэффициент Пуассона | |
| 453 | Коэффициент преломления |
Кристаллическая решётка лития:
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая объёмно-центрированная 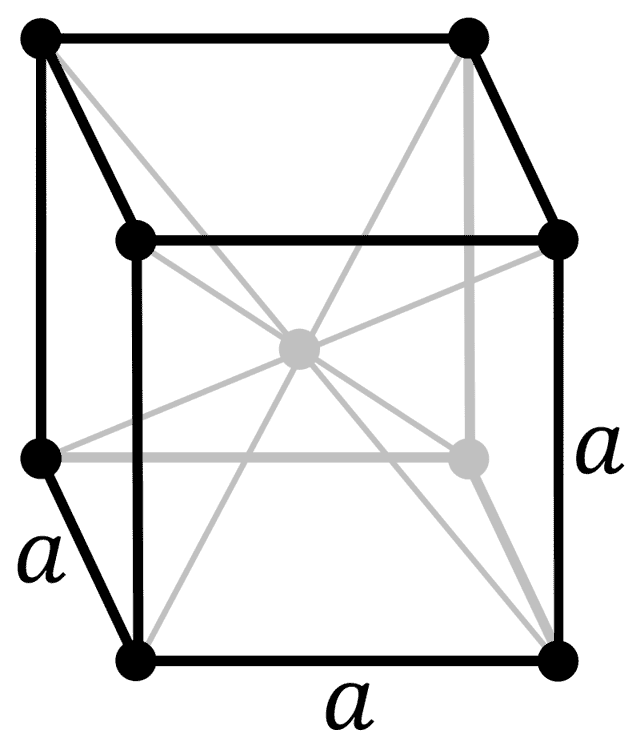 |
| 513 | Параметры решётки | 3,510 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 400 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 521 | Кристаллическая решётка #2 | |
| 522 | Структура решётки | Гексагональная плотноупакованная 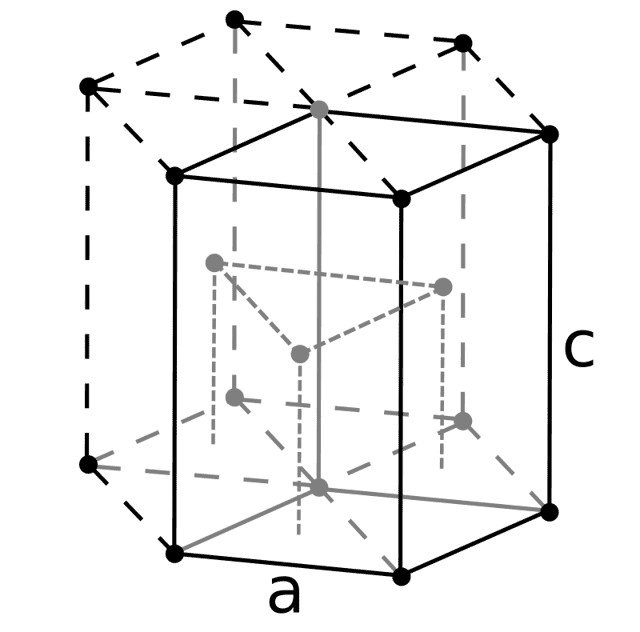 |
| 523 | Параметры решётки | a = 3,111 Å, c = 5,093 Å |
| 524 | Отношение c/a | 1,637 |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | P63/mmc |
| 527 | Номер пространственной группы симметрии | 194 |
Дополнительные сведения:
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-93-2 |
Примечание:
- 201* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
- 205* Эмпирический радиус атома лития [1] составляет 152 пм.
- 206* Ковалентный радиус лития согласно [1] и [3] составляет 128±7 пм и 134 пм соответственно.
- 402* Температура плавления лития согласно [3] составляет 180,54 °C (453,69 K, 356,97 °F).
- 403* Температура кипения лития согласно [3] составляет 1339,85 °C (613 K, 2443,73 °F).
- 407* Удельная теплота плавления (энтальпия плавления ΔHпл) лития согласно [3] и [4] составляет 2,89 кДж/моль и 4,2 кДж/моль соответственно.
- 408* Удельная теплота испарения (энтальпия кипения ΔHкип) лития согласно [3] и [4] составляет 148 кДж/моль и 138 кДж/моль соответственно.
Источники:
- https://en.wikipedia.org/wiki/Lithium
- https://de.wikipedia.org/wiki/Lithium
- https://ru.wikipedia.org/wiki/Литий
- http://chemister.ru/Database/properties.php?dbid=1&id=213
[know]
Таблица химических элементов Д.И. Менделеева
§ 35. Характеристика химического элемента по его положению в периодической системе
- а) Литий
- 1) Название химического элемента — литий, химический знак Li, относительная атомная масса 7.
- 2) Атомный (порядковый) номер в периодической системе 3, элемент 2-го периода (малого), IA-группы (главной).
3) Заряд ядра атома 3+ , оно содержит 3 прогона; в ядре нуклида 37Limathrm{^7_3Li}37Li 4 нейтрона. Так как заряд ядра лития равен 3+, то у него 3 электрона, которые размещаются на двух электронных слоях: 3Li  2e−, 1e−.mathrm{_3Li,, 2e^-,, 1e^-.}3Li2e−,1e−.
На внешнем (незавершенном) слое — один электрон.
4) Элемент относится к группе металлов. Его простое вещество при обычны условиях находится в твердом агрегатном состоянии. Формула простого вещества — Li.
5) Валентноеть лития в высшем оксиде равна 1, летучих водородных соединений не образует.
6) Формула высшего оксида — Li2Omathrm{Li_2O}Li2O. Taк как литий является типичным металлом, то этот оксид принадлежит к основным оксидам. Гидроксид, соответствующий ему, представляет собой основание (щелочь) — LiOHmathrm{LiOH}LiOH.
- 7) Летучего водородного соединения не образует.
- б) Азот
- 1) Название химического эле мента — азот, химический знак N, относительная масса 14,0.
- 2) Атомный (порядковый) номер в периодической системе 7, элемент 2-го периода (малого), VA-группы (главной).
3) Заряд ядра атома 7+, оно содержит 7 протонов; в ядре нуклида 714Nmathrm{^{14}_7N}714N 7 нейтронов. Так как заряд ядра азота равен 7+, то у него 7 электронов, которые размещаются на двух электронных слоях: 7N  2e−, 5e−.mathrm{_7N,, 2e^-,, 5e^-}.7N2e−,5e−. На внешнем (незавершенном) слое — пять электронов.
4) Элемент относится к группе неметаллов. Его простое вещество при обычных условиях находится в газообразном агрегатном состоянии. Формула простого вещества N2mathrm{N_2}N2.
5) Валентность азота в высшем оксиде равна V, так как это элемент V группы. Валентность в летучем водородном соединении равна III.
6) Формула высшего оксида — N2O5mathrm{N_2O_5}N2O5. Он принадлежит к кислотным оксидам. Гидроксид, соответствующий ему, предел являет собой кислоту HNO3mathrm{HNO_3}HNO3.
- 7) Формула летучего водородного соединения — NH3mathrm{NH_3}NH3.
- в) Алюминий
- 1) Название химического элемента — алюминий, химический знак Al, относительная масса 27.
- 2) Атомный (порядковый) номер в периодической системе 13, элемент 3-го периода (малого), IIIA-группы (главной).
3) Заряд ядра атома 13+, оно содержит 13 протонов; в ядре нуклида 1327Al  14mathrm{_{13}^{27}Al,, 14}1327Al14 нейтронов.
Так как заряд ядра алюминия равен 13+, то у него 13 электронов, которые размещаются на трех электронных слоях: 13Al  2e−, 8e−, 3e−mathrm{_{13}Al,, 2e^-,, 8e^-,, 3e^-}13Al2e−,8e−,3e−. На внешнем (незавершенном) слое — три электрона.
4) Элемент относится к группе металлов. Его простое вещество при обычных условиях находится в твердом агрегатном состоянии. Формула простого вещества — Al.
5) Валентность алюминия в высшем оксиде равна III, летучих водородных соединений не образует.
6) Формула высшего оксида A12O3mathrm{A1_2O_3}A12O3, оксид принадлежит к амфотерным оксидам. Гидроксид, соответствующий ему, проявляет амфотерные свойства — Al(OH)3mathrm{Al(OH)_3}Al(OH)3 или HAlO2mathrm{HAlO_2}HAlO2.
- 7) Летучего водородного соединения не образует.
- г) Хлор
- 1) Название химического эле мента — хлор, химический знак Cl, относительная масса 35.
- 2) Атомный (порядковый) номер в периодической системе 17, элемент 3-го периода (малого), VIIA-группы (главной).
3) Заряд ядра атома 17+, оно содержит 17 протонов; в ядре нуклида 1735Clmathrm{^{35}_{17}Cl}1735Cl 18 нейтронов. Так как заряд ядра хлора равен 17+, то у него 17 электронов, которые размещаются на трех электронных слоях: 17Cl  2e−, 8e−, 7e−.mathrm{_{17}Cl,, 2e^-,, 8e^-,, 7e^-.}17Cl2e−,8e−,7e−. На внеш нем (незавершенном) слое семь электронов.
4) Элемент относится к группе неметаллов. Его простое вещество при обычных условиях находится в газообразном агрегатном состоянии. Формула простого вещества — Cl2mathrm{Cl_2}Cl2.
5) Валентность хлора в высшем оксиде равна VII, так как это элемент VII-А группы. Валентность в летучем водородном соединении равна I.
6) Формула высшего оксида — Cl2O7mathrm{Cl_2O_7}Cl2O7. Он принадлежит к кислотным оксидам. Гидроксид, соответствующий ему, представляет собой кислоту — HClO4mathrm{HClO_4}HClO4.
7) Формула летучего водородного соединения — HClmathrm{HCl}HCl.
Литий
| Группа | 1 | Температура плавления | 180,50 ° С, 356,90 ° F, 453,65 К |
| Период | 2 | Точка кипения | 1342 ° С, 2448 ° F, 1615 К |
| Блокировать | s | Плотность (г см -3 ) | 0,534 |
| Атомный номер | 3 | Относительная атомная масса | 6,94 |
| Состояние при 20 ° C | Твердый | Ключевые изотопы | 7 Ли |
| Электронная конфигурация | [He] 2s 1 | Количество CAS | 7439-93-2 |
Использование и свойства элемента Литий
Объяснение изображения
Литий был обнаружен из минерала, в то время как другие обычные щелочные металлы были обнаружены из растительного материала. Считается, что это объясняет происхождение имени элемента; от «lithos» (греч. «камень»). В основе изображения лежит алхимический символ камня.
Внешность
Мягкий серебристый металл. У него самая низкая плотность из всех металлов. Активно реагирует с водой.
Использует
Наиболее часто литий используется в аккумуляторных батареях для мобильных телефонов, ноутбуков, цифровых фотоаппаратов и электромобилей. Литий также используется в некоторых неперезаряжаемых батареях, таких как кардиостимуляторы, игрушки и часы.
Металлический литий превращается в сплавы с алюминием и магнием, что улучшает их прочность и делает их легче. Для брони используется магниево-литиевый сплав. Алюминиево-литиевые сплавы используются в самолетах, велосипедных рамах и высокоскоростных поездах.Оксид лития используется в специальных стеклах и стеклокерамике.
Хлорид лития является одним из самых гигроскопичных известных материалов и используется в системах кондиционирования воздуха и промышленных сушильных установках (как и бромид лития). Стеарат лития используется как универсальная высокотемпературная смазка.
Карбонат лития используется в лекарствах для лечения маниакальной депрессии, хотя его действие на мозг до сих пор полностью не изучено. Гидрид лития используется как средство хранения водорода для использования в качестве топлива.
Биологическая роль
Литий не имеет известной биологической роли. Он токсичен, за исключением очень малых доз.
Природное изобилие
Литий не встречается в качестве металла в природе, но в небольших количествах он содержится в сочетании почти во всех магматических породах и в водах многих минеральных источников.
Сподумен, петалит, лепидолит и амблигонит — более важные минералы, содержащие литий.Большая часть лития в настоящее время производится в Чили из рассолов, которые дают карбонат лития при обработке карбонатом натрия.
Металл получают путем электролиза расплавов хлорида лития и хлорида калия.
История химического элемента Литий
Химические свойства
| Атомный радиус, несвязанный (Å) | 1,82 | Ковалентный радиус (Å) | 1,30 |
| Сродство к электрону (кДж моль -1 ) | 59,633 | Электроотрицательность (шкала Полинга) | 0,98 |
| Энергия ионизационной (кДж моль -1 ) | 1- й 520,2222- й 7298,153- й11815.0444 чт -5 чт -6 чт -7 чт -8 чт- |
Состояния окисления и изотопы Литий
| Общие состояния окисления | 1 | ||||
| Изотопы | Изотоп | Атомная масса | Естественное изобилие (%) | Период полураспада | Режим распада |
| 6 Ли | 6.015 | 7,59 | — | — | |
| 7 Ли | 7,016 | 92,41 | — | — |
Данные о давлении и температуре
| Удельная теплоемкость (Дж кг −1 K −1 ) | 3582 | Модуль Юнга (ГПа) | Неизвестно | |||||||
| Модуль сдвига (ГПа) | Неизвестно | Объемный модуль (ГПа) | 11.1 | |||||||
| Давление газа | ||||||||||
| Температура (K) | 400600800100012001400160018002000 г.22002400 | |||||||||
| 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 г. | 2200 | 2400 |
| Давление (Па) | 7,90 х 10-110,0004891.08109——- | |||||||||
| 7,90 х 10-11 | 0,000489 | 1.08 | 109 | — | — | — | — | — | — | — |
Adblockdetector






