- Щелочные металлы
- Общая характеристика
- Природные соединения
- Получение
- Химические свойства
- Оксиды щелочных металлов
- Получение
- Химические свойства
- Гидроксиды щелочных металлов
- Получение
- Химические свойства
- Щелочные металлы – список и особенности взрывоопасных элементов
- Что представляют собой
- Особенности структуры
- Как представлены в природе
- Технология получения
- Физико-химические свойства
- Физические характеристики
- Химические параметры
- Где используются
- Техника безопасности
- Щелочные металлы: общая характеристика, строение; свойства и получение простых веществ — урок. Химия, 9 класс
- Щелочной металл
- Реактивность
- Энергия ионизации
- Окислительно-восстановительный потенциал
- Растворимость
- Идентификация
- Атомная эмиссия
- Реакции
- Реакция с водой
- Реакция в аммиаке
- Реакция с водородом
- Реакция с кислородом
- Примечания и ссылки
Щелочные металлы.
Щелочные металлы — элементы главной подгруппы I группы Периодической системы химических элементов Д. И. Менделеева:
литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Данные металлы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
Основная характеристика щелочных металлов: В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на новом энергетическом уровне: их электронная конфигурация ns1.
Валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа.
Поэтому для всех щелочных металлов характерны восстановительные свойства. Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия — один из самых низких) и электроотрицательности (ЭО). Далее таблица свойств щелочных металлов:
| 3 | Литий Li | 0,152 | 0,078 | 5,32 | 0,98 | 0,53 | 181 | 1347 |
| 11 | Натрий Na | 0,190 | 0,098 | 5,14 | 0,93 | 0,97 | 98 | 883 |
| 19 | Калий K | 0,227 | 0,133 | 4,34 | 0,82 | 0,86 | 64 | 774 |
| 37 | Рубидий Rb | 0,248 | 0,149 | 4,18 | 0,82 | 1,53 | 39 | 688 |
| 55 | Цезий Cs | 0,265 | 0,165 | 3,89 | 0,79 | 1,87 | 28 | 678 |
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Щелочные металлы встречаются в природе в форме соединений, содержащих однозарядные катионы.
Многие минералы содержат в своём составе металлы главной подгруппы I группы.
Например, ортоклаз, или полевой шпат, состоит из алюмюсиликата калия K2[Al2Si6O16], аналогичный минерал, содержащий натрий — альбит — имеет состав Na2[Al2Si6O16].
В морской воде содержится хлорид натрия NaCl, а в почве — соли калия — сильвин KCl, сильвинит NaCl • KCl, карналлит KCl • MgCl2 • 6H2O, полигалит K2SO4 • MgSO4 • CaSO4 • 2H2O. Химические свойства щелочных металлов
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, азоту их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
1. Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий: При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
2. Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды: Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода: Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О22-и надпероксид-ион O2-.
Для тяжёлых щелочных металлов характерно образование довольно устойчивых озонидов состава ЭО3. Все кислородные соединения имеют различную окраску, интенсивность которой углубляется в ряду от Li до Cs:
| Li2O | Белый |
| Na2O | Белый |
| K2O | Желтоватый |
| Rb2O | Жёлтый |
| Cs2O | Оранжевый |
| Na2O2 | Светло- жёлтый |
| KO2 | Оранжевый |
| RbO2 | Тёмно- коричневый |
| CsO2 | Жёлтый |
Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя гидроксиды: 3. Взаимодействие с другими веществами. Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов: При нагревании щелочные металлы способны реагировать с другими металлами, образуя интерметаллиды. Активно (со взрывом) реагируют щелочные металлы с кислотами. Щелочные металлы взаимодействуют с органическими веществами спиртами (с образованием алкоголятов) и карбоновыми кислотами (с образованием солей): 4. Качественное определение щелочных металлов. Поскольку потенциалы ионизации щелочных металлов невелики, то при нагревании металла или его соединений в пламени атом ионизируется, окрашивая пламя в определённый цвет:
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Беловато-розовый |
| Cs | Фиолетово-красный |
- Получение щелочных металлов 1. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы:
- Соединения щелочных металлов. Гидроксиды
катод: Li+ + e → Li анод: 2Cl- — 2e → Cl2 2. Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов: катод: Na+ + e → Na анод: 4OH- — 4e → 2H2O + O2 Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород. Для получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрия электролизом концентрированного водного раствора поваренной соли:
Щелочные металлы
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
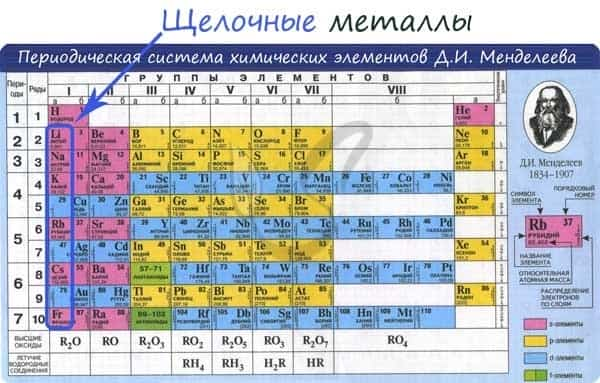
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns1:
- Li — 2s1
- Na — 3s1
- K — 4s1
- Rb — 5s1
- Cs — 6s1
- Fr — 7s1
Природные соединения
В природе щелочные металлы встречаются в виде следующих соединений:
- NaCl — галит (каменная соль)
- KCl — сильвин
- NaCl*KCl — сильвинит

Получение
Получить такие активные металлы электролизом водного раствора — невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно — безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
- Реакция с кислородом
- Li + O2 → Li2O (оксид лития)
- Na + O2 → Na2O2 (пероксид натрия)
- K + O2 → KO2 (супероксид калия)
- Реакции с неметаллами
- Li + H2 → LiH (в гидридах водород -1)
- Na + F2 → NaF (в фторидах фтор -1)
- Na + S → Na2S (в сульфидах сера -2)
- K + N2 → K3N (в нитридах азот -3)
- Реакция с водой
- Окрашивание пламени
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий — пероксид, калий, рубидий и цезий — супероксиды.
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда — взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH — натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: «… в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет». Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий — в желтый, калий — в фиолетовый, рубидий — синевато-красный, цезий — синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение
- Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
- Li + O2 → Li2O (оксид лития)
- В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
- Na2O2 + Na → Na2O
- KO2 + K → K2O
Химические свойства
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание — реакция идет, только если основание растворимо)
K2O + CO2 → K2CO3 (осн. оксид + кисл. оксид = соль)
Na2O + SO2 → Na2SO3 (обратите внимание — мы сохраняем СО серы +4)
Li2O + HCl → LiCl + H2O
Гидроксиды щелочных металлов
Относятся к щелочам — растворимым основаниям. Наиболее известные представители: NaOH — едкий натр, KOH — едкое кали.
Получение
- Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
- KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде — хлор)
- Li2CO3 + Ca(OH)2 → CaCO3↓ + LiOH
- K + H2O → KOH + H2↑
- Rb2O + H2O → RbOH

Химические свойства
Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
- LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке — получается кислая соль)
- 2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке — получается средняя соль)
- KOH + SO2 → KHSO3 (соотношение 1:1 — получается кислая соль)
- 2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 — получается средняя соль)
- NaOH + MgBr2 → NaBr + Mg(OH)2↓
- С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов — смешанных оксидов (при высоких температурах — прокаливании).
- NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
- NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел — смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
- Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
- NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
- NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
- В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
- NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

- NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
- Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам — и азотной, и азотистой.
- LiOH + NO2 → LiNO2 + LiNO3 + H2O
Щелочные металлы – список и особенности взрывоопасных элементов
Продукты на основе этих металлов стали неотъемлемой частью жизни человека. Это и поваренная соль, и пищевая сода, и марганцовка.
Щелочные металлы ценят преподаватели химии: опыты с такими субстанциями способны увлечь химией любого.

Что представляют собой
Щелочные металлы – это элементы, занимающие почти весь первый столбец таблицы Менделеева. Кроме них, там расположился только водород.
К щелочным металлам относятся:
- литий;

- натрий;
 Свежесрезанный натрий
Свежесрезанный натрий - калий.
 Калий под слоем ТГФ
Калий под слоем ТГФ
Плюс:
- рубидий;

- цезий;

- франций.
Названы щелочными вследствие растворимости соединений водой.
Результат воздействия воды – гидроксиды. Они также растворимы, потому называются щелочами.
Древние славяне под выщелачиванием подразумевали растворение вещества водой.
Особенности структуры
У атома щелочного металла на внешнем слое один электрон. Степень окисления у металлов группы одна – +1.
Этим обусловлена сходность характеристик элементов щелочного сегмента.
Как представлены в природе
Щелочная группа представлена на планете по-разному:
- Самые распространенные элементы – натрий с калием.
- Литий, рубидий, цезий причислены к редким и рассеянным.
- Самым редкостным щелочным металлом является франций. По редкости этот радиогенный материал – второй на планете: суммарный объем в земной коре не превышает трети килограмма.
Из-за повышенной активности щелочные металлы в природе не встречаются. Лишь как соединения с прочими элементами.
Поставщики натрия с калием:
- Хлорид натрия – обычная каменная соль. Ее содержит вода морей и океанов.
- Глауберова соль.
- Соли калия находят в почвах.
Металлы входят в структуру ряда минералов. Это в основном алюмосиликаты: альбит – натриевый; ортоклаз (полевой шпат) – калийный.
Технология получения
Щелочные металлы получают несколькими способами:
- Электролиз. Материалом служат расплавы их хлоридов (или других галогенидов) либо гидроксиды. Растворы солей как исходник не годятся: конечным продуктом становятся водород и щелочи.
- Восстановление из бромида, хромата либо хлорида. Восстановителями выступают магний, цирконий, кальций, кремний. Процесс получения протекает в вакууме при температурах под 1000°С, образующийся металл периодически отгоняется.
Натрий восстанавливают из карбоната. Ингредиенты: уголь, известняк, температура 990°C. Для промышленных нужд синтезируют гидроксид из крепкого раствора поваренной соли.
Физико-химические свойства
Металлы щелочного сегмента наделены общими и оригинальными физическими и химическими свойствами.
Физические характеристики
Элементы группы наделены общими физическими свойствами:
- Мягкость. Любой (кроме лития) легко режется.
- Легкость. Плотность лития, натрия, калия меньше единицы. Они не тонут в воде.
- Серебристо-белый цвет. Только цезий наделен желтоватостью на серебристом фоне.
- Металлический отблеск.
Оксиды группы обладают типичными для этого вида соединений свойствами: реагируют с водой, кислотами, их оксидами. У каждого свой цвет. Устойчивость и цветность оксидов щелочных элементов увязана с габаритами атома.
Химические параметры
Главная особенность щелочной группы – чрезмерная химическая активность:
- Разогретые щелочные элементы реагируют с азотом, кремнием, галогенами, серой, фосфором, углеродом. Результат – соответствующие продукты (галогениды, сульфиды, карбиды, силициды, др.)
- При нагревании с прочими металлами образуются полуметаллы (интерметаллиды).
- На воздухе сгорают.
При взаимодействии металлов с водой выделяется водород, возможен взрыв.
Окраска пламени щелочными металлами и их соединениями:
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Буро-красный |
| Cs | Фиолетово-красный |
Элементы, не тонущие в воде, горят и взрываются в ней:
- Калий создает пламя фиалковой гаммы, взрыв самый сильный.
- У натрия пламя желтое, взрыв послабее.
- Литий просто горит.
Взрывом заканчивается реакция с кислотами.
Все щелочные металлы бурно реагируют на воду. Процесс сопровождается водородным фонтаном, затем пламенем, взрывом.
Мирно протекают реакции со спиртами, карбоновыми кислотами, другими органическими субстанциями.
| Li2O | Белый |
| Na2O | Белый |
| K2O | Желтоватый |
| Rb2O | Жёлтый |
| Cs2O | Оранжевый |
| Na2O2 | Светло- жёлтый |
| KO2 | Оранжевый |
| RbO2 | Тёмно- коричневый |
| CsO2 | Жёлтый |
Вид щелочного металла «выдает» окрас пламени:
- Калий – фиолетовый.
- Цезий – красновато-фиалковый.
- Рубидий – цвет чайной розы.
- Литий – пурпурный.
Натрий либо его соединения делают пламя охристо-желтым.
Где используются
Промышленники оценили утилитарные свойства щелочных металлов. Они легкоплавки, пластичны (раскатываются до фольги), хорошо куются, пропускают тепло и электричество.
Самый известный продукт – поваренная соль (формула NaCl). Ее дополняют кальцинированная сода с едким натром (карбонат, гидроксид натрия), марганцовка (перманганат калия).
Их производят миллионами тонн:
- Каустическая сода (в просторечии едкий натр) – ингредиент при варке мыла, производстве алюминия, искусственных волокон.
- Кальцинированная сода – сырье для получения мыла, стекла, заменитель хозяйственного мыла.
Каустическая и кальцинированная сода, глауберова соль несъедобны. Только столовая сода и поваренная соль.
- Пищевая сода нашла применение как домашнее средство для устранения ангины, обязательный ингредиент выпечки, натуральный консервант.
Альбит и ортоклаз классифицируются как коллекционный и декоративно-поделочный материал.
Техника безопасности
Химически активные элементы требуют осторожности.
При самостоятельной работе соблюдают следующие правила:
- Перед началом работы надеть защитные перчатки и очки (маску).
- Кусочек отрезают скальпелем от массива, не вытаскивая из керосина.
- В емкости, заполненной аргоном, счищают с поверхности остатки оксидов.
- Очищенный образец помещают в сосуд, где будет проводиться опыт.
- Остатки, не затронутые реакцией, засыпают сухим спиртом.
Аналогичный порядок работы со щелочноземельными элементами. Они так же химически активны.
Щелочные и щелочноземельные металлы хранят притопленными в керосине: контакт с водой, воздухом заканчивается взрывом.
Проверить совместимость мужчины и женщины по Знаку Зодиака
Щелочные металлы: общая характеристика, строение; свойства и получение простых веществ — урок. Химия, 9 класс
Щелочными металлами называются химические элементы-металлы (IA) группы Периодической системы Д. И. Менделеева: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns1. Поэтому для всех металлов группы (IA) характерна степень окисления (+1).
Этим объясняется сходство свойств всех щелочных металлов.
Для них (сверху вниз по группе) характерно:
- увеличение радиуса атомов;
- усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
Основными источниками натрия и калия являются:
- каменная соль (хлорид натрия (NaCl)),
- глауберова соль, или мирабилит — декагидрат сульфата натрия Na2SO4 (·) 10H2O,
- сильвин — хлорид калия (KCl),
- сильвинит — двойной хлорид калия-натрия (KCl) (·)(NaCl) и др.
Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами (IA) группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.

Рис. (1). Литий

Рис. (2). Натрий
Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ=1,01 г/см3, у всех остальных металлов плотность меньше единицы.
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Все щелочные металлы активно реагируют с водой, выделяя из неё водород.
Пример:
2Na+2H2O=2NaOH+H2↑.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности.
Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах.
Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
- В расплаве хлорида натрия присутствуют ионы:
- NaCl⇄Na++Cl−.
- При электролизе
- на катоде восстанавливаются катионы Na+, а на аноде окисляются анионы Cl−:
- катод ((–)): 2Na++2e_=2Na,
- анод ((+)): 2Cl−−2e_=Cl2↑.
- Суммарное уравнение реакции при электролизе расплава хлорида натрия:
- 2NaCl→2Na+Cl2↑.
Источники:
Рис. 1. Литий © ЯКласс
Рис. 2. Натрий © ЯКласс
Щелочной металл
Щелочной металл представляет собой химический элемент в первой колонке ( 1 — й группы ) в периодической таблице , за исключением водорода .
Они являются литий — 3 Li, то натрия 11 На, калия 19 К, рубидий 37 Rb, то цезия 55 Cs и франций 87 Fr. Эти металлы из блока с имеющей электрон в валентной оболочке .
Они образуют семью очень однородный, предлагая лучший пример различий в химических и физических свойствах между элементами одной и той же группы периодической таблицы.
Щелочные металлы — это блестящие мягкие металлы, которые очень реактивны при нормальных условиях температуры и давления . Они легко теряют свой валентный электрон, образуя катион с электрическим зарядом +1.
Их можно разрезать ножом из-за их низкой твердости, обнажая блестящий срез, который быстро тускнеет на открытом воздухе из-за окисления под действием кислорода и влажности воздуха; лития также реагирует на азот атмосферного.
Их очень высокая химическая активность означает, что они вступают в реакцию с любыми следами влажности и никогда не встречаются в природе как естественные элементы ; они должны храниться в минеральном масле для защиты от воздуха, например в парафиновом масле .
Эта чувствительность увеличивается с их атомным номером , то есть вниз по столбцу: 5 е щелочной металл, цезий является наиболее реактивным из всех металлов.
Не натрий является наиболее распространенным щелочным металлом природной среды, а затем калием , то лития , то рубидий , то цезий и франций , что крайне редко (было бы не более тридцати грамм всей поверхности Земли) из — за к его очень высокой радиоактивности ( период полураспада 22 минуты).
Эти элементы используются в различных технологических и промышленных приложениях. Таким образом, рубидий и особенно цезий 133 используются в атомных часах и методах датирования , а 133 Cs обеспечивают наиболее точное измерение времени.
Натрий имеет множество промышленных применений, например, в качестве теплоносителя или в натриевых лампах . Соединения натрия, особенно органические, очень часто встречаются в повседневной жизни, такие как поваренная соль , состоящая из хлорида натрия , соды или даже отбеливателя .
Натрий и калий — это микроэлементы, которые играют важную физиологическую роль .
Слово «щелочной» происходит от заимствованного слова « щелочь» от арабского al-qily, обозначающего растительную золу, богатую калием.
Физические и химические свойства щелочных металлов можно легко объяснить их электронной конфигурацией n s 1 , где n — номер периода , который дает им слабую металлическую связь .
Следовательно, это мягкие металлы с низкой плотностью , температура плавления и кипения которых низкие, а энтальпия сублимации и испарения также довольно низкая. Они кристаллизуются в центрированной кубической структуре, и каждый из них имеет характерный цвет пламени из-за их очень легко возбудимого электрона s 1 .
Конфигурация n s 1 также придает щелочным металлам большой ионный радиус, а также высокую электропроводность и теплопроводность .
В химии щелочного металла преобладает потеря одного валентного электрона во внешнем подслое с образованием катиона в степени окисления 1, потому что оба из-за лабильного характера электрона — первая энергия ионизации щелочных металлов всегда самая низкая.
в их периоде — и высокое значение второй энергии ионизации из-за электронной конфигурации благородных газов катионов M + .
Химически хорошо известны только пять самых легких щелочных металлов, франций слишком радиоактивен, чтобы существовать в массивной форме, поэтому его химические свойства подробно не известны, а численные значения его свойств взяты из численных моделей; Однако то немногое, что мы знаем о нем, приближает этот элемент цезий в соответствии с численным моделированием.
| 6,941 ю | 180,54 ° С | 1341,85 ° С | 0,534 г · см -3 | 152 вечера | [ He ] 2s 1 | 520,2 кДж · моль -1 | 0,98 |
| 22,990 ед. | 97,72 ° С | 882,85 ° С | 0,968 г · см -3 | 186 вечера | [ Ne ] 3s 1 | 495,8 кДж · моль -1 | 0,93 |
| 39,098 ю | 63,38 ° С | 758,85 ° С | 0,890 г · см -3 | 227 вечера | [ Ar ] 4s 1 | 418,8 кДж · моль -1 | 0,82 |
| 85,468 ю | 39,31 ° С | 687,85 ° С | 1,532 г · см -3 | 248 вечера | [ Kr ] 5s 1 | 403,0 кДж · моль -1 | 0,82 |
| 132,905 ед. | 28,44 ° С | 670,85 ° С | 1,930 г · см -3 | 265 вечера | [ Xe ] 6s 1 | 375,7 кДж · моль -1 | 0,79 |
| [223] | 26,85 ° С | 676,85 ° С | 1,870 г · см -3 | — | [ Rn ] 7s 1 | 392,8 кДж · моль -1 | 0,70 |
Щелочные металлы образуют более однородное семейство, чем любые другие. Таким образом, калий , рубидий и цезий трудно отделить друг от друга из-за большого сходства их ионного радиуса ; лития и натрия , однако, являются более индивидуализированным.
Таким образом, по мере того, как человек движется вниз по столбцу периодической таблицы , атомный радиус увеличивается, электроотрицательность уменьшается, химическая реакционная способность увеличивается, а температуры плавления и кипения уменьшаются, как и энтальпия плавления и энтальпия испарения .
Их плотность увеличивается в целом от верха к низу колонны, за исключением калия , который менее плотен, чем натрий .
Щелочные металлы имеют серебристый цвет, за исключением цезия, который имеет бледно-золотистый оттенок, что делает последний одним из трех чистых цветных металлов, а двумя другими являются медь и золото ; в более тяжелых щелочноземельных металлов ( кальция , стронция и бария ), а также двухвалентные лантаноиды европия и иттербия , также показывают , бледно — желтый оттенок, но гораздо менее выражены , чем у цезия. Блеск щелочных металлов быстро тускнеет на открытом воздухе из-за образования слоя оксидов .
Реактивность
Все щелочные металлы очень реактивны и не существуют в чистом виде в естественной среде. По этой причине они хранятся в минеральном масле или парафиновом масле .
Они бурно реагируют с галогенами, образуя галогениды щелочных металлов (en) , которые являются водорастворимыми кристаллическими соединениями, за исключением фторида лития LiF. Щелочные металлы также вступают в реакцию с водой с образованием сильно основные гидроксиды , которые , следовательно , должны быть обработаны с осторожностью.
Самые тяжелые щелочные металлы обладают большей реакционной способностью, чем более легкие: при равном молярном количестве цезий при контакте с водой взрывается сильнее, чем калий.
Щелочные металлы реагируют не только с водой, но и с донорами протонов, такими как спирты и фенолы , газообразный аммиак и алкины , причем последние вызывают самые бурные реакции. Они также широко используются для восстановления других металлов из их оксидов или галогенидов .
Энергия ионизации
Первая энергия ионизации щелочного металла является самой низкой из периода в Периодической таблице из-за их низкого эффективного ядерного заряда (in) и легкости, с которой они принимают электронную конфигурацию благородного газа, теряя только один электрон.
Вторая энергия ионизации щелочных металлов всегда очень велика, что объясняется тем, что речь идет об удалении электрона из насыщенной подоболочки ближе к ядру атома . Это причина того, что щелочные металлы теряют только один электрон на образование катионов.
Щелочной анион (о) исключение: эти соединения , в которых щелочной металл находится в состоянии окисления -1. Они могут существовать постольку, поскольку имеют насыщенный подслой n s 2 . Анион M — наблюдается для всех щелочных металлов, кроме лития.
Анионы щелочных металлов представляют теоретический интерес из-за их необычной стехиометрии и низкого потенциала ионизации.
Особенно интересным примером является обратный гидрид натрия H + Na — , оба иона образуют комплекс, в отличие от гидрида натрия Na + H — : такие соединения нестабильны из-за высокой энергии, возникающей в результате смещения двух электронов от водорода к натрию. но некоторые производные могут быть метастабильными или стабильными.
Окислительно-восстановительный потенциал
С другой стороны, окислительно-восстановительный потенциал M + → M 0 является одним из редких свойств щелочных металлов, которое не демонстрирует единой тенденции в семействе: потенциал лития является аномальным, будучи значительно более отрицательным, чем у других, которые также немного уменьшается сверху вниз. Это объясняется тем фактом, что катион Li + имеет очень высокую энтальпию гидратации (en) в газовой фазе, которая компенсирует тот факт, что Li + сильно нарушает структуру воды, что вызывает изменение энтальпии. этот элемент, по-видимому, является наиболее электроположительным из щелочных металлов.
Растворимость
В водном растворе щелочные металлы образуют ионы общей формулы [M (H 2 O) n] + , n — число сольватации. Их геометрия и их координация хорошо согласуются с ожидаемыми в соответствии с их ионным радиусом .
Молекулы воды , которые связываются непосредственно с атомом металла в водном растворе, относятся к первой координационной сфере или первому сольватационному слою. Это координирующая ковалентная связь , при которой кислород отдает два электрона в связи.
Каждая координированная молекула воды, вероятно, связана с другими молекулами воды водородными связями . Это, как говорят, вторая сфера координации.
Однако это не очень хорошо определено в случае катионов щелочных металлов, поскольку эти катионы недостаточно электрически заряжены, чтобы поляризовать молекулы первого сольватного слоя до такой степени, что возникают водородные связи со вторым слоем молекул воды.
В случае лития число сольватаций катиона Li + было определено экспериментально со значением 4 с тетраэдрическим ионом [Li (H 2 O) 4] + . Число сольватации натрия, вероятно, будет равно 6 с октаэдрическим ионом [Na (H 2 O) 6] + , а у калия и рубидия, вероятно, будет 8 с ионами [K (H 2 O) 8] + и [Rb (H 2 O) 8] + антипризматический , а цезий, возможно, будет 12 с ионами [Cs (H 2 O) 12] + .
Идентификация
Атомная эмиссия
Известно, что пары щелочных металлов (или их ионов), возбуждаемые теплом или электричеством, излучают характерные цвета. Так спектроскопия сделала свои первые шаги благодаря экспериментам Бунзена и Кирхгофа .
Цвета в связи с тем , что спектр атомной эмиссии представляет собой линию спектр , а не непрерывный черный тело типа спектр , доказательство квантовой природы энергетических уровней в атомах и ионах .
Характерные цвета:
- литий : насыщенный розовый фуксия; поэтому широко используется в пиротехнике,
- натрий : интенсивный желто-оранжевый; используются в пиротехнике и в лампах уличного освещения,
- калий : бледно-лиловый.
Реакции
Реакция с водой
Известно, что щелочные металлы бурно реагируют с водой. Это насилие усиливается, когда мы спускаемся вместе с группой:
щелочной металл + вода → гидроксид щелочного металла + водород
Пример с натрием:
Твердый Na + Жидкая H 2 O→ водный NaOH + 1/2 газообразного H 2.
Эта реакция очень экзотермична и может привести к возгоранию или взрыву водорода с желтым пламенем. С калием пламя имеет сиреневый цвет .
Реакции щелочных металлов с водой могут быть, в зависимости от используемых количеств, очень опасными. Если в литиевых батареях при их разложении, например, после аварии, охлаждающая жидкость (вода) вступает в контакт (даже из-за простой влажности) с литием, это может вызвать возгорание, если температура благоприятствует этой реакции (20 ° C). .
Реакция в аммиаке
Щелочные металлы растворяются в жидком аммиаке, давая синие парамагнитные растворы .
Твердый Na + жидкий NH 3→ Na + solv + e — solv .
Из-за наличия свободных электронов раствор занимает больше, чем сумма объемов металла и аммиака. Свободные электроны делают эти растворы очень хорошими восстановителями .
Реакция с водородом
Щелочные металлы при взаимодействии с водородом образуют гидриды .
2 твердый газ Na + H 2→ 2 твердый NaH .
Эти гидриды очень нестабильны в растворе из-за своего основного характера и реагируют с водой с образованием водорода и гидроксидов .
Твердый NaH + жидкая H 2 O→ Na + сольв + OH — вод + H 2 газ.
Na + водн. + OH — водн. NaOH водн .⇌{ displaystyle rightleftharpoons}
Реакция с кислородом
При взаимодействии с кислородом щелочные металлы образуют оксид , растворимый в воде. Однако реакция должна поддерживаться нагреванием, например, в противном случае образуется пероксид или супероксид (а не оксид).
4 твердый газ Na + O 2→ 2 твердый Na 2 O : оксид .
2 твердый газ Na + O 2→ твердый Na 2 O 2 : перекись .
Твердый газ Na + O 2→ твердый NaO 2 (ru) : супероксид .
Сольватация оксида приводит к диссоциации соединений натрия и оксида. Оксид-ион нестабилен в растворе, и его основной характер приводит к депротонированию воды:
Твердый NaO 2 (ru) + H 2 O жидкость→ 2 Na + водн. + 2 ОН — водн.
Пероксиды и супероксиды диспропорционируют на кислород и оксид.
Примечания и ссылки
- ↑ (in) Справочник CRC по химии и физике , раздел 1: Основные константы, единицы и коэффициенты преобразования , подраздел: Электронная конфигурация нейтральных атомов в основном состоянии , 84- е онлайн-издание, CRC Press, Бока-Ратон, Флорида, 2003.
-
↑ (in) Джеймс Л. Дай, Джозеф М. Серасо, Мэй Локтак Б.Л. Барнетт и Фредерик Дж. Техан , « Кристаллическая соль аниона натрия (Na) » , Журнал Американского химического общества , Vol. 96, п о 2
Январь 1974 г., стр. 608-609 ( DOI 10.1021 / ja00809a060 , читать онлайн ) -
↑ (in) Фредерик Дж. Техан, Б.Л. Барнетт и Джеймс Л. Дай , « Щелочной анион. Получение и кристаллическая структура соединения, содержащего криптированный катион натрия и анион натрия » , Journal of the American Society , vol. 96, п о 23,
Ноябрь 1974 г., стр. 7203-7208 ( DOI 10.1021 / ja00830a005 , читать онлайн ) -
↑ (in) Джеймс Л. Дай , « Соединения анионов щелочных металлов » , Angewandte Chemie , vol. 18, п о 8,
Август 1979 г., стр. 587-598 ( DOI 10.1002 / anie.197905871 , читать онлайн ) -
↑ и б (в) М. Ю. Редько Мирча Vlassa James E. Jackson, Анджей W. Misiolek Rui H. Huang и Джеймс Л. Dye , » » Обратный Гидрид натрия «: кристаллическая соль , которая содержит H + и Na — » , Журнал Американского химического общества , вып. 124, п о 21,
Июнь 2002 г., стр. 5928-5929 ( DOI 10.1021 / ja025655 + , читать онлайн ) -
↑ (in) Агнешка Савицка, Петр Скурски и Джек Саймонс , « Обратный гидрид натрия: теоретическое исследование » , Журнал Американского химического общества , Vol. 125, п о 13,
2 апреля 2003 г., стр. 3954-3958 ( PMID 12656631 , DOI 10.1021 / ja021136v , читать онлайн ) - ↑
- Металл
- Щелочноземельный металл
- Бедный металл
- Переходный металл
- Химический портал






