- Атомно-кристаллическое строение металлов и сплавов
- Рекомендуемые материалы
- Атомно-кристаллическое строение металлов. Особенности кристаллического строения вещества
- Кристаллическое строение металлов и сплавов
- Кристаллическое строение сплавов
- Атомно – кристаллическая структура металлов
- Черные металлы
- Легкие цветные металлы
- Тяжелые цветные металлы
- Благородные металлы
- Редкоземельные и щелочные
- Классификация металлов по химическому составу
- Атомно — кристаллическое строение металлов
- Кристаллическое строение металлов
- Министерство образования и науки Украины
- Донбасский государственный технический университет
- Кафедра ОМД
- ЛЕКЦИЯ
- по дисциплине Металловедение
- на тему
- «Атомно-кристаллическое строение металлов»
Ст.преп. Горецкий Ю.В.
- Алчевск 2009
- «Атомно-кристаллическое строение металлов»
- 1. Строение металлов в твердом состоянии
- Все металлы и металлические сплавы – тела кристаллические, атомы (ионы) расположены в металле закономерно в отличие от аморфных тел, в которых атомы расположены хаотично.
Металлическое состояние возникает в комплексе атомов, когда при их сближении внешние электроны теряют связь с отдельными атомами, становятся общими, т.е. коллективизируются и свободно перемещаются между положительно заряженными и периодически расположенными ионами.
Устойчивость металла определяется электрическим притяжением между положительно заряженными ионами и обобщенными электронами (такое взаимодействие получило название металлической связи).
Сила связи в металлах определяется силами отталкивания и силами притяжения между ионами и электронами. Атомы (ионы) располагаются на таком расстоянии друг от друга, чтобы энергия взаимодействия была минимальной (рис. 1)
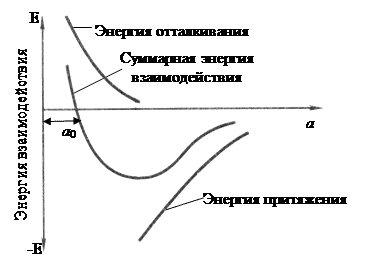
Рисунок 1. Энергетические условия взаимодействия атомов в кристаллической решетке вещества
Величина а соответствует расстояние между атомами в кристаллической решетке, а а0 соответствует равновесному расстоянию между атомами. В связи с этим в металле атомы располагаются закономерно, образуя правильную кристаллическую решетку, что соответствует минимальной энергии взаимодействия атомов.
Металлические состояния характеризуются высокой энергией связи между атомами. Мерой ее служит теплота сублимации (сумма энергии необходимой для перехода твердого металла к парообразному состоянию, для металла – от 20 до 200 ккал/(г·атом)).
2. Атомно-кристаллическое строение металлов
Под атомно-кристаллической структурой понимают взаимное расположение атомов, существующее в кристалле. Атомы в кристалле расположены в определенном порядке, который периодически повторяется в трех измерениях.
- Для описания атомно-кристаллической структуры пользуются понятием пространственной или кристаллической решетки.
- Кристаллическая решетка представляет собой воображаемую пространственную сетку, в узле которой располагаются атомы (ионы), образующие металл.
- Наименьший объем кристалла, дающий представление об атомной структуре металла во всем объеме, получил название элементарной кристаллической ячейки (решетки).
Для характеристики элементарной ячейки задают шесть величин: три ребра ячейки a, b, c и три угла между ними α, β, γ. Эти величины называют параметрами кристаллической решетки.
Кристаллические решетки бывают простыми (атомы только в вершинах решетки) и сложными.
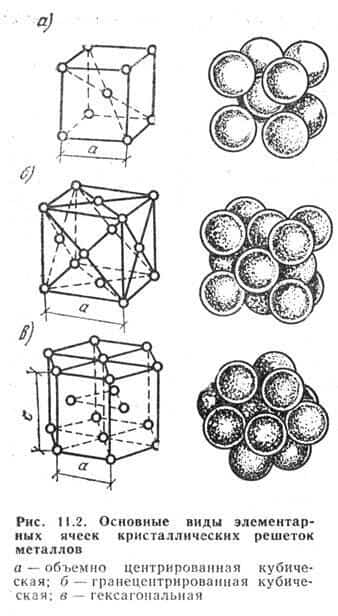
Металлы образуют одну из следующих высокосимметричных сложных решеток с плотной упаковкой атомов: кубическую объемноцентрированную (ОЦК), кубическую гранецентрированную (ГЦК) и гексагональную (ГПУ) (рис. 2).
- ОЦК: Rb, K, Na, Li, Tiβ, Tlβ, Zrβ, Ta, W, V, Feα, Cr, Nb, Ba, и др.
- ГЦК: Cu, Al, Pt, Pb, Ni, Ag, Au, Pd, Rh, Ir, Feγ, Coα, Caα, Ce, Srα, Th, Sc и др.
- ГПУ: Mg, Cd, Re, Os, Ru, Zn, Be, Coβ, Caα, Zrα, Laα, Tiα и др.
- Рисунок 2. Кристаллические решетки металлов и схемы упаковки атомов
- Расстояние между ближайшими параллельными атомными плоскостями, образующими элементарную ячейку, называют периодом решетки, измеряется в нанометрах (1нм = 10-9см = Å= 10-8см).
- Периоды решетки металлов находятся в пределах 0,2 – 0,7 нм.
- Для ОЦК: a, b, c; a = b = c.
- Для ГЦК: a, b, c; a = b = c.
- Для ГПУ: а, с; с/а = 1,633 (к Zn не относится)
- Число атомов в каждой элементарной ячейке (плотность упаковки – равняется числу атомов, приходящихся на одну элементарную ячейку):
- ОЦК: ПУ (плотноупакованная) = ;
- ГЦК: ПУ = ;
- Координационное число – под ним понимают число атомов, находящихся на равном и наименьшем расстоянии от данного атома. Чем выше координационное число, тем больше плотность упаковки атомов:
- ОЦК: расстояние (min) между атомами , на этом расстоянии от рассматриваемого атома находится 8 соседей – К8 .
- ГЦК: , К12.
- ГПУ: Г12 (с/а = 1,633).
- Коэффициент заполнения ячейки (плотность укладки) – определяется как отношение объема, занятого атомами к объему ячейки:
- ОЦК: 68%
- ГЦК: 74%
- ГПУ: 74%
Для характеристики величины атома служит атомный радиус, под которым понимается половина расстояния между ближайшими соседними атомами. Атомный радиус возрастает при уменьшении координационного числа.
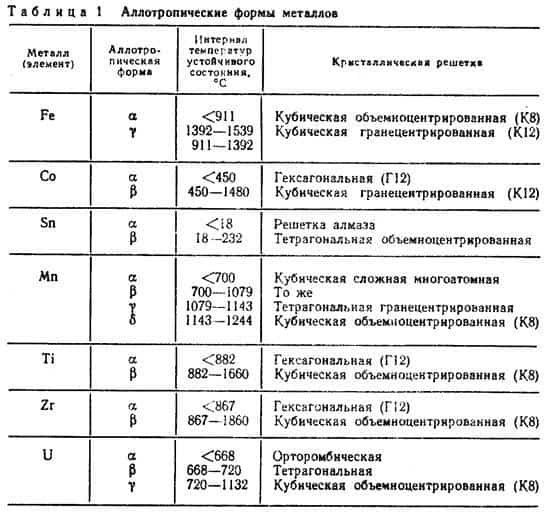
- 3. Полиморфные (аллотропические) превращения
- Атомы металла – исходя из геометрических соображений, могут образовать любую кристаллическую решетку.
- Однако устойчивым, а, следовательно, реально существующим типом является решетка, обладающая наиболее низким запасом свободной энергии.
Многие металлы в зависимости от температуры могут существовать в разных кристаллических формах (т.н. полиморфных (аллотропических) модификациях). В результате полиморфного превращения атомы кристаллического тела, имеющего решетку одного типа, перестраиваются таким образом, что образуется кристаллическая решетка другого типа.
Полиморфную модификацию, устойчивую при более низкой температуре, для большинства металлов принято обозначать буквой α, при более высокой температуре β, затем γ и т.д.
- Полиморфное превращение протекает при постоянной температуре (например, при нагреве идет поглощение теплоты).
- Известные полиморфные превращения: Feα ↔ Feβ; Coα ↔ Coβ; Tiα ↔ Tiβ; Mnα ↔ Mnβ ↔ Mnγ ↔ Mnδ; Snα ↔ Snβ, а также для Ca, Li, N, Cs, Sr, Te, Zr, V и др.
- Металл с данной кристаллической решеткой должен обладать меньшим запасом свободной энергии.
Рисунок 3. Полиморфизм железа и его связь со свободной энергией системы
Полиморфизм железа. Из рис. 3, видно, что в интервале температур 911 – 1392°С устойчивым является γ-железо (К 12) (имеет min свободную энергию), а при температурах ниже 911°С и выше 1392°С устойчиво α-железо (К 8).
В твердом металле полиморфные превращения происходят в результате зарождения и роста кристаллов аналогично кристаллизации из жидкого состояния. Зародыши новой модификации наиболее часто возникают на границах зерна исходных кристаллов.
В результате полиморфного превращения образуется новые кристаллические зерна, имеющие другой размер и форму, поэтому превращение также называют перекристаллизацией.
Полиморфное превращение сопровождается скачкообразным изменением всех свойств металлов и сплавов: удельного объема, теплоемкости, теплопроводности, электропроводности, магнитных свойств, механических и химических свойств и т.д.
Высокотемпературная модификация имеет высокую пластичность.
В таблице № 1 показан интервал температур существования различных аллотропических форм некоторых, имеющих практическое значение металлов, у которых обнаружена температурная аллотропия.
4. Анизотропия свойств металлов
Из атомно-кристаллического строения металлов видно, что плотность расположения атомов по различным плоскостям в кристаллических решетках неодинакова (рис. 4).
Вследствие неодинаковой плотности атомов в различных плоскостях и направлениях решетки многие свойства (химические, физические, механические) каждого кристалла зависят от направления решетки. Подобная неодинаковость свойств монокристалла в разных кристаллографических направлениях называется анизотропией.
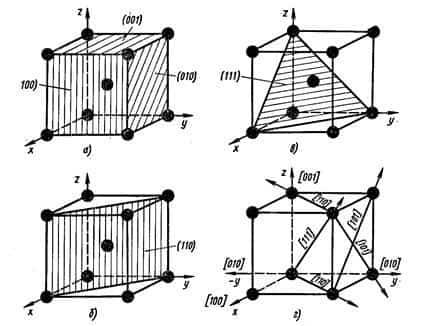
Рисунок 4. Расположение атомов в различных плоскостях и направлениях в кубической решетке (ОЦК)
Кристалл – тело анизотропное в отличие от аморфных тел (стекло, пластмассы и т.д.), свойства которых не зависят от направления.
Технические металлы являются поликристаллами, т.е. состоят из большого числа анизотропных кристаллов. В большинстве случаев, как уже указывалось выше, кристаллы статистически неупорядоченно ориентированы один по отношению к другому, поэтому во всех направлениях свойства более или менее одинаковы, т.е.
поликристаллическое тело является изотропным (вернее – квазиизотропным (ложная изотропия)). Такая мнимая изотропность не будет наблюдаться, если кристаллы имеют одинаковую преимущественную ориентировку в каких-то направлениях.
Эта ориентированность, или текстура, создается в известной степени, но не полностью в результате значительной холодной деформации; в этом случае поликристаллический металл приобретает анизотропию свойств.
Литература
1. Лахтин Ю.М., Леонтьева В.П. Материаловедение. М., 1972, 1980.
2. Гуляев А.П. Металловедение. М., 1986.
3. Новиков И.И. Дефекты кристаллического строения металлов. М., 1983.
4. Антикайн П.А. Металловедение. М., 1972.
Атомно-кристаллическое строение металлов и сплавов
2. Атомно-кристаллическое строение металлов и сплавов
Физико-механические свойства металлов тесно связаны с особенностями их кристаллического строения. В твердом состоянии атомы всех металлов и металлических сплавов располагаются в строгом порядке, образуя в пространстве правильную кристаллическую решетку. В промышленных металлах наиболее распространены следующие кристаллические решетки (рис. 11.
2): кубическая объемно-центрированная, кубическая гранецентрированная и гексагональная. В элементарной кубической объемно — центрированной решетке находится девять атомов (восемь в вершинах куба и один в центре). Такую решетку имеет железо при температуре до 910°С и выше 1390°С, хром, вольфрам, ванадии и др.
В кубической гране центрированной решетке 14 атомов (восемь в вершинах куба и по одному в центре каждой грани). Такую решетку имеют: железо при температуре 910-1390°С, медь, никель, алюминий и др. В гексагональной решетке, имеющей форму шестигранной призмы, 17 атомов (12 в вершинах, два в центре оснований и три внутри призмы).
Данная решетка имеется у магния, цинка и других металлов.
Возможны и другие формы кристаллических решеток. Атомы в решетке находятся на определенных расстояниях один от другого. Эти расстояния очень малы и вычисляются в нанометрах (1 нм = 10-9 м). Расположение атомов, межатомные расстояния, насыщенность атомами все, что влияет на качество металлов.
Размеры кристаллической решетки характеризуются параметрами (периодами) – расстояниями между центрами атомов, расположенных в узлах элементарной ячейки. Например, для железа эти параметры равны 28,4 — 36,3 нм. При этом плотность и степень упаковки атомов кристаллической решетки характеризуется отношением объема, занятого атомами, к объему кристаллической решетки.
В зависимости от формы кристаллической ячейки и степени ее упаковки каждый атом имеет различное число взаимных контактов с другими атомами.
Эта величина характеризуется координационным числом – числом атомов, находящихся на наиболее близком равном расстоянии от данного атома: при кубической объемно-центрированной решетке – К18; при кубической гранецентрированной – К12 и др.
Каждый металл имеет свою характерную кристаллическую ячейку, которая многократно повторяется и образует решетку его структуры.
В металлах действуют различные виды физико-химической связи: металлическая, ван-дер-ваальсовая, ионная и ковалентная. В переходных металлах, к которым относится сталь, преобладает металлическая связь, возникающая за счет сил притяжения между решеткой из положительно заряженных ионов и окружающим их «газом » свободных электронов.
При отсутствии внешней нагрузки атомы в кристалле находятся на равновесных расстояниях. Если приложить сжимающую нагрузку, то атомы будут сближаться до такого расстояния, при котором внутренние отталкивающие силы уравновесят внешние сжимающие силы. При растяжении кристалла расстояние между атомами увеличивается до тех пор, пока силы притяжения не уравновесят внешнюю нагрузку.
Сопротивление деформированию определяется сопротивлением сдвигу одного атомного слоя относительно другого, соседнего. В случае приложения внешней силы наряду со сдвигом разрушение может произойти путем отрыва одной части кристалла от другой.
Теоретически вычисленные напряжения, необходимые для отрыва одного атомного слоя от другого, на несколько порядков выше, чем прочность реальных кристаллов.
Столь большое расхождение между теоретической и реальной прочностью металлов обусловлено дефектами кристаллов. Дефекты, в кристаллах по геометрическим признакам разделяют на точечные, линейные, поверхностные и объемные. Точечные имеют размер порядка диаметра атома. К ним относят чужеродные атомы (примеси), вакансии, межузельные атомы и др.
Линейные дефекты обладают сечением порядка атома и одним протяженным размером. Это дислокации различных типов, цепочки вакансий, межузельных атомов. К поверхностным дефектам причисляют границы зерен и блоков, свободные поверхности кристаллов и др., они имеют только один малый размер – толщину.
К объемным дефектам относят в кристаллах микротрещины, поры, различные включения.
Рекомендуемые материалы
Дислокации играют главную роль в процессах пластической деформации металлов, они в значительной мере определяют их реальную прочность. Дислокации бывают краевые, винтовые и смешанные криволинейные.
Возникают они в металлах в процессе кристаллизации, пластической деформации и по другим причинам, вызывающим создание в кристаллической решетке полей напряжений, приводящих к соответствующим локальным деформациям и смещениям. Краевые, или линейные, дислокации характеризуются появлением в кристалле добавочной незавершенной атомной плоскости (экстраплоскости).
Дислокация называется положительной (рис. 11.3), если экстраплоскость лежит в верхней части кристалла, и отрицательной, если она расположена в нижней части кристалла.
Винтовая дислокация (рис. 11.4) появляется, если в кристалле сделать надрез и сдвинуть вниз одну часть кристалла относительно другой на одно межатомное расстояние (на рис. 11.4 плоскость сдвига заштрихована).
Как видно из рисунка, смещение уменьшается от точки А к точке В, что вызывает изгиб атомных плоскостей.
Несовершенная область вокруг линии ВС называется винтовой дислокацией, так как после появления такого несовершенства атомные плоскости кристалла закручиваются подобно винтовой лестнице.
Дефекты кристаллического строения возникают уже в процессе кристаллизации металла. Взаимодействие дефектов между собой приводит к образованию новых несовершенств. Нарушения правильности кристаллического строения приводят к изменению свойств металла.
Дислокации оказывают большое влияние на прочностные характеристики металла. На рис. 11.5 показана обобщенная зависимость между прочностью и плотностью дислокаций D. Идеальные (бездефектные) кристаллы имеют теоретическую прочность. К этому значению приближается прочность сверхтонких кристаллов с диаметром порядка 1 мкм и менее, практически не содержащих дислокаций. Такие кристаллы получили название нитевидных (НК).
Достигнув минимального значения при некоторой критической плотности дислокаций, реальная прочность вновь начинает возрастать. Повышение реальной прочности с возрастанием плотности дислокаций выше D кр объясняется тем, что при этом возникают не только параллельные друг другу дислокации, но и дислокации в разных плоскостях и направлениях. Такие дислокации будут мешать друг другу перемещаться, т. е. в элементарный акт пластической деформации будет вовлекаться одновременно все большее число атомов, и реальная прочность металла повысится. Традиционными способами упрочнения металлов, ведущими к увеличению плотности дислокаций, являются механический наклеп, измельчение зерна и общее фрагментирование кристаллов в результате термообработки.
Пространственные кристаллические решетки образуются в металле при его переходе из жидкого состояния в твердое. Этот процесс называется кристаллизацией. Превращения, происходящие в процессе кристаллизации, имеют важное значение, так как в значительной степени определяют свойства металла. Кристаллизация состоит в следующем. В жидком металле атомы непрерывно движутся.
По мере понижения температуры движение замедляется, атомы сближаются и группируются в кристаллы. Эта первичная группа кристаллов получила название центров кристаллизации. Далее к этим центрам присоединяются вновь образующиеся кристаллы. Одновременно продолжается образование новых центров.
Таким образом, кристаллизация состоит из двух стадии: образования центров кристаллизации и роста кристаллов вокруг этих центров.
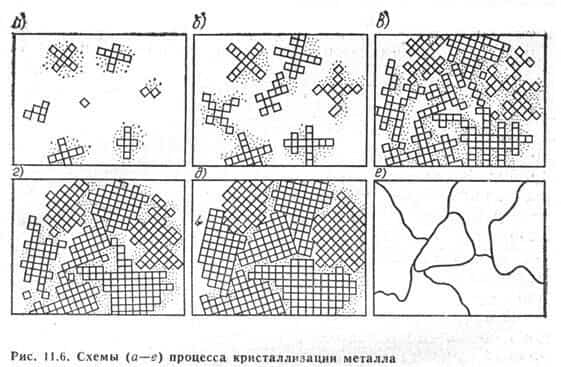
На рис. 11.6 показан механизм кристаллизации. Сначала рост кристаллов не встречает препятствий (рис. 11.6, а,б), и растущие кристаллы сохраняют правильность строения кристаллической решетки.
При дальнейшем движении кристаллы сталкиваются, и образовавшиеся зерна имеют уже неправильную форму, но сохраняют правильность строения внутри каждого кристалла. Такие группы кристаллов называют зернами (рис. 11.6, в-д). На рис. 11.
6, е показаны границы зерен различных размеров. Размеры зерен зависят от природы металла и условий его кристаллизации.
При охлаждении расплава металла с началом его кристаллизации падение температуры прекращается, на кривой охлаждения (рис. 11.7) образуется горизонтальный участок (см. левый график).
Это объясняется тем, что группировка атомов идет с выделением теплоты. По окончании затвердевания температура снова понижается.
По закону кристаллизации чистых металлов каждый металл кристаллизуется при строго индивидуальной температуре.
Температуру, при которой металл переходит из жидкого состояния в твердое, называют температурой первичной кристаллизации. Кроме первичной кристаллизации, возможна и вторичная – изменение кристаллического строения металлов в твердом состоянии.
Вам также может быть полезна лекция «3 Прямая сумма гильбертовых пространств».
При быстром отводе теплоты некоторые металлы способны определенное время находиться в жидком состоянии при температуре ниже границы первичной кристаллизации. Это явление объясняют следующим образом.
В результате быстрого отвода теплоты образуется много центров кристаллизации и происходит их интенсивный рост, что приводит к выделению значительного количества теплоты, способной некоторое время поддерживать металл в жидком состоянии и даже повышать его температуру.
Металлы обладают свойствами аллотропии, т. е. способностью одного и того же химического элемента при различной температуре иметь разную кристаллическую структуру. Аллотропические превращения сопровождаются выделением или поглощением теплоты.
Железо имеет четыре аллотропические формы: -Fe; -Fe; -Fe; -Fe. Практическое значение имеют только -Fe -Fe так как -Fe и -Fe отличаются от -Fe только величиной межатомного расстояния, а для -Fe характерно отсутствие магнитных свойств.
Температура, при которой происходит переход металла из одной аллотропической формы в другую, называется критической. Точки этих температур видны на диаграмме охлаждения чистого железа (см. рис. 11.8) как температуры горизонтальных участков, свидетельствующих о том, что фазовые превращения происходят с выделением теплоты.
Технические металлы и сплавы представляют собой поликристаллические тела, т. е. тела, состоящие из большого числа различно ориентированных кристаллических зерен; поперечные размеры этих зерен 0,001-0,1 мм.
Поэтому в целом металлы и сплавы можно считать условно изотропными телами, т. е. обладающими одинаковыми свойствами по всем направлениям.
Атомно-кристаллическое строение металлов. Особенности кристаллического строения вещества
Материальный мир: его структура и методы преобразования.Материальный мир — это вещи которые нас окружают и которые можно потрогать. Например, стул, стол, ручка. В окружающем нас пространстве материя существует в форме вещества и поля. Вещество в природе находится в виде различных структур, которые определяют строение и свойства окружающего нас материального мира.
Слово «строение» в данном случае отражает лестницу объектов, качественно отличающихся или характеризующихся степенью сложности. Окружающий нас мир современная наука разделяет на три области: микромир, макромир и мегамир Макромир — это область природы, доступная нам, т. е. область наших закономерностей.
Мегамир нам труднодоступен; это область крупных объектов, больших размеров и расстояний между ними. Эти закономерности мы изучаем опосредованно.
В этих областях имеется следующая иерархия объектов: микромир — это вакуум, элементарные частицы, ядра, атомы, молекулы, клетки; макромир — это макротела (твердые тела, жидкости, газы, плазма), индивид, вид, популяция, сообщество, биосфера; мегамир — это планеты, звезды, галактики, Метагалактика, Вселенная. 2. Естественнонаучные представления о материи.
Материя – это философская абстракция, понятие, посредством которого обозначается многообразие природных явлений и процессов, обозначается объективная реальность, которая дана человеку в его ощущениях, существуя независимо от них.
Современные естественно-научные представления о структуре материи базируются на следующих положениях: каждое материальное образование, отдельная вещь представляет собой единство вещества и поля.
Главное отличие вещества от поля заключается в том, что вещество обладает массой покоя, механической массой, тогда как электромагнитное, гравитационное и другие поля, а также нейтрино массой покоя не обладают. Вещество относительно непроницаемо, скорость движения частиц вещества всегда меньше скорости света, в веществе – значительная концентрация массы и энергии.
Поле не имеет массы покоя, легко проницаемо, обладает волновой природой, характеризуется f слабой концентрацией массы и энергии, а также скоростью света. Вещество и поле могут взаимно превращаться друг в друга: так, при столкновении электрона и позитрона, обладающих вещественными свойствами частиц, образуются два фотона (кванта света), т.е.
вещественная форма превращается в полевую форму материи, при этом не происходит уничтожения материи как таковой. Вещество как одно из важнейших видов материи состоит из молекул и может находиться в пяти различных состояниях: твердом, жидком, газообразном, плазменном и нейтронном.
Плазма – такое состояние вещества, когда в его атомах в результате нагревания до многих миллионов градусов деформируются электронные оболочки, возможны реакции ядерного синтеза.
Нейтронное состояние вещества предполагает его уплотнение до такой степени, что структура атома нарушается, электронные оболочки «сминаются», а размеры атома оказываются практически размерами ядра (вещество таких нейтронных небесных тел в силу огромной гравитации не испускает даже электромагнитного излучения). Молекулы состоят из атомов, атомы, в свою очередь, состоят из ядра и вращающихся вокруг него электронов. Стабильность ядра, состоящего из нуклонов – положительно заряженных протонов и не обладающих электрическим зарядом нейтронов, поддерживается за счет быстрого обмена между ними пи-мезонами. Электроны удерживаются на своих орбитах, благодаря притяжению противоположных зарядов электрона и протона, а также за счет своеобразного обмена с ядром фотонами: таким образом компенсируются центробежные силы. Все элементарные частицы обладают корпускулярно-волновыми свойствами. В структурном отношении многие из них являются сложными системными образованиями, в составе которых обнаружены кварки и глюоны. Тем самым подтвердилось предсказание о том, что электрон также неисчерпаем, как и атом.
Атомно-кристаллическое строение металлов. Особенности кристаллического строения вещества.
Каждый металл (вещество) может находиться в четырех агрегатных состояниях: газообразном, жидком, твердом и в виде плазмы. В газообразном состоянии расстояние между атомами (частицами) велико, силы взаимодействия малы и атомы хаотично пере- мещаются в пространстве, отталкиваясь друг от друга.
Атомы газообразного вещества обладают большой кинетической энергией. В жидком металле атомы сохраняют лишь ближний порядок, т.е. в небольшом объеме упорядоченно и закономерно расположено небольшое количество атомов.
Ближний порядок неустойчив, он может возникать и исчезать под действием тепловых колебаний.
Общее свойство металлов и сплавов — их кристаллическое строение, характеризующееся определенным закономерным расположением атомов в пространстве. Для описания атомно-кристаллической структуры используют понятие кристаллической решетки, являющейся воображаемой пространственной сеткой с ионами (атомами) в узлах.
Атомно-кристаллическая структура может быть представлена не рядом периодически повторяющихся объемов, а одной элементарной ячейкой. Так называется ячейка, повторяющаяся во всех трех измерениях. Трансляцией этого наименьшего объема можно полностью воспроизвести структуру кристалла (рис. 1.1).
В кристалле элементарные частицы (атомы, ионы) сближены до соприкосновения. Для упрощения пространственное изображение принято заменять схемами, где центры тяжести частиц представлены точками. В точках пересечения прямых линий располагаются атомы; они называются узлами решетки.
Расстояния a, b и c между центрами атомов, находящихся в соседних узлах решетки, называют параметрами, или периодами решетки. Величина их в металлах порядка 0,1–0,7 нм, размеры элементарных ячеек — 0,2–0,3 нм.
На рис. 1.2 показаны три типа элементарных ячеек кристаллических решеток, наиболее характерные для металлов: объемноцентрированная кубическая (ОЦК); гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГП), а также схемы упаковки в них атомов.
6. Типы кристаллических решёток.
Твердые вещества, как правило, имеют кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой.
Точки, в которых размещены частицы, называются узлами кристаллической решетки. В узлах воображаемой решетки могут находиться ионы, атомы или молекулы. Они совершают колебательные движения. С повышением температуры амплитуда колебаний возрастает, что проявляется в тепловом расширении тел.
В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Число ближайших соседних частиц, вплотную примыкающих к данной частице в кристалле или в отдельной молекуле, называется координационным числом.
В решетке хлорида натрия координационные числа обоих ионов равны 6. Итак, в кристалле хлорида натрия нельзя выделить отдельные молекулы соли. Их нет.
Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов Na+ и Cl-, NanCln, где n — большое число . Связи между ионами в таком кристалле весьма прочны.
Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи.
Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и уменьшению прочности связи между ними. Поэтому расплавы их проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде.
Кристаллические решетки, состоящие из молекул (полярных и неполярных), называются молекулярными.
Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решеткой невелико.
Примерами их являются лед, твердый оксид углерода (IV) («сухой лед»), твердые галогеноводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (F2, Сl2, Br2, I2, Н2, О2, N2), трех- (О3), четырех- (Р4), восьми- (S8) атомными молекулами. Молекулярная кристаллическая решетка йода показана на рис . Большинство кристаллических органических соединений имеют молекулярную решетку.
Дата добавления: 2018-05-13; просмотров: 744; Мы поможем в написании вашей работы!
 Мы поможем в написании ваших работ!
Мы поможем в написании ваших работ!
Кристаллическое строение металлов и сплавов
Определение 1
Металлы – это группа элементов периодической таблицы Менделеева, которые являются восстановителями с положительной степенью окисления, обладают твердостью, пластичностью и упругостью, обусловленными их кристаллическим строением.
Кристаллические решетки металлов представляют собой атомы, упорядоченные определенным образом. В состав каждого атома входят несколько отрицательно заряженных электронов и положительно заряженное ядро. Атомы металлов мало электронов, поэтому они являются ионами.
Единица кристаллической решетки представляет собой элементарную кристаллическую ячейку, в гранях и узлах которой находятся ионы. Вместе их удерживают металлические связи, которые возникают в результате беспорядочного движения отделившихся от атомов электронов.
Отрицательно заряженные электроны держат на равном расстоянии положительно заряженные электроны.
Подавляющему большинству металлов свойственно образование высокосимметричных кристаллических решеток с плотной упаковкой атомов. Самыми распространенными типами кристаллических решеток атомов являются:
- Объемно-центрированная кубическая кристаллическая решетка, которая представляет собой куб с дополнительными атомами, которые находятся в центре. Такая решетка имеется у железа, хрома, вольфрама, молибдена и ванадия.
- Гранецентрированная кубическая кристаллическая решетка, которая представляет собой куб с дополнительными атомами, находящиеся центре каждой грани. Такая решетка имеется у железа, алюминия, меди, никеля, а также золота.
- Гексагональная плотноупакованная кристаллическая решетка с шестиугольниками в нижнем и верхнем основаниях, которые образованы расположенными там атомами, а также одним атомом в центре каждого шестиугольника. Внутри каждой фигуры находится три атома. Такая решетка имеется у кадмия, цинка, магния и других металлов.
- Тетрагональная кристаллическая решетка получается в результате растягивания куба вдоль одной оси. Данный тип решетки может быть гранецентрированным и объемноцентрированным. Такую решетку имеют радий и индий.
У некоторых видов металлов кристаллическая решетка изменяется в результате изменения температуры. Данное явления называется аллотропией или полиморфизм. Такое явления может быть причиной изменения свойств металла, а характерно оно для цинка, железа, олова и циркония.
Кристаллическое строение сплавов
Определение 2
Сплав – это вещество, которое получается в результате сплавления двух и более элементов.
Составляющими сплава могут быть неметаллы и металлы. Кроме основных элементов в сплаве могут присутствовать примеси. Примеси могут улучшать и ухудшать свойства сплава.
Кристаллическое строение сплава значительно сложнее нежели, чем у металла.
Его кристаллическое строение напрямую зависит от взаимодействия компонентов сплава, которые образуют в процессе кристаллизации однородные объемы, которые разграничены поверхностями раздела. Компоненты в сплаве могут образовывать:
- Химическое соединение. В данном случае компоненты сплава химически взаимодействуют, в результате чего образуется новая кристаллическая решетка, которая отличается от решеток компонентов. В большинстве случаев, химические соединения образуются из тех компонентов, которые имеют существенные различия в электронном строении атомов и в типах кристаллических решеток.
- Твердый раствор. В данном случае компоненты сплава взаимнорастворимы. Один из компонентов твердого раствора сохраняет свою кристаллическую решетку, а второй компонент в виде отдельных атомов распределяется внутри кристаллической решетки первого, при этом форма решетки первого компоненты не изменяется, а размеры изменяются незначительно. Атомы растворяющегося элемента либо замещают в кристаллической решетке часть атомов растворителя, либо размещаются между атомами металла растворителя. Твердые растворы внедрения могут образовываться в том случае, когда диаметры атомов растворенного компонента значительно меньше диаметра атома металла растворителя, а также имеют близкое строение валентной оболочки.
- Механическая смесь. В данном случае составляющие сплава обладают полной взаимной нерастворимостью и имеют различные кристаллические решетки. Таким образом сплав будет состоять из смеси кристаллов составляющих его компонентов. У механической смеси постоянная температура плавления. Механическая смесь, которая образовалась в результате одновременной кристаллизации из расплава называется эвтектикой, а та, которая образовалась в процессе превращения в твердом состоянии, — эвтектоид. Примером эвтектики в белых чугунах является ледебурит, а примером эвтектоида — перлит в чугунах и сталях.
Для кристаллических решеток характерны разнообразные структурные несовершенства, которые могут значительно изменять свойства. У реального единичного кристалла всегда есть наружная (свободная) поверхность, на которой из-за поверхностного натяжения кристаллическая решетка искажена. Данное искажение может распространиться на зону, которая прилегает к свободной поверхности.
Дефекты внутреннего строения делятся на линейные (цепочки вакансий, смещение атомных дислокаций и плоскостей) плоскостные и точечные (дислоцированные атомы, вакансии, примесные атомы и т.п.).
Дефекты кристаллической решетки оказывают существенное влияние на протекание таких процессов, как самодиффузия и диффузия, которыми определяются скорости химических реакций и ионная проводимость кристаллов.
Атомно – кристаллическая структура металлов
Индустрия делит металлы на большие группы:
- Черные.
- Цветные легкие.
- Цветные тяжелые.
- Благородные.
- Редкоземельные и щелочные.
Черные металлы
В эту группу входят железо, марганец, хром и их сплавы. Группа также включает в себя стали, чугуны и ферросплавы. Эти вещества обладают хорошей электропроводностью и уникальными магнитными характеристиками.
Черные металлы
Черные металлы покрывают до 90% мировой потребности в металлоизделиях.
Легкие цветные металлы
Отличаются низкой плотностью. Группа включает в себя алюминий, титан, магний. Эти реже встречаются, чем железо, и обходятся дороже в добыче руды и в производстве. Они используются там, где малый вес изделия или детали окупает ее большую стоимость – в самолетостроении, производстве электроники, в коммуникационной индустрии.
Легкие цветные металлы
Титан не вызывает отторжения со стороны иммунной системы и применяется в протезировании костной ткани.
Тяжелые цветные металлы
Это элементы с большим удельным весом, такие, как медь, олово, свинец, цинк и никель. Обладают хорошей электропроводностью.
Медь Олово Цинк Свинец Чистый никель
Они широко используются как катализаторы реакций, в изготовлении электроматериалов, в электронике, на транспорте – везде, где требуются достаточно прочные, упругие и коррозионностойкие материалы.
Благородные металлы
В эту группу входят золото, серебро, платина, а также редко встречающееся рутений, родий, палладий, осмий, иридий. Они обладают наибольшим удельным весом, высокой коррозионной устойчивостью и высокой электрической и тепловой проводимостью.
- Золото и платина
- Серебро
- На заре человечества золото, серебро и платина применялись как универсальный платежный инструмент и как средство накопления богатств. С развитием цифровой экономики и переходом платежей в виртуальность важнее стаи их уникальные физические свойства
Редкоземельные и щелочные
К редкоземельным относятся скандий, иттрий, лантан и еще 15 редких элементов. Эти элементы отличаются значительным удельным весом, высокой химической активностью и применяются в высокотехнологичных отраслях.
- Иттрий
- Сканидий
- Лантан
К щелочным относятся литий, калий, натрий и другие. Все они отличаются малым удельным весом и исключительной химической активностью и при реакции с водой образуют щелочи, широко применяемы в быту и промышленности в составе мыла и других моющих средств.
Щелочные металлы
Классификация металлов по химическому составу
Химические свойства чистых элементов определяются строением атомов реальных металлов и прежде всего их атомным числом, характеризующим их способность реагировать с водородом, кислородом и другими элементами. Химические характеристики реально применяемых металлов могут сильно отличаться от параметров чистого вещества как в лучшую, так и в худшую сторону.
Нежелательные добавки называют примесями, а те, что вносятся преднамеренно для изменения параметров в нужную сторону — легирующими присадками.
Общепризнанной является классификация, основанная на указании главного компонента сплава.
Атомно — кристаллическое строение металлов
Внутреннее строение металлов и их характеристики определяют их физико-химические свойства. Электроны на внешних орбитах атомов слабо связаны с ядром и имеют отрицательный заряд. При наличии разницы потенциалов электроны мигрируют к положительному полюсу, создавая электрический ток. Это физическое явление обуславливает электропроводность.
Кристаллическое строение свойственно металлам и их сплавам в твердом фазовом состоянии. Атомы выстраиваются в определенную объемную структуру, называемую кристаллической решеткой.
Число атомов в вершинах и на гранях этой структуры, а также дистанция между ними определяют такие физические свойства металла, как электро- и теплопроводность, вязкость, текучесть и т.д.
Кристаллическое строение металлов и сплавов может быть двух типов:
- Межатомная дистанция одинакова по всем направлениям. Это так называемое изотропное строение. При этом физические свойства кристалла также одинаковы по всем направлениям.
- Межатомное расстояние по горизонтали и по вертикали разное. Такой кристалл называют анизотропным, и его физические параметры меняются в зависимости от направления.
Атомно-кристаллическое строение металлов
В реальном куске металлов, составленному из множества изолированных кристаллических фрагментов, атомно кристаллическое строение принадлежит к третьему типу — квазиизотропному. В среднем свойства такого куска близки к изотропным.
При выстраивании кристаллической решетки некоторые атомы не попадают на свое место, смещаются или теряются. В этом случае говорят о дефектах кристаллического строения металлов.
Дефекты структуры отрицательно влияют на свойства изделия, особенно если оно должно быть монокристаллом, как, например, в электронике, лазерной технике и других отраслях высоких технологий.
Кристаллическое строение металлов
Общее свойство металлов и сплавов — их кристаллическое строение, характеризующееся определенным закономерным расположением атомов в пространстве. Для описания атомно-кристаллической структуры используют понятие кристаллической решетки, являющейся воображаемой пространственной сеткой с ионами (атомами) в узлах.
Атомно-кристаллическая структура может быть представлена не рядом периодически повторяющихся объемов, а одной элементарной ячейкой. Так называется ячейка, повторяющаяся во всех трех измерениях.
В кристалле элементарные частицы (атомы, ионы) сближены до соприкосновения. Для упрощения пространственное изображение принято заменять схемами, где центры тяжести частиц представлены точками.
В точках пересечения прямых линий располагаются атомы; они называются узлами решетки. Расстояния a, b и c между центрами атомов, находящихся в соседних узлах решетки, называют параметрами, или периодами решетки.
Величина их в металлах порядка 0,1–0,7 нм, размеры элементарных ячеек — 0,2–0,3 нм.
Для однозначного описания элементарной ячейки кристаллической решетки необходимо знание величин параметров a, b, c и углов между ними.
В 1848 г. Французский ученый Бравэ показал, что изученные трансляционные структуры и элементы симметрии позволяют выделить 14 типов кристаллических решеток.
Для характеристики кристаллических решеток вводят понятия координационного числа и коэффициента компактности. Координационным числом I называется число атомов, находящихся на наиболее близком и равном расстоянии от данного атома.
Для ОЦК решетки координационное число равно 8, для решеток ГЦК и ГП оно составляет 12. Из этого следует, что решетка ОЦК менее компактна, чем решетки ГЦК и ГП.
В решетке ОЦК каждый атом имеет всего 8 ближайших соседей, а в решетках ГЦК и ГП их 12.
Если принять, что атомы в решетке представляют собой упругие соприкасающиеся шары, то нетрудно видеть, что в решетке, помимо атомов, имеется значительное свободное пространство. Плотность кристаллической решетки, т. Е. объем, занятый атомами, характеризуется коэффициентом компактности.
Коэффициент компактности Q равен отношению суммарного объема атомов, входящих в решетку, к объему решетки: где R — радиус атома (иона); n — базис, или число атомов, приходящихся на одну элементарную ячейку; V — объем элементарной ячейки.
Для простой кубической решетки n = (1/8) ? 8 = 1; V = a3 = (2R)3, коэффициент компактности Q = 52 %.
На решетку ОЦК приходится два атома: один центральный и один как сумма от вершин куба, так как ячейке принадлежит 1/8 атома от каждого угла.
Для ОЦК решетки n = (1/8) ? 8 + 1 = 2. Учитывая, что атомы соприкасаются по диагонали куба, длина которой равна 4 атомным радиусам, параметр решетки а коэффициент компактности QОЦК = 68 %.
Проведя аналогичные вычисления, найдем QГЦК = 74 %, QГП = 74 %.
Таким образом, решетки ГЦК и ГП более компактны, чем ОЦК.
Некоторые металлы при разных температурах могут иметь различную кристаллическую решетку. Способность металла существовать в различных кристаллических формах носит название полиморфизма или аллотропии. Принято обозначать полиморфную модификацию, устойчивую при более низкой температуре, индексом a (a-Fe), при более высокой индексом b, затем y и т.д (где а – альфа, b – бетта и y – гамма).
- Известны полиморфные превращения железа:
- Fea






