- Физические свойства металлов
- Химические свойства металлов
- Механические свойства металлов
- Технологические свойства металлов
- Таблицы свойств металлов
- Таблица «Свойства металлов: Чугун, Литая сталь, Сталь»
- Таблица «Свойства пружинной стали»
- Таблица «Свойства кузовных тонколистовых металлов»
- Таблица «Свойства цветных металлов»
- Таблица «Свойства легких сплавов»
- Таблица «Металлокерамические материалы (PM)1) для подшипников скольжения»
- Таблица «Свойства металлокерамических материалов (РМ)1 для конструкционных деталей»
- Магнитные материалы
- Таблица «Свойства магнитомягких материалов»
- Магнитомягкие металлы
- Таблица «Свойства магнитной листовой и полосовой стали»
- Материалы для преобразователей и электрических реакторов
- Магнитная проницаемость листового сердечника для классов сплавов С21, С22, Е11, Е31 и Е41 для секции тонколистового сердечника EY11
- Материалы для реле постоянного тока
- Таблица «Свойства материалов для реле постоянного тока»
- Металлокерамические материалы для магнитомягких компонентов
- Таблица «Свойства металлокерамических материалов для магнитомягких компонентов»
- Магнитомягкие ферриты
- Таблица «Свойства магнитомягких ферритов»
- Свойства металлов: химические, физические, технологические
- Химические свойства
- Физические свойства
- Механические свойства
- Технологические свойства
- Интересные факты
- Видео
- Общие свойства металлов
- Урок 5: Общие свойства металлов
- Строение атомов металлов
- Разновидности металлов
- Щелочные металлы
- Химические свойства щелочных металлов
- Взаимодействие с неметаллами
- Взаимодействие со сложными веществами
- Щелочноземельные металлы
- Химические свойства
- Взаимодействие с неметаллами
- Взаимодействие со сложными веществами
- d- металлы
- Железо
- Медь
- Цинк
- Цветной и черный металлы
- Способы получения металлов
- Электролиз
- Электролиз расплавов
- Электролиз воды
- Свойства металлов
- Физические свойства металлов
- Химические свойства металлов
- Взаимодействие металлов с кислотами
- Взаимодействие металлов с азотной кислотой (HNO3)
- Взаимодействие металлов с разбавленной азотной кислоты
- Нахождение металлов в природе
- Урановая руда
- Сплавы
- Алюминиевые сплавы
- Вывод

Металлы, это группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск. В данной статье все свойства металлов будут представлены в виде отдельных таблиц.
Свойства металлов делятся на физические, химические, механические и технологические.
Физические свойства металлов
К физическим свойствам относятся: цвет, удельный вес, плавкость, электропроводность, магнитные свойства, теплопроводность, теплоемкость, расширяемость при нагревании.
Удельный вес металла — это отношение веса однородного тела из металла к объему металла, т.е. это плотность в кг/м3 или г/см3.
Плавкость металла — это способность металла расплавляться при определенной температуре, называемой температурой плавления.
Электропроводность металлов — это способность металлов проводить электрический ток, это свойство тела или среды, определяющее возникновение в них электрического тока под воздействием электрического поля.
Под электропроводностью подразумевается способность проводить прежде всего постоянный ток (под воздействием постоянного поля), в отличие от способности диэлектриков откликаться на переменное электрическое поле колебаниями связанных зарядов (переменной поляризацией), создающими переменный ток.
Магнитные свойства металлов характеризуются: остаточной индукцией, коэрцетивной силой и магнитной проницаемостью.
Теплопроводность металлов — это их способность передавать тепло от более нагретых частиц к менее нагретым. Теплопроводность металла определяется количеством теплоты, которое проходит по металлическому стержню сечением в 1см2, длиной 1см в течение 1сек. при разности температур в 1°С.
Теплоемкость металлов — это количество теплоты, поглощаемой телом при нагревании на 1 градус. Отношение количества теплоты, поглощаемой телом при бесконечно малом изменении его температуры, к этому изменению единицы массы вещества (г, кг) называется удельной теплоёмкостью, 1 моля вещества — мольной (молярной).
Расширяемость металлов при нагревании.Все металлы при нагревании расширяются, а при охлаждении сжимаются. Степень увеличения или уменьшения первоначального размера металла при изменении температуры на один градус характеризуется коэффициентом линейного расширения.
Химические свойства металлов
К химическим — окисляемость, растворимость и коррозионная стойкость.
Окисление металлов — это реакция соединения металла с кислородом, сопровождающаяся образованием окислов (оксидов). Если рассмотреть окисляемость шире, то это реакции, в которых атомы теряют электроны и образуются различные соединения, например, хлориды, сульфиды. В природе металлы находятся в основном в окисленном состоянии, в виде руд, поэтому их производство основано на процессах восстановления различных соединений.
Растворимость металлов — это их способность образовывать с другими веществами однородные системы — растворы, в которых металл находится в виде отдельных атомов, ионов, молекул или частиц. Металлы растворяются в растворителях, в качестве которых выступают сильные кислоты и едкие щелочи. В промышленности наиболее часто используются: серная, азотная и соляные кислоты, смесь азотной и соляной кислот (царская водка), а также щелочи — едкий натр и едкий калий.
Коррозионная стойкость металлов — это их способность сопротивляться коррозии.
Механические свойства металлов
- К механическим — прочность, твердость, упругость, вязкость, пластичность.
- Прочностью металла называется его способность сопротивляться действию внешних сил, не разрушаясь.
- Твердостью металлов называется способность тела противостоять проникновению в него другого, более твердого тела.
- Упругость металлов — свойство металла восстанавливать свою форму после прекращения действия внешних сил, вызвавших изменение формы (деформацию).
Вязкость металлов — это способность металла оказывать сопротивление быстро возрастающим (ударным) внешним силам.
Вязкость — свойство обратное хрупкости.
Пластичность металлов — это свойство металла деформироваться без разрушения под действием внешних сил и сохранять новую форму после прекращения действия сил. Пластичность—свойство обратное упругости.
Технологические свойства металлов
- К технологическим — прокаливаемость, жидкотекучесть, ковкость, свариваемость, обрабатываемость резанием.
- Прокаливаемость металлов – это их способность получать закаленный слой определенной глубины.
- Жидкотекучесть металлов — это свойство металла в жидком состоянии заполнять литейную форму и воспроизводить ее очертания в отливке.
- Ковкость металлов —это технологическое свойство, характеризующее их способность к обработке деформированием, например, ковкой, вальцеванием, штамповкой без разрушения.
- Свариваемость металлов — это их свойство образовывать в процессе сварки неразъемное соединение, отвечающее требованиям, обусловленным конструкцией и эксплуатацией производимого изделия.
Обрабатываемость металлов резанием — это их способность изменять геометрическую форму, размеры, качество поверхности за счет механического срезания материала заготовки режущим инструментом. Обрабатываемость металлов зависит от их механических свойств, в первую очередь прочности и твердости.
Современными методами испытания металлов являются механические испытания, химический анализ, спектральный анализ, металлографический и рентгенографический анализы, технологические пробы, дефектоскопия. Эти испытания дают возможность получить представление о природе металлов, их строении, составе и свойствах, а также определить качество готовых изделий.
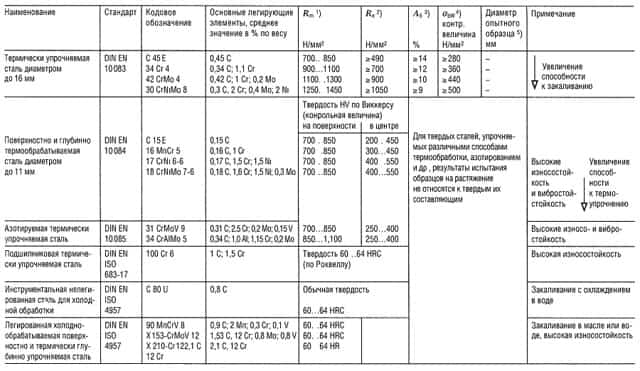
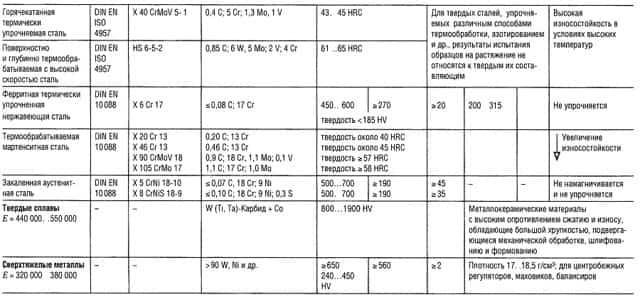
Таблицы свойств металлов
Таблица «Свойства металлов: Чугун, Литая сталь, Сталь»
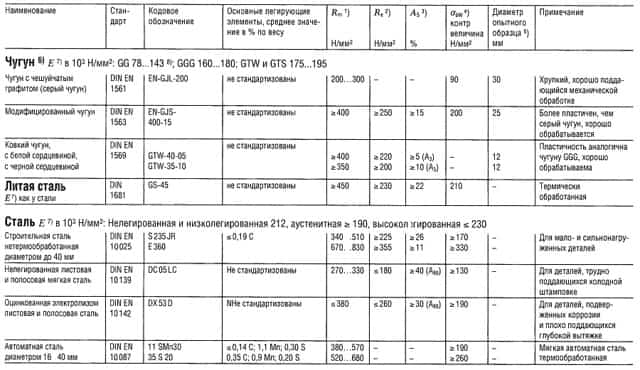
- Предел прочности на растяжение
- Предел текучести (или Rp 0,2);
- Относительное удлинение образца при разрыве;
- Предел прочности на изгиб;
- Предел прочности на изгиб приведен для образца из литой стали;
- Предел усталости всех типов чугуна, зависит массы и сечения образца;
- Модуль упругости;
- Для серого чугуна модуль упругости уменьшается с увеличением напряжения растяжения и остается практически постоянным с увеличением напряжения сжатия.
Таблица «Свойства пружинной стали»
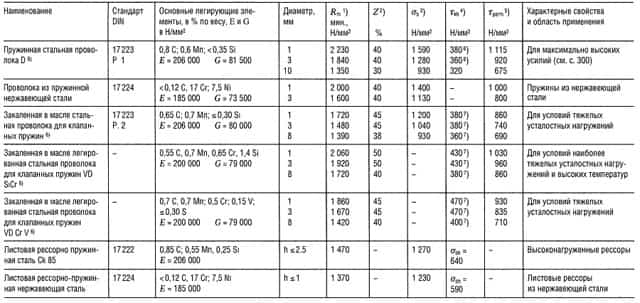
- Предел прочности на растяжение,
- Относительное уменьшение поперечного сечения образца при разрыве,
- Предел прочности на изгиб;
- Предел прочности при знакопеременном циклическом нагружении при N ⩾ 107,
- Максимальное напряжение при температуре 30°С и относительном удлинении 1 2% в течение 10 ч; для более высоких температур см. раздел «Способы соединения деталей»;
- 480 Н/мм2 для нагартованных пружин;
- Приблизительно на 40% больше для нагартованных пружин
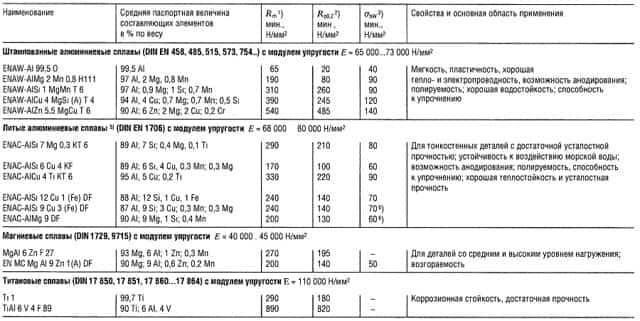
Таблица «Свойства кузовных тонколистовых металлов»
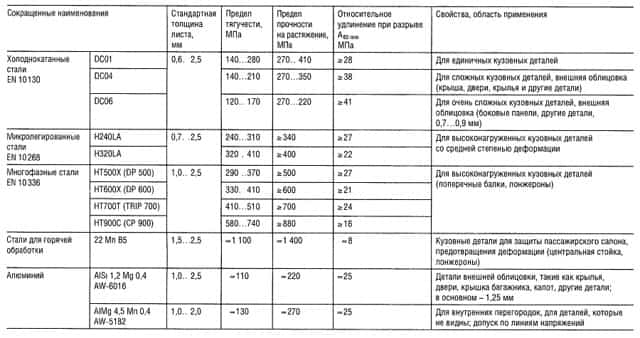
Таблица «Свойства цветных металлов»
- Модуль упругости, справочные данные;
- Предел прочности на растяжение;
- Предел текучести, соответствующий пластической деформации 0,2%;
- Предел прочности на изгиб;
- Наибольшая величина;
- Для отдельных образцов
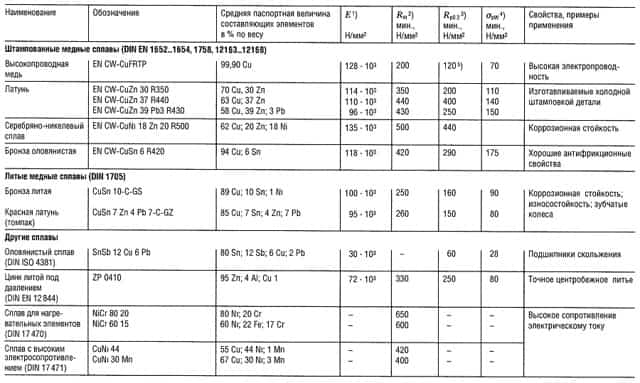
Таблица «Свойства легких сплавов»
- Предел прочности на растяжение;
- Предел текучести, соответствующий пластической деформации 0,2%;
- Предел прочности на изгиб;
- Наибольшая величина;
- Показатели прочности приведены для образцов и для отливок;
- Показатели предела прочности на изгиб приведены для случая плоского нагружения
Таблица «Металлокерамические материалы (PM)1) для подшипников скольжения»
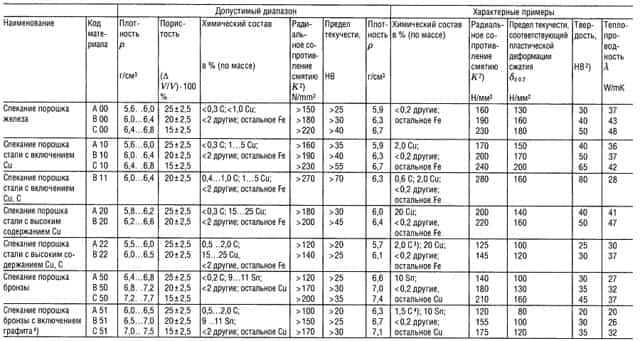
- В соответствии со стандартом DIN 30 910,1990 г. издания;
- Применительно к подшипнику 10/16 г 10;
- Углерод содержится, главным образом, в виде свободного графита;
- Углерод содержится только в виде свободного графита
Таблица «Свойства металлокерамических материалов (РМ)1 для конструкционных деталей»
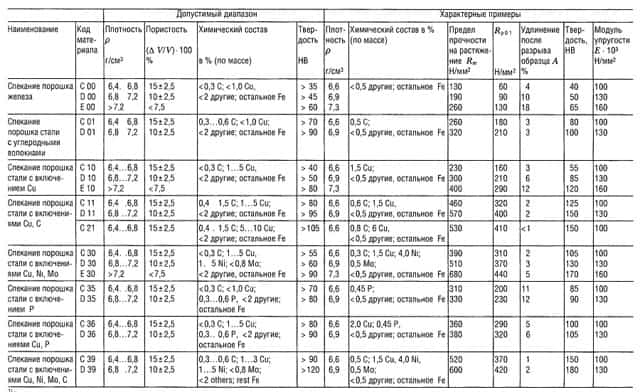
- В соответствии со стандартом DIN 30 910,1990 г. издания;
Магнитные материалы
Таблица «Свойства магнитомягких материалов»
- Данные относятся только к магнитным кольцам.
Магнитомягкие металлы
Таблица «Свойства магнитной листовой и полосовой стали»
Материалы для преобразователей и электрических реакторов
Магнитная проницаемость листового сердечника для классов сплавов С21, С22, Е11, Е31 и Е41 для секции тонколистового сердечника EY11
Материалы для реле постоянного тока
Таблица «Свойства материалов для реле постоянного тока»
Металлокерамические материалы для магнитомягких компонентов
Таблица «Свойства металлокерамических материалов для магнитомягких компонентов»
Магнитомягкие ферриты
Таблица «Свойства магнитомягких ферритов»
- Нормируемые величины;
- Потеря материалом магнитных свойств в зависимости от частоты при низкой плотности магнитного потока (В < 0,1 мТл);
- Потери магнитных свойств при высокой плотности магнитного потока; замеряются предпочтительно при f = 25 кГц, В = 200 мТл, Θ = 100°С;
- Магнитная проницаемость при строго синусоидальном магнитном поле; замеряется при f
Свойства металлов: химические, физические, технологические
Не секрет, что все вещества в природе делятся на три состояния: твердые, жидкие и газообразные.
А твердые вещества в свою очередь делятся на металлы и неметаллы, разделение это нашло свое отображение и в таблице химических элементов великого химика Д. И. Менделеева.
Наша сегодняшняя статья о металлах, занимающих важное место, как в химии, так и во многих других сферах нашей жизни.
К слову лом цветных и черных металлов всегда высоко ценился на рынке вторичной переработке. Последнее время цена на него постоянно растет. Узнайте актуальные цены, по которым можно сдать металлолом: https://citylom.ru
Химические свойства
Все мы, так или иначе, но сталкиваемся с химией в нашей повседневной жизни. Например, во время приготовления еды, растворение поваренной соли в воде является простейшей химической реакцией. Вступают в разнообразные химические реакции и металлы, а их способность реагировать с другими веществами это и есть их химические свойства.
Среди основных химических свойств или качеств металлов можно выделить их окисляемость и коррозийную стойкость. Реагируя с кислородом, металлы образуют пленку, то есть проявляют окисляемость.
Аналогичным образом происходит и коррозия металлов – их медленное разрушение по причине химического или электрохимического взаимодействия. Способность металлов противостоять коррозии называется их коррозийной стойкостью.

Физические свойства
Среди основных общих физических свойств металлов можно выделить:
- Плавление.
- Плотность.
- Теплопроводность.
- Тепловое расширение.
- Электропроводность.
Важным физическим параметром металла является его плотность или удельный вес. Что это такое? Плотность металла – это количество вещества, которое содержится в единице объема материала.
Чем меньше плотность, тем металл более легкий. Легкими металлами являются: алюминий, магний, титан, олово. К тяжелым относятся такие металлы как хром, марганец, железо, кобальт, олово, вольфрам и т. д.
(в целом их имеется более 40 видов).
Способность металла переходить из твердого состояния в жидкое, именуется плавлением. Разные металлы имеют разные температуры плавления.

Скорость, с которой в металле проводится тепло при нагревании, называется теплопроводностью металла. И по сравнению с другими материалами все металлы отличаются высокой теплопроводностью, говоря по-простому, они быстро нагреваются.
Помимо теплопроводности все металлы проводят электрический ток, правда, некоторые делают это лучше, а некоторые хуже (это зависит от строения кристаллической решетки того или иного металла).
Способность металла проводить электрический ток называется электропроводностью.
Металлы, обладающие отличной электропроводностью, это золото, алюминий и железо, именно поэтому их часто используют в электротехнической промышленности и приборостроении.
Механические свойства
Основными механическими свойствами металлов является их твердость, упругость, прочность, вязкость и пластичность.
При соприкосновении двух металлов могут образоваться микро вмятины, но более твердый металл способен сильнее противостоять ударам. Такая сопротивляемость поверхности металла ударам извне и есть его твердость.
Чем же твердость металла отличается от его прочности. Прочность, это способность металла противостоять разрушению под действием каких-либо других внешних сил.
Под упругостью металла понимается его способность возвращать первоначальную форму и размер, после того как нагрузка, вызвавшая деформацию металла устранена.
Способность металла менять форму под внешним воздействием называется пластичностью.
Технологические свойства
Технологические свойства металлов и сплавов важны в первую очередь при их производстве, так как от них зависит способность подвергаться различным видам обработки с целью создания разнообразных изделий.
Среди основных технологических свойств можно выделить:
- Ковкость.
- Текучесть.
- Свариваемость.
- Прокаливаемость.
- Обработку резанием.
Под ковкостью понимается способность металла менять форму в нагретом и холодном состояниях. Ковкость метала, была открыта еще в глубокой древности, так кузнецы, занимающиеся обработкой металлических изделий, превращением их в мечи или орала (в зависимости от потребности) на протяжении многих веков и исторических эпох были одной из самых уважаемых и востребованных профессий.

- Способность двух металлических сплавов при нагревании соединяться друг с другом называют свариваемостью.
- Текучесть металла тоже очень важна, она определяет способность расплавленного метала растекаться по заготовленной форме.
- Свойство металла закаливаться называется прокаливаемостью.
Интересные факты
- Самым твердым металлом на Земле является хром. Этот голубовато-белый метал был открыт в 1766 году под Екатеринбургом.
- И наоборот, самыми мягкими металлами являются алюминий, серебро и медь. Благодаря своей мягкости они нашли широкое применение в разных областях, например, в электроаппаратостроении.
- Золото – которое на протяжении веков было самим драгоценным металлом имеет и еще одно любопытное свойство – это самый пластичный металл на Земле, обладающий к тому же отличной тягучестью и ковкостью. Также золото не окисляется при нормальной температуре (для этого его нужно нагреть до 100С), обладает высокой теплопроводностью и влагоустойчивостью. Наверняка все эти физические характеристики делают настоящее золото таким ценным.
- Ртуть – уникальный металл, прежде всего тем, что он единственный из металлов, имеющий жидкую форму. Причем в природных условиях ртути в твердом виде не существует, так как ее температура плавления -38С, то есть в твердом состоянии она может существовать в местах, где просто таки очень холодно. А при комнатной температуре 18С ртуть начинает испаряться.
- Вольфрам интересен тем, что это самый тугоплавкий металл в мире, чтобы он начал плавиться нужна температура 3420С. Именно по этой причине в электрических лампочках нити накаливания, принимающие основной тепловой удар, изготовлены из вольфрама.
Видео
И в завершение образовательное видео по теме нашей статьи.

При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Общие свойства металлов

Металлы — основные материалы, используемые в машиностроении
Металлы — химические элементы и простые вещества, которые обладают характерными для них металлическими свойствами.
Это высокие теплопроводность, электропроводность, положительный температурный коэффициент сопротивления, характеризующий зависимость сопротивления от температуры, металлический блеск, ковкость, пластичность.
У металлов (за исключением полуметаллов) имеется ионная кристаллическая решетка. Подавляющее большинство металлов — твердые вещества при нормальных условиях. Исключение составляют ртуть и франций.
Теплопроводность и электропроводность обусловлены тем, что в кристаллических решетках металлов имеются свободные электроны, которые движутся под воздействием электрического поля.
Наибольшая электропроводность у серебра, меди и алюминия, а также у натрия. Из алюминия и меди чаще всего делают провода.
Лучший проводник тепла — серебро, хорошо проводит тепло также натрий — его используют в клапанах двигателей автомобилей для охлаждения.
Из 118 известных на сегодня химических элементов металлами являются 87, а если прибавить так называемые полуметаллы, то даже 94.
Шесть элементов относятся к группе щелочных металлов: литий (Li), натрий (Na), калий (К), рубидий (Rb), цезий (Cs), франций (Fr).
Четыре элемента относятся к группе щелочноземельных металлов. Это кальций (Са), стронций (Sr), барий (Ва), радий (Ra). Эти металлы относятся к II группе таблицы химических элементов.
Щелочноземельными эти вещества называют потому, что их гидроксиды являются щелочами, а оксиды тугоплавкие и их когда-то называли землями. Эти оксиды (земли), взаимодействуя с водой, дают щелочь.
Во II группу входят также бериллий (Be) и магний (Mg), которые, хоть иногда их и относят к щелочноземельным, обладают другими свойствами.
Сорок металлов относятся к группе переходных.
Эго скандий (Sc), титан (И), ванадий (V), хром (Сг), марганец (Мл), железо (Fe), кобальт (Со), никель (Ni), медь (Си), ЦИНК (Zn), ИТ-трий (Y), цирконий (Zr), ниобий (Nb), молибден (Мо), технеций (Тс), рутений (Ru), родий (Rh), палладий (Pd), серебро (Ag), кадмий (Cd), лантан (La), гафний (Hf), тантал (Та), вольфрам (W), рений (Re), осмий (Os), иридий (1г), платина (Pt), золото (Аи), ртуть (Hg), актиний (Ас), резерфордий (И), дубний (Db), сиборгий (Sg), борий (Bh), хассий (Hs), мейтнерий (Mt), дармпггадтий (Ds), рентгений (Rg), коперниций (Сп). Эти металлы характеризуются незавершенностью строения электронных оболочек, и у них валентные электроны находятся на разных оболочках. Они относятся к I—VIII группам периодической таблицы химических элементов.
Семь металлов относятся к легким. Это алюминий (А1), галлий (Ga), индий (In), олово (Sn), таллий (П), свинец (РЬ), висмут (Ш). Это металлы, которые обладают сравнительно малой плотностью — меньше 5 г/см3.
Пятнадцать металлов относятся к группе лантаноидов.
Это лантан (La), церий (Се), празеодим (Рг), неодим (Nd), прометий (Pm), самарий (Sm), европий (Ей), гадолиний (Gd), тербий (ТЬ), диспрозий (Dy), гольмий (Но), эрбий (Ег), тулий (Тт), иттербий (Yb), лютеций (Lu).
Данное семейство относится к III группе 6-го периода периодической таблицы и имеет атомные номера 57—71 (от лантана до лютеция). Их свойства чрезвычайно сходны.
Пятнадцать элементов относятся к группе актиноидов.
Это актиний (Ас), торий (Th), протактиний (Ра), уран (U), нептуний (Np), плутоний (Ри), америций (Ат), кюрий (Cm), берклий (Вк), калифорний (Cf), эсмий (Es), фермий (Fm), менделевий (Md), нобелий (No), лоуренсий (Lr). Эго радиоактивные химические элементы Ш группы 7-го периода периодической системы с атомными номерами 90—103. Их свойства очень похожи.
Существуют также элементы, занимающие промежуточное положение между металлами и неметаллами. Иногда их относят к неметаллам, иногда называют металлоидами или полуметаллами. Таких элементов семь. Это бор (В), кремний (Si), германий (Ge), мышьяк (As), сурьма (Sb), теллур (Те), полоний (Ро). Для них характерны ковалентная кристаллическая решетка и металлическая электропроводность.
Золото, серебро, платина и пять металлов платиновой группы: рутений, родий, палладий, осмий и иридий — считаются благородными (драгоценными) металлами. Они практически не окисляются на воздухе и потому не подвержены коррозии. Золото и серебро обладают высокой пластичностью, а остальные благородные металлы — еще и тугоплавкостью.
Также ряд металлов называют редкоземельными. Это 17 элементов, которые включают скандий, иттрий, лантан и лантаноиды. Назвали их так потому, что в XVIII— XIX вв. считалось, что их оксиды (земли) очень редкие. На самом деле они встречаются довольно часто, но название осталось.
Поделиться ссылкой
Урок 5: Общие свойства металлов
Металлы — элементы, способные «отдавать» электроны с внешних энергетических уровней, вступая в реакцию. Эта очень обширная категория элементов. И согласно расположению в периодической системе и химико-физическим свойствам их принято делить на: щелочные, щелочноземельные, d-металлы и благородные.
- План урока:
- Строение атомов металлов
- Разновидности металлов
- Способы получения металлов
- Электролиз
- Свойства металлов
- Нахождение металлов в природе
Строение атомов металлов
Решетки атомов металлов кристаллические, связанные металлической связью. Отличие металлической связи от ковалентной в том, что валентные электроны в атомах металлов притягиваются с меньшей силой к своим атомам или к своей паре атомов, и поэтому отщепление электронов от атомов происходит свободнее. И движения электронов напоминает «блуждание» между атомами.
Атомы металлов на внешнем уровне содержат от одного до четырех электронов. Этими электронами атомы металлов «делятся» с другими элементами (преимущественно с неметаллами) при взаимодействии, принимая роль восстановителей.
Разновидности металлов
Щелочные металлы
Щелочные металлы представлены: литием, натрием, калием, рубидием, цезием и францием. Все эти элементы входят в Ia группу.
Вещества характеризуются прежде всего большой активностью, потому как быстро окисляются даже на воздухе. С водой происходит активная реакция, сопровождаемая нагреванием веществ. Поэтому есть свои особенности хранения этих веществ. Хранят обычно под керосином.
По физическим свойствам данный класс веществ мягкие на ощупь, серебристо-серого цвета, могут обладать блеском, но только на свежо срезанной поверхности.
Сверху вниз в периодической таблице увеличивается атомный радиус, усиливаются основные, металлические, восстановительные свойства и реакционная активность.
Строение атома лития, как типичного представителя щелочных металлов
Химические свойства щелочных металлов
Взаимодействие с неметаллами
Щелочные металлы — сильные восстановители. Поэтому они реагируют почти со всеми неметаллами.
Взаимодействие со сложными веществами
- Таблица нахождения щелочных металлов в природе
Щелочноземельные металлы
К этой категории относят: бериллий, магний, кальций, стронций, барий и радий. Это металлы IIa группы. Металлы легкие, мягкие и реакционно активные. Они тверже щелочных, и редко обладают блеском, только серый цвет объединяет их с щелочными металлами.
Свойства веществ данной группы в зависимости от положения в периодическую систему сходны со свойствами предыдущей группы.
Рисунок. Щелочноземельные металлы в периодической системе
Получают их так же, как и щелочные металлы, электролизом расплавов, веществ, расплавленных до жидкого состояния. Или используя алюминотермию и вытеснение их из солей другими более активными металлами.
- MgCl2 → Mg + Cl2 (электролиз расплава)
- CaO + Al → Al2O3 + Ca (эта реакция носит название алюминотермии–процесс получения металлов из их оксидов, где алюминий вытесняет щелочные металлы из соединений).
- MgBr2 + Ca → CaBr2 + Mg
Химические свойства
Взаимодействие с неметаллами
Взаимодействие со сложными веществами
- Таблица нахождения щелочноземельных металлов в природе
d- металлы
Помимо щелочных и щёлочноземельных существуют d-металлы. Класс элементов, содержащих от 1 до 10 электронов на d-подуровне, уступающие щелочным и щёлочноземельным металлам в активности.
К d-металлам относят: скандий, титан, ванадий, хром, марганец, железо, кобальт, никель, медь, цинк и т.д.Отличий этих металлов в строении атома, а точнее в заполнении d-подуровня.
Железо
Железо находится в 4-м периоде, в VIII группе, в побочной подгруппе. Железо — металл средней активности, по ряду активности металлов в своих соединениях проявляет наиболее характерные степени окисления +2 и +3. Известны также соединения железа, в которых оно проявляет степень окисления +6, которые являются сильными окислителями..
Источник
Медь
Медь находится в 4-м периоде, в I группе, в побочной подгруппе. Ее наиболее устойчивые степени окисления +2 и +1. В ряду напряжений металлов медь находится после водорода, ее химическая активность не очень велика.
Источник
Цинк
Цинк находится в 4-м периоде, во II-группе, в побочной подгруппе. Цинк относится к металлам средней активности, в своих соединениях проявляет единственную степень окисления +2.
Источник
В каждом большом периоде d-элементы располагаются после двух s-элементов, которые являются щелочным и щелочноземельным металлами.
По своей значимости особо можно выделить роль этих элементов в организме человека. Микроэлементы цинка, марганца, железа, кобальта и меди очень важны для организма, наряду с биологически активными веществами, жирами, белками.
Цветной и черный металлы
Отличие цветного и черного металлов состоит в составе, структуре и свойствах. Например, черный металл подвергается влиянию магнитов, и зачастую прочнее цветных.
Черный металл — это прежде всего железо, его сплав с углеродом и добавлением иных веществ (как металлов, так и неметаллов).
Типы черных металлов
- Углеродистая сталь — железо смешано с углеродом
- Мягкая сталь — железо смешивается с относительно меньшим количеством углерода
- Нержавеющая сталь — смесь железа и хрома
- Чугун — очень высокое содержание углерода с железом
- Кованое железо — почти чистое железо
Цветные металлы — это тоже сплавы, но уже без железа, это могут быть: алюминий, магний, медь, никель, цинк, олово, свинец.
Данные подразделения металлов очень важны в жизни человечества. Но основная металлургическая промышленность использует черный металл (90% от общего объема). Важнейшие черные металлы: чугун, сталь, кованное железо.
Благодаря свойству цветного металла сопротивляться окислению, мы легко можем отличить его от черного. Черный металл ржавеет, цветной – нет. Большинству черных металлов присущи магнитные свойства.
Что используют в автомобильной и технической промышленности. Черные металлы очень прочные, а цветные легкие, но менее прочные.
Цветные металлы очень популярны в авиационной, консервной, электронной, электротехнической, строительной промышленностях
Благородными металлами называют те редкие металлы, не подвергающиеся окислению, коррозии и не взаимодействующие с кислотами.Также эти металлы называют драгоценными в силу редкости и большой цены.
Способы получения металлов
Основные способы получения металлов представлены в схеме ниже. Промышленным способом металлы получают электролизом растворов и расплавов.
- Более подробное рассмотрение пирометаллургических способов получения металлов
- Более подробное рассмотрение гидрометаллургических способов получения металлов
Электролиз
Электролизом называют процесс разложения веществ на составляющие, под действием тока. Его можно рассмотреть, как химическую реакцию.
На катоде реакции происходят различные для разных металлов. И для того, чтобы определить какая именно реакция произойдет необходимо обратиться к такому фактору, как активность металла. Эти данные мы получим из положения в электрохимическом ряду напряжений металла.
Источник
Как видно из электрохимического ряда напряжений металлов наиболее активным металлом является литий. Металлами средней активности считают элементы в ряду от алюминия до свинца. После водорода металлы малоактивные.
Электролиз расплавов
Из выше указанного стало ясно как получать малоактивные металлы в чистом виде при электролизе, а как получать активные металлы, если они не восстанавливаются на катоде при электролизе их растворов?В таких случая используют расплавы не содержащие воды.
Электролиз воды
Электролиз воды, как и в целом электролиз, это физико-химический процесс, осуществляемый с помощью электрического тока. Этот процесс позволяет очистить воду от тяжелых металлов и других примесей (примеси и металлы оседают на катоде и аноде). В результате данного процесса выделяется два газа: водород и кислород.
Электролиз воды необходим для очистки сточных вод. Сточные воды попадают в землю, в почву, и для предотвращения загрязнения окружающей среды, необходимо очищение воды.
Свойства металлов
Физические свойства металлов
Химические свойства металлов
Взаимодействие металлов с кислотами
- Взаимодействие металлов с серной кислотой
- Разбавленный раствор серной кислоты взаимодействует с металлами, стоящими в ряду активности до водорода по схеме:
- Ме + H2SO4(разб.) ↔ соль + Н2↑
Взаимодействие металлов с азотной кислотой (HNO3)
Очень сильный окислитель. И нужно запомнить, что при взаимодействии с кислотой никогда не выделяется водород в свободном виде.
- Процесс протекает следующим образом:
- Продукты восстановления HNO3:
- Какой из продуктов будет основным, зависит от концентрации кислоты и активности металла.
Взаимодействие металлов с разбавленной азотной кислоты
При реакции с разбавленной азотной кислотой металла продукты реакции другие, и каков будет продукт восстановления зависит от активности металла и представлен в схеме ниже.
Нахождение металлов в природе
Благородные малоактивные металлы, в свободном (самородном) состоянии встречаются в природе не часто, ввиду своей редкости.В самородном состоянии встречаются золото, серебро, платина, медь.
В малых количествах металлы находятся в морской воде (1,05%, — 0,12%), растениях, живых организмах. Играют при этом важную роль в организмах живых существ. Например, входят в состав важнейших питательных веществ, и в состав ферментов, необходимых для работы множества процессов.
Пожалуй, наиболее важное значение в организме живых существ играет железо, входя в состав крови, а точнее в составную часть гемоглобина крови – гемо. Гемоглобин — это белок крови транспортирующий кислород в нужные органы живого организма по крови.
Недостаток железа вызывает анемию, заболевание характеризирующийся вялым состоянием, слабостью, снижением трудоспособности и утомляемостью и в некоторых случаях имеет летальные последствия. Определяется заболевание преимущественно анализом крови.
- Таблица содержание некоторых металлов в земной коре
Урановая руда
Уран принято использовать в атомной промышленности, как топливо. Но элемент является очень активным поэтому уран в чистом виде не встречается, для его производства используют такие образования, как урановые руды. Последний содержит достаточно элемента, чтобы можно было считать добычу руды экономически выгодной.
Урановая руда Источник
Сплавы
Алюминиевые сплавы
Алюминиевые сплавы очень часто используются в отраслях промышленности. Обусловлено это тем, что сплавы алюминия отличаются большой прочностью.
Наиболее применяемые сплавы алюминия: дюралюминий, силумин.
МЕТАЛЛОТЕРМИЯ – способ восстановления металлов и соединений этих металлов.Сопровождается выделением теплоты. Этот процесс подлежит классификации по природе металла-восстановителя (алюминотермия, магниетермия, кальциетермия и др.).
- Источник
Вывод
Металлы очень большая категория веществ, объединяющая в себе элементы с различными физическими и химическими свойствами. Но при этом имеющие много общего, главное из которых — это принятие роли восстановителя в реакциях, отдавая свои электроны.
Так же многие металлы широко применяются человечеством в промышленности, в быту, в медицине, в фармацевтике и т.д. Исторически именно добыча железа из руд ознаменовала новый виток развития в истории человека.
Поэтому сложно переоценить данную категорию веществ.
Современное человечество использует металлы в промышленности, в быту и в хозяйстве. На протяжения многих веков металл является верным спутником прогресса. Но набольшее распространение металл получил в строительстве, позволяя сделать здания прочнее, а сроки возведения в разы короче.
К щелочным металлам относят: К щёлочноземельным металлам относят: 1процесс восстановления металлов химикатов 2взаимодействие металлов в особых условиях 3взаимодействие металлов с кислотой 4процесс разрушения металлов под воздействием различных факторов окружающей среды – кислорода, влаги, вредных примесей в воздухе 1синоним коррозии, или взаимодействие металлов 2способ восстановления металлов и соединений этих металлов, сопровождаемо с выделением теплоты 3это однородный материал, созданный при смеси двух или более химических элементов, где преобладают металлические компоненты При взаимодействии металла с азотной кислотой выделяется: 1выделяется водород в свободном виде 2НЕ выделяется водород в свободном виде 1 вопрос:
К щелочным металлам относят: 1) ртуть 2) железо 3) золото 4) литий
2 вопрос:
К щёлочноземельным металлам относят: 1) платина 2) золото 3) кальций 4) торий
3 вопрос:
Коррозия это …: 1) процесс восстановления металлов химикатов 2) взаимодействие металлов в особых условиях 3) взаимодействие металлов с кислотой 4) процесс разрушения металлов под воздействием различных факторов окружающей среды – кислорода, влаги, вредных примесей в воздухе
4 вопрос:
МЕТАЛЛОТЕРМИ́Я это -: 1) синоним коррозии, или взаимодействие металлов 2) способ восстановления металлов и соединений этих металлов, сопровождаемо с выделением теплоты 3) это однородный материал, созданный при смеси двух или более химических элементов, где преобладают металлические компоненты
5 вопрос:
При взаимодействии металла с азотной кислотой выделяется: 1) выделяется водород в свободном виде 2) НЕ выделяется водород в свободном виде 3) реакция невозможна
3 вопрос: процесс разрушения металлов под воздействием различных факторов окружающей среды – кислорода, влаги, вредных примесей в воздухе 4 вопрос: способ восстановления металлов и соединений этих металлов, сопровождаемо с выделением теплоты 5 вопрос: НЕ выделяется водород в свободном виде






