- Положение в периодической системе Менделеева
- Электронное строение и закономерности изменения свойств
- Физические свойства щелочноземельных металлов
- Химические свойства
- Нахождение в природе
- Способ получения
- Качественные реакции
- Применение щелочноземельных металлов
- ПОИСК
- Большая Рнциклопедия Нефти Рё Газа
- Соли Щелочных И Щелочноземельных Металлов
- ПОИСК
Щёлочноземельные металлы получили свое название за счет своих оксидов, которые сообщают воде щелочные реакции. Изучая химию, очень часто приходится взаимодействовать со сложными и непонятными названиями. Но если разобраться и понять что к чему, то изучать предмет легко и интересно.
Однако при написании формул стоит быть внимательным, не забывая про коэффициенты и признаки реакций.
Положение в периодической системе Менделеева
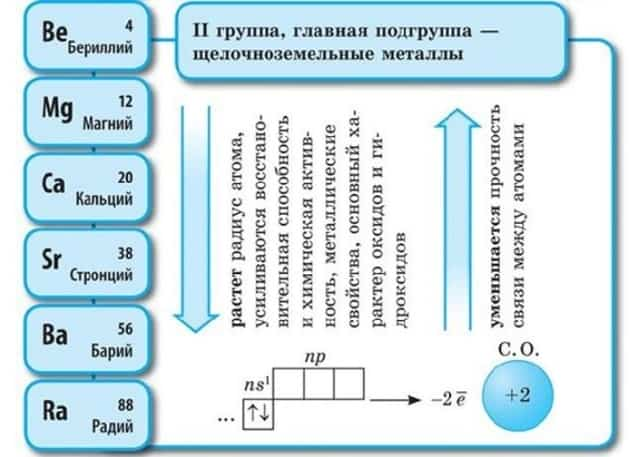
Щелочноземельные металлы – это химические элементы второй группы периодической системы химических элементов таблицы Менделеева:
- бериллий Be;
- магний Mg;
- кальций Ca;
- стронций Sr;
- барий Ba;
- радий Ra.
Электронное строение и закономерности изменения свойств
Атомы данных металлов на внешнем энергетическом уровне имеют 2 s-электрона. Отсюда следует, что максимальная степень окисления +2.
- Также могут иметь нулевую степень окисления, но не отрицательную, так как металлы не могут иметь данную степень.
- Общая конфигурация внешнего энергетического уровня nS2:

В периоде от Be до Ra металлические свойства, восстановительные, электроотрицательные увеличиваются, а неметаллические, окислительные свойства и радиус атома уменьшается.
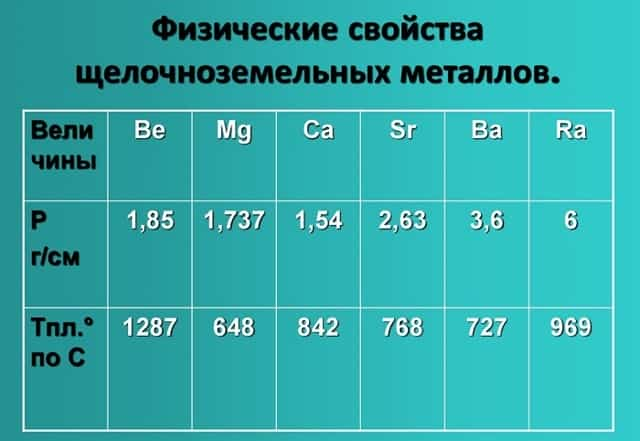
Физические свойства щелочноземельных металлов
- Физические свойства данной группы имеют следующие характеристики: светло-серый — темно-серый цвет, твердые вещества, не растворимые и нелетучие, без запаха, тепло-электропроводимые, имеют характерный металлический блеск.
- Показатели плотности и температуры плавления представлены в таблице:
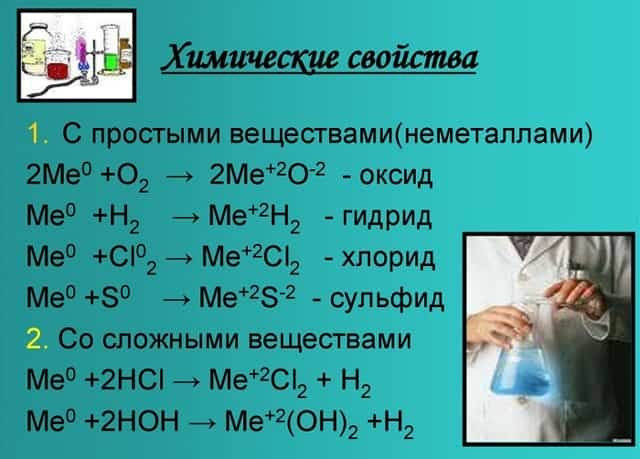
Химические свойства
Оксиды и гидроксиды щёлочноземельных металлов усиливают основные свойства при движении вниз по второй группе. Следовательно, бериллий имеет меньшие основные свойства, чем радий.
- Эти вещества взаимодействуют с любыми растворами кислот от сильной до слабой, а также с образованием солей, образуя белый осадок.
- 4Ca + 5H2SO4 (конц) = 4CaSO4 + H2S + 4H2O.
- С кислородом образуют реакцию горения и оксид:
- 2Mg + O2 = 2MgO.
- Металлы, стоящие в главной подгруппе второй группы (кроме бериллия) реагируют с водой. При проведении данных реакций выделяется водород (H2):
- Mg + 2H2O = Mg(OH)2 + H2,
- Вa + 2H2O = Вa(OH)2 + H2.
- Также реагируют с неметаллами:
- Bа + Cl2 = BаCl2 — хлорид бериллия;
- Ca + Br2 = CaBr2 — бромид кальция;
- Sr + H2 = SrH2 — гидрид стронция.
- Химические свойства щелочноземельных металлов показаны на картинке:
Нахождение в природе
Все металлы данного типа встречаются на земле, но не в чистом виде. Часто они представлены в виде минеральных солей. Самый распространённый считается кальций, магний немного уступает, затем идет барий и стронций.
Бериллий и радий являются самыми редкими, однако последний металл в больших количествах находится в урановых рудах.

Способ получения
- Магний, кальций и стронций получают электролизом расплавов солей.
- Барий получают с помощью восстановления оксида.
- При нагревании фторида бария получают сам металл.
Качественные реакции
- Одна из качественных реакций-окрашивание пламени.
- Список возможных цветов пламени при нагревании данных элементов:
- Ca — темно-оранжевый;
- Sr — насыщенный красный;
- Ba — светло-зеленый или классический зеленый.

Металлы данного типа при взаимодействии с щелочами, оксидами или растворами солей выпадают в белый осадок.
Применение щелочноземельных металлов
Бериллий из-за своей прочности добавляют в различные сплавы металлов, также препятствует коррозии. Используется в изготовлении рентгеновских аппаратов.
Магний и кальций активно использует для лекарственных средств, поскольку данные металлы играют большую роль в жизнедеятельности организма. Также в медицине используют радий, но для облучения кожи и злокачественных образований.
Стронций и барий добавляют в различный сплавы, которые работают в агрессивной среде и имеют сверхсильную проводимость.
Данные металлы играют огромную роль в жизни человека, выполняют различные функции и имеют ряд определенных свойств. Они содержатся в земной коре, поэтому довольно широко используются. Однако это не говорит о том, что их нужно расходовать безгранично.
ПОИСК
Добавление фосфатов или боратов щелочных металлов позволяет поддерживать оптимальную величину pH раствора, добавление полифосфатов устраняет выпадение в осадок солей щелочноземельных металлов и улучшает пептизацию и диспергирование, а введение органических мономолекулярных соединений (коллоиды карбокси-метилцеллюлозы) позволяет избежать отложений на волокнах. Смеси выпускают твердыми (порошок или гранулы) или жидкими, что отвечает требованиям потребителя выбор и дозировка добавок зависят от условий применения этих веществ. [c.343] В отлично от солей щелочных металлов, многие из солей щелочноземельных металлов малорастворимы е( воде. К таким солям относятся карбонаты, сульфаты, фосфаты и некоторые другие. [c.608]
В течение десятков лет различные соли нефтяных кислот применяются во многих отраслях народного хозяйства соли РЬ, 2п, Мн и Со — как сиккативы в производстве лаков, соли щелочноземельных металлов — в качестве флотоагентов, соли меди — как фунгициды и инсектициды для сохранения пищевых, текстильных и лесоматериалов, соли Ка, Са, Zn и А1 служат основными компонентами консистентных смазок, соли Са и — диспергирующими присадками к моторным маслам. Калиевые соли нефтяных кислот стимулируют рост растений, ускоряя усвоение ими глюкозы [679-681]. [c.118]
Синтезирована также многофункциональная присадка ИХП-81, представляющая собой соль щелочноземельного металла (Са, Мд, Ва) и продуктов конденсации алкилфенолов с формальдегидом и нафтеновыми кислотами. Эта присадка имеет высокие антиокислительные, противоизносные, моющие и противонагарные показатели, что дает возможность рекомендовать ее для улучшения эксплуата- [c.192]
В качестве крекирующих агентов патентами предусматривается использование окислов, гидроокисей и солей щелочноземельных металлов, например окиси, гидроокиси, карбоната кальция, а также солей слабых кислот —глюконата или ацетата кальция. В большинстве примеров использовалась окись кальция в количе- [c.102]
За сравнительно немногими исключениями щелочные соли сульфокислот хорошо растворимы в воде растворимость понижается при введении в молекулу высокомолекулярных ароматических групп и повышается с увеличением числа сульфогрупп. Щелочные соли обычно выделяются из раствора путем высаливания их избытком какой-нибудь легко растворимой соли соответствующего щелочного металла.
Более общий способ выделения соли сульфокислоты и щелочного металла заключается в нейтрализации продукта сульфирования известью или другим основанием, дающим нерастворимый осадок с ионом 804″ с последующим отфильтровыванием и обработкой фильтрата карбонатом или сульфатом щелочного металла.
Фильтрат, полученный от этой операции, упаривается, пока из него не начнет выкристаллизовываться щелочная соль сульфокислоты.
Свинцовые соли и соли щелочноземельных металлов сульфокислот, вообще говоря, хорошо растворимы в воде, но соли изомерных кислот часто сильно различаются между собой по растворимости, что дает возможность разделять продукты сульфирования посредством фракционированной кристаллизации кальциевых, бариевых или свинцовых солей. [c.10]
Соли щелочноземельных металлов обладают плотной консистенцией. В воде и спирте они не растворимы, растворяются в бензине и в более тяжелых (керосиновых и масляных) дестиллатах, в особенности при повышенных температурах. [c.30]
Помехи, связанные с образованием в пламени на стадии испарения растворителя новых термически устойчивых соединений, например алюминатов или фосфатов, при совместном присутствии солей щелочноземельных металлов и алюминия или фосфат-иона.
Влияние катионов и анионов, снижающих интенсивность излучения элементов в пламени, называют катионным или анионным эффектом. Такой вид помехи можно устранить, если вводить в раствор так называемый освобождающий реагент, например соли редкоземельных элементов (РЗЭ).
[c.13]
При определении небольших количеств серы в силикатных материалах обычно сернокислый барий осаждают после сплавления с содой из подкисленной водной вытяжки плава. Раствор содержит много солей щелочноземельных металлов, которые захватываются осадком. Однако при малом общем содержании серы ошибка определения не имеет большого значения . [c.160]
Эмульсии типа в/м могут быть получены с помощью не только гидрофобных эмульгаторов, например неводных растворов солей щелочноземельных металлов жирных кислот, но и водорастворимых стабилизаторов. Образование обратной эмульсии в последнем случае становится возможным в условиях понижения растворимости стабилизатора в воде путем добавления нейтральных солей. [c.135]
Опыт 9. Окрашивание пламени солями щелочноземельных металлов [c.261]
Какие соли щелочноземельных металлов отличаются своей нерастворимостью в воде [c.154]
Соли щелочноземельных металлов, как и соли щелочных металлов, состоят из ионов. Солн этих металлов окрашивают пламя горелки в характерные цвета, для соединений Ве и Ме этого не наблюдается. [c.128]
Многие соли щелочноземельных металлов в отличие от солей щелочных металлов нерастворимы. Растворимые соли кальция и магния вызывают жесткость воды. [c.194]
Растворимые в воде соли щелочноземельных металлов гидролизу по катиону не подвергаются. Катионы этих металлов окрашивают пламя газовой горелки в различные цвета [c.171]
Из других малорастворимых солей щелочноземельных металлов следует отметить фосфаты и силикаты. [c.51]
Железистосинеродистая кислота образует соли почти со всеми металлами, причем соли щелочных металлов хорошо растворимы в воде, соли щелочноземельных металлов труднее, а соли тяжелых металлов, как правило, нерастворимы. Соль меди СПа [Ре (СМ) ] применяется для изготовления полупроницаемых перепонок для опытов с осмотическим давлением. [c.363]
Соли щелочноземельных металлов (Са, Ва и др.) не растворимы в воде, так же как соли тяжелых металлов (например, РЬ). [c.166]
Обработать нихромовую проволоку концентрированной НС1 и прокалить в пламени спиртовой горелки, затем опустить её в раствор соли щелочноземельного металла (Са, Sr, Ва) и вновь внести в пламя спиртовой горелки. В какие цвета окрашивают пламя соли испытуемых металлов [c.13]
Напишите молекулярные и ионные уравнения реакций взаимодействия солей щелочноземельных металлов с оксалатом аммония и растворения оксалатов в соляной кислоте. [c.223]
Если в исследуемом растворе есть осадок, то он может содержать нерастворимые соли щелочноземельных металлов. Если он не растворим в соляной кислоте, то в нем имеются сульфаты щелочноземельных металлов.
Для испытания на сульфаты осадок взмучивают, 2—3 капли взвеси помещают в полумикропробирку, добавляют 3—4 капли 2 н. НС1. Если осадок не растворяется, то его исследуют отдельно. Осадок промывают дистиллированной водой 2 раза, каждый раз центрифугируя.
Промытый осадок обрабатывают при помощи Ма/ЗОз, как указано в 60. [c.175]
В сточных водах ряда производств содержатся коллоидные растворы (эмульсии) нефтепродуктов. Эти эмульсии разрушают обработкой сточных вод солями щелочноземельных металлов. [c.206]
Углекислые соли щелочноземельных металлов практически нерастворимы в воде. При накаливании они отщепляют СО2 и переходят в соответствующие окиси. По ряду Са — Sr — Ва термическая устойчивость карбонатов быстро возрастает. Наиболее практически важным из них является карбонат кальция. [c.389]
Особенности солей бериллия, магння и щелочноземельных металлов. Соли щелочноземельных металлов, внесенные в пламя горелки, дают характерное окращивание пламени кальций — кирпично-красное, стронций — карминно-красное, барий — желтовато-зеленое. На этом свойстве солей основано качественное определение этих элементов. [c.236]
Снизить нагарообразование в двигателях внутреннего сгорания можно применением ртутьсодержащих присадок (дибутилртуть), которые совместимы с другими добавками, а также добавлением органических солей щелочноземельных металлов и металлов, образующих амфотерные гидроксиды [306 пат.
США 3036905 япон. пат. 4540 франц. пат. 1252898]. Кроме того, в качестве противонагарной присадки применяют раствор медных солей хлорзамещен-ных кислот в керосине добавляемая к жидкому топливу в количестве 1 % присадка рекомендуется для дизельных и реактивных [c.
271]
В качестве противодымных присадок к топливам рекомендованы гидразин, а также соли его и растворимых в нефтепродуктах алкилзамещенных бензолсульфокислот, комплексы норборна-диенов с солями металлов переменной валентности, ацетилацето-наты железа, кобальта и меди, а также ферроцен и карбонилы железа. С целью снижения дымности выхлопных газов дизельных двигателей предлагается вводить в топливо растворимые в нем органические соли щелочноземельных металлов, а также сульфонаты кальция, бария или магния в виде растворов в легком бензине [15, с. 341]. Добавление к дизельному топливу дидецилсульфо- [c.280]
Типичными моющими присадками являются соли щелочноземельных металлов с длинными алифатическими цепями, содержащие полярные группы кислого характера. В зависимости от содержания металлического компонента различают нейтральные, среднещелочные и высокощелочные присадки. К числу моющих относятся сульфонатные, алкилфенольные, алкилсалицилатные присадки. [c.463]
Еще в 1876 г. Мёслингер [95] заметил, -что н-октилсульфат бария частично растворяется в воде и что калиевая соль представляет собой устойчивое на воздухе, похожее на мыло, растворимое в воде вещество.
Повидимому, это было первым указанием на то, что такого типа соединения могут найти применение в качестве моющих веществ в воде, содержащей соли щелочноземельных металлов.
Это наблюдение не могло быть исдользо вано с техническими целями до тех пор, пока высокомолекулярные спирты не стали доступными в больших количествах и по умеренным ценам.
Почти одновременно с разработкой каталитического метода восстановления эфиров жирных кислот появились многочисленные патенты на приготовление и применение [96] солей н-алкилсерных кислот, содержащих от 10 до 18 углеродных атомов, свидетельствующие о том, что эти соединения [c.19]
В этом отношении наименее прочные пленкп дают мыла щелочных металлов, легко разрушаемые нагревом образовавшейся пузырчатой массы (эмульсии). Более прочные пленки на границе вода — нефть образуются в присутствии нафтеновых солей щелочноземельных металлов или металлов третьей группы. [c.69]
Поскольку и одиночные (газообразные) молекулы галоидных солей щелочных металлов и кристаллы этих солей состояч из ионов, можно сделать заключение, что внешние слои этих кристаллов фактически также состоят и.з ионов.
Этот вывод, по-видимому, распространяется на кристаллы галоидных солей щелочноземельных металлов и фторидов некоторых других металлов, например фторида свинца, а также на кристаллы комплексных фторидов, таких, как фторцирконат калия (Ка2гРс) [11].
Некоторые окислы, например окислы щелочноземельных металлов, имеют в кристаллическом состоянии ионные решетки, однако одиночным молекулам этих окислов следует приписать преимущественно гомеополярный характер [12].
Поэтому нет уверенности в том, что атомы, образующие наружный слон кристаллов этих окислов, так же сильно ионизированы, как и атомы, находящиеся внутри кристалла вполне возможно, что они обладают более гомеополярным характером. Это справедливо для многих галоидных солей тяжелых металлов, например для Ай С и AgJ.
При образовании такими галоидными солями суспензий в воде (коллоидное состояние) связь между разными поверхностными атомами отдельных частиц суспензий вполне способна приобрести более ионный характер вследствие гидратации поверхностного слоя атомов. [c.24]
Исследуемые растворы наносят на бумагу в виде точек с интервалом 3 см. Подвижной фазой является смесь 80 см метанола с 10 см воды и 10 см 12,5 М НС1. Хроматограмма развивается при 20 °С в течение 3 ч подвижная фаза при этом проходит расстояние около 20 см.
На линию старта наносят последовательно 1%-ный раствор смеси K l-t-NH4 l, служащий контрольной пробой пробу неразбавленного анализируемого раствора пробу анализируемого раствора, разбавленного в отношении 1 10 вторую контрольную пробу — смесь Na l-j-4-Li l, и затем снова две пробы анализируемого раствора.
Далее наносят 0,2%-ный раствор смеси солей щелочноземельных металлов и две пробы анализируемого раствора. [c.86]
Наконец, иногда причина устойчивости обратных эмульсий мо-же заключаться в стабили аци капелек полярной дисперсной фазы броней из крупОТШС образШавшихся из нерастворимых солей щелочноземельных металлов или продуктов гидролиза. В этом случае механизм стабилизации полностью аналогичен механизму стабилизации эмульсий с помощью порошкообразных эмульгаторов, который рассмотрен ниже. , [c.375]
Опыт 5. Соли щелочноземельных металлов, а. С у л ь ф а т ы. Налейте в четыре пробирки несколько капель раствора 1Ма2504. В одну из них добавьте такой же объем раствора Mg l2, в другую — СаОз, в третью — ЗгС и в четвертую — ВаС12. В каких пробирках выпал осадок нерастворимого сульфата [c.195]
Состояние ионообменного равновесия зависит от характера взаимодействия между фиксированными ионами и противоионами.
Избирательность сорбции ионов из внешней среды (из раствора) проявляется тем значительнее, чем меньше диссоциация или растворимость образующихся соединений серебряной соли сульфокислоты, солей щелочноземельных металлов карбоновых кислот, внутрикомп-лексных соединений тяжелых металлов. [c.54]
Напишите уравнение реакции, сопровождающейся образованием хорошо растворимых в воде солей Mg l2, (МН4)2СОз. Эта реакция позволяет отделить соли магния от солей щелочноземельных металлов, карбонаты которых мало растворимы в NH4 1. [c.218]
Большая Рнциклопедия Нефти Рё Газа
Cтраница 1
Соли щелочноземельных металлов, как и соли щелочных металлов, состоят из ионов. Соли этих металлов окрашивают пламя горелки в характерные цвета, для соединений Be и Me этого не наблюдается. [1]
Соли щелочноземельных металлов Рё ароматических кетилов [54] — это системы, РІ которых диполь-дипольное взаимодействие невелико.
Щелочные соли алифатических кетилов [22] дают две димерные частицы, находящиеся в равновесии, из которых одна характеризуется интенсивным диполь-дипольным взаимодействием ( табл.
10), Р° другая — лишь незначительным диполь-дипольным взаимодействием. [2]
Соли щелочноземельных металлов образуют аморфные осадки, щ мешающие обнаружению кристаллов оксихинолата магния. [3]
Соли щелочноземельных металлов обладают плотной консистенцией.
В воде и спирте они не растворимы, растворяются в бензине и в более тяжелых ( керосиновых и масляных) дестиллатах, в особенности при повышенных температурах. [4]
Соли щелочноземельных металлов получают взаимодействием оксидов или гидроксидов с кислотами. Фосфаты практически в воде нерастворимы. [5]
Соли щелочноземельных металлов терефта-левой кислоты малорастворимы в воде. [6]
Чтобы соли щелочноземельных металлов не отлагались в разлагателе на графитовых пластинках и не вызывали потерю их активности, вода, используемая для разложения, должна быть очищена от солей жесткости. Очистка воды необходима также в связи с требованиями, предъявляемыми к чистоте получаемой каустической соды. Обычно удовлетворяются катионитовой очисткой воды на сульфоугле; иногда для разложения амальгамы используют конденсат технического пара. [7]
Какие соли щелочноземельных металлов отличаются своей нерастворимостью в воде. [8]
Многие соли щелочноземельных металлов в отличие от солей щелочных металлов нерастворимы. Растворимые соли кальция и магния вызывают жесткость воды. [9]
Многие соли щелочноземельных металлов трудно растворимы в воде.
В изменении растворимости этих солей часто обнаруживается определенная закономерность: так, у сульфатов растворимость быстро уменьшается с возрастанием атомного веса щелочноземельного металла.
Приблизительно-так же изменяется и растворимость хроматов. Большинство солей, образуемых щелочноземельными металлами со слабыми кислотами и с кислотами средней силы, растворяется с трудом, например фосфаты, оксалаты и карбонаты; некоторые из них, однако, легко растворимы; к последним относятся сульфиды, цианиды, роданиды и ацетаты. Вследствие ослабления основного характера гидроокисей при переходе от Ва к Be в этой же последовательности возрастает степень гидролиза их карбонатов. В том же направлении изменяется и их термическая устойчивость: в то время как карбонат бария даже при температуре белого каления разлагается далеко не полностью, карбонат кальция можно полностью разложить на СаО и С02 уже. [10]
Многие соли щелочноземельных металлов трудно растворимы в воде.
В изменении растворимости этих солей часто обнаруживается определенная закономерность: так, у сульфатов растворимость быстро уменьшается с возрастанием атомного веса щелочноземельного металла.
Приблизь тельно так же изменяется и растворимость хроматов. Большинство солей, образуемых щелочноземельными металлами со слабыми кислотами и с кислотами средней силы, растворяется с трудом, например фосфаты, окса-латы и карбонаты; некоторые из них, однако, легко растворимы; к последним относятся сульфиды, цианиды, роданиды и ацетаты. Вследствие ослабления основного характера гидроокисей при переходе от Ва к Be, в этой же последовательности возрастает степень гидролиза их карбонатов. [11]
Многие соли щелочноземельных металлов трудно растворимы в воде.
В изменении растворимости этих солей часто обнаруживается определенная закономерность: так, у сульфатов растворимость быстро уменьшается с возрастанием атомного веса щелочноземельного металла.
Приблизительно так же изменяется и растворимость хроматов.
Большинство солей, образуемых щелочноземельными металлами со слабыми кислотами и с кислотами средней силы, растворяется с трудом, например фосфаты, окса-латы и карбонаты; некоторые из них, однако, легко растворимы; к последним относятся сульфиды, цианиды, роданиды и ацетаты. Вследствие ослабления основного характера гидроокисей при переходе от Ва к Be, в этой же последовательности возрастает степень гидролиза их карбонатов. В том же направлении изменяется и их термическая устойчивость: в то время как карбонат бария даже при температуре белого каления разлагается далеко не полностью, карбонат кальция можно полностью разложить на СаО и С02 уже при сравнительно слабом прокаливании, а карбонат магния разлагается еще легче. [12]
Присутствие солей щелочноземельных металлов затемняет картину образовавшегося осадка.
От сернокислых солей этих металлов PbSO4 может быть отделен обработкой раствором едкой щелочи или уксуснокислого аммония ( см.
также отделение щелочноземельных металлов и свинца, стр. [13]
Для солей щелочноземельных металлов довольно отчетливо проявляется зависимость термической устойчивости от поляризующего действия катиона ( или радиуса катиона): термическая устойчивость повышается с увеличением размера катиона. Сравнительный термический анализ фторгерманатов двухвалентных металлов и соответствующих фторсиликатов указывает на большую устойчивость первых. [14]
�з солей щелочноземельных металлов растворимы в воде гало-гениды, нитраты, ацетаты, сульфиды и бикарбонаты. [15]
Страницы: 1 2 3 4
Соли Щелочных И Щелочноземельных Металлов
Соли Щелочных И Щелочноземельных Металлов
Для жизни организмов, помимо органических соединений, большое значение имеют неорганические соединения. Щелочные и щелочноземельные металлы являются нормальными составными частями внутренней среды организма. Их делят на соли натрия, кальция, калия и магния.
С учетом наиболее главного действия и применения их принято делить на соли, имеющие большое физиологическое значение, рассматриваемые в данном разделе: слабительные соли натрия и магния (см. Слабительные средства) и мочегонные соли калия (см. Мочегонные средства).
Соли действуют в молекулярном виде и в диссоциированном состоянии при распаде на ионы.
В молекулярном виде в зависимости от концентрации различают растворы изотонические (для натрия хлорида 0,9%-ные), гипертонические (для натрия хлорида более 0,9%-ных) и гипотонические (для натрия хлорида менее 0,85%-ных).
Гипертонические растворы повышают осмотическое давление в крови, усиливают диурез, увеличивают физиологическую активность тканей и вызывают ряд рефлекторных реакций. Гипотонические растворы вызывают гемолиз эритроцитов и раздражают ткани.
Изотонические растворы, осмотическое давление которых равно осмотическому давлению жидкостей организма, чаще используются в качестве кровезамещающих жидкостей и растворителей лекарственных средств.
После всасывания соли распадаются на ионы и оказывают сложное биологическое действие.
Они поддерживают постоянное осмотическое давление во внутренней среде, изменяют проницаемость мембран клеток для воды и составных частей протоплазмы, сохраняют кислотно-щелочное равновесие, сложно влияют на состояние возбудимости в клетках. Во внеклеточных жидкостях осмотическое давление создается главным образом за счет ионов натрия, а во внутриклеточных — за счет ионов калия.
Натрия хлорид (хлористый натрий) — Natrii chloridum. Белый кристаллический порошок, хорошо растворимый в воде (1:3). Встречается в морской (озерной) воде и в виде каменной соли в горах, откуда его и получают.
Действие.
После внутреннего применения оживляет секрецию и моторику желудка и кишечника, усиливает секрецию глюнных желез и поджелудочной железы, способствует образованию соляной кислоты желудочного сока, повышает аппетит, действует противобродильно и улучшает пищеварение. Особенно необходим травоядным животным, растительный корм которых богат солями калия.
После внутривенного введения гипертонических растворов повышается осмотическое давление в крови, усиливается диурез и выведение из организма продуктов обмена и ядов, повышается секреция и моторика желудочнокишечного канала, усиливается работоспособность вегетативной иннервации, органов и тканей. После всасывания регулирует осмотические процессы и содержание жидкости в организме, оказывает кровоостанавливающее действие, а ионы натрия принимают участие в возбуждении и обмене веществ в мембране клеток.
Применяют для возбуждения аппетита и улучшения пищеварения, при воспалении желудка и кишечника, гнилостных и бродильных процессах в пищеварительном канале, как необходимую составную часть корма.
Гипертонические растворы хлористого натрия (10- 20%-ные) назначают внутривенно при гипотонии и атонии преджелудков, засорении кишечника, переполнении и закупорке книжки, в качестве кровоостанавливающего средства при легочных, желудочно-кишечных и других кровотечениях.
В акушерской практике используют для профилактики родильного пареза и задержания последа у коров (после растела дают солевой раствор внутрь), а для ускорения отделения задержавшегося последа делают промывание влагалища 5-10%-ным раствором.
Назначают при лекарственных токсикозах.
Изотонический раствор вводят внутривенно и внутрибрюшинно при обильных поносах, интоксикациях, падении кровяного давления. Используют для промывания слизистых оболочек и как растворитель многих лекарственных веществ.
Среди свиней и птиц часты случаи отравления поваренной солью. В этом случае свежая вода способствует выведению соли, но обильное потребление большого количества воды при отравлении хлористым натрием может ускорить смертельный исход.
Дозы (г) внутрь: лошадям -20-75, крупному рогатому скоту-20-100, мелкому рогатому скоту-5-15, свиньям -0,5-3, курам -0,1-0,3, внутривенно: лошадям -20-30, крупному рогатому скоту -15-25, мелкому рогатому скоту -2-3. Внутривенно средняя доза 0,07- 0,1 г/кг в 20%-ном растворе.
Кальция хлорид — Calcii chloridum. Бесцветные кристаллы, легко растворимые в воде (4:1). Гигроскопичен.
Кальций, как и натрий, является необходимой составной частью органов и тканей. В костной ткани он содержится в неионизированном состоянии (до 99%), а в крови и в тканевой жидкости — в ионизированном виде.
Действие.
Повышает тонус центральной нервной системы и симпатической иннервации, возбуждает работу сердца, уплотняет мембрану клеток, действует кровоостанавливающе, противоотечно и противовоспалительно.
При недостатке кальция у молодых животных развивается рахит, а у взрослых — остеомаляция (размягчение костей), отмечаются слабость, поносы, нарушение аппетита, подергивание мышц.
Применяют чаще внутривенно (10%-ный раствор) как противоотечное, противовоспалительное и кровоостанавливающее средство при воспалении легких, печени, почек, отеке легких, гортани, при желудочно-кишечных, маточных и послеоперационных кровотечениях. Используют внутривенно в акушерской практике при метритах, эндометритах, задержании последа, родильном парезе у коров.
Входит в состав многих питательных, кровезамещающих и противошоковых жидкостей. Реже назначают внутрь 5-10%-ные растворы как отхаркивающее средство, при рахите и остеомаляции. При подкожном введении сильно раздражает ткани.
Дозы (г) внутривенно: лошадям-10-30, крупному рогатому скоту -15-40, мелкому рогатому скоту -1-3, свиньям-1-2, собакам-0,5-1,5; внутрь: лошадям — 20-50, крупному рогатому скоту -30-60, мелкому рогатому скоту и свиньям -2-5.
Кальция лактат — Calcii lactas. Белый порошок, медленно растворимый в воде (1:20).
Применяют внутрь при рахите и остеомаляции у животных, лизухе у животных, литье яиц у кур, а также молодым животным для ускорения роста и повышения устойчивости организма. Назначают 2-3 раза в день.
Дозы (г) внутрь: лошадям — 5-10, крупному рогатому скоту — 5-15, мелкому рогатому скоту — 0,5-2, свиньям — 0,3-1, собакам — 0,2-0,5.
Кальция карбонат осажденный (мел) — Calcii carbonas. Белый порошок или куски, нерастворимые в воде.
Действует вяжуще, противокислотно, противовоспалительно и адсорбирующе.
Применяют внутрь молодым животным для ускорения роста, при рахите, отравлении кислотами, вздутии желудка, при воспалении желудка и кишечника. В форме водной взвеси (10%-ной) используют для побелки животноводческих и складских помещений.
Дозы (р): лошадям и крупному рогатому скоту — 20-50 г, мелкому рогатому скоту — 5-10, свиньям — 2-5 г.
Кальция фосфат (фосфорнокислый кальций) — Calcii phosphas. Мелкокристаллический порошок, нерастворимый в воде.
Действие.
Фосфор имеет большое значение в обмене веществ, участвует в образовании макроэргических соединений, при распаде которых образуется энергия, необходимая для работы органов.
- Одновременное применение фосфора с кальцием усиливает положительное влияние на организм.
- Применяют молодым животным для ускорения роста и повышения их устойчивости, при рахите, хроническом нарушении пищеварения.
- Дозы (г): лошадям- 10-30, крупному рогатому скоту — 20-40, мелкому рогатому скоту и свиньям — 3-10.
ПОИСК
Получили применение смеси хлористых, азотнокислых и азотистокислых солей щелочноземельных металлов и смеси щелочей. Наиболее применяемые составы солей с указанием области их применения приведены в табл. 27.
[c.289]
Соли щелочноземельных металлов в переводе на сернокислые соли не более % — — — 1,0 1.0 1,0
[c.145]
Коррозия В растворах солей зависит от природы аниона (рис. 3.7), от pH раствора и реакции. При длительных испытаниях pH раствора возрастает и только в специальных случаях, при буферном воздействии выпавших в осадок гидроокисей или основных солей щелочноземельных металлов магния, можно рассчитывать на неизменную величину pH.
[c.245]
Наилучшими считаются составы, изготовленные а основе карбонатов с игольчатой кристаллической структурой, зернистость которых (табл. 6-7) зависит от условий их осаждения из растворов соответствующих солей щелочноземельных металлов.
[c.259]
При лотковом режиме течения смеси в трубах имеет место систематическое попадание мелких капель (брызг) воды на верхнюю (сухую) часть трубы с последующим испарением этих капель вплоть до выпадения тех солей, температура кипения насыщенных растворов которых ниже температуры металла.
При этом могут отлагаться не только труднорастворимые соли щелочноземельных металлов, но и те легкорастворимые натриевые, которые обладают температурой кипения насыщенного раствора, близкой к температуре кипения котловой воды.
Ликвидации этих явлений можно добиться увеличением угла наклона парообразующей трубы к горизонтали до 15—30°.
[c.56]
Реагируя с солями щелочноземельных металлов, гексаметафосфат натрия образует комплексы, в которых щелочноземельный метал находится в анионе (например, 4Ма+1Са(РОз)б] ). Эти комплексы обладают способностью захвата соединений железа, присутствующих в котловой воде.
[c.71]
В ваннах с цианистым натрием и солями щелочноземельных металлов протекают следующие реакции [c.150]
Образование накипи зависит от жесткости воды, т. е. от количества содержащихся в ней солей щелочноземельных металлов кальция и магния.
[c.259]
Жесткость определяется содержанием в воде накипеобразующих солей щелочноземельных металлов кальция и магния. Различают жесткость карбонатную (временную) Я , некарбонатную (постоянную) Нц, общую Н — сумма карбонатной и некарбонатной жесткостей
[c.187]
Для повышения стойкости швов против пористости при сварке меди большой толщины рекомендуется механическая смесь флюсов АН-26П (80%) и АН-60 (20%). Для электрошлаковой сварки меди разработаны флюсы на основе фтористых солей щелочноземельных металлов.
[c.364]
Раствори гелями окис/ia А1,Оз и других окислов являются галогенные соли щелочноземельных металлов (хлористый, фтористый литий и др.
), которые растворяют окислы и вместе с ними поднимаются из сварочной ванны в сварочный шлак.
Так как раствор обладает пониженной температурой плавления, меньшей удельной плотностью и меньшей вязкостью, чем каждый компонент в отдельности, то он выводится из металла шва в сварочный щлак.
[c.165]
Соли щелочноземельных металлов менее агрессивны, в то время как соли алюминия и аммония (кислые вследствие гидролиза), а также соли хрома (Сг ) и железа (Ре ) более агрессивны как окислители. [c.22]
Во избежание загорания плавку магниевых сплавов проводят под слоем универсальных флюсов из хлористых и фтористых солей щелочных и щелочноземельных металлов или в среде защитных газов.
[c.169]
Пленка оксида покрывает капли расплавленного металла и препятствует сплавлению их между собой и основным металлом. Для разрушения и удаления пленки и защиты металла от повторного окисления при сварке используют специальные флюсы или ведут сварку в атмосфере инертных газов.
Флюсы состоят из смеси хлористых и фтористых солей щелочноземельных металлов (Na I, K I, Ba Ij, LiF, aFj и др.). Действие флюсов основано на растворении пленки оксидов.
При сварке в защитных газах пленка разрушается в результате электрических процессов в том случае, если она оказывается в катодной области дуги.
Это реализуется при сварке плавящимся электродом на постоянном токе обратной полярности и сварке не-плавящимся электродов на переменном токе с использованием специальных источников тока (см. разд. 5, гл. II, п. 6).
[c.236]
В некоторых публикациях сообщается еще об одном варианте комбинированных ингибиторов, состоящих из органического соединения (или органических соединений) и соли постороннего металла [81 124 201 236 237 248].
Ряд металлов (в первую очередь алюминий) удается эффективно защищать от коррозии в растворах щелочей, в том числе и концентрированных, используя смесь соответствующего органического вещества и соли щелочноземельного металла. Эффективность каждого из компонентов значительно меньше, чем коэффициент тормож ния их комбинации.
Так, например, большинство из исследованных органических веществ (пиридин, пиперидин, гримин, дибензилдисульфид) не только не защищают, а даже облегчают растворение А1 ( 99%) в растворе NaOH (степень защиты органическими соединениями она повышается еще на 10—20%.
Заслуживают внимания данные тех же авторов и других [252], согласно которым положительный эффект ионов исчезает при переходе от щелочных к кислым средам.
[c.89]
Соли щелочных металлов (Na l, КС1, Na2 SO4 и др.) повышают проводимость растворов и активизируют коррозию. Несколько менее активны соли щелочноземельных металлов (СаС1г, r l2 и др.).
[c.71]
Как уже упоминалось, из солей щелочноземельных металлов основным лимитирующим компонентом является сернокислый кальций aS04. Затруднительность эксплуатационного контроля содержания сульфата кальция привела к косвенному нормированию этого соединения. В СССР принято нормирование (более удобной 20
[c.20]
Жесткость определяется содержанием Б воде ионов накипеобразова-телей — солей щелочноземельных металлов Са и Mg. Различают жесткость карбонатную (временную) и некар-
[c.193]
Жесткость определяется содержанием в воде ионов накипеобразовате-лей — солей щелочноземельных металлов Са и Mg. Различают жесткость карбонатную (временную) и некарбонатную (постоянную) Нр сумма их дает общую жесткость Но.
[c.278]
Пар барабанных котлов вследствие пусть даже ничтожного уноса котловой воды должен содержать соли натрия и в гораздо меньших количествах соли щелочноземельных металлов, т. е. кальция и магния.
Кремнекислота может в больших концентрациях содержаться в паре прямоточных котлов, так как даже при глубоком обессоливании питательной воды, через ионитные фильтры могут проходить, не поглощаясь, тонкодисперсные частички различных алюмосиликатов (глинистые частички, мельчайшие песчинки и т. д.).
Эти кремнийсодержащие примеси в системе котла подвергаются разложению под действием пара высоких параметров, причем кремнекислота выделяется в свободном виде. Поскольку растворимость SiOj в паре высокого давле-
[c.176]
Скорость коррозии, вызываемая хлоридами, составляет менее 0,6 г м сутки) и зависит от содержания олова в бронзе и степени аэрации среды. Соли щелочноземельных металлов и магния вызывают слабую коррозию.
Повышение температуры усиливает коррозию [при 75° С она достигает 2,5 г (м сутки)]. Хлорид аммония (2 н.) при комнатной температуре может вызвать коррозию со скорость до 95 г м сутки .
В производстве сульфата аммония применяют сита, шпиндели, корпуса центрифуг, изоготов-ленные из оловянистой бронзы с 5% олова [91].
[c.282]
Сварка алюминия затруднена вследствие наличия на поверхности прочной и тугоплавкой пленки окисла AI2O3, плавящейся при 2050° С. Пленка окиси покрывает также капли расплавленного металла и препятствует сплавлению их между собой и основным металлом. Только применение активных флюсов позволяет растворить этот окисел и обеспечить условия для нормального формирования сварного шва. Все флюсы и обмазки для сварки алюминия и его сплавов состоят из смеси хлористых и фтористых солей щелочноземельных металлов (Na l, K l, UFht. п.).
[c.434]
Из опробованных комплексообразователей успешный эффект был достигнут при переходе с тринатрийфосфата на гексаметафосфат натрия скорость образования желе-3001КИСНЫХ отложений при этом уменьшается в 4—5 раз.
Реагируя с солями щелочноземельных металлов, гексаметафосфат натрия образует комплексы, в которых щелочноземельный металл находится в анионе, например 4Na+[ a (РОз)б] — Эти комплексы обладают способностью захвата соединений железа, присутствующих в котловой воде.
[c.155]
Этим условиям удовлетворяют ванны е цианистым натрием, имеющие в своем составе соли щелочноземельных металлов — бария (Вааг), кальция (СаОз) и др.
[c.253]
В отличие от ванн для высокотемпературного цианирования, в которых используют нейтральные соли щелочных металлов, в ваннах для глубокого цианирования в качестве нейтральных солей применяют соли щелочноземельных металлов — бария (Ba la) и кальция ( a lj).
[c.150]
Лроцесс Нибодур проводят непрерывно, корректируя состав раствора и периодически удаляя накапливающийся борат (осаждением с помощью солей щелочноземельных металлов).
[c.141]
Содержание N в бычьем роге иногда доходит до 22%, а в эпидерме ступни—до 25%. Зола рогового вещества составляет 1,5% и содержит фосфорнокислые и сернокисльхе соли щелочноземельных металлов, а в нек-рых случаях (зола волос и перьев)—соединения железа и кремния. Содержание воды в Р. обычно 5—10%.
Роговое вещество горит труднее целлюлозы, при этом оплавляется и остается оплавленным после горения процесс горения сопровождается характерным запахом жженого рога , производимым соединениями серы. Серу считают присоединенной к Р.
мало прочно, причем при гидролизе белков она входит в цистин СООН—СН— H-(NH2)— H2—8—8—СНа—СЩКНз)—СООН. Этого соединения из Р. получается 6—7%, а из человеческих волос 13—14%. Химическое строение Р. в виду нерастворимости, неиспаряе-мости и отсутствия настоящей плавкости у Р.
до сих пор не могло быть выяснено некоторый подход к пониманию этой структуры дает рассмотрение продуктов гидролиза рогового
[c.370]
Величина концентрации водородных ионов обусловливает направление и интенсивность большинства физико-химич. процессов (коррозия, процесс растворения, коагуляция, процессы осаждения и т. д.), а также характер и интенсивность биологич. процессов в водоочистных сооружениях и в водоемах. Для применения воды на технич.
надобности весьма важное значение имеет жесткость ее, т. е. количество содержащихся в ней солей щелочноземельных металлов (кальция, магния и др.). Жесткость измеряют градусами, обозначающими весовое содержание этих солей.
Градусам жесткости в разных странах придают различную величину отличают градусы немецкий (принятый также в СССР), французский и английский. Один немецкий градус обозначает содержание в 1 л воды 10 мг извести (СаО) или эквивалентного количества солей магнезии.
Французский градус обозначает содержание в 1 л воды 10 мг углекислой извести (СаСОз), что соответствует 5,6 мг СаО, а английский — содержанию 14,3 ла углекислой извести (СаСОз), е- 8 мг СаО. Т. о. имеется следующая зависимость между градусами жесткости [c.14]
Зола состоит главным образом из солей щелочноземельных металлов (кальций, натрий, калий, магний). Входящие в состав древесины химические элементы образуют сложные органические вещества.
В среднем можно считать, что в древесине хвойных пород содержится 48—50% целлюлозы, 26—30% лигнина, 23— 26% гемицеллюлоз (10—12% пентозанов и около 13% гексозанов) лиственные породы содержат немного меньше целлюлозы, чем хвойные породы, и немного больше пентозанов.
Целлюлоза наиболее стойка к воздействию агрессивных сред. Целлюлоза нерастворима в воде, спиртах, эфирах, ацетоне и других органических растворителях.
Слабые растворы едких шелочей также не воздействуют на целлюлозу растворяется она только в крепких растворах щелочей. Минеральные кислоты вызывают гидролиз целлюлозы.
[c.472]
Присадки детергентные (моющие) и диспергирующие уменьшают количество образующихся в двигателе лаков и осадков. Молекулы моющих присадок содержат полярные группы, которые легко адсорбируют углеродистые продукты старения масла и тем самым препятствуют прилипанию смолистых веществ к поверхностям деталей.
Типичными моющими присадками являются соли щелочноземельных металлов (зольные соединения). Диспергирующие присадки в отличие от моющих являются обычно беззольными соединениями. Они отличаются способностью размельчать (диспергировать) и поддерживать во взвешенном состоянии находящиеся в масле твердые частицы.
[c.
16]
Растворы солей других щелочных металлов (например, КС1, Li l, Na2S04, KI, NaBr) влияют. на скорость коррозии аналогичным образом. Растворы солей щелочноземельных металлов несколько менее коррозионно-активны, чем соли щелочных металлов.
[c.96]
Сильная окисляемость при высоких температурах с образованием тугоплавкой (Т л=2200°С) окисной пленки А1аОз, имеющей большую плотность по сравнению с алюминием (р=3,85 г/см ). Окисная пленка затрудняет сплавление, способствует непроварам и охрупчивает металл.
Поэтому окисную пленку удаляют со свариваемых кромок механическими и химическими способами перед сваркой, во время сварки защищают зону сварки инертным газом, катодным распылением, применяют покрытия и флюсы на основе солей щелочных и щелочноземельных металлов (Na l, NaF, КС1 и
[c.133]






