Слайд 1  Текст слайда:
Текст слайда:
ЩЕЛОЧНЫЕ МЕТАЛЛЫ
Слайд 2  Текст слайда:
Текст слайда:
Щелочные металлы — это элементы главной подгруппы I группы : литий Li, натрий Nа, калий К, рубидий Rb, цезий Сs , франций Fr.
Слайд 3  Текст слайда:
Текст слайда:
Литий был открыт в 1817 г. А. Арфведсоном в минерале петалите.
Берцелиус предложил назвать ее литионом (Lithion), поскольку эта щелочь впервые была найдена в «царстве минералов» (камней); название это произведено от греч.- камень. Металлический Литий впервые получен в 1818 г. Г.
Дэви путем злектролиза щелочи. В 1855 г. Бунзен и Маттессен разработали промышленный способ получения металлического лития злектролизом хлорида лития.
Арфведсон Юхан Август(12 .01.1792 г. – 28 .10.1841 г.)
История открытия лития
Слайд 4  Слайд 5
Слайд 5  Текст слайда:
Текст слайда:
Натрий (Natrium, от англ. и франц. Sodium, нем. Natrium от древнеевр. neter — бурлящее вещество. В 1807 г. Г.Дэви путем электролиза слегка увлажненных твердых щелочей получил свободный металл — натрий, назвав его содий (Sodium). В следующем году Гильберт предложил именовать новый металл натронием (Natronium); Берцелиус сократил последнее название до «натрий» (Natrium).
Гемфри Дэви (17.12.1778 г – 29.05.1829 г)
История открытия натрия
Слайд 6  Слайд 7
Слайд 7  Текст слайда:
Текст слайда:
Калий (англ. Potassium, франц. Potassium, нем. Kalium) открыл в 1807 г. Г.Дэви, производивший электролиз твердого, слегка увлажненного едкого кали. Дэви именовал новый металл потассием (Potassium), но это название не прижилось. Крестным отцом металла оказался Гильберт, известный издатель журнала «Annalen deг Physik», предложивший название «калий»; оно было принято в Германии и России.
История открытия калия
Гемфри Дэви (17.12.1778 г – 29.05.1829 г)
Слайд 8  Текст слайда:
Текст слайда:
Природные соединения калия
Сильвин
Слайд 9 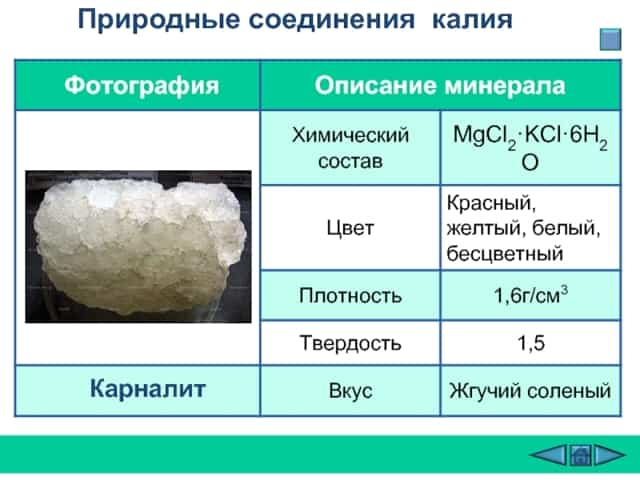 Текст слайда:
Текст слайда:
Природные соединения калия
Карналит
Слайд 10  Текст слайда:
Текст слайда:
При спектроскопическом анализе минерала лепидолит (фторсиликат лития и алюминия) и обнаружились две новые красные линии в красной части спектра. Эти линии Р. Бунзен и Г.Кирхгофф правильно отнесли к новому металлу, который назвали рубидием (лат. rubidus — красный) из-за цвета его спектральных линий. Получить рубидий в виде металла Бунзену удалось в 1863 году.
История открытия рубидия
Роберт Вильгельм Бунзен(31.03.1811 — 16.08.1899)
Щелочные металлы

Щелочные металлы
Урок для учащихся 9 класса.
Учитель: Е. А. Гвоздева.
2014г.

- 11/11/16
- Периоды
- Ряды
Положение в периодической системе химических элементов Д.И.Менделеева
- Группы элементов
- I
- VI
- III
- II
- VIII
- IV
- V
- VII
- Щелочные металлы
- I
- 1
- Li
- В главной подгруппе:
- Число электронов на внешнем слое не изменяется
- Радиус атома увеличивается
- Электроотрицательность уменьшается
- Восстановительные свойства усиливаются
- Металлические свойства усиливаются
- 3
- 2
- II
- 6,939
- Литий
- Na
- 11
- 3
- III
- 22,9898
- Натрий
- K
- 19
- IV
- 4
- 39.102
- Калий
- 5
- Rb
- 37
- V
- 6
- 85.47
- Рубидий
- 7
- Cs
- 55
- VI
- 8
- 132.905
- Цезий
- 9
- Fr
- 87
- 10
- VII
- [223]
- Франций
- 2
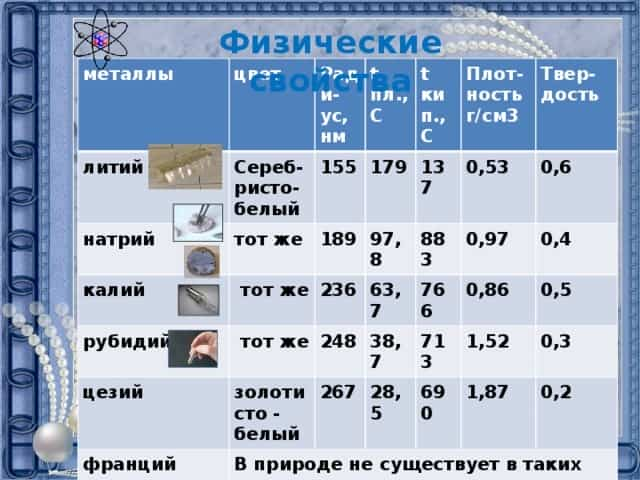
- Физические свойства
- металлы
- литий
- цвет
- натрий
- Ради-ус, нм
- Сереб-ристо- белый
- t пл.,С
- 155
- тот же
- калий
- 189
- t кип., C
- 179
- рубидий
- тот же
- 137
- 97,8
- Плот-ность г/см3
- 236
- цезий
- тот же
- 883
- 0,53
- Твер-дость
- 63,7
- 248
- франций
- золотисто — белый
- 0,97
- 0,6
- В природе не существует в таких количествах, которые достаточны для изучения его свойств.
- 267
- 766
- 38,7
- 0,4
- 713
- 28,5
- 0,86
- 1,52
- 690
- 0,5
- 0,3
- 1,87
- 0,2
- Щелочные металлы
- Литий
- Натрий
- Франций
- История открытия
- Цезий
- Калий
- Рубидий

История открытия лития
Литий был открыт в 1817 г. А. Арфведсоном в минерале петалите. Берцелиус предложил назвать ее литионом (Lithion), поскольку эта щелочь впервые была найдена в «царстве минералов» (камней); название это произведено от греч.- камень. Металлический Литий впервые получен в 1818 г. Г. Дэви путем злектролиза щелочи.
В 1855 г. Бунзен и Маттессен разработали промышленный способ получения металлического лития злектролизом хлорида лития.
Арфведсон Юхан Август
(12 .01.1792 г. – 28 .10.1841 г.)

История открытия натрия
Натрий (Natrium, от англ. и франц. Sodium, нем. Natrium от древнеевр. neter — бурлящее вещество. В 1807 г. Г.Дэви путем электролиза слегка увлажненных твердых щелочей получил свободный металл — натрий, назвав его содий (Sodium).
В следующем году Гильберт предложил именовать новый металл натронием (Natronium); Берцелиус сократил последнее название до «натрий» (Natrium).
Гемфри Дэви (17.12.1778 г – 29.05.1829 г)

Крестным отцом металла оказался Гильберт, известный издатель журнала » width=»640″>
История открытия калия
Калий (англ. Potassium, франц. Potassium, нем. Kalium) открыл в 1807 г. Г.Дэви , производивший электролиз твердого, слегка увлажненного едкого кали.
Дэви именовал новый металл потассием (Potassium), но это название не прижилось.
Крестным отцом металла оказался Гильберт, известный издатель журнала «Annalen deг Physik», предложивший название «калий»; оно было принято в Германии и России.
Гемфри Дэви (17.12.1778 г – 29.05.1829 г)
Щелочные металлы §11, упр 5 цель: повторить свойства металлов, систематизировать и углубить знания о щелочных металлах на основании их сравнительной. — презентация
1
2 ЩЕЛОЧНЫЕ МЕТАЛЛЫ §11, упр 5
3 Цель: повторить свойства металлов, систематизировать и углубить знания о щелочных металлах на основании их сравнительной характеристики. Сформировать понятие о физических и химических свойствах щелочных металлов.
4
5
6 На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемуся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются очень сильными восстановителями.
Во всех своих соединениях щелочные металлы проявляют степень окисления +1. Восстановительные свойства их усиливаются при переходе от Li к Сs, что связано с ростом радиусов их атомов.
Это наиболее типичные представители металлов: металлические свойства выражены у них особенно ярко.
7
8 Серебристо-белые мягкие вещества (режутся ножом), с характерным блеском на свежесрезанной поверхности. Все они легкие и легкоплавкие, причем, как правило, плотность их возрастает от Li к Сs, а температура плавления, наоборот, уменьшается.
9
10
11 Все щелочные металлы чрезвычайно активны, во всех химических реакциях проявляют восстановительные свойства, отдают свой единственный валентный электрон, превращаясь в положительно заряженный катион. В качестве окислителей могут выступать простые вещества – неметаллы, оксиды, кислоты, соли, органические вещества.
- 12
- 13 Химические свойства Щелочные металлы с Не Ме +Г2+Г2 MeГ +O 2 Li 2 O, Na 2 O 2, KO 2 +H 2 МеH+ N 2 Me 3 N со сложными веществами +H 2 O (бурно) МеOH +H 2 + к-ты (бурно) соль+H 2 R-OHR-OMe +H 2 Проверь себя
- 14
- 15 Щелочные металлы легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность: оксид образует только литий: 4Li + O2 = 2Li2O, натрий образует пероксид: 2Na + O2 = Na2O2, калий, рубидий и цезий – надпероксид: K + O2 = KO2.
- 16 Взаимодействие с водородом, серой, фосфором, углеродом, кремнием протекает при нагревании: с водородом образуются гидриды: 2Na + H2 = 2NaH, с серой – сульфиды: 2K + S = K2S, с фосфором – фосфиды: 3K + P = K3P, с кремнием – силициды: 4Cs + Si = Cs4Si, с углеродом карбиды образуют литий и натрий: 2Li + 2C = Li2C2
17 С азотом легко реагирует только литий, реакция протекает при комнатной температуре с образованием нитрида лития: 6Li + N2 = 2Li3N. С галогенами все щелочные металлы образуют галогениды: 2Na + Cl2 = 2NaCl.
18 Химические свойства 1)2Na + Cl 2 = 2NaCl (в атмосфере F 2 и Cl 2 щелочные Me самовоспламеняются) 2)4Li + O 2 = 2Li 2 O 2Na + O 2 = Na 2 O 2 2K + 2O 2 = K 2 O 4 оксид Li пероксид Na надпероксид K 3) 2Na + Н 2 = 2NaН (при нагревании o C) 4) 6Li + N 2 = 2Li 3 N (Li — при комнатной T, остальные щелочные Me -при нагревании) 5) 2Na + 2Н 2 О = 2NaОН + Н 2 (Li — спокойно, Na — энергично, остальные – со взрывом – воспламеняется выделяющийся Н 2 Rb и Cs реагируют не только с жидкой Н 2 О, но и со льдом.. 6) 2Na+ Н 2 SО 4 = Na 2 SО 4 + Н 2 (протекают очень бурно) 7) 2C 2 H 5 OH + 2Na = 2C 2 H 5 ONa + Н 2 Щелочные металлы с водой
- 19 Качественное определение щелочных металлов Li+ Na+ K+ Для распознавания соединений щелочных металлов по окраске пламени исследуемое вещество вносится в пламя горелки на кончике железной проволоки. Li+ — карминово-красный K+ — фиолетовый Cs+ — фиолетово-синий Na+ — желтый Rb + — красный
- 20
- 21 Все щелочные металлы реагируют с водой, литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
22 Щелочные металлы способны реагировать с разбавленными кислотами с выделением водорода, однако реакция будет протекать неоднозначно, поскольку металл будет реагировать и с водой, а затем образующаяся щелочь будет нейтрализоваться кислотой.
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно. Взаимодействие щелочных металлов с кислотами практически всегда сопровождается взрывом, и такие реакции на практике не проводятся.
Взаимодействие с кислотами
23 Соединения щелочных металлов В свободном виде в природе щелочные металлы не встречаются из-за своей исключительно высокой химической активности. Некоторые их природные соединения, в частности соли натрия и калия, довольно широко распространены, они содержатся во многих минералах, растениях, природных водах.растениях
24 Гидроксид натрия NаОН в технике известен под названиями едкий натр, каустическая сода, каустик. Техническое название гидроксида калия КОН едкое кали.
Оба гидроксида NaОН и КОН разъедают ткани и бумагу, поэтому их называют также едкими щелочами. Едкий натр применяется в больших количествах для очистки нефтепродуктов, в бумажной и текстильной промышленности, для производства мыла и волокон.
Едкое кали дороже и применяется реже. Основная область его применения производство жидкого мыла.
25 Соли Соли щелочных металлов твердые кристаллические вещества ионного строения.. Nа 2СO3 карбонат натрия, образует кристаллогидрат Nа 2СO3* 10Н2O, известный под названием кристаллическая сода, которая применяется в производстве стекла, бумаги, мыла.
Вам в быту более известна кислая соль гидрокарбонат натрия NаНСO3, она применяется в пищевой промышленности (пищевая сода) и в медицине (питьевая сода). К2С03 карбонат калия, техническое название поташ, используется в производстве жидкого мыла.
Nа 2SO4 10Н2O кристаллогидрата сульфата натрия, техническое название глауберова соль, применяется для производства соды и стекла и в качестве слабительного средства.
26 1) Электролиз расплавов соединений щелочных металлов: 2МеCl = 2Ме + Cl 2 4МеOH = 4Ме + 2Н 2 О + О 2 2) Восстановление оксидов и гидроксидов щелочных металлов: 2Li 2 O + Si = 4Li + SiO 2 KOH + Na = NаOH + K Получение щелочных металлов Ванна состоит из стального кожуха с шамотной футеровкой, графитовым анодом А и кольцевым железный катодом К, между которыми расположена сетчатая диафрагма. Электролитом служит более легкоплавкая смесь его с 25% NaF и 12% КСl (что позволяет проводить процесс при 610–650°С). Металлический натрий собирается в верхней части кольцевого катодного пространства, откуда и переходит в сборник. По мере хода электролиза в ванну добавляют NaCl. Схема электролизера для получения натрия
- 27 Применение щелочных металлов Литий Для получения трития Получение сплавов для подшипников Восстановитель в органическом синтезе Химические источники тока Пиротехника
- 28 Применение щелочных металлов Натрий Восстановитель в органическом синтезе Термическое получение металлов Производство натриево- серных аккумуляторов Газоразрядные лампы Качественный анализ органических веществ Теплоноситель в ядерных реакторах
- 29 Применение щелочных металлов Калий В гальванотехнике Калийные удобрения Для получения перекиси калия Катализатор Термическое получение металлов Теплоноситель в ядерных реакторах
- 30 Применение щелочных металлов
- 31
32 Физические свойства щелочных металлов Щелочные металлы — серебристо–белые вещества, за исключением цезия — серебристо-желтого цвета, с металлическим блеском. Все щелочные металлы характеризуются малой плотностью, малой твердостью, низкими температурами плавления и кипения и хорошей электропроводностью.
Благодаря малой плотности Li, Na и К всплывают на воде (Li–даже на керосине). Щелочные металлы легко режутся ножом. Несветящееся пламя газовой горелки щелочные металлы и их летучие соединения окрашивают в характерные цвета: Li – в карминово–красный, Na – в желтый, К – фиолетовый, Rb — красный и Cs – в фиолетово-синий.
Заполни пропуски
33 1. Предложил назвать калий от арабского «алкали» — щелочь И. Арфведсон Г.Деви Й. Берцеллиус 2. В ряду от лития к францию атомный радиус: уменьшается не изменяется увеличивается 3.
Степень окисления щелочных металлов равна: Цвет пламени, в который его окрашивают ионы натрия фиолетовый красный желтый 5. Соединение NaOH называется.
каустическая сода поташ кристаллическая сода проверить Тест «Щелочные металлы»
34 Nа + O2 Nа + Н2О Na + HCl Na + N2 Nа + CH3OH NаО 2 Nа 2O2Nа 2O2 NаОН NaC l Na 2 NNa 3 N NаО 2 Cl 2 NaN NaH Na 2 O H2H2 H2H2 H 2 CH 3 ONa
35 Габриелян О.С. Химия. 9 класс: Учеб. для общеобразоват.учебн. заведений.-М.: Дрофа, Ахметов Н. С. Общая и неорганическая химия. М.: Высшая школа, 2001 Лидин Р. А., Андреева Л. Л., Молочко В. А. Справочник по неорганической химии. М.: Химия, Некрасов Б. В.
Основы общей химии. М.: Химия, Неорганическая химия. Весь школьный курс в таблицах,сост. МанкувичН.В., М г Видеоопыты из диска «Splint.
Химия для всех — XXI: Самоучитель решению химических задач» %81%D0%BA%D0%B8%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0% BD%D1% html Литература и интернет-ресурсы
36
37 NаСl хлорид натрия, или поваренная соль, эта соль вам хорошо известна из курса прошлого года. Хлорид натрия является важнейшим сырьем в химической промышленности, широко применяется и в быту.
38
Презентация к уроку "Щелочные металлы", 9 класс
Слайд 1
Металлы
Слайд 2
F:videoplayback (online-video-cutter.com).mp4
- Слайд 3
- Металлы главной подгруппы I группы (щелочные металлы) литий Li натрий Nа калий К рубидий Rb цезий Сs франций Fr
- Слайд 4
Металлы С u, Au, Ag не взаимодействуют с водой даже при нагревании. Металлы обладают электропроводностью и теплопроводностью. Для металлов характерна металлическая кристаллическая решетка. У атомов металлов на внешнем уровне 1-3 электрона. У атомов металлов на внешнем уровне 1-3 электрона. Металлы являются восстановителями и окислителями.
Для металлов характерна металлическая кристаллическая решетка. Металлы обладают электропроводностью и теплопроводностью. При взаимодействии с кислородом металлы принимают электроны. Все металлы активно взаимодействуют с кислотами. Металлы С u, Au, Ag не взаимодействуют с водой даже при нагревании. М g, Be относятся к щелочноземельным металлам.
Убери лишнее :
Слайд 5
Объясните «нестандартное поведение» натрия ! Почему металл хранят под слоем керосина? Какое вещество сразу образует белый налет на свежем срезе металла? 3. Почему металл горел в воде? 4. Почему металл растворился в воде? 5 . Какой газ выделился? 6. Почему изменилась окраска раствора? Какое вещество образовалось? 7. Как записать уравнение реакции взаимодействия натрия с водой?
Слайд 6
План характеристики щелочных металлов: I . Атомы Положение атомов в ПСХЭ Особенности строения атомов Возможные степени окисления в соединениях II . Простые вещества 4. Химическая связь и кристаллическая решетка 5. Физические свойства 6. Химические свойства 7. Получение 8. Области применения.
Слайд 7
Задания для самостоятельной работы: 1. Определи положение щелочных металлов в периодической системе химических элементов Д.И.Менделеева. Запиши в тетрадь эту информацию. 2. Составь схемы строения …
Слайд 8
План характеристики щелочных металлов: I . Атомы Положение атомов в ПСХЭ Особенности строения атомов Возможные степени окисления в соединениях II . Простые вещества 4. Химическая связь и кристаллическая решетка 5. Физические свойства 6. Химические свойства 7. Получение 8. Области применения.
Слайд 10
СТРОЕНИЕ АТОМОВ На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону . Они легко отдают этот электрон , поэтому являются очень сильными восстановителями . Восстановительные свойства их усиливаются при переходе от Li к Сs, что связано с ростом радиусов их атомов . Во всех соединениях щелочные металлы проявляют степень окисления + 1
- Слайд 11
- Физические свойства щелочных металлов Металлическая кристаллическая решетка Li Na K Rb Cs
- Слайд 12
Серебристо-белые , кроме цезия ( золотистый ) , мягкие ( режутся ножом ), с характерным блеском на свежесрезанной поверхности , Все они легкие и легкоплавкие , проводят электрический ток . Пластичны.
Слайд 13
Химические свойства Все щелочные металлы чрезвычайно активны , во всех химических реакциях проявляют восстановительные свойства , отдают свой единственный валентный электрон , превращаясь в катион . В качестве окислителей могут выступать простые вещества-неметаллы , вода, кислоты, соли .
- Слайд 14
- Химические свойства Проверь себя
- Слайд 15
- Щелочные металлы легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность: оксид образует только литий: 4Li + O2 = 2Li2O, натрий образует пероксид: 2Na + O2 = Na2O2, калий, рубидий и цезий – надпероксид: K + O2 = KO2.
- Слайд 16
- Взаимодействие с водородом, серой, фосфором, углеродом, кремнием протекает при нагревании: с водородом образуются гидриды: 2Na + H2 = 2NaH, с серой – сульфиды: 2K + S = K2S, с фосфором – фосфиды: 3K + P = K3P, с азотом – нитриды: 6 Li + N2 = 2 Li3 N
- Слайд 17
- Все щелочные металлы реагируют с водой, литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом : 2K + 2 H2O = 2KOH + H2
- Слайд 18
- Щелочные металлы способны реагировать с разбавленными кислотами , однако реакция будет протекать неоднозначно… Взаимодействие с кислотами
- Слайд 19
- Электролиз расплавов соединений щелочных металлов : 2МеCl = 2Ме + Cl 2 4МеOH = 4Ме + 2Н 2 О + О 2 Получение щелочных металлов Гемфри Дэви 1778 – 1829)
- Слайд 20
Объясните «нестандартное поведение» металла! Почему металл хранят под слоем керосина? Какое вещество сразу образует белый налет на свежем срезе металла? 3. Почему металл горел в воде? 4. Почему металл растворился в воде? 5 . Какой газ выделился? 6. Почему изменилась окраска раствора? 7. Как записать уравнение реакции взаимодействия натрия с водой?
- Слайд 21
- Вопросы: От лития к францию у атомов щелочных металлов увеличивается Более сильным восстановителем, чем К будет Активнее всех с водой будет взаимодействовать Na может реагировать со всеми веществами группы Щелочные металлы находятся в природе в виде… число валентных электронов восстановительные свойства Электроотрицательность окислительные свойства Rb Li Ca Na Rb Na Li Cs С a, H 2 O, Cl 2 N 2 , H 2 , H 2 O CO 2 , H 2 , C NaOH , O 2 , S оксидов сульфидов солей в свободном виде Ответы:
- Слайд 22
- Решим задачу: Какой объем водорода выделится при взаимодействии 2,3 г натрия с водой ?
- Слайд 23
- Рефлексия Железная логика Стальной характер Золотая голова Медный лоб
- Слайд 24
Домашнее задание. П.30, упражнения: 1 . Исправить ошибки: Na + O 2 Na 2 O K + H 2 O KOH + O 2 Li + Cl 2 LiCl 2 AlCl 3( раствор ) + K KCl + Al 2 «ЗГ». Осуществить превращения: Na Na 2 O 2 Na 2 O Na 2 SO 4 NaOH . В первом уравнении расставить коэффициенты методом электронного баланса.
- Слайд 25
- Применение щелочных металлов Литий Для получения трития Получение сплавов для подшипников Восстановитель в органическом синтезе Химические источники тока Пиротехника
- Слайд 26
- Применение щелочных металлов
- Слайд 27
- Применение щелочных металлов Калий В гальванотехнике Калийные удобрения Д ля получения перекиси калия К атализатор Термическое получение металлов Теплоноситель в ядерных реакторах
- Слайд 28
- Применение щелочных металлов
- Слайд 29
- Применение щелочных металлов
- Слайд 30
Литий был открыт в 1817 г. А. Арфведсоном в минерале петалите . Берцелиус предложил назвать ее литионом ( Lithion ), поскольку эта щелочь впервые была найдена в » царстве минералов » ( камней ) . Литий впервые получен в 1818 г. Г. Дэви путем злектролиза щелочи . Арфведсон Юхан Август (1792 – 1841 ) История открытия лития
Слайд 31
Натрий ( от нем . Natrium от древнеевр . neter — бурлящее вещество . В 1807 г. Г.Дэви получил свободный металл — натрий , назвав его содий (Sodium). В следующем году Гильберт предложил именовать новый металл натронием ( Natronium ); Берцелиус сократ ил название до » натрий » ( Natrium ). Гемфри Дэви (1778 г –1829 г) История открытия натрия
Слайд 32
Калий ( англ . Potassium, франц . Potassium, нем . Kalium ) открыл в 1807 г. Г.Дэви , он именовал новый металл потассием (Potassium), но это название не прижилось . Крестным отцом металла оказался Гильберт , известный издатель журнала » Annalen deг Physik «, предложивший название » калий «; оно было принято в Германии и России . История открытия калия
Слайд 33






