- Получение оснований
- Свойства оснований
- Безопасность в работе со щелочами
- Что за вещество «нашатырный спирт»?
- Применение оснований
- Щелочные продукты питания
- Щелочи: понятие, свойства и применение
- Свойства щелочей
- Применение щелочей
- Едкий натр
- Едкое кали
- Гидроксид алюминия
- Гидроокись кальция
- Гидроокись лития
- Гидроокись бария
- Основания. Что это такое? Свойства, примеры, определение
- Названия оснований
- Тривиальные названия некоторых оснований
- По числу гидроксогрупп
- Физические свойства оснований
- Взаимодействие с кислотными оксидами
- Взаимодействие с кислотами
- Взаимодействие с солями
- Термическое разложение
- Взаимодействие амфотерных гидроксидов со щелочами
- Получение оснований
- Взаимодействие металла с водой
- Взаимодействие оксидов щелочных и щелочноземельных металлов с водой
- Электролиз
- Получение нерастворимых оснований при взаимодействии соли со щелочью
- Вопросы для самопроверки
- Характерные химические свойства оснований и амфотерных гидроксидов
- Номенклатура оснований
- Классификация оснований
- Химические свойства щелочей (Щ)
- Химические свойства нерастворимых оснований
- Химические свойства амфотерных гидроксидов
- ПОИСК
- Химическая коррозия
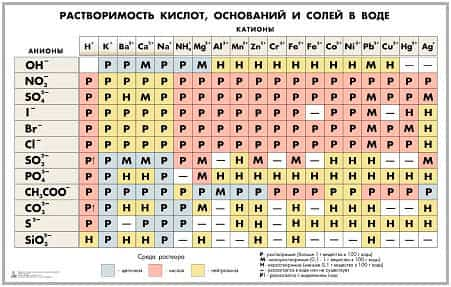
Основания состоят из положительно заряженных ионов металла и гидроксид-ионов ОН-. Щёлочи — это основания, которые хорошо растворимы в воде.
Сведения о растворимости в воде можно брать из таблицы растворимости. Р – растворимые основания, то есть щёлочи, м – малорастворимые, н – нерастворимые, черта «–» означает, что такого основания не существует.
В обычных условиях являются твёрдыми веществами. Имеют вид белых порошков, легко впитывающих влагу. Требуют хранения в банках из толстого стекла с широким горлышком или полиэтиленовых емкостях.
Получение оснований
- Щёлочь образуется в результате реакции металла и воды с большим выделением теплоты. 2Na + 2H2O>2NaOH + H2
- CaO + H2O>Ca(OH)2.
- Гидроксиды натрия и калия образуются при воздействии на раствор электрического тока: KCl + 2H2O>2KOH + H2 + Cl2.
Свойства оснований
Щёлочи реагируют 1. С кислотными оксидами: 2КОН+SO3>K2SO4+H2O.
Щёлочи способны растворять оксидную плёнку алюминия (амфотерного оксида):
2. С кислотами: NaOH+HCl>NaCl+HOH.
Можно определить, осталась ли щёлочь, если добавить 1-2 капли раствора фенолфталеина. Щёлочь прореагировала полностью, если малиновый цвет окрашивания раствора не появился.
Реакция между основанием и кислотой – реакция нейтрализации. Подобные реакции часто применяют с целью очищения сточных вод промышленных предприятий от щелочей и кислот. Продукты таких реакций – соли, которые более безопасны для окружающей среды. Очень эффективной и экономически выгодной является нейтрализация стоков различных производств.
3. С солями. Это реакции обмена. Происходят в растворе, при этом исходная соль должна быть водорастворимой. А получаемое вещество – нерастворимым: 2NaOH+Mn(NO3)2=Mn(OH)2v+2NaNO3
4. С галогенами. На холоде: Cl2 + 2NaOH = NaClO+NaCl+H2O.
- При нагревании: 3Cl2+6NaOH = NaClO3+5NaCl+3H2O.
- Расплавить можно только гидроксиды натрия и калия (температуры плавления соединений составляют 322о и 405о соответственно).
Безопасность в работе со щелочами
Химические ожоги, причиняемые щелочами, в том числе едким натром и едким кали, намного опаснее, чем химические ожоги от кислот. Ожог усугубляется, если кусочек кристаллического вещества прилипает к коже.
Щёлочи способны разъедать много материалов, вызывать серьёзные ожоги на коже и слизистых оболочках, поражать глаза. Поэтому гидроксид натрия называют «едким натром», а гидроксид калия – «едким кали».
При работе со щелочами и их растворами, нужно соблюдать осторожность. При попадании раствора щелочи на кожу, нужно сразу смыть его большим количеством воды. Затем обработать это место слабым раствором уксусной или борной кислоты.
И опять промыть водой.
Что за вещество «нашатырный спирт»?
Жидкость с названием «нашатырный спирт» — это водный раствор газа аммиака NH3. Его используют, как лекарственный препарат. В нашатырном спирте содержатся основание NH4OH (гидроксид аммония). Образуется в результате реакции: NH3+H2O- NH4OH.
Во взаимодействие вступает небольшое количество растворённого аммиака и одновременно распадается на исходные вещества, на что указывает знак «-» в уравнении. Гидроксид аммония, подобно щелочам, изменяет окрашивание индикатора, взаимодействует с кислотными оксидами, кислотами и солями. 2NH4OH+СО2>(NH4)2СО3+H2O NH4OH+HCl>NH4Cl+H2O
NH4OH+Pb(NO3)2>Pb(OH)2v+2NH4NO3.
Применение оснований
Нашатырный спирт используют не только для того, чтобы привести человека в сознание. С его помощью можно отлично вымыть окна, используя 1 столовую ложку препарата на 1 литр воды. Затем нужно вытереть поверхность бумажными полотенцами.
Если смешать 1 часть нашатырного спирта с 1 частью уксуса, а потом протирать полученным раствором поверхность утюга, то он станет чистым. Но не стоит думать, что получится мгновенный эффект. Поверхность нужно аккуратно потереть.
Широко применяют, прежде всего, гидроксиды кальция и натрия. Гашёная известь – это гидроксид кальция Сa(OH)2. Её используют, как вяжущий материал в строительстве. Смешивают с песком и водой. Полученную смесь наносят на кирпич, штукатурят стены.
В результате взаимодействия основания с углекислым газом и оксидом силициума (IV), смесь твердеет. Известь способна поглощать кислые газы.
Также может впитывать токсичные вещества, поэтому для здоровья жильцов белить комнату предпочтительнее, чем красить.
Также гидроксид кальция используют в сахарной промышленности, сельском хозяйстве, при изготовлении зубных паст, получении многих веществ.
Гидроксид натрия (каустическую соду) используют при производстве мыла в реакции щёлочи с жиром, при изготовлении лекарств, в кожной промышленности, для очищения нефти. Каустическая сода применяется для чистки масляных пятен. Всем известный «Крот» для труб представляет собой раствор гидроксида натрия, способный растворять жиры и даже волосы.

Щёлочи разъедают стекло и фарфор. Растворяют белковые вещества.
Применяются в медицине в качестве антисептиков, раздражающих и прижигающих препаратов. При заболеваниях пищеварительной системы щелочные минеральные воды действуют оздоравливающе. Эффективны в лечении подагры, стоматита, в лечении заболеваний дыхательной системы. Являются мочегонным средством. Нейтрализуют отравление кислотами.
Немаловажно участие щелочей в изготовлении каучука, искусственного волокна, красителей, очищения предметов из металла, обработки деревянных поверхностей. Являются хладагентом холодильных установок. Используются в сельском хозяйстве, лёгкой промышленности и металлургии.
Щелочные продукты питания
Различают кислые, щелочные и нейтральные продукты питания. Среди щелочных продуктов можно перечислить зелень, репу, огурцы, хрен, сельдерей, лимоны, свеклу, морковь, капусту, цитрусовые, смородину, виноград, вишню, сухофрукты, картофель, перец, помидоры, чеснок.

Примечательно, что в составе нейтральных продуктов содержатся и кислоты, и щёлочи. Это растительное, сливочное масло.
Интересно, что молоко — это щелочной продукт. Но тёплое или кипячёное молоко – кислый продукт.
Щёлочи активно используются человеком. При этом следует помнить и в обязательном порядке соблюдать правила техники безопасности.
Щелочи: понятие, свойства и применение
- Щелочи — это водорастворимые сильные основания. В настоящее время в химии принята теория Брёнстеда — Лоури и Льюиса, которая определяет кислоты и основания. В соответствии с этой теорией, кислоты — это вещества, способные отщеплять протон, а основания — отдавать электронную пару OH−. Можно сказать, что под основаниями понимают соединения, которые при диссоциации в воде образуют только анионы вида OH−. Если совсем просто, то щелочами называют соединения, состоящие из металла и гидроксид-иона OH−.К щелочам принято относить гидроксиды щелочных и щелочно-земельных металлов.Все щелочи — это основания, но не наоборот, нельзя считать определения «основание» и «щелочь» синонимами. Правильное химическое название щелочей — гидроксид (гидроокись), например, гидроокись натрия, гидроксид калия. Часто употребляются также названия, которые сложились исторически. Ввиду того, что щелочи разрушают материалы органического происхождения — кожу, ткани, бумагу, древесину, их называют едкими: например, едкий натр, едкий барий. Однако понятием «едкие щелочи» химики определяют гидроксиды щелочных металлов — лития, натрия, калия, рубидия, цезия.
Свойства щелочей
Щелочи — твердые вещества белого цвета; гигроскопичные, водорастворимые. Растворение в воде сопровождается активным выделением тепла. Вступают в реакции с кислотами, образуя соль и воду. Эта реакция нейтрализации является важнейшей из всех свойств щелочей. Кроме этого, гидроксиды реагируют с кислотными оксидами (образующими кислородосодержащие кислоты), с переходными металлами и их оксидами, с растворами солей.Гидроксиды щелочных металлов растворяются в метиловом и этиловом спиртах, способны выдерживать температуры до +1000 °С (за исключением гидроксида лития).Щелочи — активные химические реагенты, поглощающие из воздуха не только водяные пары, но и молекулы углекислого и сернистого газа, сероводорода, диоксида азота. Поэтому хранить гидроксиды следует в герметичной таре или, например, доступ воздуха в сосуд со щелочью организовать через хлоркальциевую трубку. В противном случае хим.реактив после хранения на воздухе будет загрязнен карбонатами, сульфатами, сульфидами, нитратами и нитритами.Если сравнивать щелочи по химической активности, то она увеличивается при движении по столбцу таблицы Менделеева сверху вниз.Концентрированные щелочи разрушают стекло, а расплавы щелочей — даже фарфор и платину, поэтому растворы щелочей не рекомендуется хранить в сосудах с пришлифованными стеклянными пробками и кранами, так как пробки и краны может заклинить. Хранят щелочи, обычно, в полиэтиленовых емкостях.Именно щелочи, а не кислоты, вызывают более сильные ожоги, так как их сложнее смыть с кожи и они проникают глубоко в ткань. Смывать щелочь надо неконцентрированным раствором уксусной кислоты. Работать с ними необходимо в средствах защиты. Щелочной ожог требует немедленного обращения к врачу!
Применение щелочей
— В качестве электролитов.— Для производства удобрений.— В медицине, химических, косметических производствах.— В рыбоводстве для стерилизации прудов.
В магазине «ПраймКемикалсГрупп» вы найдете самые востребованные щелочи по выгодным ценам.
Едкий натр
Самая популярная и востребованная в мире щелочь.
Применяется для омыления жиров в производстве косметических и моющих средств, для изготовления масел в процессе нефтепереработки, в качестве катализатора и реактива в химических реакциях; в пищепроме.
Едкое кали
Применяется для производства мыла, калийных удобрений, электролитов для батареек и аккумуляторов, синтетического каучука. Также — в качестве пищевой добавки; для профессиональной очистки изделий из нержавеющей стали.
Гидроксид алюминия
Востребован в медицине как отличный адсорбент, антацид, обволакивающее средство; ингредиент вакцин в фармацевтике. Кроме этого, вещество применяется в очистных сооружениях и в процессах получения чистого алюминия.
Гидроокись кальция
Популярная щелочь с очень широким спектром применения, которую в быту знают под названием «гашеная известь». Используется для дезинфекции, смягчения воды, в производстве удобрений, едкого натра, «хлорки», строительных материалов. Применяется для защиты деревьев и деревянных сооружений от вредителей и огня; в пищепроме как пищевая добавка и реактив при производстве сахара.
Гидроокись лития
Гидроокись бария
Применяется в химпроме как катализатор, а также в пищепроме для очистки жиров, сахара.
В аналитической химии применяются фиксаналы щелочей, которые можно купить у нас:— стандарт-титр Натрий гидроокись (Натрий гидроксид) 0,1 H— стандарт-титр Калий гидроокись (Калий гидроксид) 0,1 Н
Основания. Что это такое? Свойства, примеры, определение
- Основания (гидроксиды) — это сложные вещества, которые состоят из катиона металла и гидроксильной группы (OH).
- Общая формула оснований: Me(OH)n, где Me — химический символ металла, n — индекс, который зависит от степени окисления металла.
- Примеры оснований: NaOH, Ba(OH)2, Fe(OH)2.
Названия оснований
Названия гидроксидов строятся по систематической номенклатуре следующим образом:
-
Пишем слово «гидроксид».
-
Указываем название второго химического элемента в родительном падеже.
-
Если второй элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
- Примеры названий оснований:
- Ni(OH)2 — гидроксид никеля (II);
- Al(OH)3 — гидроксид алюминия.
У некоторых оснований существуют и тривиальные названия. Собрали их в таблице.
Тривиальные названия некоторых оснований
| KOH | Едкое кали |
| NaOH | Едкий натр, каустическая сода |
| Ca(OH)2 | Гашеная известь |
| Ca(OH)2 (прозрачный раствор) | Известковая вода |
| Ca(OH)2 (мутный раствор) | Известковое молоко |
| Ba(OH)2 | Едкий барит |
В зависимости от растворимости в воде выделяют:
- щелочи. Эти основания растворимы в воде: NaOH, KOH, Ba(OH)2 и другие. Ca(OH)2, хотя малорастворим, тоже относится к щелочам из-за своей едкости;
- нерастворимые основания. К таким основаниям относятся Fe(OH)2, Cu(OH)2 и другие;
- амфотерные гидроксиды. К амфотерным относятся те основания, которые образованы металлами со степенью окисления +3 или +4. Эти основания отличаются тем, что проявляют как основные свойства, так и кислотные.
Также есть основания, которые относятся к амфотерным, но образованы металлом с иной степенью окисления: Zn(OH)2, Pb(OH)2, Sn(OH)2, Be(OH)2.
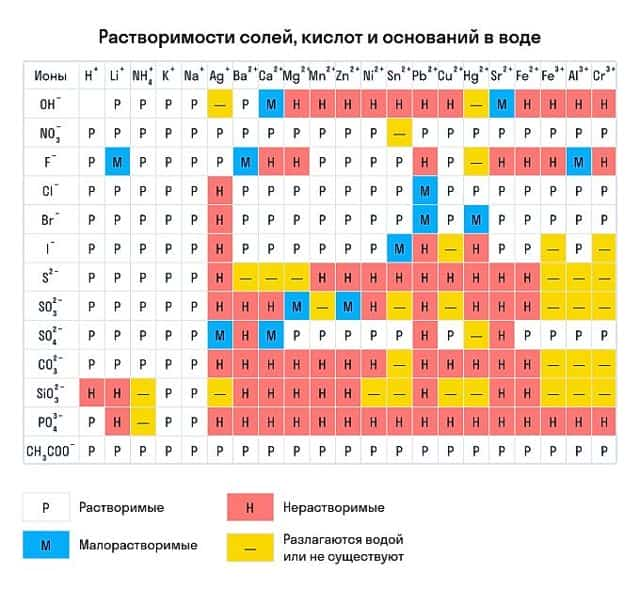
Напомним, что растворимость мы проверяем по таблице растворимости кислот и оснований в воде.
По числу гидроксогрупп
В зависимости от количества гидроксильных групп, способных замещаться на кислотный остаток, выделяют следующие виды оснований:
- однокислотные: KOH, NaOH;
- двухкислотные: Fe(OH)2, Ba(OH)2;
- трехкислотные: Al(OH)3, Fe(OH)3.
Физические свойства оснований
Основания при обычных условиях — это твердые кристаллические вещества без запаха, нелетучие, чаще всего белого цвета. В таблице приведены основания, которые имеют иную окраску.
| Белый |
|
| Желтый | Гидроксид меди (I) CuOH |
| Светло-розовый (при соприкосновении с кислородом воздуха — коричневый) | Гидроксид марганца (II) Mn(OH)2 |
| Красно-коричневый | Гидроксид железа (III) Fe(OH)3 |
| Белый с зеленоватым оттенком (темнеет при соприкосновении с кислородом воздуха) | Гидроксид железа (II) Fe(OH)2 |
| Светло-зеленый | Гидроксид никеля (II) Ni(OH)2 |
| Синий | Гидроксид меди (II) Cu(OH)2 |
Гидроксид-ионы, которые содержатся в растворе щелочи, взаимодействуют с индикатором, образуя новые соединения. Признак реакции — окраска раствора.

Взаимодействие с кислотными оксидами
Щелочи вступают в реакцию с любыми кислотными оксидами. Нерастворимые основания взаимодействуют только с кислотными оксидами, которые соответствуют сильным кислотам.
Кислотный оксид + основание = соль + вода
Например: N2O5 + 2NaOH = 2NaNO3 + H2O
Взаимодействие с кислотами
Щелочи вступают в реакцию со всеми кислотами. Нерастворимые основания могут взаимодействовать только с сильными кислотами.
- Основание + кислота = соль + вода
- Например: Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
- Взаимодействие основания с кислотой называют реакцией нейтрализации — это частный случай реакции обмена.
Взаимодействие с солями
Основания взаимодействуют с растворимыми солями по обменному механизму. В результате такой реакции должен выделиться осадок или газ (CO2, SO2, NH3).
Основание + соль = другое основание + другая соль
Например: KOH + MgSO4 = Mg(OH)2↓ + K2SO4
Термическое разложение
При нагревании нерастворимые основания разлагаются на соответствующий оксид (степень окисления металла остается неизменной) и воду.
Нерастворимое основание
оксид металла + вода
Взаимодействие амфотерных гидроксидов со щелочами
Продукты реакции зависят от условий ее проведения.
-
- При сплавлении двух оснований:
- Амфотерный гидроксид (тв) + щелочь (тв) = средняя соль + вода
- Например: Al(OH)3 + KOH = KAlO2 + 2H2O
-
- Если реакция проводится в растворе:
- Амфотерный гидроксид (р-р) + щелочь (р-р) = комплексная соль
- Например: Al(OH)3 + KOH = K[Al(OH)4]
Получение оснований
Взаимодействие металла с водой
- Активные металлы (металлы групп IA и IIA, кроме Be и Mg) активно взаимодействуют с водой при обычных условиях с образованием щелочей.
- Нерастворимые основания данным способом получить невозможно, за исключением Mg(OH)2.
- Металл + вода = гидроксид металла + водород
- Например: Na + H2O = NaOH + H2↑
- Гидроксид магния можно получить данным способом, но только при нагревании:
Взаимодействие оксидов щелочных и щелочноземельных металлов с водой
- Этим способом получают только растворимые в воде основания.
- Оксид металла + вода = щелочь
- Например: CaO + H2O = Ca(OH)2
Электролиз
- Гидроксид натрия и калия в промышленности получают с помощью электролиза — через раствор хлорида калия проводят постоянный электрический ток:
- KCl + H2O = KOH + H2↑ + Cl2↑
- Электролиз хлорида натрия протекает по аналогичной схеме.
Получение нерастворимых оснований при взаимодействии соли со щелочью
Растворимая соль + щелочь = нерастворимое основание + другая соль
Например: Cu(NO3)2 + 2KOH = Cu(OH)2↓ + 2KNO3
Вопросы для самопроверки
-
Вспомните определение оснований и приведите 2 примера этих веществ.
-
Какие виды оснований существуют? Чем они отличаются?
-
К какому виду оснований относится Zn(OH)2?
-
Взаимодействуют ли основания с основными оксидами? Приведите примеры веществ, с которыми основания вступают в реакцию.
-
Можно ли получить гидроксид алюминия с помощью взаимодействия алюминия с водой?
Основания и другие темы по химии изучать интереснее, когда понимаешь, как применять знания в реальной жизни. На онлайн-курсах по химии в Skysmart преподаватели приводят яркие примеры: от процессов в природе до использования химических реакций в промышленности. Приходите учиться — вводный урок бесплатный!
Учёба без слёз
Пошаговый гайд от Екатерины Мурашовой о том, как перестать делать уроки за ребёнка и выстроить здоровые отношения с учёбой

Характерные химические свойства оснований и амфотерных гидроксидов
Характерные химические свойства оснований и амфотерных гидроксидов добавить в закладки
Первое знакомство с основаниями состоялось при изучении взаимодействия воды с активными металлами и с оксидами активных металлов. В состав оснований входит одновалентная группа атомов OH (гидроксогруппа). Следовательно, основаниям можно дать следующее определение:
Основания – сложные вещества, в состав которых входят атомы металлов, соединенные с одной или нескольким группами атомов OH.
Общая формула оснований выглядит следующим образом: Ме (ОН)x, где Ме – металл; x – индекс.
Номенклатура оснований
Название оснований включает в себя слово «гидроксид», названия металла и его валентности. Более того, для элементов с постоянной валентностью она не указывается.
Название основания = «Гидрооксид» + название Me + валентность (в скобках)
Классификация оснований
Все основания можно классифицировать по различным признакам. Рассмотрим это в нижеприведенной таблице.
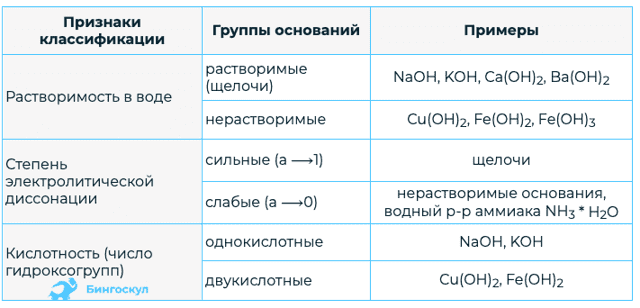
Из таблицы мы видим, что наблюдается большое различие по некоторым признакам. В зависимости от этого, различные группы оснований, обладают не схожими химическими свойствами.
Химические свойства щелочей (Щ)
- Водные растворы Щ изменяют окраску индикаторов, тем самым можно определить реакцию среды.
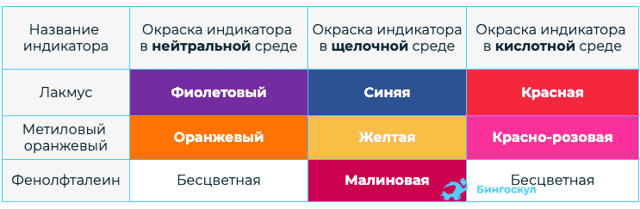
- Реакция нейтрализации заключается во взаимодействии основания и кислоты, ход которой можно проследить по изменению окраски индикаторов. Данная реакция характерна и для щелочей, и для нерастворимых оснований.
NaOH + HCl → NaCl + H2O
- Для Щ характерны реакции с солями, в результате образуется другая соль и основание.
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
- Могут вступать в реакции с кислотными оксидами, при этом образуется нерастворимая соль и вода.
Ca(OH)2 + CO2 = CuCO3↓ + H2O
- В отличии от нерастворимых оснований, не разлагаются при нагревании.
Химические свойства нерастворимых оснований
- Так же как и щелочи, могут изменять окраску индикаторов.
- Характерна реакция нейтрализации.
Fe(OH)2 + H2SO4 → FeSO4 + 2H2O
- При нагревании разлагаются с образованием основного оксида и воды.
Химические свойства амфотерных гидроксидов
Камфотерным гидроксидамотносятся сложные вещества, способные проявлять свойства кислот либо оснований при определенных условиях.
Формулы данных соединений можно представить в виде оснований и в виде кислот.
- ZnO — Zn(OH)2 ↔ H2ZnO2
- Al2O3 — Al(OH)2 ↔ H3AlO3
- GeO2 — Ge(OH)4 ↔ H4GeO4
- В нейтральной среде не растворяются и не диссоциируют на ионы. Способны разлагаться в кислотах и щелочах.
- При взаимодействии с кислотами образуется соль и вода.
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
- В результате реакции со щелочами образуются те же соединения, что и в предыдущей реакции.
Zn(OH)2 + 2NaOH =Na2[Zn(OH)4]комплексная соль
- Способны взаимодействовать с основными оксидами
2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O
- Так же как и щелочи взаимодействуют с солями.
2Al(OH)3 + Na2CO3 = 2NaAlO2 + CO2 + 3H2O
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных
- Характерные химические свойства кислот
- Характерные химические свойства солей: средних, кислых, оснóвных; комплексных ( на примере соединений алюминия и цинка)
- Взаимосвязь различных классов неорганических веществ
ПОИСК
Действие щелочей на металлы [c.112]
Щелочи на металлы не действуют, исключая Ве [c.260]
В лабораторной практике водород обычно получают действием металлов на разбавленные кислоты, воду и растворы щелочей. Составить уравнения реакций получения водорода иа кислот, воды и растворов щелочей. [c.227]
Опыт 2. Действие металла на щелочь. Поместить в пробирку 3 мл 20% раствора едкого натра и несколько кусочков алюминия. Если реакция идет плохо, осторожно подогреть раствор. Определить, какой газ выделяется. [c.137]
Получение водорода действием металлов на водные растворы щелочей. Неблагородные металлы, гидроксиды которых амфотерны, из водных растворов щелочей выделяют водород. Таковыми являются цинк и алюминий [c.622]
Действие щелочей на металлы. Металлы, гидроксиды которых амфотерны, окисляются водными растворами сильных оснований. При этом окислителем является вода, в результате восстановления которой происходит выделение водорода.
Образующийся катион металла координирует гидроксид-ионы ОН из щелочи в прочный гидроксокомплекс, что постоянно сдвигает равновесие между исходными и окисленными атомами металла в сторону последних.
Поэтому водными, растворами сильных оснований способны окисляться лишь те металлы, катионы которых образуют устойчивые гидроксокомплексы и, следовательно, оксиды которых проявляют амфотерные свойства. Например, [c.178]
В лабораторной практике водород получают действием металлов на воду, разбавленные растворы кислот и растворы щелочей (в последнем случае применяются металлы, гидроокиси которых амфотерны). Использовать можно только те металлы, которые в. ряду напряжений располагаются выше водорода (см. табл. 15, стр. 173). [c.153]
Имеется сплав двух металлов. Один компонент сплава растворяется в щелочах, оба металла растворяются в соляной кислоте. В соединениях металлы проявляют степень окисления +2. При действии раствора гидроксида натрия на образец сплава массой 5,7 г выделился водород объемом 2,24 л.
Масса нерастворимого остатка составила 4,8 г. При растворении образца сплава массой 3,42 г в соляной кислоте образовался водород объемом 4,032 л. Какие металлы образуют сплав Определите их массовые доли в сплаве. Объемы газов приведены к нормальным условиям. Ответ бериллий— 15,8% магний — 84,2%.
[c.221]
Под влиянием внешних условий (действия воздуха, различных газов, воды, растворов кислот, щелочей, солей) металлы подвергаются разрушению. Разрушение металлов, вызванное химическим или электрохимическим воздействием на них среды, в которой они находятся, получило название коррозии. Один из распространенных примеров коррозии — это ржавление металлов. [c.180]
Фенолы обладают слабокислотными свойствами. Если спирты дают алкоголяты только при действии на них свободного металла, то водород гидроксильной группы фенолов замещается не только при действии металла, но и при действии на фенолы едких щелочей. Получающиеся при этом вещества называются фенолятами-. [c.451]
По химическим свойствам твердые углеводороды имеют ярко выраженный насыщенный характер. Они устойчивы к действию самых разнообразных реагентов (кислот, щелочей, щелочных металлов), на холоде не поддаются действию окислителей. [c.59]
Аналогичным образом при действии гидросульфидами щелоч-шх металлов могут быть синтезированы тиолы. [c.151]
Известны десятки различных методов получения На.
На первом этапе развития производства водорода, когда его потребление исчислялось десятками кубометров в час, использовались главным образом методы, основанные на способности многих металлов вытеснять водород из воды, разбавленных кислот или щелочей.
К ним относятся растворение цинка в разбавленной кислоте и алюминия или кремния в едкой щелочи, действие натрия или гидрида кальция на воду. В настоящее время эти методы применяют лишь в лабораторной практике или для получения небольших количеств водорода в полевых условиях. [c.8]
- Действие щелочи на металл [c.75]
- Действие металла на щелочь Опыт проводить под вытяжным шкафом [c.51]
- Получение водорода действием металлов на щелочь [c.110]
К аналогичным результатам приводит изучение явлений анодной пассивности в щелочных растворах, в которых такие металлы, как железо и никель, очень быстро принимают сильно электроположительный потенциал и теряют способность растворяться на аноде.
Это дает возможность употреблять их в качестве нерастворимых электродов при электролитическом получении кислорода и водорода путем электролиза щелочных растворов.
Так как электрохимический метод исследования, в его применении к изучению пассивности, является весьма чувствительным, то химическое исследование действия щелочей на металлы было углублено применением методов электрохимических.
В ряде работ было показано, что самые концентрированные растворы щелочи могут оставлять железо до некоторой степени активным, причем наблюдается некоторый оптимум пассивирования (при концентрации щелочи около 4 н.). Особенно заметно проявляется активность железа при более высокой температуре, что, повидимому, стоит в связи со свойством защитной пленки растворяться при таких условиях в щелочных растворах. [c.425]
В отличие от алкильных эфиров, арильные эфиры, синтезированные из фенолов и хлорангидрида кислоты, являются очень устойчивыми соединениями [4506]. Они легко растворяются в разбавленной щелочи, выпадая из раствора в неизмененном виде при действии кислот.
Гидролиз их происходит только при нагревании с 50%-ным раствором едкого натра, тогда как алкильные эфиры полностью гидролизуются горячей водой, в которой метиловый эфир легко растворим.
Арильные эфиры вследствие наличия достаточно подвижного водорода дают соли щелочных металлов в водном растворе, но алкильные эфиры образуют металлические соли только в безводном растворителе, например в бензоле при действии металла, причем получающиеся соли разлагаются спиртом или водой.
Так, дифенилметионат содержит, очевидно, более подвижный водород, чем диэтилмалонат, кислотные свойства которого в свою очередь выражены сильнее, чем у диэтилме-тионата. Натриевые и калиевые производные алкильных и арильных эфиров легко алкилируются иодистыми алкилами или диметилсульфатом.
На этой реакции основан метод синтеза гомологов метионовой кислоты, получение которых другими путями затруднительно. Представляется довольно интересным, что натрийалкил-эфиры, повидимому, не претерпевают внутримолекулярного алкилирования, которое, как можно было бы ожидать, будет происходить по схеме [c.177]
Отношение к кислотам и щелочам. Соляная и разбавленная серная кислоты окисляют Ре, Со и Ni до Э (П). Концентрированные HNO3 и H2SO4, а также царская водка окисляют железо до Э (П1), а кобальт и никель — до Э (П).
Под действием дымящей HNO3 на холоде железо, кобальт, никель пассивируются, образуя на поверхности оксидные слои. При 600 С никель взаимодействует с расплавленными щелочами. Водные растворы щелочей на металлы не действуют. [c.
396]
Одним из лабораторных методов его получения служит взаимодействие цинка с ра 5бавленной серной или соляной кислотой (в атшрате Киппа). Щелочные и щелочно-земельные металлы вытесняют водород даже из воды.
Другой лабораторный метод — электролиз воды, точнее 25%-ного раствора гидроксида натрия или 34%-ного раствора гидроксида калия, имеющих максимальную электрическую проводимость и не корродирующих никелевые электроды.
Иногда водород получают действием едких щелочей на металлы [c.275]
В роли окислителя вода выступает также при взаимо действии с гидридами щелочных и щелочь оземельных металлов, являющихся очень сильными восстановителями [c.679]
Рассматриваемые металлы отличаются друг от друга своим отношением к щелочам. Хром даже при высоких температурах не взаимодействует с расплавленными щелочами. На молибден щелочи действуют при нагревании. Вольфрам не растворяется в расплавленных щелочах, однако он реагирует с ними в присутствии, кислорода илл ощелителей (ЫаНОз, КСЮз), образуя вольфра- [c.470]
Мягче, чем сплавление со щелочами, действует сплавление с гидратами окислов щелочноземельных металлов или их смесей с едкими щелочами. Гидраты окислов щелочноз1мельных металлов препятствуют дальнейшему 1идроксилированию вс.аедствие окисления и предупреждают расщепление антрахинонового ядра, которое иногда происходит при сплавлении а-сульфокислот с едкими щелочами [c.260]
Наиболее активным катализатором реакции вытеснения, как уже неоднократно указывалось [8—10], является никель, в особенности в коллоидальном состоянии.
Применения никеля можно избежать при проведении реакции в специальных условиях часто (но не всегда) отмечается усиленное образование олефина также в присутствии щелочи.
Если в течение некоторого времени применяющийся этилен обрабатывать (с целью полной его очистки) расплавленным алюмотетраэтнлнатрием, то наблюдается идущая без видимой сначала причины интенсивная реакция образования олефина, т. е. реакция, обратная реакции достройки.
Добавляя некоторое количество диэтилалюминийхлорида к алюминийтриалкилу, этого осложнения можно избежать. Однако только замещение не вызывает изменения скорости реакции. Необходимо удалить следы щелочи.
Возможно, щелочь действует косвенно, растворяя следы тяжелых металлов материала, из которого изготовлен автоклав. С триалкилалюминием, содержащим некоторое количество диэтилалюминийхлорида, в стальном автоклаве (желательно, чтобы в нем никогда прежде не производилось гидрирование с никелем в качестве катализатора), как правило, удается провести реакцию достройки, в особенности при втором—третьем повторении. [c.155]
Алкоголяты могут бьпъ получены при действии на спирты силь-ньи оснований — гидридов или амидов щелочных или щелоч-. ноземельных металлов, а также реактивов Гриньяра. [c.243]
Серебро — медь, промотор никель-олово, ингибитор карбонаты щелочных металлов делают металлы более способными к коррозии в растворах, чем в дестиллированной воде согласно коллоидной теории коррозии щелочи действуют как ингибиторы, когда они употребляются в концентрациях, достаточных для осаждения золя катализатора сразу при его образовании [c.381]
Кроме перечисленных катализаторов, примеси в изоцианатах или полиолах также могут оказывать значительное каталитическое действие.
Примеси щелочей или металлов в полиолах действуют как катализаторы, в то время как кислые примеси в изоцианатах и полиолах могут уменьшать суммарный каталитический эффект в результате нейтрализации части прибавляемого катализатора.
Опубликован подробный обзор по катализу различных реакций изоцианатов [329]. [c.401]
Петров, Данилович и Раби овкаталитическое действие металлов— порошкообразного свинца, железа и цинка — на окисление нефтяных лшсел при 100—105″ Из этих. металлов свинец оказался лучшим, дав около 2,6—3,6% кислот. С другими.
металлами выхода кислот (0,41—0,7%) были меньшими или во всяком случае не большими, че.м те, которые получались в отсутствии катализатора. Однако масло после очистки серной кислотой и щелочью не ол ислялось при 49-часовом действии воздуха при 100, ни в присутствш, ни h отсутствии цинка или железа.
Свинец катализировал образование оксикислот, нерартворимых в бензоле. [c.1005]
При действии на хлористый какодил щелочи вновь получается окись какодила, а при действии металлов — свободный какодил (на самом деле — дикакодил) [c.338]
Германий — твердый, очень хрупкий, серебристо-белый металл, пл. 5,323, т. пл. 958,5 С. В обычных условиях достаточно пассивен.
Концентрированная Н2304 только слегка разъедает его сильнее действует она, если в нее добавлен 3%-ный раствор Н2О2. Для травления германия употребляется смесь азотной и плавиковой кислот.
Щелочи действуют на него в присутствии окислителей [c.264]
Глаубер подробно изучил вопрос об образовании и составе многих солей. Действуя кислотами на щелочи, на металлы и металлические извести , он получил хлориды, сульфаты и нитраты и пришел к выводу, что соли состоят из двух начал — кислотного и щелочного.
Глауберу была известна нейтрализация он даже оценивал относительную силу различных кислот по их способности вытеснять другие кислоты из солей он установил явление так называемого двойного избирательного сродства на примере реакции между сулемой и сернистой сурьмой при нагревании их смеси перегоняется сурьмяное масло (треххлористая сурьма), а в реторте остается киноварь (сернистая ртуть). Большое практическое значение получила открытая Глаубером реакция взаимодействия поташа с азотной kh .iotou с образованием чистой калийной селитры. [c.166]
Действие металлов на кислоты и щелочи.
Быстрое растворение металлов в разбавленных растворах таких кислот, как НС1 или H2SO4, можно рассматривать первом приближении тоже как взаимодействие их с водой в условиях, когда защитная плета из гидрата окисла, препятствующая растворению металлов в простой воде, не может удерживаться на иоверхиости металла, так как все время превращается кислотой в растворимую соль металла (гипотеза Лапласа). [c.194]
Наиболее часто в качестве катализаторов применяют третичные амины, а также октоат и олеат олова, диоктоат дибутилолова и дилаурат дибутилолова.
Каталитическое действие оказывают также примеси щелочей или металлов, которые могут остаться в смолах.
Примеси кислого характера в смолах или изоцианатах нейтрализуют часть катализатора, слегка понижая таким образом его эффективность. [c.287]
Химическая коррозия
- Коррозия металлов
- Свойства оксидов и гидроксидов металлов
- Действие щелочей на металлы
Щелочи взаимодействуют с некоторыми металлами р-семейства (Аl, Gа, In, Рb, и др.) и d-семейства (Zn, Сr, и др.) с выделением водорода и образованием солей. В разбавленных растворах щелочей образуются комплексные соли
- Zn + 2NaOH = Na2ZnO2 + H2
- цинкат натрия
- или Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
- Na2[Zn(OH)4] − тетрагидроксоцинкат натрия.
- Из металлов s-семейства только бериллий растворяется в щелочи:
- Be + 2NaOH + 2H2O = Na2[Be (OH)4] + H2
- Na2[Be (OH)4] − тетрагидроксобериллат натрия.
- Выше приведенные реакции характерны для металлов, оксиды и гидроксиды которых проявляют амфотерные свойства.
Оксиды металлов имеют, преимущественно, основной характер. Лишь некоторые из них проявляют амфотерные свойства. Реагируют с водой лишь оксиды щелочных и щелочно-земельных металлов, образуя растворимые в воде гидроксиды (NаОН, КОН, Ва(ОН)2и др.), которые являются очень сильными основаниями и называются щелочами.
Большинство же оксидов металлов непосредственно с водой не реагирует, соответствующие им гидроксиды получают косвенным путем (при взаимодействии щелочей с солями металлов); они нерастворимы в воде и являются слабыми основаниями, например, Fе(ОН)3, Сu(ОН)2, Ni(ОН)2, Со(ОН)2и др.
Гидроксиды, проявляющие как свойства оснований, так и свойства кислот (в зависимости от реагента, вступающего с ним в реакцию), называются амфотерными. К ним относятся Ве(ОН)2, Zn(ОН)2, Рb(ОН)2, Аl(ОН)3, Сr(ОН)3 и др.
Практически амфотерность гидроксида можно доказать в лаборатории путем растворения его как в кислоте, так и в растворе щелочи. Молекулярные и сокращенные ионно-молекулярные уравнения реакций, доказывающих амфотерный характер гидроксидов цинка и алюминия, приводятся ниже:
| Zn(OH)2 + 2HCl = ZnCl2 + 2H2O Zn(OH)2+ 2H+ = Zn+2 + 2H2O | Al(OH)3 + 3HCl = Al Cl3 + 3H2O Al(OH)3 + 3H+ = Al +3 + 3H2O |
| Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] Zn(OH)2 + 2OH- = [Zn(OH)4]2- | Al(OH)3 + NaOH = Na[Al(OH)4] Al(OH)3 + OH- = [Al(OH)4]- |
Самопроизвольное разрушение металлов и сплавов на их основе, происходящее под воздействием окружающей среды, называетсякоррозией. Следующей схемой можно представить коррозию (окисление) металла:
Meo — nê ® Men+
По механизму взаимодействия металла с окружающей средой различают химическую и электрохимическую коррозии.
Разрушение металла происходит, в большинстве случаев, при повышенной температуре в отсутствие следов влаги, в среде неэлектролита.
Например, при работе двигателя внутреннего сгорания в неводных органических средах (бензин, смазочные масла), при термической обработке металла, разрушение арматуры печей и т.д.
В результате коррозии на поверхности металла образуется пленка соответствующего соединения: оксида, сульфида, хлорида металла и т.п. Активные металлы s-семейства (Nа, К, Са, Ва ) энергично окисляются на воздухе при комнатной температуре, поэтому их хранят под слоем керосина или масла.






