- Общая характеристика элементов VIa группы
- Основное состояние атома кислорода
- Природные соединения
- Получение
- Химические свойства
- Кислород
- Физические свойства O2
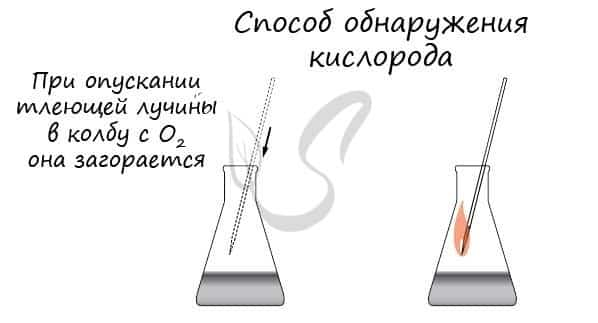
- Способы получения
- Химические свойства кислорода
- Окисление щелочных металлов
- Окисление всех металлов, кроме Au, Pt
- Окисление неметаллов, кроме галогенов и благородных газов
- Окисление водородных соединений неметаллов и металлов
- Окисление низших оксидов и гидроксидов поливалентных металлов и неметаллов
- Окисление сульфидов металлов
- Окисление органических веществ
- Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
- Понятие о степени окисления (С.О.)
- Сущность окислительно-восстановительных реакций
- Типичные окислители
- Типичные восстановители
- Разновидности ОВР
- Составление ОВР методом электронного баланса
- Коррозия металлов
- Защита от коррозии
- Значение ОВР
- Кислород в металле. Окисление примесей
- 1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
- Виды окислительно-восстановительных реакций
- Межмолекулярные ОВР
- Внутримолекулярные ОВР
- Реакции диспропорционирования
- Расстановка коэффициентов в окислительно-восстановительных реакциях
- Метод электронного баланса
- Окислители
- Восстановители
- Коррозия металлов и способы защиты от нее
- Способы защиты металлов от коррозии
Кислород (лат. Oxygenium) — элемент VIa группы 2 периода периодической таблицы Д.И. Менделеева. Первым открывает группу халькогенов — элементов VIa группы.
Газ без цвета, без запаха, составляет 21% воздуха.

Общая характеристика элементов VIa группы
Общее название элементов VIa группы O, S, Se, Te, Po — халькогены. Халькогены (греч. χαλκος — руда + γενος — рождающий) — входят в состав многих минералов. Например, кислород составляет 50% массы земной коры.
От O к Po (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
Среди элементов VIa группы O, S, Se — неметаллы. Te, Po — металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np4:
- O — 2s22p4
- S — 3s23p4
- Se — 4s24p4
- Te — 5s25p4
- Po — 6s26p4
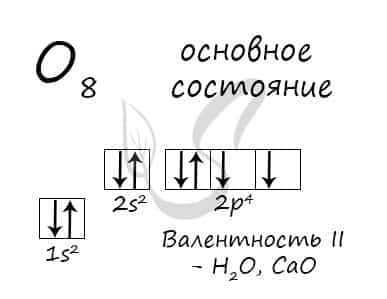
Основное состояние атома кислорода
У атома кислорода (как и атомы азота, фтора, неона) нет возбужденного состояния, так как отсутствует свободная орбиталь с более высоким энергетическим уровнем, куда могли бы перемещаться валентные электроны.
Атом кислорода имеется два неспаренных электрона, максимальная валентность II.
Природные соединения
- Воздух — в составе воздуха кислород занимает 21% (это число пригодится в задачах!)
- В форме различных минералов в земной коре кислорода содержится около 50%
- В живых организмов кислород входит в состав органических веществ: белков, жиров, углеводов и нуклеиновых кислот
Получение
В промышленности кислород получают из сжиженного воздуха. Также активно применяются кислородные установки, мембрана которых устроена как фильтр, отсеивающие кислород (мембранная технология).
В лаборатории кислород получают разложением перманганата калия (марганцовки) или бертолетовой соли при нагревании. Применяется реакция каталитического разложения пероксида водорода.
- KMnO4 → K2MnO4 + MnO2 + O2↑
- KClO3 → KCl + O2↑
- H2O2 → (кат. — MnO2) H2O + O2
- На подводных лодках для получения кислорода применяют следующую реакцию:
- Na2O2 + CO2 → Na2CO3 + O2↑

Химические свойства
Является самым активным неметаллом после фтора, образует бинарные соединения со всеми элементами кроме гелия, неона, аргона. Чаще всего реакции с кислородом экзотермичны (горение), ускоряются при повышении температуры.
- Реакции с неметаллами
- Во всех реакциях, кроме взаимодействия со фтором, кислород проявляет себя в качестве окислителя.
- NO + O2 → (t) NO2
- S + O2 → (t) SO2
- 2C + O2 = (t) 2CO (неполное окисление — угарный газ, соотношение 2:1)
- C + O2 = (t) CO2 (полное окисление — углекислый газ, соотношение 1:1)
- F + O2 → OF2 (фторид кислорода, O+2)
- Реакции с металлами
- Li + O2 → Li2O (оксид)
- Na + O2 → Na2O2 (пероксид)
- K + O2 → KO2 (супероксид)
- Горение воды
- Окисление органических веществ
- Контролируемое окисление
В реакциях кислорода с металлами образуются оксиды, пероксиды и супероксиды. Реакции с активными металлами идут без нагревания.
Известна реакция горения воды во фторе.
F2 + H2O → HF + O2
Все органические вещества сгорают с образованием углекислого газа и воды.
C3H7 + O2 = CO2 + H2O

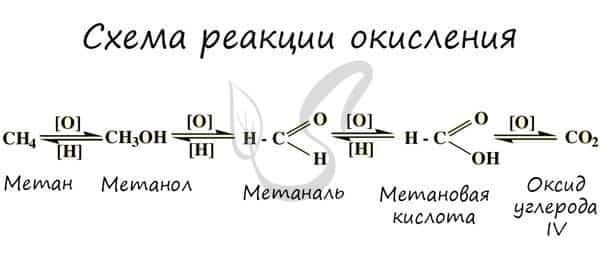
При применении катализаторов и особых реагентов в органической химии достигают контролируемого окисления: алканы окисляются до спиртов, спирты — до альдегидов, альдегиды — до кислот.
Процесс можно остановить на любой стадии в зависимости от желаемого результата.
Кислород
Кислород (О2) впервые был получен К. Шееле в 1770 г. при нагревании селитры. В 1774 г. Дж. Пристли осуществил получение кислорода разложением оксида ртути.
- 8О 1s22s22p4; Аr = 15,999
Изотопы: 16O (99,759 %); 17О (0,037 %); 18О (0,204 %); ЭО — 3,5 - Кларк в земной коре 47% по массе; в гидросфере 85,82% по массе; в атмосфере 20,95% по объему.
- Самый распространенный элемент.
- Формы нахождения элемента: а) в свободном виде — О2, О3;
- б) в связанном виде: анионы О2- (преимущественно)
- Кислород — типичный неметалл, p-элемент. Валентность = II; степень окисления -2 ( за исключением Н2О2, OF2, O2F2)
Физические свойства O2
Молекулярный кислород O2 при обычных условиях находится в газообразном состоянии, не имеет цвета, запаха и вкуса, малорастворим в воде. При глубоком охлаждении под давлением конденсируется в бледно — голубую жидкость (Тkип — 183°С), которая при -219°С превращается в кристаллы сине — голубого цвета.
Способы получения
- 1. Кислород образуется в природе в поцессе фотосинтеза mCО2 + nH2O → mO2 + Сm(H2O)n
- 2. Промышленное получение
- а) ректификация жидкого воздуха (отделение от N2);
- б) электролиз воды: 2H2O → 2Н2↑ + О2↑
- 3.
В лаборатории получают термическим окислительно-восстановительным разложением солей:
- а) 2КСlO3 = 3О2↑ + 2KCI
- б) 2КМпO4 = О2↑ + МпО2 + К2МпО4↑
- в) 2KNO3 = О2↑ + 2KNО2
- г) 2Cu(NO3)O2 = О2↑ + 4NО2↑ + 2CuO
- д) 2AgNO3 = О2↑ + 2NО2↑ +2Ag
- 4.
В герметически замкнутых помещениях и в аппаратах для автономного дыхания кислород получают реакцией:
- 2Na2O2 + 2СO2 = О2↑ + 2Na2CO3
Химические свойства кислорода
Кислород — сильный окислитель. По химической активности уступает только фтору. Образует соединения со всеми элементами, кроме Не, Ne и Аг.
Непосредственно реагирует с большинством простых веществ при обычных условиях или при нагревании, а также в присутствии катализаторов (исключение — Au, Pt, Hal2, благородные газы).
Реакции с участием О2 в большинстве случаев экзотермичны, часто протекают в режиме горения, иногда — взрыва. В результате реакций образуются соединения, в которых атомы кислорода, как правило, имеют С.О. -2:
Окисление щелочных металлов
- 4Li + О2 = 2Li2O оксид лития
- 2Na + О2 = Na2О2 пероксид натрия
- К + О2 = КО2 супероксид калия
Окисление всех металлов, кроме Au, Pt
Me + О2 = МеxOy оксиды
Окисление неметаллов, кроме галогенов и благородных газов
- N2 +О2 = 2NO — Q
- S + О2 = SО2;
- C + О2 = CО2;
- 4Р + 5О2 = 2Р2О5
- Si + О2 = SiО2
Окисление водородных соединений неметаллов и металлов
- 4HI + О2 = 2I2 + 2Н2O
- 2H2S + 3О2 =2SО2 + 2Н2O
- 4NH3 + 3О2 =2N2 + 6Н2O
- 4NH3 + 5О2 = 4NO + 6Н2O
- 2PH3 + 4О2 = P2О5 + 3Н2O
- SiH4 + 2О2 = SiО2 + 2Н2O
- CxHy + О2 = CО2 + Н2O
- MeHx + 3О2 = MexOy + Н2O
Окисление низших оксидов и гидроксидов поливалентных металлов и неметаллов
- 4FeO + О2 = 2Fe2О3
- 4Fe(OH)2 +О2 + 2H2O = 4Fe(OH)3
- 2SО2 + О2 = 2SО3
- 4NО2 + О2 + 2H2O = 4HNО3
Окисление сульфидов металлов
4FeS2 + 11О2 = 8SО2 + 2Fe2О3
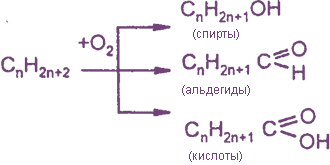
Окисление органических веществ
- Все органические соединения горят, окисляясь кислородом воздуха.
- Продуктами окисления различных элементов, входящих в их молекулы, являются:
- С → CO2
- Н → Н2O
- Hal → Hal2
- N → N2
- P → P2O5
- S → SO2
- Кроме реакций полного окисления (горения) возможны также реакции неполного окисления.
- Примеры реакций неполного окисления органических веществ:
- 1) каталитическое окисление алканов
2) каталитическое окисление алкенов
- 3) окисление спиртов
- 2R-CH2OH + O2 → 2RCOH + 2Н2O
- 4) окисление альдегидов
- Озон О3 — более сильный окислитель, чем O2, так как в процессе реакции его молекулы распадаются с образованием атомарного кислорода.
- Чистый О3 — газ синего цвета, очень ядовит.
- К + О3 = КО3 озонид калия, красного цвета.
- PbS + 2О3 = PbSО4 + О2↑
- 2KI + О3 + Н2O = I2 + 2КОН + О2↑
- Последняя реакция используется для качественного и количественного определения озона.
Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее добавить в закладки
Среди тысяч химических превращений, которыми овладел человек, особое и самое большое место занимают окислительные и восстановительные процессы.
Они – суть самой жизни. В круговороте веществ на нашей планете, в осуществлении фотосинтеза, дыхания и метаболизма живыми организмами – всюду протекают взаимосвязанные реакции окисления и восстановления (ОВР).
Понятие о степени окисления (С.О.)
С.О. – основная характеристика состояния химических элементов.
Она условно обозначает заряд атома в химическом веществе, приобретенный этим атомом в процессе отдачи или принятия электронов от других элементов.
У элемента, отдавшего электрон, появляется положительная С.О., у принявшего электрон – отрицательная.
Важно помнить. В веществах молекулы электронейтральны, и сумма С.О. всех входящих в эти молекулы атомов будет всегда нулевой.
Это позволяет находить С.О. по формулам соединений.
Сущность окислительно-восстановительных реакций
Взаимодействия веществ с изменением С.О. атомов составляющих их элементов называют окислительно-восстановительными реакциями.
- В этой трансформации заключается их главный и характерный признак
- Ещё одно определение ОВ-реакций – это химическое преобразование, протекающее с переносом электронов от одних частиц (восстановителей) к другим (окислителям).
- 2Na0 + Cl20 = 2Na+Cl-
- Приведенный пример ОВР умозрительно можно представить состоящим из двух полуреакций:
2Na0 – 2e- = 2Na+ – здесь идёт отдача электроотрицательных частиц (электронов) от атома натрия, являющимся в данном случае восстановителем. Происходит окисление.
Во втором полупроцессе Cl2 + 2e- = 2Cl- – окислитель хлор, принимая электрон, участвует в восстановлении.
Усвоению этих процессов и обозначающих их терминов может помочь схема:

Советы для избежания путаницы в этих понятиях:
- Составить аббревиатуру по первым буквам терминов:
Окислитель – взял е- — восстановился → ОВВ Восстановитель – отдал е- — окислился → ВОО
- Выучить стихотворение:
Восстановитель — это тот, кто электроны отдает. Сам отдает грабителю, злодею-окислителю. Отдает — окисляется, сам восстановителем является.
Типичные окислители
- Сильными окислителями являются неметаллы в свободном состоянии: фтор F2, хлор Cl2, бром Br2, йод I2, кислород O2, озон O3, сера S и другие.
- группа кислородсодержащих кислот, в их числе: азотная HNO3, концентрированная серная Н2SO4, хромовая H2CrO4, а также соответствующие им оксиды N2O5, Mn2O7, CrO3.
- к менее сильным окислителям относятся соли вышеназванных кислородосодержащих кислот, например, KMnO4 (Mn+7), K2Cr2O7 (Cr+7).
- Положительно заряженные частицы металлов в самой высокой степени окисления меди Cu2+, олова Sn4+, железа Fe3+, ртути Hg2+, свинца Pb4+.
Типичные восстановители
- Простые вещества группы металлов, например, железо Fe0, цинк Zn0, алюминий Al0 и др.
- Положительно заряженные частицы металлов в самой низкой С.О., например, олова Sn2+, железа Fe2+, свинца Pb2+ и др.
- кислородсодержащие кислоты со своими окислами, в которых кислотообразующий элемент находится в низшей степени окисления, к примеру, сернистая кислота H2SO3, азотистая кислота HNO2 и т.д.
- группа бескислородных кислот и их солей: иодистовородная кислота НI, иодид калия KI, сероводород Н2S, сульфид натрия Na2S и т.д.
У веществ, содержащих атомы элементов с промежуточной С.О., может возникать окислительно-восстановительная двойственность.
Так, азотистокислый натрий будет восстановителем относительно сильных окислителей (K2Cr2O7) и окислителем относительно типичного восстановителя KI.
Разновидности ОВР
- Межмолекулярные. К ним относят ОВ-реакции, в которых С.О. меняются у атомов разных соединений.
C0 + O20 = C+4CO2-2; N20 + 3H20 = 2N-3H3+1.
- Внутримолекулярные. В этом случае и окислитель, и восстановитель являются атомами одного элемента:
2H2O2-1 = 2H2O-2 + O20; 2H2+1O2-2 = 2H20 +O20;
- Диспропорционирование. Другое название ОВ-реакция самоокисления-самовосстановления. В процессе её один и тот же элемент в одном и том же веществе выступает и как окислитель, и как восстановитель:
Cl20 + H2+O-2 = H+Cl- + H+Cl+O-2
Хлор Cl2 здесь и окисляющий и восстанавливающий элемент.
Составление ОВР методом электронного баланса
При написании ОВ-реакций важно соблюдать не только закон сохранения масс веществ до и после взаимодействия, но и равенство (баланс) электрических зарядов исходных реагентов и полученных продуктов.
При способе электронного баланса производится сравнение С.О.в левой и правой части уравнения. При этом необходимо знать формулы получаемых веществ.
Правило. В уравнении ОВР слева сначала записывается восстановитель, отдающий электроны, потом окислитель, их принимающий. Справа, в первую очередь пишут продукт окисления, потом восстановления, после все остальные вещества.
Пример составления уравнения ОВР углерода (С) с алюминием (Al).
Al + C → Al4C3
- Сначала следует определить элементы, изменившие свои С.О.
Al0 + C0 → Al4+3C3-4
- Алюминий, отдав три электрона, сменил С.О. с 0 до +3
Al0 → Al+3 1Al0 — 3e- → 1Al+3
- Углерод, приняв четыре электрона, сменил свою С.О. с 0 на – 4
C0 → C+4 1C0 + 4e- → 1C-4
- Далее уравнение нужно сбалансировать, подбирая множители. Число отданных Al электронов подставить в полуреакцию углерода C, а число принятых углеродом электронов записать в схему полуреакции алюминия:
4| 1Al0-3e- → 1Al+3
3| 1C0+4e- → 1C-4
В результате алюминий лишился 4×3 = 12 электронов, а углерод принял 3×4 = 12 электронов.
- Последний этап – уравнивание количества атомов слева и справа с помощью стехиометрических коэффициентов: реакцию вступило 4·1Al0=4Al0 атома алюминия и 3·1C0=3C0 атома углерода.
Окончательно уравнение выглядит так:
4Al0+3C0 = Al4+3C3-4
| ОКИСЛИТЕЛИ | |
|
|
Коррозия металлов
Разрушение металла от воздействий окружающей среды называется коррозией. По сути коррозия – химический окислительно-восстановительный процесс, зависящий от места, где он происходит.
Следует различать химическую (Х.К.) и электрохимическую (Э.Х.К.) коррозию.
- При химической коррозии металлы подвергаются деструкции от вредных влияний газов, жидкостей, не способных проводить электричество. Например, появление окалины на железе от контакта с кислородом при повышенных температурах. Или разрушение металлического оборудования, трубопроводов от воздействия сернистых соединений, содержащихся в нефтяных фракциях.
- Электрохимическая коррозия непосредственно связана с деструкцией металла в электролитном растворе под действием возникающего в нем электрического тока. Для возникновения разрушительных электрических токов необходим контакт металлов разной активности или наличие неоднородных участков на поверхности корродирующего металла. Таким электрохимическим разрушениям часто подвергаются морские корабли, котельное оборудование, заглублённые в почву металлические сооружения.
Справка. В мире ежегодно из-за коррозии теряется 25% произведённого человечеством железа!
Защита от коррозии
- Создание щадящих условий эксплуатации металлоконструкций и аппаратов. Размещение их в помещениях с пониженной влажностью, под навесами, защищающими от атмосферных воздействий.
- Нанесение защищающих неметаллических покрытий: красок, лаков, эмалей, полимерных плёнок (ПЭ, ПВХ).
- Обработка металлических изделий химическим способом для создания на них изолирующих оксидных, нитридных, фосфатных покрытий.
- Нанесение гальваническими технологиями защитных металлопокрытий: никелевых, хромовых, цинковых, кадмиевых.
- Оцинковывание железных листов термическим способом.
- Антикоррозионная защита электрохимическим методом:
- катодной защитой при подключении металлосооружения проводниками к катодному полюсу источника электротока или к куску более активного металла (протектору).
- Легирование металлов при их выплавке специальными добавками хрома, никеля, цинка (пример нержавеющей стали).
- Воздействие на агрессивную среду, в которой эксплуатируется металлический объект, например, добавлением в неё ингибиторов (замедлителей) коррозии или дегазацией – удаление газов, вызывающих разрушение.
Значение ОВР
В начале статьи говорилось о значении ОВ — процессов для жизни на Земле.
Люди научились применять их для своих нужд. Используют для получения металлов, необозримого количества веществ и материалов, для очистки окружающей среды от загрязняющих её продуктов своей жизнедеятельности.
Но познание глубин и тайн этих сложнейших явлений природы продолжается…
Смотри также:
Кислород в металле. Окисление примесей
В течение плавки стали в дуговой печи кислород попадает в металл и частично растворяется в нем, такой процесс обычно называют окислением металла.
Окисление металла и его примесей происходит в основном за счет оксидов железа, загруженных на шлак твердых окислителей, вдуваемого в печь и в расплав газообразного кислорода и в незначительной степени за счет кислорода печной атмосферы.
Присадки твердых окислителей на шлак приводят к повышению содержания в нем оксидов железа (Fe2O3, FeO). На границе раздела металл – шлак Fe2О3 восстанавливается до FeО.
В соответствии с законом распределения кислород переходит из шлака в металл по схеме
- (FеО) = [Fе] + [О].
- Оксиды железа могут передавать в металл кислород из печной атмосферы, в том числе и в случае подачи кислорода в рабочее пространство, когда на поверхности контакта шлака и печной атмосферы FеО окисляется до Fе2O3 по схеме
- 2(FеО) – 1/2 O2=(Fе2O3).
Образовавшийся оксид Fе2O3 восстанавливается на поверхности контакта с металлом до FеО, что способствует переходу кислорода в металл вследствие увеличения концентрации и активности FеО и повышения окислительной способности шлака. Кислород, поступивший в расплав, расходуется в основном на окисление примесей.
- При вдувании газообразного кислорода непосредственно в металлический расплав струя кислорода внедряется в металл, и в этой зоне, по-разному называемой в специальной литературе (зона продувки, зона внедрения, реакционная зона), на поверхности пузырьков и струй идет прямое окисление железа по схеме
- 2[Fе] + O2газ=2(FеО).
- Там же может протекать окисление примесей кислородом:
- [С] + 1/2 O2газ=СО; 2[Мn] + O2газ =2(МnО);
[Si] + O2газ = (SiO2) и т.д.
Объем зоны продувки сравнительно невелик, даже в кислородных конверторах он не превышает 10… 13 %. Поэтому окисление примесей в основном протекает в остальном объеме ванны, часто называемом циркуляционной зоной. Кислород туда попадает вследствие растворения его в железе в зоне продувки по схеме (FеО) = Fе + [О] и последующего переноса в объеме расплава конвективными потоками.
- Следует помнить, что часть примесей, находящихся в металлическом расплаве, легко окисляется кислородом (Si, Тi, Аl, V, В); часть примесей практически не окисляется (Ni, Мо, Сu, Со, W); часть примесей окисляется не полностью (Мn, Сr).
- Наибольший интерес для металлургов представляет реакция окисления углерода, так как продуктом этой реакции является газообразный оксид углерода СО , пузырьки которого, выделяясь из металлического расплава, перемешивают его, способствуют выравниванию химического состава расплава и его температуры, ускоряют нагрев металла, удаляют растворенные в металле газы, проходя через слой шлака, способствуют его вспениванию.
- Процесс окисления углерода в ванне сталеплавильной печи достаточно хорошо изучен и может быть описан следующими схемами:
- 1) окисление кислородом оксидов железа шлака
- [С] + (FеО)ж = Fеж + СОгаз;
- 2) окисление кислородом, растворенным в металле,
- [С] + [O] → СOгаз;
- 3) окисление газообразным кислородом в виде пузырьков, попавших в ванну при продувке кислородом,
- [С] + 1/2 O2газ → СОгаз .
Повышение температуры всегда способствует более полному и быстрому окислению углерода. Заметное окисление углерода наблюдается лишь при определенной температуре. Минимальный необходимый перегрев металла над линией ликвидуса (температурой полного расплавления), при котором начинается процесс окисления углерода, составляет 30…40 °С, практически он несколько выше.
Следует помнить, что при окислении углерода газообразным кислородом суммарный тепловой эффект процесса положителен и выделяется большое количество тепла; при окислении углерода оксидами железа шлака суммарный тепловой эффект процесса отрицательный из-за больших затрат энергии на перенос кислорода из шлака и тепло поглощается ванной.
Поэтому окисление углерода газообразным кислородом в принципе начинается раньше и может быть использовано, как отмечалось выше, для ускорения расплавления ванны.
При окислении углерода оксидами железа шлака, вносимыми в шлак твердыми окислителями, температура ванны сначала может снизиться, так как тепло расходуется на нагрев и плавление твердых окислителей, а затем— на осуществление реакции окисления углерода оксидами железа шлака, соответственно уменьшится и скорость окисления углерода.
Практически с самого начала применения газообразного кислорода в металлургии даже в старых цехах с маломощными печами стремились проводить комбинированное окисление углерода твердыми окислителями и газообразным кислородом для ускорения процесса.
При изучении кинетики процесса обезуглероживания многочисленными исследованиями были установлены так называемые критические концентрации углерода (0,15…0,30 %), при достижении которых резко снижается скорость окисления углерода и изменяется режим взаимодействия углерода и кислорода.
В области концентраций углерода выше критических процесс окисления углерода лимитируется внешней диффузией (интенсивностью подачи кислорода), т. е. увеличив интенсивность подачи кислорода в расплав, можно увеличить и скорость реакции окисления.
При концентрации углерода ниже критических скорость обезуглероживания почти не зависит от интенсивности продувки кислородом и уменьшается пропорционально понижению концентрации углерода.
При концентрациях углерода менее 0,05 % скорость обезуглероживания определяется только диффузией углерода к месту протекания реакции и может быть повышена лишь за счет дополнительного перемешивания расплава.
В отдельных случаях скорость процесса обезуглероживания может определяться процессом выделения СО, получаемого в результате окисления углерода.
Известно, что для образования пузырька СО в металле необходимо преодолеть давление столба металла рм, столба шлака рш, атмосферы над ними ратм, силы сцепления жидкости 2 σ/r, где σ – поверхностное натяжение металла, r — радиус образующегося пузырька:
РвыдCO ≥ Рм + Рш + Ратм + 2 σ/r
При малых значениях r величина 2 σ/r огромна и образование пузырьков СО в объеме жидкого металла практически невозможно.
Такой процесс возможен лишь на границах раздела фаз: шлак – металл; неметаллическое включение – металл; футеровка ванны – металл; газовый пузырь -металл.
Наиболее благоприятны условия образования пузырьков СО на границе раздела футеровка – металл, вследствие шероховатости футеровки, плохой смачиваемости ее металлом и наличия микропор, заполненных воздухом, в поверхностном слое футеровки.
Наблюдаемая в конце окислительного периода плавки окисленность металла близка к равновесной для реакции окисления углерода, но несколько выше ее (рис. 3.1). Разница между фактической и равновесной концентрациями углерода вызвана как раз трудностями с выделением оксида углерода (СО) в газовую фазу.
Зависимость фактических и равновесных со шлаком концентраций кислорода в стали от содержания углерода в процессе его окисления в дуговых печах вместимостью 100 и 40 т
Следует подчеркнуть, что для условий окислительного периода плавки вполне допустимо окисленность металла характеризовать содержанием кислорода в металле, определенном методом вакуум- плавки. Как известно, этот метод позволяет определить лишь общее содержание кислорода в металле
[O]общ = [O]раств + [O]включ
В окислительный период плавки в результате кипения ванны практически все кислородсодержащие неметаллические включения из ванны удаляются и [О]общ = [О]раств, т. е. весь кислород растворен в металле.
В дальнейшем после раскисления стали в ней содержится некоторое количество неметаллических продуктов раскисления и часть кислорода находится в виде [О]вкл .
Из-за трудностей определения содержания растворенного в металле кислорода окисленность металла в таких случаях обычно характеризуют величиной активности кислорода в металле , получаемой расчетным путем с учетом состава стали либо определяемой методом ЭДС непосредственно в жидком металле.
1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Окислительно-восстановительные реакции (ОВР) — такие реакции, которые протекают с изменением степеней окисления элементов.
Изменение степеней окисления происходит из-за полной или частичной передачи электронов от одних атомов к другим:
Поскольку электроны имеют заряд «-1» , следовательно, понижение степени окисления атома химического элемента происходит в результате приобретения им дополнительных электронов.
Процесс приобретения атомом дополнительных электронов называется восстановлением:
- Вещество, которое содержит восстанавливающиеся атомы, называют окислителем.
- В примере выше окислителем является азотная кислота HNO3.
- Аналогично повышение степени окисления происходит в том случае, когда атом элемента теряет некоторое количество своих электронов. Процесс потери атомом электронов называют окислением:
Химическое вещество, которое содержит окисляющиеся атомы, называют восстановителем. В указанном примере восстановителем является фосфин PH3.
Виды окислительно-восстановительных реакций
Межмолекулярные ОВР
Межмолекулярные окислительно-восстановительные реакции — такие реакции, в которых атомы окислителя и атомы восстановителя находятся в разных веществах. Например:
Внутримолекулярные ОВР
Внутримолекулярные окислительно-восстановительные реакции — такие реакции, в которых атомы восстановителя и атомы окислителя содержатся в одном веществе. Например:
Реакции диспропорционирования
Реакциями диспропорционирования называют такие реакции, в которых атомы одного химического элемента, являются окислителями и восстановителями и при этом находятся в одном веществе. Такие реакции также называют реакциями самоокисления-самовосстановления. Например, к таким реакциям относятся все реакции взаимодействия галогенов с растворами щелочей:
Расстановка коэффициентов в окислительно-восстановительных реакциях
Метод электронного баланса
Метод электронного баланса — метод расстановки коэффициентов в окислительно-восстановительной реакции, основанный на том, что количество электронов, отданных восстановителем, равно числу электронов, полученных окислителем.
Алгоритм расстановки коэффициентов данным методом выглядит следующим образом:
1) Следует записать схему реакции, указав формулы всех реагентов и продуктов. Например, при взаимодействии концентрированной серной кислоты с фосфором образуется фосфорная кислота, диоксид серы и вода:
2) Далее следует расставить все степени окисления и найти те элементы, у которых изменилось значение степени окисления.
3) После расстановки степеней окисления химических элементов находят те элементы, которые изменили свои степени окисления. Далее записывают уравнения полуреакций окисления и восстановления. В нашем случае они имеют вид:
4) Поскольку количество отдаваемых электронов восстановителем должно быть равно количеству принимаемых электронов окислителем, далее следует подобрать дополнительные множители к записанным полуреакциям:
- 5) Подобранные к полуреакциям множители переносятся в схему реакции:
- 6) Отталкиваясь от тех коэффициентов, которые уже известны из электронного баланса, оставшиеся коэффициенты расставляют методом подбора:
- Примечание:
- Следует отметить, что если в одной структурной единице какого-либо участника реакции содержится не один атом химического элемента, изменившего степень окисления, а 2 или больше, то это обязательно следует учитывать при записи уравнений полуреакций. Обратите внимание на составление электронного баланса для реакции горения этана в кислороде:
Как можно видеть в первом уравнении полуреакции, мы учли то, что в левой части уравнения уже сразу содержится не менее двух атомов углерода, поскольку одна формульная единица C2H6 содержит два атома C. По этой причине мы поставили коэффициент 2 перед атомами углерода в левой и правой частях полуреакции, а также удвоили количество «уходящих» электронов (14 вместо 7-ми).
Во второй полуреакции мы также учли, что в левой части уравнения реакции не может быть менее двух атомов кислорода, поскольку 2 атома O содержатся в одной молекуле O2. Однако как вы могли заметить, в случае простого вещества кислорода мы не стали писать 2O, а записали O2. Также следует поступать и в случае других простых молекулярных веществ, например, O2, F2, Cl2, N2, H2 и т.д.
Очевидно, что электронный баланс — не самая сложная часть в процессе составления уравнения окислительно-восстановительной реакции. Часто трудности возникают в том, какие продукты записывать в правой части схемы реакции.
Для того чтобы записывать уравнения ОВР, не нужно пытаться выучить все возможные реакции, тем более, что это невозможно в принципе. Надо учиться их составлять.
В первую очередь, что действительно следует выучить, так это формы существования окислителей и восстановителей до и после реакции в зависимости от среды раствора. Среда раствора определяется по наличию или отсутствию среди реагентов кислоты или щелочи.
Также всегда нужно помнить, что в качестве возможных продуктов не следует писать формулы веществ, реагирующих с остальными продуктами и/или со средой. Так, например, в продуктах не может быть кислоты, если изначально среда раствора щелочная и наоборот.
В общем, говоря более простыми словами, все продукты должны быть химически «безразличны» друг к другу, а также к среде раствора (исключение — электролиз).
Ниже представлены основные окислительно-восстановительные переходы окислителей и восстановителей в зависимости от среды. Во многих случаях указаны не целые формулы веществ, а формулы ионов, входящих в их состав.
В таком случае для записи уравнения реакции в молекулярном виде формулу иона требуется дополнить противоионами.
Катионы металлов, чаще всего, объединяют с кислотными остатками, если среда кислая, а анионы с катионами металлов (если среда щелочная) или водорода, если среда кислая или нейтральная.
Окислители
Восстановители
Коррозия металлов и способы защиты от нее
Коррозией металла называют процесс его самопроизвольного разрушения в результате контакта с окружающей средой.
Коррозия бывает химическая и электрохимическая.
Химическая коррозия — вид коррозии, при котором металл разрушается из-за его взаимодействия с газами или жидкостями, не проводящими электрический ток.
Так, например, к химической коррозии относится образование окалины при взаимодействии железа с кислородом при высоких температурах, а также разрушение металлического оборудования под действием нефтяных фракций, содержащих сернистые соединения.
Электрохимической коррозией называют разрушение металла в растворе электролита вследствие возникновения в данной системе электрических токов.
Электрические токи, способствующие коррозии, возникают в тех случаях, когда в растворе электролита изделие из металла контактирует с другим менее активным металлом.
Также такие токи могут появляться из-за химической неоднородности металлического материала, из которого выполнено изделие.
Так, например, из-за электрохимической коррозии страдают подводные части судов, паровые котлы, трубопроводы, металлические конструкции в почве и т.д.
Способы защиты металлов от коррозии
1) Контроль условий, в которых эксплуатируется металлическое оборудование. Например, хранение и использование изделий из стали на открытом воздухе нежелательно и этого, по возможности, следует избегать. Эксплуатация металлического оборудования в помещениях с низкой влажностью существенно продлит его срок службы.
2) Создание защитных покрытий, изолирующих металлоконструкцию от контакта с окружающей средой. Среди таких покрытий различают:
— неметаллические покрытия — всевозможные краски, лаки, эмали, а также пленки из таких полимеров, как полиэтилен, поливинилхлорид и т.д.;
— химические покрытия (оксидные, нитридные, фосфатные и т.д.) (Такие покрытия получают специальной химической обработкой поверхности металла.);
— металлические покрытия.
Металлические покрытия получают нанесением на защищаемую металлическую конструкцию тонкого слоя другого металла (чаще всего с помощью процесса электролиза).
При этом, если в качестве покрытия используется менее активный металл, то такое покрытие будет защищать металлоконструкцию только при условии его целостности. В случае, если целостность такого покрытия будет нарушена, защищаемый металл будет ускоренно корродировать.
Также широко используется покрытие металлоконструкций более активным металлом. Например, распространено использование так называемого оцинкованного железа.
Такое покрытие защищает металлические объекты даже при нарушении его целостности, поскольку пока практически полностью не исчезнет слой покрытия из более активного металла, коррозия металла, из которого сделан защищаемый объект, не начнется.
- 3) Электрохимические методы защиты:
- — катодная защита — вид защиты, при котором металлический объект подключается с помощью проводников к катоду внешнего источника тока либо же приводится в контакт с более активным металлом.
- Частный случай катодной защиты, при котором металлическая конструкция приводится в контакт с более активным металлом, называют протекторной защитой.
- 4) Изменение химических свойств среды, в которой эксплуатируется металлическое изделие, в частности:
- — добавление в среду веществ, замедляющих коррозию (ингибиторов коррозии).
- — дегазация среды (удаление растворенных в ней газов, в частности, кислорода). Например, такой метод работает для защиты от ржавления железа, поскольку в процессе ржавления железа активное участие принимает не только вода, но и кислород:
- 4Fe + 6H2O + 3O2 = 4Fe(OH)3






