Перейти к содержимому
ЗАДАНИЕ 1Напишите уравнения возможных реакций взаимодействия натрия и цинка с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
2Nа + 2Н2О = 2NаОН + Н22Nа + 2НСl = 2NаСl + Н22Nа + Cl2 = 2NаСlZn + Cl2 = ZnCl2Zn0 -2e→Zn2+ окисляется, восстановительCl20+2e→2Cl- восстанавливается, окислительZn + H2O = ZnO + H2.
Zn + 2HCl = ZnCl2 + H2
- ЗАДАНИЕ 2Напишите уравнения реакций, с помощью которых можно осуществить превращения по схемеFe →FeCl2 →Fe(N03)2 →Fe(OH)2 →FeO.
- Превращение 3 рассмотрите в свете ТЭД.
- Fe + 2HCl = FeCl2 + H2FeCl2 + 2AgNO3 = 2AgCl + Fe(NO3)2Fe(NO3)2 + 2NaOH = Fe(OH)2 + 2NaNO3Fе2++ 2NO3-+ 2Na++2OH- =2Na++2NO3-+ Fе(ОН)2 Fе2++ 2OH- = Fе(ОН)2
- Fе(ОН)2= FеО+ Н2О
ЗАДАНИЕ 3При взаимодействии 12 г магния с избытком соляной кислоты выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
- Mg + 2HCl = MgCl2 + H2n (Mg) = 12/24 = 0,5 мольV (H2) = 10/22,4 = 0,446 мольn (Mg) = n (H2) по уравнению (теор.)
- выход = 0,446 /0,5 = 0,89 = 89 %
- ЗАДАНИЕ 1Напишите уравнения возможных реакций лития и меди с веществами: хлором, водой, соляной кислотой.
- Рассмотрите одну из записанных реакций в свете ОВР.
- 2Li + Cl2 = 2LiCl2Li + 2H2O = 2LiOH + H22Li + 2HCl = 2LiCl + H2Cu + Cl2 = CuCl2Cu + H2O = не реагируетCu + HCl = не реагирует2Li+CL2= 2LiCL Li- e—> Li+ восстановитель
- CL2+2e—-> 2CL- окислитель
- ЗАДАНИЕ 2Напишите уравнения реакций, с помощью которых можно осуществить превращения по схемеСа →CaO →Са(ОН)2 →Ca(N03)2 → Са3(Р04)2.
- Превращение 3 рассмотрите в свете ТЭД.
- 2Ca+O2=2CaO CaO+2NaOH=Ca(OH)2+Na2O2HNO3 + Ca(OH)2 =Ca(NO3)2 + 2H2O2H+ +2NO3- + Ca(OH)2 =Ca2+ +2NO3- + 2H2O2H+ + Ca(OH)2 =Ca2+ +2H2O
- 3Ca(NO3)2 + 2Н3PO4 = Ca3(PO4)2 + 6HNO3
ЗАДАНИЕ 3При термическом разложении 10 г известняка было получено 1,68 л углекислого газа (н. у.). Вычислите объемную долю выхода продукта реакции.
- CaCO3 = CaO+CO2n (CaCO3) = 10/100 = 0,1 мольV (CO2) = 1,68/22,4 = 0,075 мольn (CaCO3) = n (CO2) по уравнению (теор.)
- выход = 0,075/0,1 = 0,75 = 75 %
- ЗАДАНИЕ 1Напишите уравнения возможных реакций кальция и железа с веществами: хлором, водой, соляной кислотой.
- Рассмотрите одну из записанных реакций в свете ОВР.
- Са + Cl2 = CaCl2Ca + 2HCl = CaCl2 + H2Ca + 2H2O = Ca(OH)2 + H22Fe + 3Cl2 = 2FeCl3
- Fe + 2HCl = FeCl2 + H2

ЗАДАНИЕ 2Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:Аl →Аl203 →АlСl3 →Аl(ОН)3 →Al(N03)3.Превращение 3 рассмотрите в свете ТЭД.4Al + 3O2 = 2 Al2O3Al2O3 + 6HCl = 2AlCl3 + 3H2OAlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4ClAl3+ +3Cl- + 3NH3 + 3H2O = Al(OH)3 + 3NH4+ +Cl-Al3+ + 3NH3 + 3H2O = Al(OH)3 + 3NH4+
Аl(ОН)3+3НNО3=Аl(NО3)3+3Н2О.
ЗАДАНИЕ 3При взаимодействии 23 г натрия с водой было получено 8,96 л водорода (н. у.). Найдите объемную долю выхода продукта реакции (в %).
- 2Na + 2H2O = 2NaOH + H2 ↑n (Na) = 23/23= 1 мольV (H2) = 8,96/22,4 = 0,4 мольn (Na) : n (H2) = 2:1 n (H2) = 1/ 2 = 0,5 моль по уравнению (теор.)
- выход = 0,4/0,5 = 0,8 = 80 %
- ЗАДАНИЕ 1Напишите уравнения возможных реакций металлов калия и магния с хлором, водой, соляной кислотой.
- Рассмотрите одну из этих реакций в свете ОВР.
- 2K + 2H2O = 2KOH + H2.2К + CI2 = 2КCI2К + 2HCI = 2КCI + H2Mg + 2HCl = MgCl2 + H2Mg + Cl2 = MgCl2Mg 0 -2e→ Mg 2+ окисляется, восстановительCl20+2e→2Cl- восстанавливается, окислитель
- Mg+2H2O=Mg(OH)2+H2
- ЗАДАНИЕ 2Напишите уравнения реакций для данных переходов:Li →Li20 →LiOH →Li2S04.
- Превращение 3 рассмотрите в свете ТЭД.
- 4Li + O2 = 2Li2OLi2O + H2O = 2LiOH2LiOH + Н2SO4 = Li2SO4 + 2Н2О2Li+ +2OH- + 2Н+ +SO42- = 2Li+ +SO42- + 2Н2О
- 2OH- + 2Н+ — = 2Н2О
ЗАДАНИЕ 3При взаимодействии 60 г кальция с водой выделилось 30 л водорода (н. у.). Найдите объемную долю выхода продукта реакции.Са + 2Н2О = Са(ОН)2 + Н2n (Са) = 60/40= 1,5 мольV (H2) = 30/22,4 = 1,34 мольn (Са) = n (H2) = по уравнению (теор.)
выход = 1,34/1,5 = 0,89 = 89 %
ЗАДАНИЕ 1Напишите уравнения возможных реакций магния и алюминия с веществами: кислородом, бромом, разбавленной серной кислотой.Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
2 Мg + O2 = 2 МgОМg 0 -2e→ Мg 2+ окисляется, восстановительО20+4e→2 О 2- восстанавливается, окислительМg + Br 2 = Мg Br2Мg 0 -2e→ Мg 2+ окисляется, восстановительBr 20+2e→2 Br — восстанавливается, окислительМg + Н2SO4 = МgSО4 + Н2Мg + 2Н+ = Мg2+ + Н24Al + 3O2 = 2Al2O3,2Al + 3H2SO4 = Al2(SO4)3 + 3H2
2Al + 3Br2 = 2AlBr3
ЗАДАНИЕ 2Определите формулы веществ Х1 и Х2 в цепочке превращений:Са →Х1 →Са(ОН)2 →Х2 →Са(НС03)2.Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.2Ca+O2=2CaOCaO+H2O=Ca(OH)2Ca(OH)2 + CO2 = CaCO3 ↓ + H2O
CaCO3 + CO2 + H2O ↔ Ca(HCO3)2
ЗАДАНИЕ 3При взаимодействии 12 г магния с избытком соляной кислоты выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции (в %).
Mg + 2НСl = MgCl2 + Н2n (Mg) = 12/24= 0,5 мольn (H2) = n (Mg) по уравнению (теор.)n (H2) = 10/22,4 = 0,44 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,44/0,5 = 0,89 = 89%
- ЗАДАНИЕ 1Напишите уравнения возможных реакций меди и магния с веществами: кислородом, иодом, разбавленной серной кислотой.
- Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
- 2Cu + O2 = 2CuO2Cu + I2 = 2CuICu + H2SO4 = не идет2 Мg + O2 = 2 МgОМg 0 -2e→ Мg 2+ окисляется, восстановительО20+4e→2 О 2- восстанавливается, окислительМg + Н2SO4 = МgSО4 + Н2Мg + 2Н+ = Мg2+ + Н2Мg + I 2 = Мg I 2Мg 0 -2e→ Мg 2+ окисляется, восстановитель
- I 20+2e→2 I — восстанавливается, окислитель
ЗАДАНИЕ 2Определите формулы веществ X1 и Х2 в цепочке превращений:Zn →Х1→ ZnS04 →Х2 →ZnO.Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.2Zn + O2 = 2ZnOZnO+H2SO4 —>ZnSO4 + H2OZnSO4 + 2NaOH (разб.) = Zn(OH)2↓ + Na2SO4
Zn(OH)2= ZnO + H2O
ЗАДАНИЕ 3При термическом разложении 10 г карбоната кальция было получено 1,68 л углекислого газа (н. у.). Вычислите объемную долю выхода продукта реакции.
CaCO3 → CaO + CO2 n (CaCO3) = 10/100= 0,1 мольn (CO2) = n (CaCO3) по уравнению (теор.)n (CO2) = 1,68/22,4 = 0,075 моль (пр.)
ŋ = V (CO2) (пр.)/ V (CO2) (теор.) = n (CO2) (пр.)/ n (CO2) (теор.) = 0,075/0,1 = 0,75 = 75%
ЗАДАНИЕ 1Напишите уравнения возможных реакций железа и цинка с веществами: кислородом, хлором, разбавленной серной кислотой.Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
3Fe + 2O2 = Fe2O3 • FeOFe + Н2SO4 = FeSO4 + Н22Fe + 3Cl2 = 2FeCl32Zn + O2 = 2ZnOZn 0 -2e→ Zn 2+ окисляется, восстановительО20+4e→2 О 2- восстанавливается, окислительZn + Cl2 = ZnCl2Zn0 -2e→Zn2+ окисляется, восстановительCl20+2e→2Cl- восстанавливается, окислительZn + H2SO4 = ZnSO4 + H2
- Zn + 2Н+ = Zn 2+ + Н2
- ЗАДАНИЕ 2Определите формулы веществ Х1 и Х2 в цепочке превращений:Fe →Х1 →Fe(OH)2 →Х2 →Fe.
- Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe — 1 —> FeCl2 — 2 —> Fe (OH)2 — 3 —> FeO -4-> Fe1. Fe + 2HCl —> FeCl2 + H2 2. FeCl2 + 2NaOH —> Fe(OH)2 + 2NaClFe2+ + 2OH- —> Fe (OH)2 3. Fe (OH)2 — t —> FeO + H2O
4. FeO + C = Fe + CO
ЗАДАНИЕ 3При взаимодействии 23 г натрия с водой было получено 8,96 л водорода (н. у.). Найдите объемную долю выхода продукта реакции.
2Na + 2H2O = 2NaOH + H2 ↑n (Na) = 23/23= 1 моль2n (H2) = n (Na) по уравнению (теор.)n (H2) = 0,5 моль теор.n (H2) = 8,96/22,4 = 0,4 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,4/0,5 = 0,8 = 80%
- ЗАДАНИЕ 1Напишите уравнения возможных химических реакций бериллия и железа с веществами: кислородом, бромом, разбавленной серной кислотой.
- Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
- 3Fe + 2O2 = Fe2O3 • FeOFe + Н2SO4 = FeSO4 + Н22Fe + 3Br 2 = 2Fe Br32 Ве + O2 = 2 ВеОВе0 -2e→ Ве 2+ окисляется, восстановительО20+4e→2 О 2- восстанавливается, окислительВе + Br 2 = Ве Br2Ве 0 -2e→ Ве 2+ окисляется, восстановительBr 20+2e→2 Br — восстанавливается, окислительВе + Н2SO4 = Ве SО4 + Н2
- Ве + 2Н+ = Ве 2+ + Н2
- ЗАДАНИЕ 2Определите формулы веществ Х1 и Х2 в цепочке превращений:Fe → Х1 →Fe(OH)3 →Х2 →Fe.
- Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe 1→FeCl3 2→Fe(OH)3 3→Fe2O3 4→ Fe1. 2Fe + 3Cl2 t →2FeCl32. FeCl3+ 3NaOH → Fe(OH)3 ↓ + 3NaCl3. 2Fe(OH)3 t → Fe2O3 + H2O
4. 2Fe2O3 + 3C t → 4 Fe + 3CO2
ЗАДАНИЕ 3При взаимодействии 60 г кальция с водой выделилось 30 л водорода (н. у.). Найдите объемную долю выхода продукта реакции (в %).
Ca + 2H2О = Ca(OH)2 + Н2n (Ca) = 60/40= 1,5 мольn (H2) = n (Ca) по уравнению (теор.)n (H2) = 30/22,4 = 1,34 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 1,34/1,5 = 0,89 = 89%
- ЗАДАНИЕ 1Напишите уравнения возможных реакций магния, алюминия и серебра с неметаллом, водой, кислотой, раствором соли.
- Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. Mg + 2HCl = MgCl2 + H2Mg + 2H+ = Mg2+ + H2Mg0 — 2e = Mg2+ восстановитель2H+ + 2e= H2 окислительMg + Cl2 = MgCl2Mg+2H2O=Mg(OH)2+H2Mg + CuCl2 = MgCl2 + CuMg0 + Cu2+ = Mg2+ + Cu0Mg0 — 2e = Mg2+ восстановительCu2+ + 2e= Cu0 окислитель2.
2Al + 6HCl = 2AlCl3 + 3H22Al + 6H+ = 2Al3+ + 3H02Al 0 — 3e = Al3+ восстановитель2H+ + 2e= H2 окислитель2Al + 3Cl2 = 2AlCl32Al + 6H2O = 2Al(OH)3 + 3H23HgCI2 + 2Al = 2AICI3 + 3Hg3Hg2+ + 2Al0 = 2AI3+ + 3Hg0Hg2+ + 2е = Hg0 восстановительAl0 – 3е= AI3+ окислитель3.
Ag + 2HCl = не реагирует2Ag + S = Ag2SAg+ H2O = не реагируетAg + FeCl3 = AgCl + FeCl2Ag0 + Fe3+= Ag++ Fe2+Ag0 — 1е= Ag+ восстановитель
Fe3++1е= Fe2+окислитель
ЗАДАНИЕ 2Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.2Ве + О2 = 2ВеОВеО +2HCl = BeCl2 + H2OBeCl2 + 2NaOH = Be(OH)2 + 2NaCl
Be(OH)2 + 2NaOH= Na2BeO2 + 2H2O
ЗАДАНИЕ 3При взаимодействии 12 г технического магния, содержащего 5% примесей, с избытком соляной кислоты, выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Mg + 2HCl = MgCl2 + H2n(Mg) = 12-12*0,05/24 = 11,4 /24= 0,475 мольn (H2) (теор.) = n(Mg) =0,475 мольn (H2) = 10/22,4 = 0,44 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,44/0,475 = 0,92 = 92%
- ЗАДАНИЕ 1Напишите уравнения возможных реакций лития, меди, бария, алюминия с веществами: неметаллом, водой, кислотой, раствором соли.
- Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. 2Li + Сl2 = 2LiСl2Li + 2H2O = 2LiOH + H22Li + 2НСl = 2LiСl + Н22Li0 + 2Н+ = 2Li+ + Н02Li0 – 1e = Li+ восстановитель2Н+ + 2e= Н02 окислитель2Li + CuСl 2= 2LiС1 + Cu2Li0 + Cu2+ = 2Li+ + Cu0Li0 – 1e = Li+ восстановительCu2+ + 2e= Cu0 окислитель2.
2Al + 6HCl = 2AlCl3 + 3H22Al + 6H+ = 2Al3+ + 3H02Al 0 — 3e = Al3+ восстановитель2H+ + 2e= H2 окислитель2Al + 3Cl2 = 2AlCl32Al + 6H2O = 2Al(OH)3 + 3H23HgCI2 + 2Al = 2AICI3 + 3Hg3Hg2+ + 2Al0 = 2AI3+ + 3Hg0Hg2+ + 2е = Hg0 восстановительAl0 – 3е= AI3+ окислитель3.
Ва + 2HCl = ВаCl2 + H2Ва + 2H+ = Ва 2+ + H2Ва 0 — 2e = Ва 2+ восстановитель2H+ + 2e= H2 окислительВа + Cl2 = ВаCl2Ва +2H2O= Ва(OH)2+H2Ва + CuCl2 = ВаCl2 + CuВа + Cu2+ = Ва 2+ + Cu0Ва 0 — 2e = Ва 2+ восстановительCu2+ + 2e= Cu0 окислитель4.
Cu + Cl2 = CuCl2Cu + H2O = не реагируетCu + HCl = не реагируетCu + 2FeCl3 = CuCl2 + 2FeCl2.Cu 0 + Fe3+= Cu2 ++ Fe2+Cu 0 — 2е= Cu + восстановитель
Fe3++1е= Fe2+окислитель
ЗАДАНИЕ 2Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
- Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
- Fe + 2HСl → FeCl2 + H2↑FeCl2+ 2NaOH → Fe(OH)2 + 2NaCl4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3↓
- 2Fe(OH)3 = Fe2O3 + 3H2O
ЗАДАНИЕ 3При термическом разложении 20 г известняка, содержащего 10% некарбонатных примесей, было получено 3,23 л углекислого газа (н. у.).
Вычислите объемную долю выхода продукта реакции (в %).
CaCO3 = CaO+CO2n (CaCO3) = 20-20*0,1/100= 18/100=0,18 мольV (CO2) = 3,23/22,4 = 0,145 моль (практ.)n (CaCO3) = n (CO2) по уравнению (теор.)= 0,18 моль
- выход = 0,145/0,18 = 0,801 = 80,1 %
- ЗАДАНИЕ 1Напишите уравнения возможных реакций кальция, железа и цинка с неметаллом, водой, кислотой, раствором соли.
- Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. Са + 2HCl = СаCl2 + H2Са0 + 2H+ = Са 2+ + H2Са 0 — 2e = Са 2+ восстановитель2H+ + 2e= H2 окислительСа + Cl2 = СаCl2Са +2H2O= Са(OH)2+H2Са + CuCl2 = СаCl2 + CuСа + Cu2+ = Са 2+ + Cu0Са 0 — 2e = Са 2+ восстановительCu2+ + 2e= Cu0 окислитель2.
2Fe + 3Cl2 t →2FeCl3
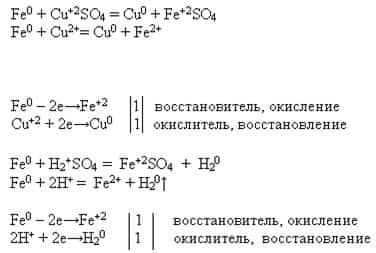
- 3. 2Zn + O2 = 2ZnOZn + H2O = ZnO + H2Zn + H2SO4 = ZnSO4 + H2Zn + 2Н+ = Zn 2+ + Н2Zn 0 + 2H+ = Zn 2+ + H02Zn 0 — 2e = Zn 2+ восстановитель2H+ + 2e= H2 окислительZn + CuSO4 = Cu + ZnSO4Zn 0 + Cu2+ = Zn 2+ + Cu0Zn 0 — 2e = Zn 2+ восстановитель
- Cu2+ + 2e= Cu0 окислитель
- ЗАДАНИЕ 2Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
- Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
- 2Ca+O2=2CaO CaО+H2O=Ca(OH)2Ca(OH)2+H2CO3=CaCO3+2H2OCaCO3 + CO2 + H2O ↔ Ca(HCO3)2
- Ca(HCO3)2 t →CaCO3↓ + CO2 + H2O
ЗАДАНИЕ 3Прй взаимодействии 24,15 г технического натрия, содержащего 5% примесей, было получено 8,96 л водорода (н. у.).
Вычислите объемную долю выхода продукта реакции (в %).
2Na + 2H2O = 2NaOH + H2n(Na) = 24,15-24,15*0,05/23 =23 /23= 1 мольn (H2) (теор.) = 0,5 n(Mg) =0,5 мольn (H2) = 8,96/22,4 = 0,4 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,4/0,5 = 0,8 = 80%
- ЗАДАНИЕ 1Напишите уравнения возможных реакций бериллия, железа и меди с веществами: неметаллом, водой, кислотой, раствором соли.
- Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. 2 Ве + O2 = 2 ВеОВе + Н2SO4 = ВеSО4 + Н2Ве + 2Н+ = Ве 2+ + Н22. Cu + Cl2 = CuCl2Cu + H2O = не реагируетCu + HCl = не реагируетCu + 2FeCl3 = CuCl2 + 2FeCl2.Cu 0 + Fe3+= Cu2 ++ Fe2+Cu 0 — 2е= Cu + восстановитель Fe3++1е= Fe2+окислитель
3. 2Fe + 3Cl2 t →2FeCl3

ЗАДАНИЕ 2Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
- Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
- 2Zn + O2 = 2ZnOZnO + 2HNO3 = Zn(NO3)2 + H2OZn(NO3)2 + 2NaOH = 2NaNO3 + Zn(OH)2
- Zn(OH)2= ZnO + H2O
ЗАДАНИЕ 3При взаимодействии 60 г технического кальция, содержащего 2% примесей, с водой было получено 30 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.Ca + 2H2О = Ca(OH)2 + Н2n(Ca) = 60-60*0,02/40 =58,8 /40= 1,47 мольn (H2) (теор.) = n(Ca) =1,47 мольn (H2) = 30/22,4 = 1.34 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 1,34/1,47 = 0,91 = 91%
18.01.2016
Тест по Химии "Металлы и неметаллы" 8-9 класс
Наша кнопка
Скачать материал
- Т-9 вариант 1
- 1. Металлом является
- 1) селен 3) хром
- 2) йод 4) фосфор
- 2. Неметаллом является
- 1) платина 3) вольфрам
- 2) мышьяк 4) барий
- 3. Жидкое агрегатное состояние (при комнатной температуре) имеет
- 1) калий 3) сера
- 2) ртуть 4) азот
- 4. Твердое агрегатное состояние (при комнатной температуре) имеет
- 1) ртуть 3) бром
- 2) хлор 4) алюминий
- 5. Двухатомную молекулу (при обычных условиях) имеет
- 1) сера 3) натрий
- 2) йод 4) магний
- 6. Самый легкий металл из перечисленных:
- 1) кальций 3) барий
- 2) литий 4) железо
- 7. В отличие от многих металлов железо
- 1) имеет металлический блеск
- 2) твердое
- 3) притягивается магнитом
- 4) тугоплавкое
- 8. Соотнесите:
- Простое вещество
- А) хлор В) алюминий
- Б) сера Г) золото
- Характеристика
- 1) твердое вещество желтого цвета
- 2) притягивается магнитом
- 3) способно резать стекло
- 4) используется в самолетостроении
- 5) является самым пластичным веществом
- 6) используется для производства зеркал
- А
- Б
- В
- Г
9. Выберите свойства, характерные для йода. Ответ представьте в виде
- ряда чисел, соответствующих порядковым номерам правильных ответов.
- 1) твердое вещество серого цвета
- 2) является металлом
- 3) является неметаллом
- 4) имеет металлический блеск
- 5) используется в производстве зеркал
- 6) при растворении в спирте образует антисептическое средство
- 7) твердое вещество фиолетового цвета
- Ответ : _____________________________
- Т-9 вариант 2
- 1. Металлом является
- 1) азот 3) бром
- 2) марганец 4) сера
- 2. Неметаллом является
- 1) никель 3) стронций
- 2) цинк 4) йод
- 3. Жидкое агрегатное состояние (при комнатной температуре) имеет
- 1) кальций 3) бром
- 2) кислород 4) фосфор
- 4. Твердое агрегатное состояние (при комнатной температуре) имеет
- 1) азот 3) магний
- 2) бром 4) фтор
- 5. Двухатомную молекулу (при обычных условиях) имеет
- 1) хлор 3) фосфор
- 2) кальций 4) кремний
- 6. Самый легкий металл из перечисленных:
- 1) натрий 3) осмий
- 2) вольфрам 4) медь
- 7. В отличие от многих металлов медь
- 1) твердая
- 2) теплопроводная
- 3) тугоплавкая
- 4) имеет красно-кирпичный цвет
- 8. Соотнесите:
- Простое вещество
- А) графит В) медь
- Б) озон Г) натрий
- Характеристика
- 1) мягкое вещество, легко режется ножом
- 2) твердое вещество, режет стекло
- 3) мягкое вещество серого цвета, оставляет след на бумаге
- 4) газообразное вещество с запахом свежести
- 5) используется для изготовления проводников
- 6) имеет желто-зеленый цвет
А
- Б
- В
- Г
9. Выберите свойства, характерные для серебра. Ответ представьте
- в виде ряда чисел, соответствующих порядковым номерам правильных
- ответов.
- 1) твердое вещество серого цвета
- 2) является металлом
- 3) является неметаллом
- 4) имеет металлический блеск
- 5) используется в производстве зеркал
- 6) при растворении в спирте образует антисептическое средство
- 7) твердое вещество фиолетового цвета
- Ответ : _____________________________
- Т-9 вариант 3
- 1. Металлом является
- 1) фосфор 3) йод
- 2) селен 4) хром
- 2. Неметаллом является
- 1) барий 3) мышьяк
- 2) платина 4) вольфрам
- 3. Жидкое агрегатное состояние (при комнатной температуре) имеет
- 1) азот 3) ртуть
- 2) калий 4) сера
- 4. Твердое агрегатное состояние (при комнатной температуре) имеет
- 1) алюминий 3) хлор
- 2) ртуть 4) бром
- 5. Двухатомную молекулу (при обычных условиях) имеет
- 1) магний 3) йод
- 2) сера 4) натрий
- 6. Самый легкий металл из перечисленных:
- 1) железо 3) литий
- 2) кальций 4) барий
- 7. В отличие от многих металлов железо
- 1) тугоплавкое
- 2) имеет металлический блеск
- 3) твердое
- 4) притягивается магнитом
- 8. Соотнесите:
- Простое вещество
- А) золото В) сера
- Б) хлор Г) алюминий
- Характеристика
- 1) используется для производства зеркал
- 2) твердое вещество желтого цвета
- 3) притягивается магнитом
- 4) способно резать стекло
- 5) используется в самолетостроении
- 6) является самым пластичным веществом
- А
- Б
- В
- Г
9. Выберите свойства, характерные для йода. Ответ представьте в виде
- ряда чисел, соответствующих порядковым номерам правильных ответов.
- 1) твердое вещество фиолетового цвета
- 2) твердое вещество серого цвета
- 3) является металлом
- 4) является неметаллом
- 5) имеет металлический блеск
- 6) используется в производстве зеркал
- 7) при растворении в спирте образует антисептическое средство
- Ответ : _____________________________
- Т-9 вариант 4
- 1. Металлом является
- 1) сера 3) марганец
- 2) азот 4) бром
- 2. Неметаллом является
- 1) йод 3) цинк
- 2) никель 4) стронций
- 3. Жидкое агрегатное состояние (при комнатной температуре) имеет
- 1) фосфор 3) кислород
- 2) кальций 4) бром
- 4. Твердое агрегатное состояние (при комнатной температуре) имеет
- 1) фтор 3) бром
- 2) азот 4) магний
- 5. Двухатомную молекулу (при обычных условиях) имеет
- 1) кремний 3) кальций
- 2) хлор 4) фосфор
- 6. Самый легкий металл из перечисленных:
- 1) медь 3) вольфрам
- 2) натрий 4) осмий
- 7. В отличие от многих металлов медь
- 1) имеет красно-кирпичный цвет
- 2) твердая
- 3) теплопроводная
- 4) тугоплавкая
- 8. Соотнесите:
- Простое вещество
- А) натрий В) озон
- Б) графит Г) медь
- Характеристика
- 1) имеет желто-зеленый цвет
- 2) мягкое вещество, легко режется ножом
- 3) твердое вещество, режет стекло
- 4) мягкое вещество серого цвета, оставляет след на бумаге
- 5) газообразное вещество с запахом свежести
- 6) используется для изготовления проводников
А
- Б
- В
- Г
9. Выберите свойства, характерные для серебра. Ответ представьте
- в виде ряда чисел, соответствующих порядковым номерам правильных
- ответов.
- 1) твердое вещество фиолетового цвета
- 2) твердое вещество серого цвета
- 3) является металлом
- 4) является неметаллом
- 5) имеет металлический блеск
- 6) используется в производстве зеркал
- 7) при растворении в спирте образует антисептическое средство
- Ответ : _____________________________
- Т-9 вариант 5
- 1. Металлом является
- 1) хром 3) селен
- 2) фосфор 4) йод
- 2. Неметаллом является
- 1) вольфрам 3) платина
- 2) барий 4) мышьяк
- 3. Жидкое агрегатное состояние (при комнатной температуре) имеет
- 1) сера 3) калий
- 2) азот 4) ртуть
- 4. Твердое агрегатное состояние (при комнатной температуре) имеет
- 1) бром 3) ртуть
- 2) алюминий 4) хлор
- 5. Двухатомную молекулу (при обычных условиях) имеет
- 1) натрий 3) сера
- 2) магний 4) йод
- 6. Самый легкий металл из перечисленных:
- 1) барий 3) кальций
- 2) железо 4) литий
- 7. В отличие от многих металлов железо
- 1) притягивается магнитом
- 2) тугоплавкое
- 3) имеет металлический блеск
- 4) твердое
- 8. Соотнесите:
- Простое вещество
- А) алюминий В) хлор
- Б) золото Г) сера
- Характеристика
- 1) является самым пластичным веществом
- 2) используется для производства зеркал
- 3) твердое вещество желтого цвета
- 4) притягивается магнитом
- 5) способно резать стекло
- 6) используется в самолетостроении
- А
- Б
- В
- Г
9. Выберите свойства, характерные для йода. Ответ представьте в виде
- ряда чисел, соответствующих порядковым номерам правильных ответов.
- 1) при растворении в спирте образует антисептическое средство
- 2) твердое вещество фиолетового цвета
- 3) твердое вещество серого цвета
- 4) является металлом
- 5) является неметаллом
- 6) имеет металлический блеск
- 7) используется в производстве зеркал
- Ответ : _____________________________
- Т-9 вариант 6
- 1. Металлом является
- 1) бром 3) азот
- 2) сера 4) марганец
- 2. Неметаллом является
- 1) стронций 3) никель
- 2) йод 4) цинк
- 3. Жидкое агрегатное состояние (при комнатной температуре) имеет
- 1) бром 3) кальций
- 2) фосфор 4) кислород
- 4. Твердое агрегатное состояние (при комнатной температуре) имеет
- 1) магний 3) азот
- 2) фтор 4) бром
- 5. Двухатомную молекулу (при обычных условиях) имеет
- 1) фосфор 3) хлор
- 2) кремний 4) кальций
- 6. Самый легкий металл из перечисленных:
- 1) осмий 3) натрий
- 2) медь 4) вольфрам
- 7. В отличие от многих металлов медь
- 1) тугоплавкая
- 2) имеет красно-кирпичный цвет
- 3) твердая
- 4) теплопроводная
- 8. Соотнесите:
- Простое вещество
- А) медь В) графит
- Б) натрий Г) озон
- Характеристика
- 1) используется для изготовления проводников
- 2) имеет желто-зеленый цвет
- 3) мягкое вещество, легко режется ножом
- 4) твердое вещество, режет стекло
- 5) мягкое вещество серого цвета, оставляет след на бумаге
- 6) газообразное вещество с запахом свежести
А
- Б
- В
- Г
9. Выберите свойства, характерные для серебра. Ответ представьте
- в виде ряда чисел, соответствующих порядковым номерам правильных
- ответов.
- 1) при растворении в спирте образует антисептическое средство
- 2) твердое вещество фиолетового цвета
- 3) твердое вещество серого цвета
- 4) является металлом
- 5) является неметаллом
- 6) имеет металлический блеск
- 7) используется в производстве зеркал
- Ответ : _____________________________
- Т-9 вариант 7
- 1. Металлом является
- 1) йод 3) фосфор
- 2) хром 4) селен
- 2. Неметаллом является
- 1) мышьяк 3) барий
- 2) вольфрам 4) платина
- 3. Жидкое агрегатное состояние (при комнатной температуре) имеет
- 1) ртуть 3) азот
- 2) сера 4) калий
- 4. Твердое агрегатное состояние (при комнатной температуре) имеет
- 1) хлор 3) алюминий
- 2) бром 4) ртуть
- 5. Двухатомную молекулу (при обычных условиях) имеет
- 1) йод 3) магний
- 2) натрий 4) сера
- 6. Самый легкий металл из перечисленных:
- 1) литий 3) железо
- 2) барий 4) кальций
- 7. В отличие от многих металлов железо
- 1) твердое
- 2) притягивается магнитом
- 3) тугоплавкое
- 4) имеет металлический блеск
- 8. Соотнесите:
- Простое вещество
- А) сера В) золото
- Б) алюминий Г) хлор
- Характеристика
- 1) используется в самолетостроении
- 2) является самым пластичным веществом
- 3) используется для производства зеркал
- 4) твердое вещество желтого цвета
- 5) притягивается магнитом
- 6) способно резать стекло
- А
- Б
- В
- Г
9. Выберите свойства, характерные для йода. Ответ представьте в виде
- ряда чисел, соответствующих порядковым номерам правильных ответов.
- 1) используется в производстве зеркал
- 2) при растворении в спирте образует антисептическое средство
- 3) твердое вещество фиолетового цвета
- 4) твердое вещество серого цвета
- 5) является металлом
- 6) является неметаллом
- 7) имеет металлический блеск
- Ответ : _____________________________
- Т-9 вариант 8
- 1. Металлом является
- 1) марганец 3) сера
- 2) бром 4) азот
- 2. Неметаллом является
- 1) цинк 3) йод
- 2) стронций 4) никель
- 3. Жидкое агрегатное состояние (при комнатной температуре) имеет
- 1) кислород 3) фосфор
- 2) бром 4) кальций
- 4. Твердое агрегатное состояние (при комнатной температуре) имеет
- 1) бром 3) фтор
- 2) магний 4) азот
- 5. Двухатомную молекулу (при обычных условиях) имеет
- 1) кальций 3) кремний
- 2) фосфор 4) хлор
- 6. Самый легкий металл из перечисленных:
- 1) вольфрам 3) медь
- 2) осмий 4) натрий
- 7. В отличие от многих металлов медь
- 1) теплопроводная
- 2) тугоплавкая
- 3) имеет красно-кирпичный цвет
- 4) твердая
- 8. Соотнесите:
- Простое вещество
- А) озон В) натрий
- Б) медь Г) графит
- Характеристика
- 1) газообразное вещество с запахом свежести
- 2) используется для изготовления проводников
- 3) имеет желто-зеленый цвет
- 4) мягкое вещество, легко режется ножом
- 5) твердое вещество, режет стекло
- 6) мягкое вещество серого цвета, оставляет след на бумаге
А
- Б
- В
- Г
9. Выберите свойства, характерные для серебра. Ответ представьте
- в виде ряда чисел, соответствующих порядковым номерам правильных
- ответов.
- 1) используется в производстве зеркал
- 2) при растворении в спирте образует антисептическое средство
- 3) твердое вещество фиолетового цвета
- 4) твердое вещество серого цвета
- 5) является металлом
- 6) является неметаллом
- 7) имеет металлический блеск
- Ответ : _____________________________
Листать вверх Листать вниз Скачивание материала начнется через 51 сек.
Нравится материал? Поддержи автора!
Ещё документы из категории химия:
Задание по химии для 8 класса — «Металлы и неметаллы»
Выполните задание онлайн олимпиады и узнайте результат.
Для зарегистрированных участников, результаты отправляются на электронную почту.
Вы уже проходили тест ранее. Вы не можете запустить его снова.
Вы должны войти или зарегистрироваться для того, чтобы начать тест.
Вы должны закончить следующие тесты, чтобы начать этот:
- Правильных ответов: 0 из 10
- Ваше время:
- Время вышло
- Вы набрали 0 из 0 баллов (0)
| Средний результат |
| Ваш результат |
-

Поздравляем!
Вы отлично справились с заданием.
Ваш результат соответствует 1 месту.
Оформить диплом -

Поздравляем!
Вы хорошо справились с заданием.
Ваш результат соответствует 2 месту.
Оформить диплом -

Поздравляем!
Вы выполнили задние допустив незначительное количество ошибок.
Ваш результат соответствует 3 месту.
Оформить диплом -

Сделайте работу над ошибками.
Попробуйте пройти тестирование еще раз и добиться хорошего результата.
Ваш результат может стать значительно лучше.
Контрольная работа по химии на тему "Неметаллы"
- Контрольная работа по теме: «Неметаллы»
- Вариант — 1
- Часть А
- А1. В каком ряду представлены простые вещества-неметаллы:
- 1) хлор, никель, серебро 3) железо, фосфор, ртуть
- 2) алмаз, сера, кальций 4) кислород, озон, азот
А2.
Химическому элементу 3-го периода V группы периодической системы Д.И.Менделеева соответствует схема распределения электронов по слоям:
- 1) 2,8,5 2) 2,3 3) 2,8,3 4) 2,5
- А3. У элементов подгруппы углерода с увеличением атомного номера уменьшается:
- 1) атомный радиус 3) число валентных электронов в атомах
- 2) заряд ядра атома 4) электроотрицательность
- А4. Наиболее прочная химическая связь в молекуле
- 1) F2 2) Cl2 3) O2 4) N2
- А5. Взаимодействие аммиака с хлороводородом относится к реакциям:
- 1) разложения 2) соединения 3) замещения 4) обмена
- А6. Сокращенное ионное уравнение реакции Ag+ + Cl- AgCl
- соответствует взаимодействию между растворами:
- 1) карбоната серебра и соляной кислоты
- 2) нитрата серебра и серной кислоты
- 3) нитрата серебра и соляной кислоты
- 4) сульфата серебра и азотной кислоты
- А7. С помощью раствора серной кислоты можно осуществить превращения:
- 1) медь сульфат меди (II) 3) карбонат натрия оксид углерода ( IV)
- 2) углерод оксид углерода (IV) 4) хлорид серебра хлороводород
- А8. Степень окисления фосфора в ряду веществ, формулы которых
- Са3 Р2 — Р — Р2О3 — Р2О5
- 1) повышается от 0 до +5
- 2)повышается от -3 до +5
- 3) понижается от +6 до -2
- 4) повышается от -4 до +4
- А9. Реактивом на карбонат-анион является катион:
- 1) Н+ 2) NН4+ 3) К+ 4) Nа+
- А10. Массовая доля азота в сульфате аммония равна
- 1)12,3 % 2) 21,2 % 3) 43,1% 4) 48,5%
- А11. Горящая свеча гаснет в закрытой пробкой банке, потому что:
- 1) не хватает кислорода 3) повышается содержание азота
- 2) повышается температура 4) образуется водяной пар, гасящий пламя
- Часть В
-
Осуществите цепочку превращений(2б)
P = P2O5 = Na3PO4 = Ag3PO4
-
Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.(2 б)
P + HNO3 + H2O = H3PO4 + NO
Часть С(3 б)
Найдите массу серной кислоты, необходимой для нейтрализации 200г. 20% раствора гидроксида натрия.
- Контрольная работа по теме: «Неметаллы»
- Вариант – 2
- Часть А
- А1. О кислороде как о простом веществе говорится в предложении:
- 1) растения, животные и человек дышат кислородом
- 2) кислород входит в состав воды
- 3) оксиды состоят из двух элементов, один из которых — кислород
- 4) кислород входит в состав химических соединений, из которых построена живая
- клетка
- А2. В атоме фосфора общее число электронов и число электронных слоев соответственно
- равны: 1) 31 и 4 2) 15 и5 3) 15 и 3 4) 31 и 5
- А3. У элементов подгруппы кислорода с увеличением атомного номера уменьшается:
- 1) атомный радиус 3) число валентных электронов в атомах
- 2) заряд ядра атома 4) электроотрицательность
- А4. Ковалентная полярная химическая связь характерна для:
- 1) KCl 2) HBr 3) P4 4) CaCl2
- А5. Реакция, уравнение которой 3N2 + H2 2NH3 + Q , относят к реакциям:
- 1) обратимым, экзотермическим 3) обратимым, эндотермическим
- 2) необратимым, экзотермическим 4) необратимым, эндотермическим
- А6. С помощью раствора соляной кислоты можно осуществить превращения:
- 1) медь хлорид меди (II) 3) карбонат натрия оксид углерода ( IV)
- 2) углерод оксид углерода (IV) 4) хлорид серебра хлороводород
- А7. Признаком реакции между соляной кислотой и цинком является:
- 1) появление запаха 3) выделение газа
- 2) образование осадка 4) изменение цвета раствора
- А8. Сокращенному ионному уравнению Ba2+ + SO42- BaSO4 соответствует
- Взаимодействие между: 1) фосфатом бария и раствором серной кислоты
- 2) растворами сульфата натрия и нитрата бария
- 3) растворами гидроксида бария и серной кислоты
- 4) карбонатом бария и раствором серной кислоты
- А9. Степень окисления серы в ряду веществ, формулы которых
- SO3 — SO2 — S — H2S
- 1) повышается от 0 до +5
- 2) понижается от +5 до 0
- 3) повышается от -4 до +4
- 4) понижается от +6 до -2
- А10. Реактивом на сульфат -анион является катион:
- 1) Н+ 2) NН4+ 3) Ba2+ 4) Nа+
- А11. Массовая доля кислорода в нитрате меди (II) равна
- 1) 32,8 % 2)44,9 % 3)51,1% 4) 66,3%
- Часть В
-
Осуществите цепочку превращений(2 б)
S = SO2 = SO3 = Na2SО4 = BaSO4
-
Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.(2 б)
S + KClO3 = KCl + SO2
Часть С(3 б)
Найдите массу сернистой кислоты, необходимой для нейтрализации 200г. 20% раствора гидроксида натрия.
Урок по теме "Простые вещества — металлы и неметаллы"
- Цели: отработка обязательного материала минимального уровня по данной теме в ходе закрепления; доведение до автоматизма умения выполнять шаблонные задания, соответствующие минимальному уровню планируемых результатов обучения: определять простые и сложные вещества, металлы и неметаллы, иметь представления о аллотропных модификациях неметаллов, устанавливать соответствие состава простых веществ и их физических свойств.
- Оборудование: мультимедийный комплекс, раздаточный материал на столы учащихся.
- Ход урока
1. Организация класса.
В целях актуализации знаний рассказывается вопрос-сказка «Удивительная страна»
Мы с вами побываем в одной Удивительной стране. Коренные жители этой страны назывались … Впрочем, догадайтесь сами по характеру её жителей. Народ в этой стране был беден, но беспечен.
Хотя в карманах у большинства из них не было ни одной свободной монетки (а «валюта» в стране называлась электронами), никто не горевал по этому поводу.
Напротив, если у них заводился хоть один лишний электрончик, то характер их портился, они становились агрессивными и даже опасными, потому скорее хотели от него избавиться, чтобы стать опять весёлыми и добрыми.
- Надо сказать, что «высшая знать» этой страны отличалась от простых граждан своей скупостью. Свою «электронную валюту» они неохотно одалживали, и наоборот, при малейшей возможности стремились забрать ещё …
- Скажите, кто были жители этой страны? (металлы и неметаллы)
- Итак мы продолжаем с вами путешествовать по этой удивительной стране.
Тема урока: Простые вещества-металлы и неметаллы (Приложение 1. Слайд 1).
Целью урока (слайд 2) будет повторить и закрепить с помощью различных заданий основные сведения о простых веществах – металлах и неметаллах.
План урока: (записано на доске)
- Повторение. Теоретическая часть.
- Практическая часть.
- Проверочная работа.
2. Теоретическая часть. Повторение пройденного материала по схеме (слайд 3). Работа в парах постоянного состава (устная) с последующим контролем по вопросам: (слайд 4)
- Простые и сложные вещества.
- Деление простых веществ на металлы и неметаллы.
- Связь состава, свойств веществ и их применением
- Аллотропия.
В завершении повторения давайте поиграем (слайд 5-6)
(На экране спроецированы дидактические задания: найти выигрышный путь из веществ металлов и неметаллов; электронные схемы атомов.)
3. Практическая часть (Приложение 2).
Часть I.
- Выполнение учащимися задания с пошаговым контролем.
Задание. В списке формул веществ О3 , Н2О, Cl2, Pкр, Al, Ca, О2 , KCl.
а) подчеркните формулы простых веществ одной чертой; металлов – двумя чертами;
б) из общего списка выберите формулы аллотропных модификаций элемента кислорода и подчеркните их волнистой чертой. Ответ объясните.
- Самостоятельная работа учащихся с самоконтролем.
Задание. В списке формул веществ графит , НCl, Cu, Pбел, Na, P, CО2 , K.
- а) подчеркните формулы простых веществ одной чертой; металлов – двумя чертами;
- б) из общего списка выберите формулы аллотропных модификаций элемента фосфора и подчеркните их волнистой чертой.
- Для проверки — (слайд 7)
- Часть II.
- Выполнение учащимися задания с комментированием.
Задание. Установите соответствие состава простых веществ и их физических свойств.
Часть III.
- Работа в парах с последующей проверкой по выданному образцу.
Задание. Заполните таблицу (при необходимости можете воспользоваться учебником).
| Химический элемент | Аллотропные модификации |
| Углерод | |
| Олово |
- Ответ — (слайд

- Физкультпауза.
- Для глаз: — направление взгляда на указательный палец вытянутой руки, затем вдаль.
Для плечевого пояса: И.п. – стоя, кисти тыльной стороной на поясе. 1-2- свести локти вперёд, голову наклонить вперёд. 3-4- локти назад, прогнуться. Повторить 3 раза. Затем руки вниз и потрясти расслабленно. Темп медленный.
Часть IV.
- Проверочная работа минимального уровня.
Работы учащихся собираются и проверяются учителем к следующему уроку.
Урок заканчивается экспресс-опросом, который проводят в форме селекторного совещания. Учащиеся кладут перед собой сигнальные карты: зеленая обозначает – “да”, красная – “нет”, желтая – “сомневаюсь”.Верно ли, что (слайд 9)
- Среди известных химических элементов большая часть – металлы?
- Молекула озона состоит из двух атомов кислорода?
- Оловом покрывают изнутри консервные банки?
- Неметаллы хорошие проводники электрического тока?
- Для живых организмов особое значение имеет кислород?
В конце урока осуществляется рефлексия:
В заключении мне бы хотелось услышать ваше мнение о сегодняшнем уроке. Начните предложения со слов: «Сегодня на уроке мне понравилось ….» или «Сегодня на уроке мне не понравилось ….»
- Запишите домашнее задание: &13-14, список заданий (после урока тренинг-минимум учащимся выдаётся блок заданий для домашнего выполнения – Приложение 3). (слайд 10)
- Итог урока, выставление оценок.
- Литература:
- О.С. Габриелян. Химия 8 класс. М. “Дрофа”, 2007 г.
- Е.П. Сгибнева, А.В.Скачков. Современные открытые уроки химии 8-9 классы. Ростов н/Д. «Феникс», 2002.
- Т.К. Толкачева, Л.Г. Лазыкина. Уроки химии по интегральной технологии. М. «Дрофа», 2007.
9.08.2009






