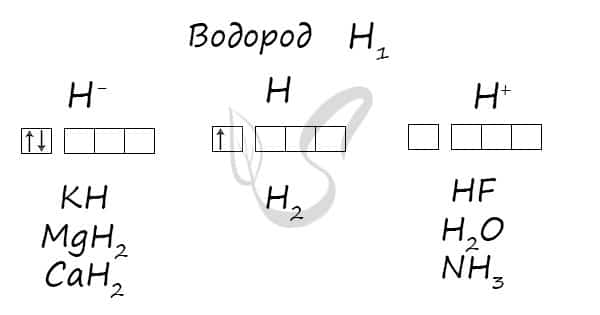
- Степени окисления
- Получение
- Химические свойства
- Вода
- Кристаллогидраты
- Пероксид водорода
- Урок 26. Получение водорода и его применение – HIMI4KA
- Получение водорода в лаборатории
- Получение водорода в промышленности
- Применение водорода
- Водород — простое вещество [1983 Николаев А.Л. — Первые в рядах элементов: Элементы I группы период, системы Д. И. Менделеева]
- Практическая работа №5
- Получение водорода из алюминия и водного раствора щелочи, реактор, простые эксперименты
- Получение водорода — Основы химии на Ида Тен
- Получение водорода в лаборатории
- Получение водорода в промышленности
Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) — самый легкий химический элемент, при обычных условиях — газ без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород — самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).

Степени окисления
Проявляет степени окисления: -1, 0, +1.
Получение
В промышленности водород получают различными методами:
- Конверсия с водяным паром при t = 1000 °C
- Методом газификации угля, торфа, сланца
- Электролизом водных растворов щелочей
- Каталитическим окислением кислородом (неполное окисление)
CH4 + H2O → CO + H2
C + H2O → CO + H2
H2O → H2↑ + O2↑
CH4 + O2 → CO + H2

Лабораторные методы традиционно отличаются от промышленных своей простотой. В лаборатории водород получают:
- Вытеснением водорода из кислот
- Гидролизом гидридов
- Взаимодействием активных металлов с водой
- Реакцией цинка или алюминия с раствором щелочи
Fe + HCl → FeCl2 + H2↑
CaH2 + H2O → Ca(OH)2 + H2↑
Ca + H2O → Ca(OH)2 + H2↑
Al + NaOH + H2O → Na[Al(OH)4] + H2↑
Химические свойства
- В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых выше, чем у водорода:
- Как восстановитель реагирует с кислородом, галогенами, азотом, серой, оксидами металлов. При комнатной температуре из перечисленных реакция идет только со фтором.
- H2 + O2 → (t) H2O
- H2 + F2 → HF (со взрывом в темноте)
- H2 + Cl2 → (t) HCl (со взрывом только на свету)
- H2 + N2 → NH3
- H2 + S → H2S
- H2 + ZnO → Zn + H2O
- Как окислитель реагирует с металлами

Na + H2 → NaH (гидрид натрия)
Mg + H2 → MgH2
Вода
Химические свойства:
- Реакция с металлами
- Реакции с основными и кислотными оксидами
- Гидролиз солей
- Реакция с гидридами активных металлов
- Реакции с C, CO, CH4
- C + H2O → CO + H2
- H2O + CO → (кат.) CO2 + H2
- H2O + CH4 → (кат.) CO + H2
- С галогенами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды. K + H2O → KOH + H2
Реагирует с основными оксидами — с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами — с образованием соответствующих кислот. Не забывайте сохранять степени окисления! CaO + H2O → Ca(OH)2 P2O5 + H2O → H3PO4
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3), а другой — по аниону (Na2CO3). Na2CO3 + CrBr3 + H2O → Cr(OH)3↓ + CO2 + NaBr
LiH + H2O → LiOH + H2↑
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты — без нагревания) Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты — при нагревании) 
Кристаллогидраты
Кристаллогидраты — кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O, Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O. Медный купорос имеет характерный голубой цвет, а безводный сульфат меди — белый.

В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует вычесть кристаллизационную воду и найти массу безводного сульфата меди.

Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
- Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
- K2O2 + H2O → KOH + H2O2
- BaO2 + H2SO4 → BaSO4 + H2O2
- В разбавленных растворах пероксид водорода легко разлагается:
- H2O2 → H2O + O2↑
- Также перекись проявляет окислительные свойства:
- KCl + H2O2 + H2SO4 → Cl2 + K2SO4 + H2O

Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки, предотвращая осложнение в виде бактериальной инфекции.
Урок 26. Получение водорода и его применение – HIMI4KA
Архив уроков › Химия 8 класс
В уроке 26 «Получение водорода и его применение» из курса «Химия для чайников» узнаем о получении водорода в лабораториях и в промышленности, а также выясним в каких отраслях промышленности его применяют.

Водород находит широкое применение в технике и лабораторных исследованиях. Мировое промышленное производство водорода из меряется десятками миллионов тонн в год.
Выбор промышленного способа получения простых веществ зависит от того, в какой форме соответствующий элемент находится в природе. Водород находится в природе преимущественно в соединениях с атомами других элементов. Поэтому для его получения необходимо использовать химические методы. Эти же методы применяют для получения водорода и в лабораторной практике.
Получение водорода в лаборатории
В лабораториях водород получают уже известным вам способом, действуя кислотами на металлы: железо, цинк и др. Поместим на дно пробирки три гранулы цинка и прильем небольшой объем соляной кислоты. Там, где кислота соприкасается с цинком (на поверхности гранул), появляются пузырьки бесцветного газа, которые быстро поднимаются к поверхности раствора:
Атомы цинка замещают атомы водорода в молекулах кислоты, в результате чего образуется простое вещество водород Н2, пузырьки которого выделяются из раствора. Для получения водорода таким способом можно использовать не только хлороводородную кислоту и цинк, но и некоторые другие кислоты и металлы.
Соберем водород методом вытеснения воздуха, располагая пробирку вверх дном (объясните почему), или методом вытеснения воды и проверим его на чистоту. Пробирку с собранным водородом наклоняем к пламени спиртовки. Глухой хлопок свидетельствует о том, что водород чистый; «лающий» громкий звук взрыва говорит о загрязненности его примесью воздуха.
В химических лабораториях для получения относительно небольших объемов водорода обычно применяют способ разложения воды с помощью электрического тока:
Получение водорода в промышленности
Очевидно, что при огромных объемах промышленного производства сырьем для получения водорода должны быть легкодоступные и дешевые вещества. Такими веществами являются природный газ (метан СН4) и вода. Запасы природного газа очень велики, а воды — практически неограниченны.
Самый дешевый способ получения водорода — разложение метана при нагревании:
Эту реакцию проводят при температуре около 1000 °С.
В промышленности водород также получают, пропуская водяные пары над раскаленным углем:
Существуют и другие промышленные способы получения водорода.
Применение водорода
Водород находит широкое практическое применение. Основные области его промышленного использования показаны на рисунке 103.
Значительная часть водорода идет на переработку нефти. Около 25 % производимого водорода расходуется на синтез аммиака NH3. Это один из важнейших продуктов химической промышленности. Производство аммиака и азотных удобрений на его основе осуществляется в нашей стране на ОАО «Гродно Азот». Республика Беларусь поставляет азотные удобрения во многие страны мира.
В большом количестве водород расходуется на получение хлороводородной кислоты. Реакция горения водорода в
кислороде используется в ракетных двигателях, выводящих в космос летательные аппараты. Водород применяют и для получения металлов из оксидов. Таким способом получают тугоплавкие металлы молибден и вольфрам.
В пищевой промышленности водород используют в производстве маргарина из растительных масел. Реакцию горения водорода в кислороде применяют для сварочных работ. Если использовать специальные горелки, то можно повысить температуру пламени до 4000 оС. При такой температуре проводят сварочные работы с самыми тугоплавкими материалами.
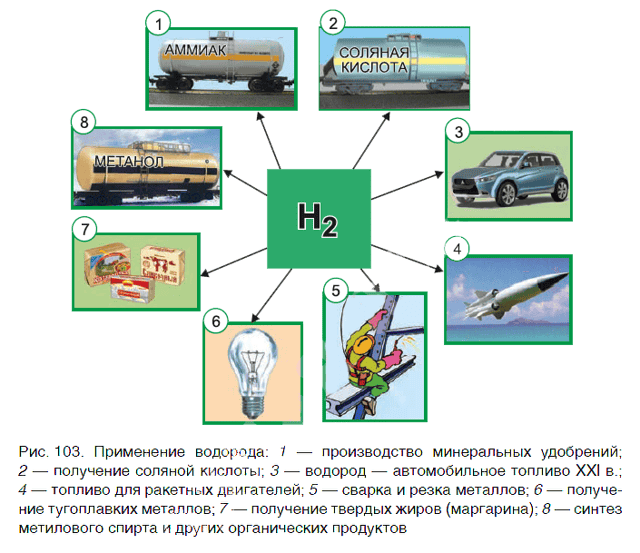
В настоящее время в ряде стран, в том числе и в Беларуси, начаты исследования по замене невозобновляемых источников энергии (нефти, газа, угля) на водород. При сгорании водорода в кислороде образуется экологически чистый продукт — вода. А углекислый газ, вызывающий парниковый эффект (потепление окружающей среды), не выделяется.
Предполагают, что с середины XXI в. должно быть начато серийное производство автомобилей на водороде. Широкое применение найдут домашние топливные элементы, работа которых также основана на окислении водорода кислородом.
Краткие выводы урока:
- В лаборатории водород получают действием кислот на металлы.
- В промышленности для получения водорода используют доступное и дешевое сырье — природный газ, воду.
- Водород — это перспективный источник энергии XXI в.
Надеюсь урок 26 «Получение водорода и его применение» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Водород — простое вещество [1983 Николаев А.Л. — Первые в рядах элементов: Элементы I группы период, системы Д. И. Менделеева]
Новости Библиотека Таблица эл-тов Биографии Карта сайтов Ссылки О сайте
Получение водорода. Для получения обычного водорода существует много различных способов. К ним относится действие воды и кислот на металлы, действие растворов щелочей на амфотерные металлы, взаимодействие гидридов металлов с водой, процессы электролиза водных растворов щелочей, разделение компонентов водяного газа, конверсия углеводородов и их неполное окисление и др.:
- Ca + 2H2О = Ca(OH)2+H2↑
- 6H2О + 2Al + 2NaOH = 2Na[Al(OH)4] + 3H2↑
- Zn + H2SО4 = ZnSО4 + H2↑
- LiH + H2О = LiOH + H2↑
Процесс образования водорода щелочными и щелочноземельными металлами при взаимодействии с водой сопровождается большим выделением теплоты. Оно настолько велико, что реакция с водой калия и более тяжелых металлов I группы, сопровождается самовоспламенением водорода.
Сравнительно немного кислот пригодно для получения водорода. Обычными сочетаниями кислота — металл, применяемыми для получения небольших количеств водорода, являются: цинк и серная кислота, цинк и соляная кислота, железо и соляная кислота, железо и серная кислота.
Последнее сочетание использовалось на заре развития воздухоплавания для получения относительно больших объемов водорода, требовавшихся для наполнения воздушных шаров. В органической химии иногда применяют для целей восстановления олово с соляной кислотой.
Магний реагирует с кислотами энергично и редко используется для получения водорода, азотную кислоту применять не следует, так как она восстанавливается водородом и практически выделяются только оксиды азота.
- Действие щелочей на амфотерные металлы, например алюминий*:
- * ()
- 2Al + 2NaOH + 2H2О = 2NaA1О2 + 3H2,
- облегчается за счет растворения в щелочах тонкой пленки гидроксида амфотерного металла, получающегося при действии на него воды. Гидриды натрия, кальция и других типичных металлов энергично реагируют с водой:
- СаН2 + 2Н2О = Са(ОН)2 + 2Н2↑
- В условиях военного времени эта реакция использовалась для быстрого пополнения запаса водорода в аэростатах.
Электролиз воды, точнее растворов щелочей (25 % раствора гидроксида натрия или 34 % раствора гидроксида калия), целесообразно производить лишь в тех местах, где дешевая электроэнергия.
Механизм электролитического выделения водорода сложен и различен в зависимости от свойств среды и природы электрода, на котором происходит процесс. Если концентрация ионов водорода (ионов гидроксония) в растворе велика (т. е.
раствор кислый), на катоде разряжаются ионы Н3О+ и образовавшиеся атомы Н рекомбинируют:
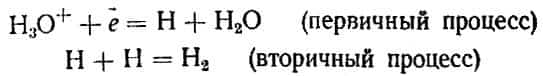
В щелочном растворе электроны, находящиеся на катоде, присоединяются к молекулам воды:
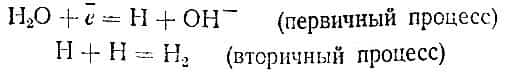
Фактически, по-видимому, всегда протекают оба процесса, но второй в кислых средах делается заметным лишь при больших плотностях тока. В особых условиях может происходить и присоединение электронов к моле* кулам кислот (угольной), в результате чего выделяется молекула водорода и получается анион кислоты:
- Водород входит в состав водяного газа — смеси, полученной пропусканием водяного пара над раскаленным углем:
- Н2О + С=СО↑ + Н2↑
- Эта реакция эндотермическая, поэтому часть газа сжигают для ее поддержания. Повторное смешивание с водяным паром полученного газообразного продукта и пропускание над железохромовым катализатором (при 550 °С) дает возможность превратить СО в СО2:
- Н2О + СО = СО2 + Н2
- Оксид углерода (IV) удаляют растворением в воде при повышенном давлении и таким образом получают практически чистый Н2.
В настоящее время водород получают из природного газа, попутных газов (коксовый газ, газы нефтепереработки) и электролизом воды. Получение водорода из природных газов основано на реакции углеводородов, содержащихся в этих газах с водяным паром (процесс конверсии). В качестве примера можно привести реакцию конверсии метана:
- СН4+Н2О = СО + 3Н2
- Эта реакция протекает с поглощением теплоты. Далее
- оксид углерода (II) реагирует со второй молекулой воды:
- СО + Н2О = СО2 + Н2
Конверсия метана ускоряется никелевым катализатором и протекает при 800° С. Для поддержания этой температуры приходится сжигать часть исходного газа.
Использование водорода. Из газов переработки нефти и коксового газа водород получают методом глубокого охлаждения, продукт содержит азот (около 15 %).
Содержание азота повышают (до 25 %) и используют смесь непосредственно для синтеза аммиака. Главным потребителем водорода и является производство аммиака.
Кроме того, значительное количество водорода идет для получения метанола, необходимого в химической промышленности. Метанол образуется из водорода и оксида углерода (II):
2Н2 + СО=СН3ОН
в присутствии катализаторов, содержащих оксиды переходных металлов. Главная роль принадлежит водороду при гидрогенизации жиров, масел и в производстве различных видов жидкого топлива.
Нужен Н2 для синтеза хлороводорода в производстве соляной кислоты. Его смесь с кислородом используют при сварке, а в чистом виде в атомарных горелках.
Применение водорода в качестве восстановителя лежит в основе технического метода получения некоторых металлов (например, вольфрама).
В последние годы в связи с удешевлением способов получения водорода и возрастанием общего потребления нефтепродуктов важное значение приобрела проблема использования водорода как горючего в двигателях.
Водород представляет собой очень удобный источник энергии (точнее: его реакция с кислородом).
При сгорании этого газа выделяется много теплоты, двигатель может развить большую мощность и в то же время продукты сгорания (водяной пар) абсолютно безвредны и не загрязняют окружающую среду.
Устройство электрохимического водородно-кислородного топливного элемента показано на рис. 4. Газы поступают в элемент, заполненный щелочным раствором, сквозь пористые угольные электроды, на которых происходят реакции:
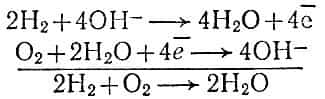
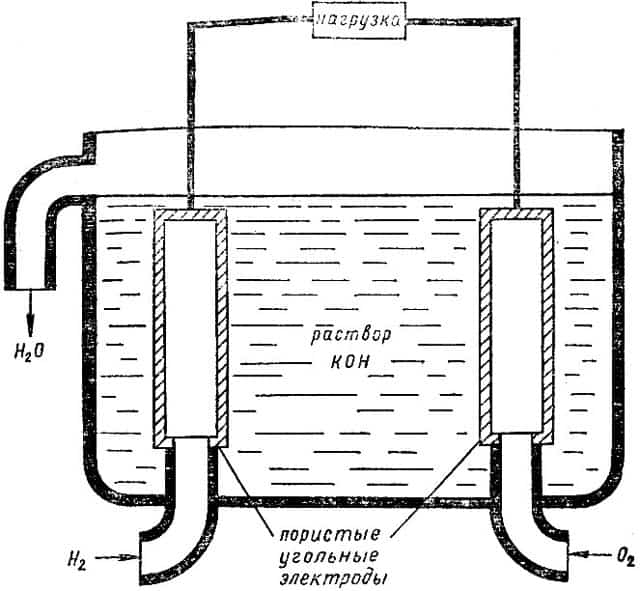 Рис. 4. Устройство водородно-кислородного топливного элемента
Рис. 4. Устройство водородно-кислородного топливного элемента
Водороду несомненно принадлежит в развитии энергетики большое будущее.
Практическая работа №5
Цель работы: получить водород в реакции кислоты с металлом, собрать полученный газ и исследовать его свойства.
Реактивы и оборудование: раствор хлороводородной кислоты, гранулы цинка (или кусочки железа), части прибора для получения газов, стаканчик или пробирка с водой, пробирка для собирания водорода, спиртовка, спички, лучинка.
Опыт 1. Получение водорода.
Соберите прибор для получения водорода и проверьте его на герметичность. Положите в пробирку несколько гранул цинка и прилейте к ним небольшой объем (1-2 см3) раствора хлороводородной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой, конец которой погрузите в стаканчик или пробирку с водой.
Опыт 2. Изучение свойств водорода.
Физические свойства водорода. Наблюдая за протеканием опыта 1, обратите внимание на отсутствие окраски у водорода. Растворяется ли водород в воде?
Химические свойства водорода. Соберите водород. Для этого газоотводную трубку извлеките из воды и введите в пробирку, закрепленную в штативе вверх дном. Вспомните, почему пробирка должна быть расположена именно так.
Примерно через 1 минуту осторожно извлеките газоотводную трубку и к отверстию пробирки поднесите горящую лучинку или спичку.
Какой признак свидетельствует о протекании химической реакции? Какое химическое свойство проявляет водород в этой реакции?
Составьте отчет о проделанной работе. Сделайте вывод о способе получения водорода в лаборатории, о его физических и химических свойствах, которые вы исследовали. Составьте соответствующие уравнения химических реакций.
ОТВЕТЫ
Опыт 1.
Для цинкаZn + 2HCl = ZnCl2 + H2Это реакция замещения. Её продуктами являются хлорид цинка и водород.
Для железаFe + 2HCl = FeCl2 + H2Это реакция замещения. Её продуктами являются хлорид железа (II) и водород.
Опыт 2.
Водород в воде практически нерастворим.Для собирания водорода пробирку нужно держать вверх дном потому, что водород легче воздуха.При поднесении горящей лучины (спички) к отверстию пробирки с водородом мы слышим хлопок – происходит взрыв в результате взаимодействия кислорода воздуха с водородом. В результате этой реакции на стенках пробирки можно увидеть капельки прозрачной жидкости – воды.
2H2 + O2 = 2H2
В этой химической реакции водород проявляет свойство горючести.
Получение водорода из алюминия и водного раствора щелочи, реактор, простые эксперименты
Лабораторные работы — этакое таинство позволяющее прочувствовать полезность и практичность теории из учебников и тетрадок. Живые опыты производят изрядное впечатление наглядно демонстрируя как интересен и удивителен мир вокруг. Это хороший дополнительный фактор, чтобы заинтриговать наукой юных обормотов. К превеликому сожалению современные школы все более манкируют натурными экспериментами при изучении естественных наук. Демонстрацию фото-видео, презентаций предпочитают возне с пробирками и настоящими реактивами. Это проще и дешевле для школы и преподавателя, однако и меньше вовлекает учеников. И если в школах больших городов еще существуют лаборатории при кабинетах физики и химии, то в школах сельских, дела обстоят из рук вон плохо. Поскольку спасение утопающих, дело сами-знаете-чьих рук, мы стараемся хоть иногда организовывать для своего ребенка интересные работы в разных областях. Чтобы если не привить любовь к исследованиям, то по крайней мере продемонстрировать. Эта работа была посвящена водороду — его простому получению и выяснению некоторых зрелищных особенностей. Заодно можно коснуться и истории (воздухоплавания — аппараты легче воздуха, Шарльеры). Итак. Наиболее простым и безопасным способом получения Н2 можно признать сугубо химический — из водного раствора щелочи и алюминия. Реактивы просты и относительно безопасны, водорода выделяется много — даже нетерпеливый вьюнош соскучится не успеет. Попутно мы сделали небольшой настольный (напольный) реактор позволяющий получать достаточно газа и меньше заботиться о безопасности (опрокидывании). Чтобы не было конфуза, первым делом попробовал сделать эксперимент самостоятельно. Взял несколько алюминиевых обрезков от работы с лампой и залил их раствором щелочи.
Эксперимент №1
Чистой щелочи не нашлось, применил сухой (гранулы) очиститель для труб в состав которого она входит. Надо сказать, что не все химикаты подобного рода работают в нужном качестве, например «Крот» жидкий в бутылке с носиком уточкой, на алюминий никакого впечатления не произвел — в его состав кроме щелочи входит и ингибитор коррозии.
Мой первый эксперимент проходил ни шатко ни валко — реактивы брал на глазок, щелочи положил мало. Шарик на фото образовывался почти за двое суток. Для эксперимента №2 отмерил реактивы на весах, залил избытком воды (реакция экзотермическая, раствор разогревается), алюминий измельчил, применил катализатор — кальцинированную соду.
Дело пошло существенно веселее, несколько литров газа получалось за минуты, однако, одноразовая 1.5 л ПЭТ бутылка оказалась не лучшим реактором — разогрев алюминиевой засыпки на дне деформировал и проплавил емкость, она стала протекать.
- Эксперимент №2
- Итак, что нам понадобилось для изготовления и опытов.
- Подстаканник.
Тогда было решено сделать реактор из имеющегося 2 л. порошкового огнетушителя в толстом пластиковом корпусе. Основательный корпус вселял надежду на прочность и относительную термостойкость, однако прибор узковысок и неустойчив. Гулять так гулять — мы его снабдили хорошим устойчивым подстаканником. К посильным работам привлекалась и жертва неуемной родительской педагогики. Б/у огнетушитель ОП-2, набор инструментов для столярных работ, ЛКМ, посуда, мелочи. Реактивы — алюминий, щелочь, вода, мыльный раствор.В хороший солнечный денек подобрал подходящие обрезки сосновых досок, в основном попорченные древоточцами, не пригодные для других столярных или плотницких работ. Предварительно прострогал их, опилил в размер и прострогал еще разок до нужной толщины (12…13 мм). При этом удачно удалились все внутренние паршивцы портящие деревяшки, вместе со своими следами ходами. Чудненько. На пиле маятниковой (торцевой) обрезал заготовки в размер, опилил углы. Из дефектов на деревяшках осталась большая дырка от выпавшего сухого сучка, ничего, сойдет за люк для контроля температуры (пальцем пробовать корпус реактора), опять же — вентиляция. Зашкуриванием занимался загрустивший от трудностей научной работы ребенок. В дне подстаканника просверлил ряд отверстий, как в мыльнице, чтобы стекало ежели чего прольется. Заготовки скрепил клеем (столярный ПВА) с некрупными гвоздиками. Чтобы наш подстаканник не размокал и не пачкался грязными пальцами покрасили его в зеленый цвет засыхающими остатками эмали ПФ-115. Для работ снова был привлечен практикант, уже повеселевший — красить мы любим. Для покраски было выделено рабочее место в проветриваемом дровнике, выданы материалы, доведена техника безопасности. Деревяшки обмели и продули от пыли, для первого слоя краску слегка разбавили растворителем. Перед нанесением слоя второго, первый слегка зашкурили некрупной затертой наждачкой — чтобы удалить встопорщившиеся волокна древесины.
Крышка реактора.
Огнетушитель нам достался со сломанной верхней частью, но все что нужно для запирания емкости было в наличии. Большую накидную металлическую гайку удалось отвернуть зажав ее в слесарных тисках. Внутри обнаружилась соломинка с раструбом на дне (для правильного забора рабочего тела — порошка) и небольшой баллончик для сжатого газа.
Баллончик удалось отвернуть не без труда (фиксатор или герметик на резьбе). Применили разводной ключ и тиски. Соломинку укоротили и привинтили навыворот — снаружи, получился удобный патрубок для наполнения шарика. Для присоединения нетолстого силиконового шланга сделали еще один патрубок, поменьше.
Из оставшейся соломинки с раструбом получилась хорошая воронка для наполнения реактора химикатами. Патрубок для шланга сделали из кусочка сменной ампулы шариковой ручки. Вклеили ее термоклеем. Действовали так — полностью залили отрезок толстого красного патрубка термоклеем с одной стороны, после его застывания, залили и с другой.
Чтобы расплавленный клей не выливался с обратной стороны, заткнули ее гладким металлическим (не прилипает клей) цилиндриком походящим по диаметру (гальванический элемент типоразмера ААА). Дали клею полностью остыть и отвердеть и просверлили сквозное отверстие. Получился этакий тройник.
Сборку пластиковых частей сделали с применением силиконового герметика, залили термоклеем и несколько ненужных отверстий в крышке. Осталась только загрузочная горловина с резьбовой пробкой.
Реактор в сборе с подстаканником.
- Транспортное положение воронки — соломинки.
- Собственно опыты.
- 2Al + 2KOH + 6H2O = 2 K[Al(OH)4] + 3H2↑
Первым делом не худо будет напомнить (объяснить) ребенку что происходит внутри реактора и почему оттуда выходит газ — водород. Дескать, происходит химическая реакция между водой, щелочью и алюминием. Интересно, что алюминий, паче чаяний, метал очень активный (в электрохимическом ряду металлов стоит между магнием и цинком). Он вполне способен самостоятельно вступать в реакцию с водой, но на поверхности Аl очень быстро образуется прочная пленка окисла предохраняющего металл. Щелочь удаляет оксидную пленку, происходит хим.реакция, выделяется водород. Мы решили сделать с водородом два простых опыта — наполнять им мыльные пузыри (взлетают вверх — видим что водород легче воздуха) и поджечь мыльную пену наполненную водородом (продемонстрировать горючесть). В обоих случаях нужны мыльные пузыри. Их мы сделали из непижонского шампуня немного разбавив его водой и добавив капельку глицерина для прочности. Попробовали что получилось, кстати пришлась и соломинка от огнетушителя. Ничего, все работает, можно приступать. К толстому патрубку реактора прикрепили ресивер — воздушный шарик. Засыпали алюминиевые гранулы, залили щелочь. Реактивы остались от предыдущих опытов, несколько изношенные, но работали.
Гранулирование алюминия.
Реактор не следует заливать под пробку, около 5 см лучше оставить пустыми иначе в наружу лезет щелочная пена. Водород — самый легкий из газов, весит он в 14.5 раз легче воздуха. Мыльный пузырь наполняемый водородом, дивным образом взлетает вверх.
Опыт следует проводить в закрытом помещении без сквозняков, вдали от открытого пламени. Некоторое время нужно дать реактору поработать «на помещение» или выпустить на улице первую порцию накопленного газа — водород здесь с примесью воздуха.
Иногда на конце соломинки (шланга) скапливается избыток мыльной жидкости, при надувании пузыря она висит капелькой на его дне как корзина аэростата и мешает взлету — после макания в мыльный раствор конец шланга лучше слегка стряхнуть.
Следует помнить и о влажности полученного водорода — вместе с газом из реактора увлекается и щелочная взвесь (лопающиеся на поверхности пузырьки водорода) и испаряется вода (реакция экзотермична — раствор щелочи разогревается). Однако легкости даже влажного водорода вполне хватает для всплывания мыльных пузырей.
Можно попробовать несколько осушить его, пропуская через простые фильтры. При надувании пузырей из тонкого шланга, довольно было и тока водорода образующегося при реакции. Регулировали мы его пережимая мягкий шланг в удобном месте.
Для выдувания пузырей поосновательней, применили всю ту же соломинку сделав к ней переходник. Водород в этом случае приходилось накапливать в ресивере. Потренировавшись, пришли к выводу, что лучше всего запускать небольшие, не больше 3…4 см. пузырики, ведут они себя не в пример благонадежнее, поведение их вполне очевидно.
Горение водорода.
Водород горюч и воспламеняется чрезвычайно легко. Смесь водорода с кислородом или воздухом взрывается. Наиболее взрывчата смесь, состоящая из двух объемов водорода и одного кислорода, — гремучий газ. Такая смесь получается естественным образом при электролизе водного раствора (чаще всего щелочи) и весьма опасна в неумелых руках.
Сила взрыва гремучего газа велика, скорость горения очень высока (большой риск обратного удара при использовании в горелках). Не следует собирать сколь ни будь значительное количество (наполнять объем) гремучего газа, тем более в стеклянную посуду. По возможности, сосуды для работы с гремучим газом следует делать с избыточной прочностью.
Массовая доля водорода в воздухе, более 18 % уже грозит взрывом. Перед опытами связанными с поджиганием водорода, следует проверить его на чистоту — собрать (способом вытеснения воздуха или воды) в небольшую емкость (обычно это пробирка) водород и поджечь его поднеся к пламени. Чистый водород сгорает относительно спокойно, с легким хлопком. Наличие примеси воздуха приводит к взрыву — это короткий резкий ДАХ! бьющий по ушам. Разница слышна очень хорошо. В качестве проверки на чистоту мы поджигали небольшой пузырек (мыльный) с водородом. Основной эксперимент — получение мыльной пены с водородом внутри, поджигание её. Мыльный раствор использовали из предыдущего опыта, накапливали в шарике-ресивере газ, погружали конец шланга в мыльный раствор и открывали кран. Плошку с водородной пеной относили подальше от реактора и поджигали. Удобно использовать зажигалку для газовой плиты с длинным носиком или горящую лучинку. Мы бросали в пену горящую спичку. Ресивер с водородом мы отсоединили от реактора и презентовали учащемуся для развлечения. Заслужил, молодец.
Бабай Мазай, май, 2020 г.
Становитесь автором сайта, публикуйте собственные статьи, описания самоделок с оплатой за текст. Подробнее здесь.
Получение водорода — Основы химии на Ида Тен
История открытия водорода История водорода начинается с XVI века, когда было замечено, что при действии кислот на железо и другие металлы выделяется некий неизвестный газ.
Первоначально его назвали «горючим воздухом». Такое название газ получил из-за способности гореть.
Во второй половине XVIII века английский ученый Генри Кавендиш получил водород при действии соляной кислоты HCl на цинк:
Zn + 2HCl = ZnCl2 + H2
Что же такое кислота с точки зрения химии? Кислота – это сложное вещество, в состав которого всегда входят атомы водорода. В формулах кислот атомы водорода принято писать на первом месте. Атомы, следующие в формуле за водородом, называют кислотным остатком. Так, в соляной кислоте HCl кислотный остаток – Cl.
Например, в серной кислоте H2SO4, кислотный остаток – SO4. Кислота – сложное вещество, в состав которого входят атомы водорода и кислотный остаток Генри Кавендиш изучил свойства «горючего воздуха». Он установил, что этот газ намного легче воздуха, а при сгорании на воздухе образует прозрачные капли жидкости. Этой жидкостью оказалась вода.
Генри Кавендиша считают первооткрывателем водорода. Вывод о том, что «горючий воздух» представляет собой простое вещество, был сделан в 1784 году французским химиком Антуаном Лораном Лавуазье.
Антуан Лоран Лавуазье дал этому веществу латинское название (Hydrogenium), которое происходило от греческих слов «хюдор» – вода и «геннао» – рождаю. В те годы под элементами подразумевали простые вещества, которые нельзя далее разложить на составные части.
Поэтому у химического элемента водорода такое же название, как и у просто вещества H2. Русское слово водород – это точный перевод латинского названия Hydrogenium.
Получение водорода в лаборатории
Современный лабораторный способ получения водорода не отличается от того, которым его получал Генри Кавендиш. Это реакции металлов с кислотами. В лаборатории водород получают в аппарате Киппа (рисунок 152).
Аппарат Киппа изготовляется из стекла и состоит из нескольких частей:
- реакционная колба с резервуаром;
- воронка с длинной трубкой;
- газоотводная трубка.
Реакционная колба имеет верхнюю шарообразную часть с отверстием, в которое вставляется газоотводная трубка, снабженная краном или зажимом, и нижний резервуар в виде полусферы.
Нижний резервуар и реакционная колба разделены резиновой или пластиковой прокладкой с отверстием, через которое проходит в нижний резервуар длинная трубка воронки, доходящая почти до дна. На прокладку через боковое отверстие шпателем насыпают твёрдые вещества (мрамор, цинк). Отверстие закрывается пробкой с газоотводной трубкой.
Затем при открытом кране или зажиме в верхнюю воронку заливается раствор кислоты. Когда уровень жидкости достигает вещества на прокладке, начинается химическая реакция с выделением газа. При закрытии крана давление выделяющегося газа выдавливает жидкость из реактора в верхнюю часть воронки. Реакция прекращается.
Открытие крана приводит к возобновлению реакции. Поместим в реакционную колбу кусочки цинка. В качестве кислоты воспользуемся серной кислотой. При контакте цинка и серной кислоты протекает реакция:
Zn + H2SO4 = ZnSO4 + H2
Водородом можно заполнить мыльный пузырь.
Для этого необходимо опустить газоотводную трубку в мыльный раствор. На конце трубки начнется формирование мыльного пузыря, заполненного водородом; со временем пузырь отрывается и улетает вверх, что доказывает легкость водорода. Соберем выделяющийся водород.
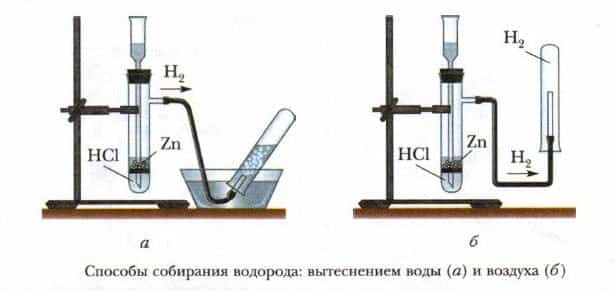
С учетом того, что водород намного легче воздуха, для сбора водорода сосуд, в котором собирается газ, необходимо располагать вверх дном, или производить собирание методом вытеснения воды. Как обнаружить водород? Заполним пробирку водородом, держа ее вверх дном, по отношению к газоотводной трубке.
Поднесем пробирку отверстием к пламени спиртовки – слышится характерный хлопок.
Хлопок – это признак того, что в пробирке содержится водород. При поднесении пробирки к пламени водород вступает в реакцию с кислородом, содержащимся в воздухе. При малых количествах реакция кислорода и водорода сопровождается хлопком. Более подробно об этой реакции будет рассказано в следующем параграфе.
Получение водорода в промышленности
Одним из промышленных способов получения водорода является реакция разложения воды под действием электрического тока:
2H2O эл.ток → 2H2 + O2.
Данный метод позволяет получить чистый водород и кислород. Процесс превращения химических веществ в другие вещества под действием электричества называется электролизом.
Электролиз – химическая реакция, протекающая под действием электрического тока Проведем электролиз воды. В стакан наполненный водой, опустим металлические электроды. Поверх электродов опустим в стакан пробирки, заполненные водой. Подсоединим электроды к источнику тока – батарейке.
В пробирках наблюдается выделение газов – водорода и кислорода, которые вытесняют воду. Наблюдая за процессом электролиза, можно заметить, что в одной из пробирок газа собирается в два раза больше, чем в другой. Проанализировав уравнение реакции электролиза воды, можно сделать вывод, в какой пробирке выделяется водород, а в какой – кислород.
Попробуйте это сделать самостоятельно.
Существуют и другие способы получения водорода. Железо-паровой метод долгое время широко применялся в промышленности.
Через электрическую трубчатую печь проходит трубка из нержавеющей стали, заполненная железными стружками. Через трубку с железными стружками пропускают водяной пар.
При температуре около 800°С пары воды взаимодействуют с железом, образуя оксид Fe3O4 (железную окалину) и газообразный водород:
3Fe + 4Н2О = 4Н2 + Fe3O4.
Можно получить Н2, пропуская Н2О через слой раскаленного угля. При этом образуется смесь двух газов – СО и Н2 (водяной газ):
Н2О + С = CO + Н2
В настоящее время водород получают взаимодействием углеводородов (в основном метана, СН4) с водяным паром или неполным окислением метана кислородом:
СН4 + Н2О = СО + 3Н2
2СН4 + О2 = 2СО + 4Н2
Итог статьи:
- В лаборатории водород получают в аппарате Киппа
- Исходными веществами для получения водорода в лаборатории являются некоторые металлы и кислоты
- Собирать водород нужно методом вытеснения воды, или методом вытеснения воздуха, расположив пробирку вверх дном по отношению к газоотводной трубке
- Кислота – сложное вещество, в состав которого входят атомы водорода и кислотный остаток
- Обнаружить водород можно по характерному хлопку при поднесении пробирки с водородом к пламени
- Одним из промышленных способов получения водорода является электролиз воды
- Электролиз – химическая реакция, протекающая под действием электрического тока






