- Химические свойства металлов — с чем реагируют? Свойства и таблица
- Ряд активности металлов
- Взаимодействие с кислотами
- Взаимодействие с солями
- Взаимодействие с аммиаком
- Взаимодействие с органическими веществами
- Взаимодействие металлов с оксидами
- Вопросы для самоконтроля
- Подведем итоги
- Таблица «Химические свойства металлов»
- Общие химические свойства металлов — урок. Химия, 9 класс
- Химические свойства металлов
- Взаимодействие с простыми веществами
- Взаимодействие металлов друг с другом
- Взаимодействие металлов с водой
- Взаимодействие металлов с кислотами
- Взаимодействие металлов с солями
- Примеры решения задач
- § 44. Общие химические свойства металлов
- Ряд активности металлов
Химические
свойства металлов во многом зависят от строения его внешнего или предвнешнего
электронного слоя. Для металлов, расположенных в одной группе периодической
системы и имеющих одинаковое строение внешней электронной оболочки, следует
ожидать определённые сходства в химических свойствах.
В атоме
металлов на внешнем энергетическом уровне небольшое количество электронов и
очень большой радиус атома, что способствует быстрой отдаче электронов атомами
металлов в результат их взаимодействия с другими соединениями.
Металлы
окисляются, сами при этом выступают в роли восстановителя.
Кроме этого,
положение металла в ряду активности характеризует свойства металла и его
катионов в водных растворах и связано с его химической активностью.
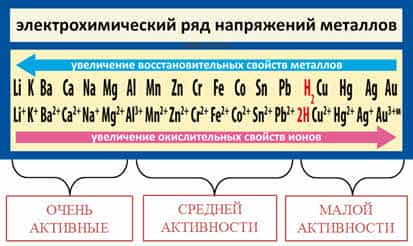
Как известно, самые
активные металлы расположены в начале ряда (слева), а самые
малоактивные – в конце (справа).
На основании
восстановительной способности металлов в ряду напряжений металлы условно можно
разделить на три группы: от лития до алюминия – очень активные
металлы, от алюминия до водорода – металлы средней
активности, от водорода до золота – малоактивные металлы.
Следует отметить,
что высокая электрохимическая активность металла не всегда означает его
химическую активность и наоборот. Обратите внимание на расположение лития и
натрия в ПС и в ряду активности металлов.
На основании положения в ПС натрий
активнее лития, так как радиус у натрия больше, на основании положения их в
ряду активности видно, что литий стоит левее натрия, то есть его восстановительная
способность выше, так как здесь учитывается не только радиус атома, но и
энергия отрыва электрона, энергия разрушения кристалла и энергия гидратации
ионов металла.
Например, с
кислородом активно при комнатной температуре реагируют только щелочные металлы,
при этом образуются оксиды или пероксиды. Так, в реакции лития с кислородом
образуется оксид лития, а в реакции натрия с кислородом – пероксид натрия.
4Li + O2 = 2Li2O
2Na + O2 = Na2O2
Металлы средней
активности реагируют с кислородом при нагревании. Например, проведём
эксперимент горения магния в кислороде. В результате данной реакции образуется
оксид магния, магний горит яркой вспышкой. Эта реакция сопровождается
выделением большого количества и света и ранее использовалась фотографами в
качестве вспышки при съёмке.
2Mg + O2 = 2MgO
Алюминий в
порошке также горит ослепительным пламенем с образованием оксида алюминия. Эта
способность используется в фейерверках, салютах, бенгальских огнях.

Такие металлы,
как Au, Pt не
реагируют с кислородом и поэтому на воздухе практически не изменяют своего
блеска.
Большинство
металлов, кроме Au, Pt реагируют при нагревании с серой, при этом образуются
соответствующие сульфиды.
Так, в реакции
цинка с серой образуется сульфид цинка, в реакции серебра с серой образуется
сульфид серебра (I).
Проведём
эксперимент, для этого на асбестовой сетке поместим цинк с серой, подожжём эту
смесь горящим магнием, в результате у нас образуется сульфид цинка.
Практически все
металлы реагируют с галогенами. Условия протекания этих реакций зависит от
активности металла и галогена.
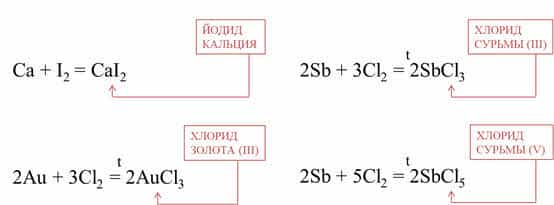
Например, кальций реагирует с йодом при
комнатной температуре, при этом образуется йодид кальция, а золото реагирует с
хлором при сильном нагревании, при это образуется хлорид золота (III).
Очень красиво горит сурьма в хлоре, при этом образуется
смесь хлоридов: хлорид сурьмы (III) и хлорид сурьмы (V).
С металлами
реагируют соединения всех классов – оксиды (в том числе вода), кислоты,
основания и соли.
При нагревании
металлы реагируют и с другими неметаллами. Так, в реакции алюминия с
азотом, образуется нитрид алюминия, в реакции кальция с форфором, образуется
фосфид кальция, в реакции алюминия с углеродом – карбид алюминия, в реакции
магния с кремнием – силицид магния.

С водородом
реагируют только активные металлы. Например, в реакции натрия с водородом
образуется гидрид натрия.
Так, активные
металлы бурно реагируют с водой при комнатной температуре. Например, в реакции
лития с водой образуется гидроксид лития и водород, в реакции бария с водой
образуется гидроксид бария и водород.
Проведём
эксперимент, для этого в воду добавим фенолфталеин и опустим туда кусочек
натрия. Натрий начинает бегать по поверхности из-за выделения водорода, раствор
приобретает малиновую окраску, вследствие образования щёлочи. Таким образом, в реакции
натрия с водой образуется щёлочь – гидроксид натрия и газ – водород.
Поверхность таких
металлов, как магний и алюминий, защищена плотной плёнкой соответствующего
оксида. Это препятствует протеканию реакции с водой.
Но если убрать
эту плёнку, то эти металлы активно будут вступать в реакцию. Например,
порошкообразный магний реагирует с горячей водой, при этом образуется гидроксид
магния и водород.
При повышенной
температуре с водой реагируют и менее активные металлы, но в данном случае
образуется окси д и водород. Например, в реакции цинка с водой образуется оксид
цинка и водород.
Металлы, стоящие
в ряду активности до водорода, реагируют с кислотами (кроме HNO3
любой концентрации и H2SO4
концентрированной) с образованием солей и водорода.
Активные металлы реагируют
с растворами кислот очень быстро.
Например, в реакции кальция с соляной
кислотой образуется соль – хлорид кальция и водород, в реакции алюминия с
разбавленной серной кислотой образуется соль – сульфат алюминия и водород.
Малоактивные
металлы часто практически не растворяются в кислотах. Это обусловлено
образованием на их поверхности плёнки нерастворимой соли. Например, свинец,
стоящий в ряду активности до водорода, практически не растворяется в
разбавленной серной и соляной кислотах вследствие образования на его
поверхности плёнки нерастворимых солей (PbCl2,
PbSO4).
В азотной кислоте
растворяются металлы, стоящие и до, и после водорода. При этом образуются
нитраты, а также различные продукты восстановления азотной кислоты.
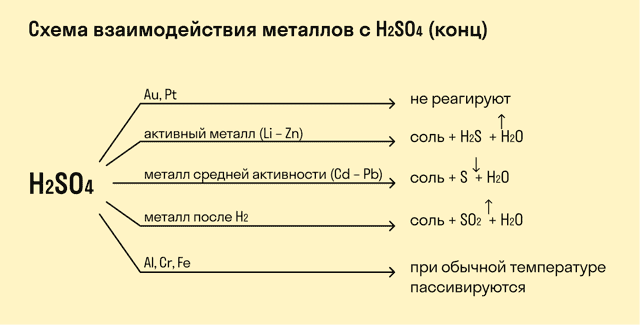
Концентрированная
серная кислота также может вступать в реакции с металлами, расположенными в
ряду активности после водорода. Например, в реакции серебра с концентрированной
серной кислотой образуется сульфат серебра (I), сернистый
газ и вода, а в реакции магния с концентрированной серной кислотой образуется
сульфат магния, сероводород и вода.
Al,
Cr, Fe при
комнатной температуре не вступают в реакцию и с концентрированной серной
кислотой из-за образования на их поверхности оксидной плёнки. Это явление
называется пассивацией. Благодаря этому становится возможным транспортировать
концентрированную азотную серную кислоты в стальных цистернах.
- Проведём
эксперимент, поместим в четыре пробирки металлы: в первую – магний, во вторую –
цинк, в третью – железо, а в четвёртую – медь и прильём в каждую пробирку
соляной кислоты. - Интенсивнее всего
выделение наблюдается в первой пробирки, где находится цинк, кроме этого,
реакция сопровождается выделение теплоты, во второй и третье пробирке
интенсивность выделения водорода меньше, а в четвёртой пробирке водород вообще
не выделяется. - Mg + 2HCl = MgCl2
+ H2↑ + Q - Zn + 2HCl = ZnCl2
+ H2↑ - Fe + 2HCl = FeCl2
+ H2↑ - Cu + HCl ≠
Тоже самое
сделаем в другом опыте, но использовать здесь будем уксусную кислоту.
Получается, что при комнатной температуре с уксусной кислотой реагирует
только магний, цинк и железо реагирует с уксусной кислотой только при
нагревании, а медь не вступает во взаимодействие с уксусной кислотой.
- Mg + 2CH3COOH = (CH3COO)2 Mg + H2↑
- Zn + 2CH3COOH = (CH3COO)2 Zn + H2↑
- Fe + 2CH3COOH = (CH3COO)2 Fe + H2↑
- Cu + CH3COOH
≠ - Таким образом, металл
реагирует с раствором кислоты, если он стоит в ряду активности левее водорода,
при этом должна образоваться растворимая соль, концентрированная серная и
азотная кислота иначе реагируют с кислотами, щелочные металлы для данных
реакций лучше не использовать из-за их высокой химической активности. - Некоторые
металлы, такие, как Be, Zn, Al, легко растворяются в водных растворах щелочей с
образованием комплексных соединений. - Например, в
реакции бериллия с раствором гидроксида натрия образуется комплексная соль –
тетрагидроксобериллат натрия, а в реакции цинка с водным раствором гидроксида
калия образуется комплексная соль – тетрагидроксоцинкат калия. - Be + 2H2O + 2NaOH = Na2[Be(OH)4] +
H2↑ - Zn + 2H2O + 2KOH = K2[Zn(OH)4] + H2↑
Металлы, оксиды и
гидроксиды которых амфотерны, взаимодействуют также с расплавами щелочей при
нагревании. Например, в реакции цинка с расплавом гидроксида натрия образуется
соль – цинкат натрия и водород.
Zn + 2NaOH (тв.)
= Na2ZnO2
+ H2↑
Активные
металлы вытесняют малоактивные из растворов их солей. Так, в реакции железа
с хлоридом меди (II) железо замещает медь в его хлориде
и образуется хлорид железа (II) и медь, в реакции меди
с нитратом серебра (I) образуется соль – нитрат меди (II) и серебро.
- Fe + CuCl2 = FeCl2 + Cu↓
- Cu + 2AgNO3 = Cu (NO3)2 +
2Ag↓ - Проведём
эксперимент, опустим железный гвоздь в раствор сульфата меди (II),
через некоторое время на железном гвозде осела медь и раствор стал жёлтого
цвета, если опустить медную платину в раствор сульфата железа (II), то в данной случае признаков реакции не наблюдается,
ведь медь менее активный металл, чем железо. - Fe + CuSO4 = FeSO4 + Cu↓
- Cu + FeSO4 ≠
- В данных реакциях
нужно соблюдать следующие условия: щелочные металлы брать нельзя, так как они
будут взаимодействовать с водой, металл должен находится левее того металла,
который входит в состав соли, в данных реакциях должна образоваться растворимая
соль.
Металлы могут
реагировать и с органическими веществами. Например, в реакции фенола с натрием,
образуется фенолят натрия, в реакции этанола с натрием образуется этилат
натрия.
2C6H5OH + 2Na → 2C6H5ONa + H2↑
2C2H5OH + 2Na → 2C2H5ONa + H2↑
Кроме этого,
натрий вступает в реакцию Вюрца с галогеналканами. Так, в реакции хлорметана с
натрием образуется хлорид натрия и этан.
2H3CCl + 2Na C2H6
+ 2NaCl
Соединение Pb(C2H5)4
– тетраэтилсвинец – применяется как антидетонатор в моторном топливе. Это
сильно ядовитое соединение, если бензин содержит тетраэтилсвинец, тогда его
называют «этилированным».
Таким образом, о
химической активности металлов можно примерно судить по их расположению в
электрохимическом ряду напряжений металлов.
Чем левее расположен
металл, тем выше его химическая активность в водном растворе. Активные
металлы размещаются вначале вытеснительного ряда, а малоактивные – в конце.
Металлы
реагируют как с простыми веществами – неметаллами, так и со сложными: оксидами,
кислотами, основаниями и солями.
Химические свойства металлов — с чем реагируют? Свойства и таблица
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
| Li, K, Na, Ca, Ba | Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb | H2 | Cu, Hg, Ag, Pt, Au |
- Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
- 2Li + 2H2O = 2LiOH + H2
- Ca + 2H2O = Ca(OH)2 + H2
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
- Cr + H2O = Cr2O3 + H2
- Zn + H2O = ZnO + H2
- Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
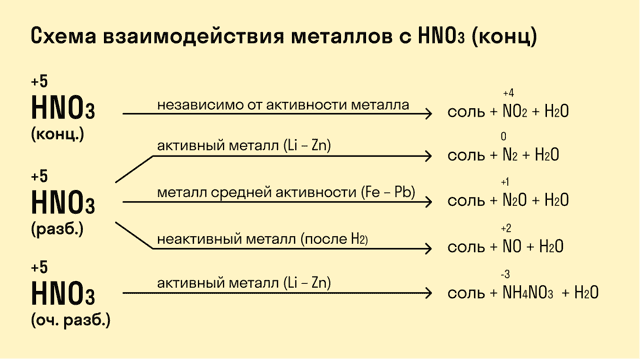
- Металлы IА группы:
- 2K + H2SO4 (раствор) = K2SO4 + H2
- 8K + 5H2SO4 (конц) = 4K2SO4 + H2S + 4H2O
- 8Na + 10HNO3 (раствор) = 8NaNO3 + NH4NO3 + 3H2O
- 3Na + 4HNO3 (конц) = 3NaNO3 + NO + 2H2О
- Металлы IIА группы
- Mg + H2SO4 (раствор) = MgSO4 + H2
- 4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O
- Mg+ 4HNO3 (конц) = Mg(NO3)2 + 2NO2 + 2H2O
- 4Mg + 10HNO3 (раствор) = 4Mg(NO3)2 + 2N2O + 5H2O
- Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
- Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
- Zn + CuSO4 = ZnSO4 + Cu
- На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
- Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2
Взаимодействие с органическими веществами
- Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
- 2Na + 2C2H5OH = 2C2H5ONa + H2
- 2K + 2C6H5OH = 2C6H5OK + H2
- Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
- Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
- 8Al + 3Fe3O4 = 4Al2O3 + 9Fe (алюмотермия)
- 3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
-
С чем реагируют неактивные металлы?
-
С чем связаны восстановительные свойства металлов?
-
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
-
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
-
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Летняя перезагрузка
Бесплатный телеграм-марафон для мам и пап. Узнайте, как провести семейное лето с пользой, и подготовьтесь к нему уже сейчас!

Общие химические свойства металлов — урок. Химия, 9 класс
Среди металлов традиционно выделяют несколько групп. Входящие в их состав представители характеризуются отличной от других металлов химической активностью. Такими группами являются:
- благородные металлы (серебро, золото, платина);
- щелочные металлы (металлы, образованные элементами (I)А группы периодической системы);
- щелочноземельные металлы (кальций, стронций, барий, радий).
Простые вещества, обладающие металлическими свойствами, в химических реакциях всегда являются восстановителями. Положение металла в ряду активности характеризует то, насколько активно данный металл способен вступать в химические реакции (т. е. то, насколько сильно у него проявляются свойства восстановителя).
| (Li, K, Ba, Ca, Na, ) | (Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb) | H2 | (Cu, Hg, Ag, Pt, Au) |
1. В ряду активности восстановительные свойства металлов снижаются. Самые сильные восстановительные свойства у первых металлов ряда.2. Более активный металл может вытеснить из растворов солей металлы, расположенные в ряду активности после него.3. Металлы, расположенные в ряду активности до водорода, вытесняют его из растворов кислот.
4. Щелочные и щелочноземельные металлы в водных растворах сначала вступают в реакцию с водой.
Общие химические свойства металлов
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды.
Металл + кислород → оксид.
Например, при взаимодействии магния с кислородом образуется оксид магния:
2Mg0+O02→2Mg+2O−2.
Видеофрагмент:
| Горение магния в воздухе |
Обрати внимание!
Серебро, золото и платина с кислородом не реагируют.
2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом и иодом), образуя галогениды.
Металл + галоген → галогенид металла.
Например, при взаимодействии натрия с хлором образуется хлорид натрия:
2Na0+Cl02→2Na+1Cl−1.
3. Металлы взаимодействуют с серой, образуя сульфиды.
Металл + сера → сульфид металла.
Например, при взаимодействии цинка с серой образуется сульфид цинка:
Zn0+S0→Zn+2S−2.
Видеофрагмент:
| Взаимодействие цинка с серой |
4. Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
- Например, при взаимодействии лития с азотом образуется нитрид лития:
- 6Li0+N02→2Li+13N−3.
- При взаимодействии кальция с фосфором образуется фосфид кальция:
- 3Ca0+2P0→Ca+23P−32.
- Взаимодействие со сложными веществами
1. Щелочные и щелочноземельные металлы взаимодействуют с водой при обычных условиях, образуя растворимое в воде основание (щёлочь) и водород.
Активный металл + вода → щёлочь + водород.
Например, при взаимодействии натрия с водой образуются гидроксид натрия и водород:
2Na0+2H+12O−2→2Na+1O−2H+1+H02.
Видеофрагмент:
| Взаимодействие натрия с водой |
Обрати внимание!
Некоторые металлы средней активности реагируют с водой при повышенной температуре, образуя оксид металла и водород.
Например, раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe3O4 и водород:
3Fe0+4H+12O−2→Fe+2O−2⋅Fe+32O−23+4H02.
2. Mеталлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот, образуя соль и водород.
Металл + кислота → соль + водород.
Например, при взаимодействии алюминия с серной кислотой образуются сульфат алюминия и водород:
2Al0+3H+12S+6O−24→Al+32(S+6O−24)3+3H02.
Видеофрагмент:
| Реакция алюминия с серной кислотой |
3. Металлы реагируют с солями менее активных металлов в растворе, образуя соль более активного металла и менее активный металл в свободном виде.
Более активный металл + соль → соль более активного металла + менее активный металл.
Например, при взаимодействии железа с сульфатом меди((II)) образуются сульфат железа((II)) и медь:
Fe0+Cu+2S+6O−24→Fe+2S+6O−24+Cu0.
Видеофрагмент:
| Взаимодействие железа с сульфатом меди |
Химические свойства металлов
Все металлы, в зависимости от их окислительно-восстановительной активности объединяют в ряд, который называется электрохимическим рядом напряжения металлов (так как металлы в нем расположены в порядке увеличения стандартных электрохимических потенциалов) или рядом активности металлов:
Li, K, Ва, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Рt, Au
Наиболее химически активные металлы стоят в ряду активности до водорода, причем, чем левее расположен металл, тем он активнее. Металлы, занимающие в ряду активности, место после водорода считаются неактивными.
Взаимодействие с простыми веществами
- Металлы способны реагировать с простыми веществами, такими как кислород (реакция горения), галогены, азот, сера, водород, фосфором и углеродом. В реакцию взаимодействия с кислородом вступают все металлы (исключение составляют Au, Pt), в результате чего возможно образование трех различных продуктов — пероксидов, оксидов и надпероксидов:
- 4Li + O2 = 2Li2O (оксид лития)
- 2Na + O2 =Na2O2 (пероксид натрия)
- K + O2 = KO2 (надпероксид калия)
- Металлы средней активности (начиная с Al) и неактивные металлы реагируют с кислородом только при нагревании:
- 2Al + 3/2 O2 = Al2O3
- 2Cu + O2 = 2CuO
В реакцию взаимодействия с азотом способны вступать только активные металлы, в результате чего образуются азиды, причем при н.у. с азотом реагирует только литий, остальные активные металлы – только при нагревании:
- 6Li + N2 = 2Li3N (азид лития)
- Только активные металлы способны взаимодействовать с углеродом и водородом, причем в случае реакции с водородом – это только щелочные и щелочноземельные металлы:
- 2Li+2C = Li2C2 (карбид лития)
- 2Na + H2 = NaH (гидрид натрия)
- С серой реагируют все металлы кроме Au и Pt:
- 2K +S = K2S (сульфид калия)
- Также металлы способны взаимодействовать с галогенами и фосфором:
- 2Na + Cl2 = 2NaCl (хлорид натрия)
- 3Ca + 2P = Ca3P2 (фосфид кальция)
Все реакции взаимодействия с простыми веществами носят окислительно-восстановительный характер, металлы в них окисляются, проявляя свойства восстановителей, т.е. демонстрируют способность отдавать электроны:
- Fe + S = FeS
- Fe -2e = Fe2+ процесс окисления, железо — восстановитель
- S +2e = S2- процесс восстановления, сера – окислитель
Взаимодействие металлов друг с другом
Металлы взаимодействуют друг с другом, образуя интерметаллические соединения:
3Cu + Au = Cu3Au
Взаимодействие металлов с водой
- Активные металлы (щелочные и некоторые щелочноземельные металлы — Ca, Sr, Ba) способны взаимодействовать с водой с образованием гидроксидов:
- Ba + 2H2O = Ba(OH)2 + H2↑
- 2Na + 2H2O = 2NaOH + H2↑
- Металлы, характеризующиеся средней активностью (начиная с Al) вступают в реакцию с водой в более жестких условиях (наличие щелочной или кислотной среды и др. условия); при этом образуется соответствующий оксид и выделяется водород:
- Pb + H2O = PbO + H2↑
- Неактивные металлы с водой не реагируют.
- Реакции взаимодействия металлов с водой также относятся к ОВР и металлы в них являются восстановителями.
Взаимодействие металлов с кислотами
- Металлы, стоящие в ряду активности до водорода способны реагировать с кислотами:
- 2Al + 6HCl = 2AlCl3 + 3 H2↑
- Zn + 2HCl = ZnCl2 + 2H2↑
- Fe + H2SO4 = FeSO4 + H2↑
- Неактивные металлы взаимодействуют с кислотами при особых условиях. Так, концентрированная серная кислота способна растворять медь (1), а при взаимодействии меди с концентрированной азотной кислотой в зависимости от её концентрации (60% или 30%) образуются различные продукты реакции (2, 3):
- Cu + 2H2SO4 = CuSO4 + SO2↑ +2H2O (1)
- Cu + 4HNO3(60%) = Cu(NO3)2 + 2NO2↑ + 2H2O
- 3Cu +8HNO3(30%) = 3Cu(NO3)2 + 2NO↑ + 4H2O
Взаимодействие металлов с солями
Более активные металлы способны взаимодействовать с солями, образованными менее активными металлами, и вытеснять их (металлы) из солей:
3Na + AlCl3 = 3NaCl + Al
Примеры решения задач
§ 44. Общие химические свойства металлов
Общие химические свойства металлов
По химическим свойствам металлы являются восстановителями, так как легко отдают свои электроны атомам неметаллов, превращаясь в положительно заряженные ионы — катионы.
Способность атомов металлов отдавать, а их катионов — присоединять электроны может служить мерой их химической активности.
Так, алюминий на воздухе очень быстро покрывается оксидной плёнкой, а с золотом заметных изменений не происходит. Цинк активно взаимодействует с соляной кислотой, а серебро — нет.
Поэтому алюминий и цинк можно отнести к активным металлам, а золото и серебро — к неактивным.
Ряд активности металлов
Химическую активность разных металлов легко сопоставить, анализируя их поведение в водных растворах солей и кислот.
Например, если в раствор сульфата меди(II) опустить цинковую пластинку или железный гвоздь, то практически сразу же на их поверхности появляется красноватый налёт меди.
Это свидетельствует о том, что цинк и железо вытесняют медь из раствора. Эти процессы можно представить следующими уравнениями:
- Zn + CuSО4 = ZnSО4 + Сu↓,
- Zn0 + Сu2+ = Zn2+ + Cu0;
- Fe + CuSО4 = FeSО4 + Сu↓,
- Fe0 + Cu2+ = Fe2+ + Сu0.
В этих реакциях цинк и железо отдают свои электроны ионам меди, то есть они окисляются. Ионы меди принимают электроны, поэтому медь восстанавливается.
Если поступить наоборот и в раствор сульфата цинка поместить медную пластинку, то на ней не произойдёт осаждения цинка. В чём тут причина?
Экспериментальным путём, изучая способность одних металлов вытеснять другие из водных растворов их солей, русский учёный Н. Н. Бекетов расположил металлы в ряд. В нём металлы, находящиеся левее, способны восстанавливать последующие из растворов их солей. Поскольку эта способность металлов связана с их восстановительной активностью, то этот ряд получил название ряда активности металлов.
Ряд активности металлов
Li K Ba Sr Cа Na Mg Al Mn Zn Cr Fe Ni Sn Pb (H2) Cu Hg Ag Pd Pt Au
Чем левее в этом ряду расположен металл, тем большими восстановительными свойствами в водном растворе он обладает, то есть легче отдаёт свои электроны окислителю и переходит в виде катиона в раствор; тем труднее катион этого металла восстанавливается. Цинк и железо легче отдают свои электроны, чем медь, и поэтому восстанавливают Cu2+ из раствора.
- По положению цинка в ряду активности можно прогнозировать, что этот металл способен восстановить из раствора ионы олова, меди и серебра:
- Zn0 + Sn2+ = Zn2+ + Sn0;
- Zn0 + Сu2+ = Zn2+ + Cu0;
- Zn0 + 2Ag+ = Zn2+ + 2Ag0.
- В то же время медь будет восстанавливать только ионы серебра, но не восстановит ионы олова:
- Cu0 + 2Ag+ = Cu2+ + 2Ag0.
Это означает, что цинк обладает большей восстановительной способностью. Он легче отдаёт электроны, чем олово, медь и серебро. Поэтому цинк считается более активным металлом, чем эти металлы. В свою очередь, медь — более активный металл, чем серебро.
Ряд активности металлов позволяет не только прогнозировать поведение металлов в реакциях с растворами солей, но и сравнивать их отношение к воде, растворам кислот, а также к неметаллам и ряду других веществ.
Так, слева от водорода расположены металлы, которые вытесняют водород из воды и кислот (то есть восстанавливают ионы водорода Н+). Металлы, расположенные справа от водорода, такой восстановительной активности в реакциях с растворами кислот не проявляют. Например, цинк реагирует с соляной кислотой, вытесняя водород:
- Zn + 2НСl = ZnCl2 + Н2↑,
- Zn0 + 2Н+ = Zn2+ + ,
- а серебро водород не вытесняет.
Взаимодействие металлов с простыми и сложными веществами
К общим химическим свойствам металлов относят их реакции с неметаллами, водой, кислотами, солями. Для некоторых металлов также характерны реакции с растворами щелочей. Часть металлов вступает в реакции с органическими веществами.
Многие перечисленные взаимодействия вам известны из предыдущих глав пособия. Кроме того, вы изучали химические свойства металлов в 9-м классе. Поэтому на данном этапе обучения мы систематизируем известные вам свойства, составив таблицу 31.
Таблица 31. Общие химические свойства металлов
| Реагенты и уравнения реакций | Особенности взаимодействия с металлами |
| Неметаллы | Образуют бинарные соединения: оксиды, гидриды, нитриды, галогениды. Реакции протекают как при обычных условиях, так и при нагревании |
|
Вода |
|
|
Щелочные металлы реагируют с кислотами-окислителями HNO3(конц), H2SO4(конц) со взрывом. Pb пассивируется в разбавленных HCl, H2SO4. Напомним, что при взаимодействии металлов с кислотами-окислителями HNO3(конц) и H2SO4(конц) водород не выделяется, а образуются продукты восстановления азота и серы |
|
В водных растворах металлы s-элементов, обладая сильными восстановительными свойствами, вытесняют из воды водород, а не ионы менее активных металлов из солей. Остальные металлы реагируют в соответствии с положением в ряду активности |
| Растворы щелочей | В такие реакции вступают цинк, алюминий, бериллий |
Отметим, что с водой при нормальных условиях взаимодействуют все металлы s-элементов, кроме бериллия и магния. Магний реагирует с водой при нагревании. Алюминий взаимодействует с водой при комнатной температуре, но только после удаления с его поверхности плёнки оксида алюминия.
При этом образуются гидроксиды металлов. Остальные металлы от марганца до водорода в ряду активности взаимодействуют с парами воды при нагревании, образуя, как правило, оксиды металлов. Металлы, находящиеся в ряду напряжений после водорода, не взаимодействуют с водой ни при каких условиях.
Активные металлы (Na, K) вступают в реакции с карбоновыми кислотами, спиртами, фенолами.
Положение металла в ряду активности металлов позволяет прогнозировать его поведение в окислительно-восстановительных реакциях, протекающих в водных растворах.
Атомы металлов во всех химических превращениях являются восстановителями.
Металлы в химических превращениях являются восстановителями и легко отдают свои электроны, превращаясь в положительно заряженные ионы — катионы.
Активность металлов в окислительно-восстановительных реакциях, протекающих в водных растворах, определяется по их положению в ряду активности: чем левее в этом ряду расположен металл, тем большими восстановительными свойствами он обладает и тем труднее катионы этого металла восстанавливаются.
Более активные металлы восстанавливают менее активные металлы из растворов их солей. Металлы, стоящие в ряду напряжений левее водорода, вытесняют его из разбавленных кислот (кроме азотной). Металлы s-элементов, за исключением бериллия и магния, вытесняют водород из воды при обычной температуре.
- Назовите характерные для металлов физические свойства.
- Перечислите p-элементы, которые относятся к элементам-металлам.
- Расставьте коэффициенты в уравнении реакции методом электронного баланса: Cu + HNO3(разб) → Cu(NO3)2 + NO↑ + H2O.
- Составьте уравнения возможных химических реакций с учётом, что медь окисляется до степени окисления +2:
- а) Ag + НСl →; б) Сu + Hg(NО3)2 → ;
- в) Mg + H2SО4(pазб) →; г) Ni + NaCl → ;
- д) Zn + АgNО3 → ; е) Au + H2O → .
- Составьте уравнения реакций взаимодействия цинка с неметаллами (O2, P), кислотами (разбавленными HCl, H2SO4), с растворами щелочей (NaOH, KOH), с солями (AgNO3, Pb(NO3)2).
- Цинк массой 1,3 г растворили в концентрированном растворе гидроксида натрия. Рассчитайте объём выделившегося газа.
- Составьте уравнения реакций, которые могут протекать на поверхности активного металла, например лития, на воздухе.
- Укажите, как изменится масса цинковой пластинки (увеличится, уменьшится, не изменится) при погружении её на небольшое время в раствор: 1) серной кислоты; 2) гидроксида натрия; 3) сульфата магния; 4) сульфата меди(II); 5) нитрата серебра(I).
- Определите объём водорода, который выделится при взаимодействии 260 г цинка с раствором серной кислоты объёмом 250 см3. Массовая доля H2SO4 равна 15 %, плотность — 1,1 г/см3.
- Железную пластинку массой 90 г погрузили в раствор медного купороса. Через некоторое время её вынули, промыли, высушили и взвесили. Масса стала равна 92,4 г. Определите массу прореагировавшего железа и массу меди, осевшей на пластинке.
*Самоконтроль
1. В порядке увеличения восстановительной активности металлы расположены в ряду:
- а) Mg, Ca, Na;
- б) Cu, Ag, Hg;
- в) Cа, K, Cs;
- г) Zn, Al, Pb.
2. Реагируют с растворами щелочей:
- а) Zn;
- б) Ca;
- в) Al;
- г) Be.
3. Реагируя с парами воды, образуют оксиды:
- а) Li;
- б) Ag;
- в) Fe;
- г) Zn.
4. Масса цинковой пластинки увеличится при погружении её в раствор:
- а) Hg(NO3)2;
- б) Cu(NO3)2;
- в) AgNO3;
- г) HNO3.
5. На растворение 13 г цинка требуется раствор, содержащий гидроксид натрия массой (г):
- а) 40;
- б) 20;
- в) 16;
- г) 4.






