- Обсуждение: «Кислоты — окислители»
- Кислоты в химии — реакции, свойства и примеры
- Диссоциация
- Разложение
- Взаимодействие кислот с металлами
- Таблица: химические свойства кислот-окислителей
- Взаимодействие кислот с солями
- Взаимодействие кислот с основными и амфотерными оксидами
- Восстановительные свойства бескислородных кислот
- Способность окрашивать индикаторы
- Вопросы для самоконтроля
- 2.6. Характерные химические свойства кислот
- 1) Наличие атомов кислорода в кислоте
- 2) Основность кислоты
- 3) Летучесть
- 4) Растворимость
- 5) Устойчивость
- 6) Способность к диссоциации
- 7) Окисляющие свойства
- Химические свойства кислот
- 1. Способность к диссоциации
- 2. Взаимодействие кислот с металлами
- 3. Взаимодействие кислот с основными и амфотерными оксидами
- 4. Взаимодействие кислот с основаниями и амфотерными гидроксидами
- 5. Взаимодействие кислот с солями
- 6. Специфические окислительные свойства азотной и концентрированной серной кислот
- 7. Восстановительные свойства бескислородных кислот
- Характерные химические свойства кислот
- Общая характеристика
- Классификация:
- Физические свойства
- Химические свойства
- Изменение цвета индикаторов
- Взаимодействие кислот с металлами
- Взаимодействие кислот с основными и амфотерными оксидами
- Взаимодействие кислот с основными и амфотерными гидроксидами
- Взаимодействие кислот с солями
- Разложение кислородсодержащих кислот
- Взаимодействие кислот с оксидами металлов
- Давайте рассмотрим свойства
- и продукты их реакций
- Автор статьи — Саид Лутфуллин
- Свойства концентрированной серной кислоты — окислителя
Концентрированная серная кислота – бесцветная тяжелая маслянистая нелетучая жидкость. Не имеет запаха и тянет сказать: «без вкуса», но вкус у нее все же есть, пробовать не советую.
Разбавленная серная кислота ничем особым непримечательна. Свойства как и у других кислот. За исключением того, что она не реагирует со свинцом, так как образующийся сульфат свинца нерастворим. Нерастворимое вещество покрывает кусочек металла и «защищает его от реакции»
- Pb + H2SO4 ≠
- А вот концентрированная серная кислота – сильный окислитель (за счет атома серы в высшей степени окисления).
- Раз сера – окислитель, то она будет восстанавливаться:
- Глубина восстановления серы зависит от активности восстановителя:
- сильные восстановители восстанавливают серную кислоту до H2S,
- слабые — до SO2,
- восстановители средней активности – до S.
На практике образуются несколько продуктов в разных пропорциях. Преобладание того или иного продукта зависит от множества факторов: от вышеупомянутой активности восстановителя, температуры, концентрации кислоты (95%, 90%. 85%, 80%, 75% – это все концентрированная кислота). Но в реалиях школьной программы все схематично и пишем один единственный продукт.
1. Взаимодействие металлов в концентрированной серной кислотой.
Концентрированная серная кислота реагирует с металлами, даже стоящими после водорода. Но кроме платины и золота – эти металлы слишком малоактивны.
Схема этих реакций:

- Активные металлы восстанавливают серную кислоту до H2S:
8Li + 5H2SO4 конц → 4Li2SO4 + H2S ↑ + H2O
4Mg + 5H2SO4 конц → 4MgSO4 + H2S ↑ + H2O
- Металлы средней активности восстанавливают серную кислоту до S:
3Mn + 4H2SO4 конц → 3MnSO4 + S ↓ + 4H2O
3Zn + 4H2SO4 конц → t→ 3ZnSO4 + S ↓ + 4H2O
- Малоактивные металлы восстанавливают серную кислоту до SO2:
Cu + 2H2SO4 конц → CuSO4 + SO2 ↑ + 2H2O
2Ag + 2H2SO4 конц → Ag2SO4 + SO2 ↑ + 2H2O
Некоторые металлы (конкретно нужно запомнить — Fe, Al, Cr) при контакте с концентрированной серной кислотой покрываются защитной пленкой – и реакция не идет. Поэтому серную кислоту без всякой опасности перевозят в железных цистернах. Это явление называют пассивацией.
То, что железо, алюминий и хром пассивируются не означает, что реакция невозможна. Просто нужно нагреть – при нагревании от защитной пленки не остаётся и следа:

2. Взаимодействие неметаллов с концентрированной серной кислотой.
Не все неметаллы реагируют с концентрированной серной кислотой: лишь те, что проявляют восстановительные свойства. Поэтому кислород, азот и галогены не вступают в эти реакции.
Мы рассмотрим взаимодействие с фосфором, углеродом, бором, серой. Неметаллы – не такие активные восстановители как типичные металлы – поэтому серная кислота восстанавливается до SO2.
- Неметалл окисляется до высшей степени окисления: образуется оксид. Поскольку оксид неметалла – кислотный, то он тут же в момент получения реагирует с водой и образуется кислота:
- 2P + 5H2SO4 конц → 2H3PO4 + 5SO2 ↑+ 2H2O
- 2B + 3H2SO4 конц → 2H3BO3 + 3SO2 ↑
- Угольная кислота не образуется – получается углекислый газ:
- C + 2H2SO4 конц → CO2 ↑ + 2SO2 ↑+ 2H2O
- Концентрированная серная кислота окисляет серу:

3. Взаимодействие концентрированной серной кислоты с галогенидами.
Галогениды металлов – это соли галогеноводородов (HF, HCl, HBr, HI). Галогеноводороды – летучие кислоты, а HF еще к тому же и слабая.
- Поэтому серная кислота их вытесняет из солей:
- 2KF тв + H2SO4 конц → K2SO4 + 2HF↑
- 2NaCl тв + H2SO4 конц → Na2SO4 + 2HCl↑
Соли нужно брать твердые, не раствор. Тогда галогеноводороды будут вытесняться в виде газов.
А к фториду можно и в раствор прилить кислоты, так как фтороводородная кислота – слабая, она вытеснится. Только останется в растворе, вот и вся разница.
- С хлоридами и фторидами происходит простая реакция обмена, без изменения степеней окисления.
- Галоген окисляется до простого вещества. Сера восстанавливается:
-

А вот бромиды и иодиды – восстановители. После вытеснения галогеноводорода он тут же окисляется. Поэтому реакции концентрированной серной кислоты с бромидами и иодидами протекают с изменением степеней окисления.
- Бромоводород и иодоводород окисляются так же, как и их соли:
- 2HBr + H2SO4 конц → Br2 + SO2 ↑ + 2H2O
- 8HI + H2SO4 конц → 4I2 ↓+ H2S ↑ + 4H2O
- Азотная кислота — окислитель.
- Производство.
- Сырье для производства азотной кислоты – аммиак. Три последовательные реакции окисления:
- 1. Каталитическое окисление аммиака:
- 4NH3+5O2 → кат., t°→ 4NO+6H2
- Реакция экзотермическая, необратимая.
- 2. Окисление NO до NO2:
- 2NO+O2→2NO2
- Реакция экзотермическая, обратимая.
- 3. Поглощение NO2 водой и одновременно его окисление:
Реакция экзотермическая, обратимая – по этой же схеме азотная кислота разлагается при хранении. Поэтому с течением времени прозрачная изначально азотная кислота буреет. Бурый цвет кислоте придает, образующийся при разложении NO2.
Если растворять NO2 в воде без доступа кислорода, то азот диспропорционирует:
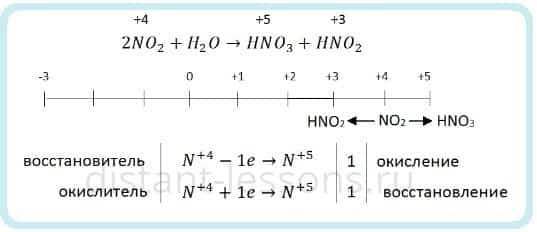
Поэтому оксид азота (IV) NO2 мы относим к кислотным. Хоть у него и нет соответствующей кислоты, при растворении его в воде образуются HNO3 и HNO2.
Азотная кислота – жидкость с резким запахом. Свежая азотная кислота бесцветная. При хранении она разлагается и за счет бурого NO2 приобретает желтоватый цвет.
Важно знать, что азотная кислота летучая, легкокипящая, поэтому и имеет запах. А раз она летучая, то ее можно вытеснить из соли нелетучей кислотой, например, концентрированной серной:
NaNO3 тв + H2SO4 → t → NaHSO4 + HNO3 ↑
Важно, чтобы нитрат был твердым, а серная кислота концентрированная – меньше воды. Чтобы азотная кислота испарялась, испаряется – значит покидает реакционную смесь, значит реакция идет до конца.
Химические свойства.
Свойства азотной кислоты в целом повторяют свойства концентрированной серной. Но с одной поправкой, в отличие от серной, азотная кислота и концентрированная, и разбавленная проявляет сильные окислительные свойства.
1. Взаимодействие с металлами.
До чего может восстанавливаться азот? Вспомним диаграмму степеней окисления азота:

Получиться может любой из этих продуктов. А на практике – несколько сразу. Мы рассмотрим упрощенный вариант: берем только преобладающий продукт и только два фактора, влияющие на глубину восстановления:
- Активность металла – чем активнее, тем глубже идет восстановление.
- Концентрация кислоты – разбавленная кислота восстанавливается глубже.
- Еще больше упрощая берем только четыре продукта: NH4NO3, N2O, NO, NO2.
- Наиболее глубокое восстановление дает разбавленная кислота и активный металл – NH4NO3.
- 4Ca + 10HNO3 разб → 4Ca(NO3)2 + NH4NO3 + 3H2O
Соответственно при взаимодействии концентрированной кислоты и малоактивного металла образуется NO2. Самое неглубокое восстановление.
Cu + 4HNO3 конц → Cu(NO3)2 + 2NO2 ↑+ 2H2O
Теперь нужно определить в каком случае будет N2O, а в каком NO. Фактор активности металла – решающий. С активным металлом и концентрированной кислотой будет N2O. А с малоактивным металлом и разбавленной кислотой образуется NO.
- 8Na + 10HNO3 конц → 8NaNO3 + N2O ↑ + 5H2O
- 3Cu + 8HNO3 разб → 3Cu(NO3)2 + 2NO ↑ + 4H2O

-
Концентрированная азотная кислота пассивирует Fe, Cr, Al, как и концентрированная серная.
- Чтобы провести реакцию нужно нагреть:
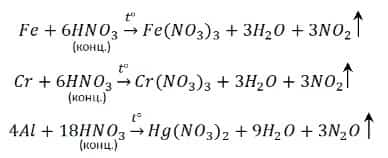
- С разбавленной кислотой эти металлы реагируют и без нагревания:
2. Взаимодействие с неметаллами (C, P, B, S).
Неметаллы окисляются до высших кислот. Реагирует и концентрированная, и разбавленная азотная кислота. Неметаллы – не очень хорошие восстановители, поэтому кислота восстанавливается как в реакции с малоактивными металлами (образуются N2O и NO2).
-
В отличие от серной кислоты, очень концентрированная азотная кислота (безводная) окисляет при нагревании иод до иодноватой кислоты (HIO3): - I2 + 10HNO3 конц → t → 2HIO3 + 10NO2 ↑ + 4H2O
3. Взаимодействие с галогенидами.
Эти реакции могут запутать, хотя ничего сложного в них нет. Вам нужно просто понять логику каждой из них.
На что следует опираться:
- Реакции могут быть либо окислительно-восстановительными, либо обменными.
- Помним, что фториды (F–) и хлориды (Cl–) – восстановители плохие, если быть точнее, то никакие. А бромиды (Br–) и иодиды (I–) – хорошие восстановители.
- HF – слабая кислота, HCl, HBr, HI – сильные.
- Фториды металлов – это соли слабых кислот, поэтому сильная азотная кислота вытесняет фтороводород. И не важно концентрированная или разбавленная – это простая реакция обмена/p>
- KF + HNO3 → HF + KNO3
Фтороводород не реагирует с азотной кислотой. Реакция обмена невозможна и окислительно-восстановительная тоже: фторид – слабый восстановитель.
Хлориды металлов и хлороводород не реагируют с азотной кислотой. Хлорид ион – слабый восстановитель – не возможна ОВР. Хлориды металлов не реагируют, потому что соляная кислота – сильная (предыдущая плавиковая – слабая, если помните).
Бромиды и иодиды вступают с азотной кислотой в окислительно-восстановительное взаимодействие. Сами окисляются до простых веществ. Азотная кислота восстанавливается до NO2 если концентрированная, разбавленная – до NO, то есть так, как будто взаимодействует с малоактивным металлом.
Обсуждение: «Кислоты — окислители»
(Правила комментирования)
Кислоты в химии — реакции, свойства и примеры
Кислоты — это сложные химические вещества, состоящие из одного или нескольких атомов водорода, способных замещаться атомами металла, и кислотных остатков.
Кислоты проявляют ряд общих химических свойств: диссоциацию и разложение, взаимодействуют с металлами, основаниями, солями, основными и амфотерными оксидами. Для ряда кислот характерны специфические свойства. Все кислоты имеют определенную окраску в индикаторах.
Рассмотрим подробнее общие свойства кислот.
Диссоциация
Кислоты — это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Диссоциация кислот происходит ступенчато. По способности к диссоциации кислоты разделяют на две группы:
-
Хорошо диссоциирующие (сильные): H2SO4, HCl, HBr, HNO3, HClO4, HI.
-
Малодиссоциирующие (слабые): H2CO3, H2SO3, H2SiO3.
H2SO4 = H+ +HSO4−
HSO4− = H+ + SO42−
Разложение
В результате реакций разложения кислородсодержащих кислот образуются кислотный оксид и вода. Бескислородные кислоты образуют простые вещества. Для разложения некоторых кислот необходимо нагревание или излучение (HCl, HNO3, H3PO4) другие же разлагаются самопроизвольно в момент образования (H2CO3, H2SO3, HNO2).
H2CO3 = CO2 + H2O
2HCl = H2 + Cl2
Взаимодействие кислот с металлами
Металл может вытеснять водород из кислоты только в том случае, если металл стоит левее водорода в ряду активности металлов. Продукты реакции — соль и водород.

- Mg + 2HCl = MgCl2 + H2
- Zn + H2SO4 = ZnSO4 + Н2
- При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Высокая окислительная способность серной и азотной кислот позволяет им вступать в реакции с металлами. Продукты реакции будут зависеть от активности металла и от концентрации кислот.
Таблица: химические свойства кислот-окислителей
| HNO3(разб) | NaNO3 + NH4NO3 +H2O | Mg(NO3)2 + в зависимости от концентрации +NO2, NO, N2O, N2, NH4NO3 + H2O | Al(NO3)3 + в зависимости от разбавления кислоты N2O, NH4NO3 + H2O | Zn(NO3)2 + в зависимости от концентрации +NO2, NO, N2O, N2, NH4NO3 + H2O | Fe(NO3)3 + NO + H2O | Cu(NO3)2 + NO + H2O |
| HNO3(конц) | NaNO3 + N2O + H2O | На холоду — пассивация | На холоду — пассивация | Cu(NO3)2 + NO2 + H2O | ||
| H2SO4(разб) | Na2SO4 + H2 | MgSO4 + H2 | При нагревании Al2(SO4)3 + H2 | ZnSO4 + H2 | При нагревании FeSO4 +H2 | Реакция не проходит |
| H2SO4(конц) | Na2SO4 + H2S + H2O | MgSO4 + H2S + H2O | На холоду — пассивация | ZnSO4 + SO2 + H2O | На холоду — пассивация | CuSO4 + SO2 + H2O |
| При нагревании Al2(SO4)3 + SO2 + H2O | При нагревании ZnSO4 +H2S + H2O | При нагревании Fe2(SO4)3 + SO2 + H2O |
Кислоты реагируют с основаниями и амфотерными гидроксидами, в результате образуются соль и вода. Взаимодействие кислот с основаниями называют реакцией нейтрализации.
NaOH + HCl = NaCl + H2O
Fe(OH)2 + 2HBr → FeBr2 + 2H2O
Взаимодействие кислот с солями
Сильные кислоты вытесняют слабые из растворов их солей, при этом образуются новая соль и новая кислота. Условие протекания реакции кислот с солями — одним из продуктов реакции должны быть нерастворимая соль или слабая кислота, вода, газ.
H2SO4 + BaCl2 = BaSO4↓ + HCl
HCl + CaCO3 = CaCl2 + H2O + CO2
Взаимодействие кислот с основными и амфотерными оксидами
Кислоты вступают в реакцию с основными и амфотерными оксидами (последние ведут себя как основные оксиды). В результате реакции образуется соль и вода.
ZnO + H2SO4 → ZnSO4 + H2O
2HCl + MgO = MgCl2 + H2O
Восстановительные свойства бескислородных кислот
- Бескислородные кислоты (кроме HF) проявляют восстановительные свойства за счет химического элемента, который входит в состав аниона, при действии на них различных окислителей.
- Например, в качестве окислителей для всех галогеноводородных кислот выступают диоксид марганца MnO2, перманганат калия KMnO4, дихромат калия K2Cr2O7.
- Результат этих реакций — образование свободных галогенов.
- 4HCl + MnO2 =MnCl2 + Cl2 + 2H2O
- 14HBr + K2Cr2O7 = 2CrBr3 + 3Br2 + 2KBr + 7H2O
- 16HI + 2KMnO4 = 2MnI2 + 5I2 + 2KI + 8H2O
Из галогеноводородных кислот наибольшая восстановительная активность — у йодоводородной.
Ее могут окислять оксид железа (III) и соль трехвалентного железа.
- 6HI + Fe2O3 = 2FeI2 + I2 + 3H2O
- Высокая восстановительная активность характерна для сероводородной кислоты, она может быть окислена диоксидом серы.
- 2H2S + SO2 = 3S + 2H2O
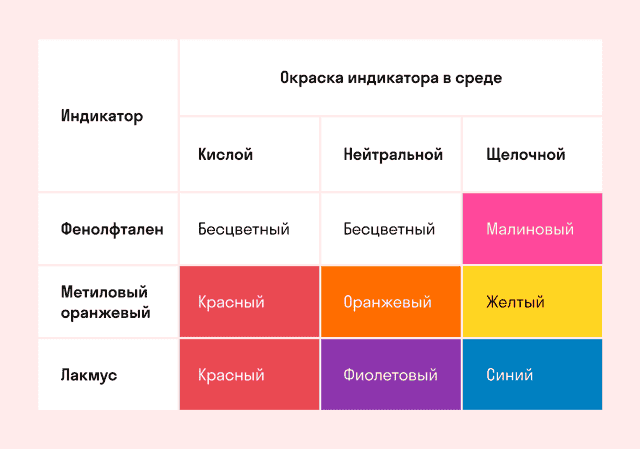
Способность окрашивать индикаторы
Индикаторы кислот — это специальные вещества, при помощи которых определяют наличие кислот в растворе.
Вопросы для самоконтроля
-
С чем реагируют кислоты?
-
При каких условиях кислоты взаимодействуют с солями? Приведите пример.
-
- Составьте уравнения реакций и назовите продукты реакций:
- Ca + HCl
- Na + H2SO4
- CaO + HNO3
- Fe2O3 + H2SO4
- KOH + HNO3
- Al(OH)3 + HF
- HNO3 + CaCO3
-
Разбавленный раствор серной кислоты реагирует с: медью, хлоридом меди, сульфатом меди, цинком?
-
- Соляная кислота вступает в реакцию с каждым из двух веществ:
- а. водой и цинком;
- б. магнием и оксидом серы (IV);
- в. железом и оксидом кальция;
г. сульфатом натрия и углеродом.
Все репетиторы Skysmart
Каталог проверенных преподавателей, которые помогут ребёнку влюбиться в предмет и достичь поставленных целей
2.6. Характерные химические свойства кислот
Кислоты можно классифицировать исходя из разных критериев:
1) Наличие атомов кислорода в кислоте
| Кислородсодержащие | Бескислородные |
| H3PO4,HNO3,HNO2,H2SO4,H3PO4,H2CO3,H2CO3, HClO4 все органические кислоты (HCOOH, CH3COOH и т.д.) | HF, HCl, HBr, HI, H2S |
2) Основность кислоты
Основностью кислоты называют число «подвижных» атомов водорода в ее молекуле, способных при диссоциации отщепляться от молекулы кислоты в виде катионов водорода H+, а также замещаться на атомы металла:
| одноосновные | двухосновные | трехосновные |
| HBr, HCl, HNO3, HNO2, HCOOH, CH3COOH | H2SO4, H2SO3, H2CO3, H2SiO3 | H3PO4 |
3) Летучесть
Кислоты обладают различной способностью улетучиваться из водных растворов.
| Летучие | Нелетучие |
| H2S, HCl, CH3COOH, HCOOH | H3PO4, H2SO4, высшие карбоновые кислоты |
4) Растворимость
| Растворимые | Нерастворимые |
| HF, HCl, HBr, HI, H2S, H2SO3, H2SO4, HNO3, HNO2, H3PO4, H2CO3, CH3COOH, HCOOH | H2SiO3, высшие карбоновые кислоты |
5) Устойчивость
| Устойчивые | Неустойчивые |
| H2SO4, H3PO4, HCl, HBr, HF | H2CO3, H2SO3 |
6) Способность к диссоциации
| хорошо диссоциирующие (сильные) | малодиссоциирующие (слабые) |
| H2SO4, HCl, HBr, HI, HNO3, HClO4 | H2CO3, H2SO3, H2SiO3 |
7) Окисляющие свойства
| слабые окислители (проявляют окислительные свойства за счет катионов водорода H+) | сильные окислители (проявляют окислительные свойства за счет кислотообразующего элемента) |
| практически все кислоты кроме HNO3 и H2SO4 (конц.) | HNO3 любой концентрации, H2SO4 (обязательно концентрированная) |
Химические свойства кислот
1. Способность к диссоциации
- либо в таком виде: HCl = H+ + Cl—
- либо в таком: HCl → H+ + Cl—
- По сути направление стрелки говорит нам о том, что обратный процесс объединения катионов водорода с кислотными остатками (ассоциация) у сильных кислот практически не протекает.
- В случае, если мы захотим написать уравнение диссоциации слабой одноосновной кислоты, мы должны использовать в уравнении вместо знака две стрелки . Такой знак отражает обратимость диссоциации слабых кислот — в их случае сильно выражен обратный процесс объединения катионов водорода с кислотными остатками:
- CH3COOH CH3COO— + H+
Многоосновные кислоты диссоциируют ступенчато, т.е. катионы водорода от их молекул отрываются не одновременно, а по очереди. По этой причине диссоциация таких кислот выражается не одним, а несколькими уравнениями, количество которых равно основности кислоты. Например, диссоциация трехосновной фосфорной кислоты протекает в три ступени с поочередным отрывом катионов H+ :
- H3PO4 H+ + H2PO4—
- H2PO4— H+ + HPO42-
- HPO42- H+ + PO43-
Следует отметить, что каждая следующая ступень диссоциации протекает в меньшей степени, чем предыдущая. То есть, молекулы H3PO4 диссоциируют лучше (в большей степени), чем ионы H2PO4— , которые, в свою очередь, диссоциируют лучше, чем ионы HPO42-. Связано такое явление с увеличением заряда кислотных остатков, вследствие чего возрастает прочность связи между ними и положительными ионами H+.
Из многоосновных кислот исключением является серная кислота. Поскольку данная кислота хорошо диссоциирует по обоим ступеням, допустимо записывать уравнение ее диссоциации в одну стадию:
H2SO4 2H+ + SO42-
2. Взаимодействие кислот с металлами
Седьмым пунктом в классификации кислот мы указали их окислительные свойства. Было указано, что кислоты бывают слабыми окислителями и сильными окислителями. Подавляющее большинство кислот (практически все кроме H2SO4(конц.
) и HNO3) являются слабыми окислителями, так как могут проявлять свою окисляющую способность только за счет катионов водорода.
Такие кислоты могут окислить из металлов только те, которые находятся в ряду активности левее водорода, при этом в качестве продуктов образуется соль соответствующего металла и водород. Например:
H2SO4(разб.) + Zn ZnSO4 + H2
2HCl + Fe FeCl2 + H2
Что касается кислот-сильных окислителей, т.е. H2SO4 (конц.) и HNO3, то список металлов, на которые они действуют, намного шире, и в него входят как все металлы до водорода в ряду активности, так и практически все после.
То есть концентрированная серная кислота и азотная кислота любой концентрации, например, будут окислять даже такие малоактивные металлы, как медь, ртуть, серебро.
Более подробно взаимодействие азотной кислоты и серной концентрированной с металлами, а также некоторыми другими веществами из-за их специфичности будет рассмотрено отдельно в конце данной главы.
3. Взаимодействие кислот с основными и амфотерными оксидами
- Кислоты реагируют с основными и амфотерными оксидами. Кремниевая кислота, поскольку является нерастворимой, в реакцию с малоактивными основными оксидами и амфотерными оксидами не вступает:
- H2SO4 + ZnO ZnSO4 + H2O
- 6HNO3 + Fe2O3 2Fe(NO3)3 + 3H2O
- H2SiO3 + FeO ≠
4. Взаимодействие кислот с основаниями и амфотерными гидроксидами
HCl + NaOH H2O + NaCl
3H2SO4 + 2Al(OH)3 Al2(SO4)3 + 6H2O
5. Взаимодействие кислот с солями
- Данная реакция протекает в случае, если образуется осадок, газ либо существенно более слабая кислота, чем та, которая вступает в реакцию. Например:
- H2SO4 + Ba(NO3)2 BaSO4↓ + 2HNO3
- CH3COOH + Na2SO3 CH3COONa + SO2↑ + H2O
- HCOONa + HCl HCOOH + NaCl
6. Специфические окислительные свойства азотной и концентрированной серной кислот
Как уже было сказано выше, азотная кислота в любой концентрации, а также серная кислота исключительно в концентрированном состоянии являются очень сильными окислителями. В частности, в отличие от остальных кислот они окисляют не только металлы, которые находятся до водорода в ряду активности, но и практически все металлы после него (кроме платины и золота).
Так, например, они способны окислить медь, серебро и ртуть.
Следует однако твердо усвоить тот факт, что ряд металлов (Fe, Cr, Al) несмотря на то, что являются довольно активными (находятся до водорода), тем не менее, не реагируют с концентрированной HNO3 и концентрированной H2SO4 без нагревания по причине явления пассивации — на поверхности таких металлов образуется защитная пленка из твердых продуктов окисления, которая не позволяет молекулами концентрированной серной и концентрированной азотной кислот проникать вглубь металла для протекания реакции. Однако, при сильном нагревании реакция все таки протекает.
В случае взаимодействия с металлами обязательными продуктами всегда являются соль соответствующего метала и используемой кислоты, а также вода. Также всегда выделяется третий продукт, формула которого зависит от многих факторов, в частности, таких, как активность металлов, а также концентрация кислот и температура проведения реакций.
Высокая окислительная способность концентрированной серной и концентрированной азотной кислот позволяет им реагировать не только практическим со всеми металлами ряда активности, но даже со многими твердыми неметаллами, в частности, с фосфором, серой, углеродом. Ниже в таблице наглядно представлены продукты взаимодействия серной и азотной кислот с металлами и неметаллами в зависимости от концентрации:
7. Восстановительные свойства бескислородных кислот
Все бескислородные кислоты (кроме HF) могут проявлять восстановительные свойства за счет химического элемента, входящего в состав аниона, при действии различных окислителей. Так, например, все галогеноводородные кислоты (кроме HF) окисляются диоксидом марганца, перманганатом калия, дихроматом калия. При этом галогенид-ионы окисляются до свободных галогенов:
- 4HCl + MnO2 MnCl2 + Cl2↑ + 2H2O
- 16HBr + 2KMnO4 2KBr + 2MnBr2 + 8H2O + 5Br2
- 14НI + K2Cr2O7 3I2↓ + 2Crl3 + 2KI + 7H2O
Среди всех галогеноводородных кислот наибольшей восстановительной активностью обладает иодоводородная кислота. В отличие от других галогеноводородных кислот ее могут окислить даже оксид и соли трехвалентного железа.
- 6HI + Fe2O3 2FeI2 + I2↓ + 3H2O
- 2HI + 2FeCl3 2FeCl2 + I2↓ + 2HCl
- Высокой восстановительной активностью обладает также и сероводородная кислота H2S. Ее может окислить даже такой окислитель, как диоксид серы:
- 2H2S + SO2 3S↓+ 2H2O
Характерные химические свойства кислот
Характерные химические свойства кислот добавить в закладки
Кислоты – это химические соединения, содержащие в себе положительный атом водорода (катион H+) и кислотный остаток (анион A-). Является сложным веществом.
Общая характеристика
В первую очередь кислоты различают по растворимости. Есть нерастворимые, растворимые и полурастворимые кислоты. Эти различия прописаны в таблице растворимости, так что наизусть запоминать не требуется.
Классификация:
- Кислоты различают по составу на кислородсодержащие и бескислородные. Примеры кислот приведены ниже в таблице. Бескислородные кислоты – это растворы галогеноводородов, атомы которых в растворе связаны полярной ковалентной связью. Название кислоты складывается из названия кислотного остатка в первую очередь, а дальше называется катион (водород). Так с хлором и водородом образуется хлороводородная кислота, а с серой – сероводородная. Кислородосодержащие кислоты, или оксокислоты называют за счёт наличия в них кислорода. Общего принципа построения названия этих кислот нет, так что их названия необходимо запоминать на память.
- Кислоты различают по количеству атомов водорода на одноосновные (один атом водорода), двухосновные (два атома водорода), трёхосновные (три атома водорода).
| Основность кислоты — это число активных атомов водорода в молекуле кислоты | |
| Одноосновные | HClO4, HCl |
| Двухосновные | H2SO4, H2CO3 |
| Трехосновные | H3PO4 |
- Кислоты разделяют на сильные и слабые. К сильным относят галогенводородные и высшие кислородсодержащие кислоты, они растворимы. К слабым относят неустойчивые и нерастворимые в воде кислоты. Чтобы определить силу кислоты, существует правило: из числа атомов кислорода вычесть число атомов водорода, если получаемое число 2 или 3 – кислота сильная, если 1 или 0 – кислота слабая.
Физические свойства
Кислоты, в зависимости от условий, могут быть в трёх агрегатных состояниях: в жидком, твёрдом и газообразном состоянии. Кислоты могут обладать цветом и запахом.
Химические свойства
Изменение цвета индикаторов
Кислота в водной среде способна изменить цвет разных индикаторов. Кислоты окрашивают в красных цвет лакмус, метилоранж и универсальный индикатор. Фенолфталеин не окрашивается.
Взаимодействие кислот с металлами
- Кислота способна реагировать только с металлами, находящимися левее водорода в ряду активности металлов.
- Mg + 2HCl → MgCl2 + H2↑
- Из приведенного выше химического уравнения нужно отметить, что при взаимодействии кислоты и металла происходит реакция замещения, образуется соль и выделяется H2.
Взаимодействие кислот с основными и амфотерными оксидами
- При взаимодействии кислоты с основным или амфотерным оксидами происходит реакция обмена в результате которой образуются соль и H2O.
- В качестве примера приведены следующие реакции:
- K2O + 2HNO3 → 2KNO3 + H2O Al2O3 + 6HCl → 2AlCl3 + 3H2O
- Из приведённого выше химического уравнения нужно отметить, что в реакциях основного оксида калия и амфотерного оксида алюминия (III) с кислотами, образуется соль и H2O.
Взаимодействие кислот с основными и амфотерными гидроксидами
При взаимодействии кислоты с основным и амфотерным гидроксидами образуются H2O и новая соль, как и в случае с оксидами, происходит реакция обмена. Второе название этой реакции — реакция нейтрализации.
KOH + HNO3 → KNO3 + H2O Al(OH)3 + 3HCl → AlCl3 + 3H2O
Из приведённой выше химического уравнения нужно отметить, что при реакции основного гидроксида калия и амфотерного гидроксида алюминия (III) с кислотами образуются соль и H2O.
Взаимодействие кислот с солями
Реакция кислоты с солью является реакцией обмена, так же ее называют реакцией нейтрализации. Она возможно только в случае выпадения соли в осадок, выделения газа, слабые электролиты или вода. Рассмотрим все случаи более подробно.
- Реакции, в результате которых выпадает осадок. H2SO4 + BaCl2 → BaSO4↓ + 2HCl Na2SiO3 + 2HNO3 → H2SiO3↓ + 2NaNO3 Из приведённого выше химического уравнения можно увидеть, что при взаимодействии кислоты и соли образуются новые кислота и нерастворимая соль, которые выпадают в осадок. Осадок может иметь различную окраску, плотность и консистенцию.
- Реакции, в результате которых при нагревании или обычных условиях выделяется газ. NaCl(тв.) + H2SO4 (конц.) → Na2SO4 + 2HCl↑ FeS + 2HCl → FeCl2 + H2S↑ Из приведённых выше химических уравнений нужно отметить, что при реакции соли с кислотой образуется новая соль и выделяется газ. Разберём одну из реакций: при взаимодействии твёрдого хлорида натрия с концентрированной хлороводородной кислотой образовалась натриевая соль серной кислоты и выделился летучий газ хлороводород.
- Реакции, в результате которых образуется слабый электролит. Такие реакции возможны только при условии, когда одним из реагентов сильный электролит. Для того, чтобы убедиться, что реакция будет протекать используют вытеснительный ряд: В этом ряду кислоты расположены так, что в растворах кислот и их солей могут в результате реакции вытесняют из раствора те, что стоят левее в ряду. Азотная и фосфорная кислоты находятся на одном месте в ряду, т.к. имеют одинаковые вытеснительные способности. Из приведённого выше химического уравнения нужно отметить, что хлороводородная кислота, которая находится в данном ряду левее, способна вытеснять кислотный остаток карбоновой кислоты, стоящей в ряду правее. Нужно учитывать, что карбоновая кислота слабая и при стандартных условиях она распадется на углекислый газ и воду. Углекислый газ выделяется из раствора, а вода остаётся.
Разложение кислородсодержащих кислот
В результате реакции разложения кислородсодержащих кислот всегда образуется вода и оксид.
Из приведённых выше реакций можно увидеть, что карбоновая легко разлагается при обычных условиях, так как является одной из самых слабой кислотой. Для разложения сернистой и кремниевой кислоты их растворы необходимо нагреть. Во всех трёх реакция в результате образуется вода и оксиды кислотных остатков.
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства солей: средних, кислых, оснóвных; комплексных ( на примере соединений алюминия и цинка)
- Взаимосвязь различных классов неорганических веществ
Взаимодействие кислот с оксидами металлов
Цель урока:
- Знакомство учащихся еще с одним свойством кислот — взаимодействие их с оксидами металлов: а) значение реакции обмена между кислотами и оксидами
б) очистка поверхности металла от ржавчины
- Проверить и закрепить полученные знания и умения: а) типы химических реакций
б) свойства кислот
- Обобщение полученных знаний.
- Закрепление знаний учащихся .
- Подготовка к практической работе.
Методы работы:
Беседа. Демонстрация опыта: взаимодействие серной кислоты с оксидом меди(II) . Лабораторные опыты. Взаимодействие соляной кислоты с оксидом магния. Демонстрация опыта. Пропускание оксида углерода (IV) через раствор серной кислоты. Обобщение и наблюдение.
Фронтальная беседа.
- Какие известные вам кислоты?
- Сравните свойства серной и соляной кислот.
- Какое правило нужно соблюдать при использовании серной кислоты в воде?
- Назовите общие свойства кислот. Ответ поясните примерами.
- Перед вами две кислоты: а) обратите внимание на их признаки; б) по этим признакам назовите каждую;
в) запишите их формулы.
- Приводятся формулы различных веществ: а) выпишите из них формулы кислот и назовите их. б) подчеркните формулы бескислородных кислот: Cu (OH)₂‚ HCl‚ CO₂‚ P₂O₅‚ H₃PO₄‚ KOH‚ H₂SO₄‚H₂S‚ Al₂O₃‚ H₂SO₃‚ CuSO₄‚ HNO₃.
в) определите валентность кислотных остатков.
- Пойдут ли реакции: а) между медью и соляной кислотой; б) между цинком и соляной кислотой; в) между железом и разбавленной серной кислотой?
Какой этот тип химической реакции?
- Какие известны еще типы химических реакции? Приведите примеры.
Урок начинается с постановки «проблем».
- Взаимодействуют ли кислоты с оксидами металлов, неметаллов?
- Как получить соль металла, не вытесняющего водород из кислоты? Объяснить на примере получения сульфата меди (II).
Решаем первый вопрос: будут ли реагировать кислоты с оксидами металлов? Демонстрация опыта. Взаимодействие оксида меди с серной кислотой.
Показать оксид меди, серную кислоту и предложить учащимся описать их свойства. Затем учитель наливает в стакан объемом 150-200мл. 20-25мл. серной кислоты(1:5), высыпает ложку оксида меди (II), перемешивает. Происходят ли какие изменения? Заметных изменений нет. Нагреваем. Что наблюдаем?
Раствор становится голубым, черный порошок на дне стакана растворился. Добавляем еще немного оксида и перемешиваем до полного его растворения. Добавление оксида меди прекращаем до того, когда новая порция не остается на дне стакана не растворившейся. И только тогда приливаем немного воды.
Что представляет собой раствор голубого цвета? Как выделить образовавшееся вещество из раствора?
- Показать фильтрование горячего раствора: а) приготовление фильтра.
б) правила фильтрования.
- Выпаривание филтрата в фарфоровой чашке.
- Обратить внимание на некоторые трудности выпаривания – соль разлетается, чтобы этого избежать, нужно особенно подчеркивать, что раствор надо перемешивать и выпаривать только до появления первых кристаллов, а не досуха.
- На доске записываем уравнение реакции:
- CuO+H₂SO₄= CuSO₄ + H₂O
- Можно ли отнести эту реакцию к одному из известных вам типов?
Атомы меди и водорода поменялись местами. Это реакция обмена. Реакцией обмена называются реакции между двумя сложными веществами, при которых они обмениваются своими составными частями.
- Вывод учащихся: при взаимодействии серной кислоты с оксидом меди, получается соль и вода.
- Могут ли другие кислоты реагировать с оксидами?
- Учащиеся выполняют лабораторные опыты:
- Взаимодействие соляной кислоты с оксидом железа (III).(оксид железа должен быть в виде буро-красного порошка. Темно-серая кристаллическая модификация почти не растворятся в кислотах).
- Взаимодействие оксида магния с соляной кислотой.
Учащиеся оформляют лабораторную работу.
Взаимодействие кислот с оксидами металлов.
| кислоты | оксиды | Условия реакции | Признаки реакции | Уравнение и тип реакции | Вывод. Название соли. |
| HCl | Fe₂O₃ | Нагревание | Изменение цвета(желтый раствор) | Fe₂O₃+6HCl=2FeCl₃+3H₂O (реакция обмена) | Оксид железа (III) реагируют с соляной кислотой, образуется хлорид железа (III) в растворе. |
| HCl | MgO | Нагревание | Получается бесцветный раствор | MgO+2 HCl=MgCl₂ + H₂O. Реакция обмена. | Оксид магния реагирует с соляной кислотой. Образуется соль хлорид магния в растворе. |
- Будут ли реагировать кислоты с оксидами неметаллов?
- Демонстрация опыта: Пропускание углекислого газа CO2 через раствор кислоты.
- Почернение лучинки, смоченной в кислоте после опыта, показывает, что кислота не изменилась.
- Учащиеся делают вывод: С кислотами взаимодействуют оксиды металлов, а оксиды неметаллов с кислотами не взаимодействуют.
- Практическое применение этих реакций:
- Используют для очистки поверхности металлов при различных покрытиях, в целях защиты металлов от разрушения. При травлении железа используют 5-10% раствор серной кислоты или 10% раствор соляной кислоты. Учащимся предлагают составить уравнения реакций, проходящих на поверхности железа при обработке его серной кислотой перед оцинкованием.
- Применение ингибиторов.
Самостоятельная работа учащихся:
1. Закончить уравнения химических реакций. Назвать полученные вещества:
| Mgo + HNO₃= | Na₂O + H₂SO₄= |
| Al₂O₃ + HCl= | ZnO + HNO₃= |
2. Какие четыре типа химических реакций вам известны? К какому из них относятся данные реакции:
- а) окисление простых веществ кислородом,
- б) восстановление металлов из их оксидов водородом,
- в) вытеснение металлом водорода из кислот,
- г) реакция между водородом и оксидами металлов?
- Приведение по одному примеру уравнений реакций каждого типа.
- На дом: §36 страница 74. Упражнение 3,4
19.03.2010






