- Задача 82
- Задача 84
- Задача 85
- Задача 86
- Задача 87
- Задача 88
- Видеоурок «Химические свойства металлов. Взаимодействие металлов с неметаллами»
- Химические свойства металлов — с чем реагируют? Свойства и таблица
- Ряд активности металлов
- Взаимодействие с кислотами
- Взаимодействие с солями
- Взаимодействие с аммиаком
- Взаимодействие с органическими веществами
- Взаимодействие металлов с оксидами
- Вопросы для самоконтроля
- Подведем итоги
- Таблица «Химические свойства металлов»
- Практический подход в обучении химии. Урок: "Общие химические свойства металлов"
- I. Вводное слово учителя
- II. Проверка домашнего задания
- III. Изучение нового материала
- Краткое содержание ответов экспериментальных групп
- IV. Выводы
- V. Домашнее задание
- Химические свойства металлов
- Взаимодействие с простыми веществами
- Взаимодействие металлов друг с другом
- Взаимодействие металлов с водой
- Взаимодействие металлов с кислотами
- Взаимодействие металлов с солями
- Примеры решения задач
- Цель урока: Повторить и обобщить общие химические свойства металлов с учетом их положения в ЭХРНМ. — презентация
Решение:
Щелочные металлы стоят в начале ряда напряжений металлов. Являясь наиболее активными, они легко окисляются кислородом воздуха уже при обычных температурах. Однако для каждого из указанных металлов есть свои особенности. Литий уже при обычных температурах реагирует как с кислородом воздуха, так и со вторым компонентом воздуха — азотом, образуя, соответственно, оксид и нитрид лития:
При высоких температурах вместо оксида лития образуется пероксид лития:
Натрий: а) при обычной температуре —
б) при высоких температурах —
б) при высоких температурах —
Задача 82
Основываясь на знании общих химических свойств металлов, написать уравнения следующих химических реакций:
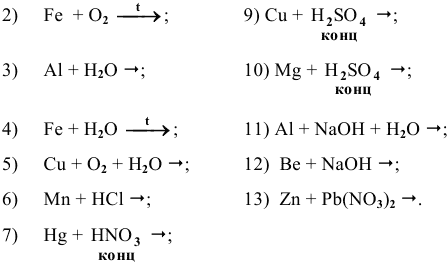
Решение:
5) Электрохимическая коррозия меди с кислородной деполяризацией:
- Задача 83
- С какими из следующих веществ может реагировать ртуть:
- Решение:
Задача 84
- Среди металлов: — найти наиболее и наименее сильный восстановитель:
- а) в водных средах;
- б) в неводных средах.
- Решение:
- В водных средах количественной характеристикой восстановительных свойств металла является величина его электродного потенциала.
Для изучаемых металлов величины стандартных электродных потенциалов следующие:
- Наиболее низкий электродный потенциал у кальция, значит, он наиболее сильный восстановитель в водных средах, а наиболее высокий электродный потенциал у цинка, значит, он наиболее слабый восстановитель среди перечисленных металлов.
- В неводных средах количественной характеристикой восстановительных свойств металла является величина его энергии ионизации.
- Величины энергий ионизации изучаемых металлов находим в справочнике:
Наиболее низкая энергия ионизации (ионизационный потенциал) у натрия — самого сильного восстановителя из перечисленных металлов, наиболее высокая энергия ионизации у цинка — самого слабого восстановителя.
Задача 85
- Составить и уравнять с помощью электронного баланса ОВ реакции.
- Решение:
- Ниже приводятся уравнения уже составленных и уравненных реакций:
Задача 86
- Каким методом может быть получен металлический магний?
- Решение:
- Магний — это очень активный металл, его электродный потенциал
Значит, магний может быть получен не электролизом водных растворов солей магния, а электролизом расплавов его солей, например электролизом расплава :
Магний также может быть получен металлотермией при использовании какого-либо металла, химическое сродство которого к атому, с которым он связан, выше, чем у магния, например:
Докажем возможность использования Na:
Так как , то реакция термодинамически возможна. Металлический натрий может быть использован для получения металлического магния из .
Задача 87
При смешивании расплавленных масс магния и свинца образуется интерметаллическое соединение, содержащее 81% РЬ. Какова его формула?
Решение:
— формула интерметаллического соединения в общем виде. Индексы х и у находим из следующих отношений:
Таким образом, формула интерметаллического соединения — .
Задача 88
Для определения процентного содержания серебра в старой монете растворили 0,3 г этой монеты в концентрированной . Затем из полученного раствора серебра осадили раствором соляной кислоты в виде осадка . Масса осадка равна 0,199 г. Каково содержание серебра в монете?
Решение:
Уравнения химических реакций, происходящих в ходе анализа, следующие:
Согласно уравнениям этих двух реакций, 1 моль образует 1 моль .
Рассчитаем массу серебра, соответствующую 0,199 г :
Вычислим процентное содержание серебра в монете:
- Эти задачи взяты со страницы решения задач по неорганической химии:
- Задачи с решением по неорганической химии
- Возможно эти страницы вам будут полезны:
Видеоурок «Химические свойства металлов. Взаимодействие металлов с неметаллами»
§ 1 Взаимодействие металлов с неметаллами
- В этом уроке мы рассмотрим взаимодействие металлов с неметаллами.
- Металлы проявляют восстановительные свойства, так как их атомы отдают свои электроны и образуют положительные ионы – катионы, а атомы неметаллов выступают в роли окислителей – принимают электроны.
- Взаимодействие металлов с галогенами (элементами седьмой группы главной подгруппы: фтором, хлором, бромом, иодом).

- При взаимодействии металлов с хлором образуются хлориды, например, если тонкую стальную проволоку накалить и опустить в колбу, заполненную газообразным хлором, проволока сгорает, образуя бурый хлорид железа (III).
- Запишем уравнение реакции: 2Fe + 3Cl2 = 2FeCl3 .
- Если высыпать в колбу с хлором порошок меди, он горит без нагревания с образованием хлорида меди (II). Уравнение этой реакции записывается так:
- Cu+Cl2 = CuCl2.
При взаимодействии металлов с бромом образуются бромиды, например, при смешивании порошок алюминия с бромом загорается, и образуется бромид алюминия. Уравнение этой реакции записывается так: 2Al + 3Br2 = 2AlBr3.
При взаимодействии металлов с иодом образуются иодиды, если взять смесь порошков цинка и иода (в соотношении 1:1) и капнуть из пипетки несколько капель воды, начнется бурная химическая реакция, в результате которой образуется иодид цинка. Уравнение этой реакции записывается так: Zn+I2=ZnI2. Вода в данной реакции является катализатором.
- Взаимодействие металлов с кислородом.
- С кислородом воздуха легко взаимодействуют щелочные и щелочноземельные металлы с образованием оксидов, пероксидов, поэтому их хранят под слоем керосина, а литий — в вазелиновом масле.
- При взаимодействии лития с кислородом образуется оксид лития.
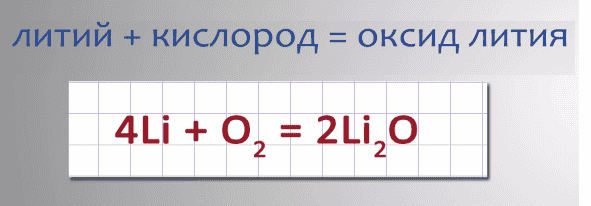
Запишем уравнение реакции: 4Li + O2 = 2Li2O.

Кальций на воздухе окисляется до оксида кальция, уравнение этой реакции записывается так: 2Ca+ O2 = 2CaO.
Химические реакции с менее активными металлами происходят при нагревании.
Например, для реакции кислорода с магнием необходимо порошок магния поджечь. Магний моментально сгорает ярким пламенем с образованием белого оксида магния.

Уравнение этой реакции записывается так: 2Mg+ O2 = 2MgO.
Это свойство магния – ярко гореть – используется в пиротехнике. Измельченный магний – составляющая смесей для фейерверков. Вспышку магния использовали фотографы 100 лет назад для освещения моделей.
Медь и другие менее активные металлы энергично окисляются кислородом только при нагревании. Если прокаливать медную проволоку на пламени спиртовки, она покрывается черным налетом оксида меди (II). Запишем уравнение этой реакции: 2Cu+O2 = 2CuO.
- Золото и платиновые металлы кислородом воздуха не окисляются.
- Взаимодействие металлов с другими неметаллами.
- При взаимодействии металлов с серой образуются сульфиды. Если смесь порошков цинка и серы поджечь, образуется сульфид цинка по следующему уравнению:
- Zn+ S= ZnS.
Сульфид ртути образуется при взаимодействии серы с ртутью, при комнатной температуре реакция идет очень медленно, при нагревании процесс ускоряется. Уравнение этой реакции: Hg+ S= HgS. Это соединение нелетучее и не растворяется в воде, поэтому его можно использовать при демеркуризации помещений.
Металлы могут реагировать с водородом с образованием гидридов, реакции протекают при нагревании. Например, уравнение реакции получение гидрида натрия: 2Na+ H2 = 2NaH.
§ 2 Краткий итог урока
Взаимодействие металлов с неметаллами происходит с образованием бинарных соединений: хлоридов, оксидов, бромидов, сульфидов и других.
Условия протекания химических реакций зависят как от активности металла, так и от активности неметалла.
Наиболее активные металлы (щелочные и щелочноземельные) вступают в реакции без нагревания, менее активные металлы реагируют только при нагревании. В результате химических реакций металлы отдают свои электроны, а неметаллы принимают.
Список использованной литературы:
- Габриелян О.С. Химия. 9 класс: учебник для общеобразовательных учреждений. — М.: Дрофа, 2010.
- Химия. 9 класс: Настольная книга учителя./О.С. Габриелян, И.Г. Остроумов. – М.: Дрофа, 2003.
- school-collection.edu.ru/catalog/res/55a4babd-d3a0-e5b4-6daa…/view/
Использованные изображения:
Химические свойства металлов — с чем реагируют? Свойства и таблица
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
| Li, K, Na, Ca, Ba | Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb | H2 | Cu, Hg, Ag, Pt, Au |
- Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
- 2Li + 2H2O = 2LiOH + H2
- Ca + 2H2O = Ca(OH)2 + H2
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
- Cr + H2O = Cr2O3 + H2
- Zn + H2O = ZnO + H2
- Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
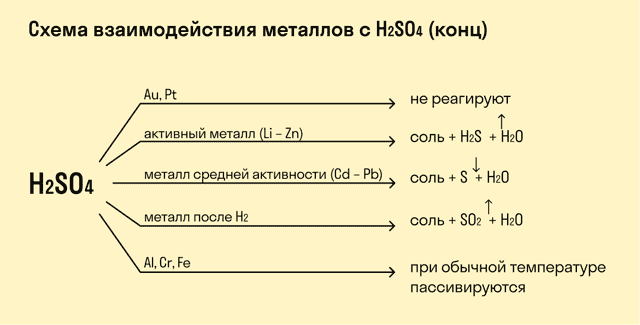
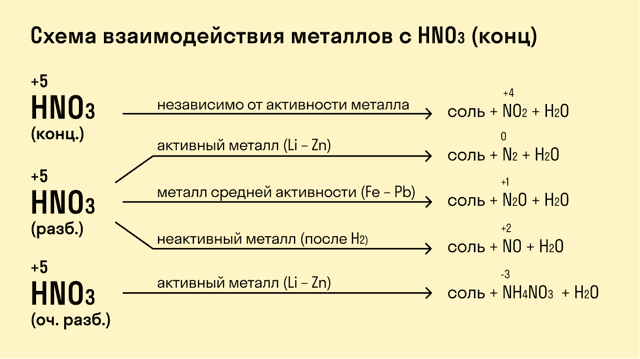
- Металлы IА группы:
- 2K + H2SO4 (раствор) = K2SO4 + H2
- 8K + 5H2SO4 (конц) = 4K2SO4 + H2S + 4H2O
- 8Na + 10HNO3 (раствор) = 8NaNO3 + NH4NO3 + 3H2O
- 3Na + 4HNO3 (конц) = 3NaNO3 + NO + 2H2О
- Металлы IIА группы
- Mg + H2SO4 (раствор) = MgSO4 + H2
- 4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O
- Mg+ 4HNO3 (конц) = Mg(NO3)2 + 2NO2 + 2H2O
- 4Mg + 10HNO3 (раствор) = 4Mg(NO3)2 + 2N2O + 5H2O
- Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
- Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
- Zn + CuSO4 = ZnSO4 + Cu
- На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
- Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2
Взаимодействие с органическими веществами
- Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
- 2Na + 2C2H5OH = 2C2H5ONa + H2
- 2K + 2C6H5OH = 2C6H5OK + H2
- Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
- Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
- 8Al + 3Fe3O4 = 4Al2O3 + 9Fe (алюмотермия)
- 3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
-
С чем реагируют неактивные металлы?
-
С чем связаны восстановительные свойства металлов?
-
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
-
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
-
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Летняя перезагрузка
Бесплатный телеграм-марафон для мам и пап. Узнайте, как провести семейное лето с пользой, и подготовьтесь к нему уже сейчас!

Практический подход в обучении химии. Урок: "Общие химические свойства металлов"
Цель
- Дать понятия об общих химических свойствах металлов и их восстановительных способностях.
- Задачи
- Образовательные
- Дать понятия об общих химических свойствах металлов;
- Закрепить представления об окислительно-восстановительных реакциях;
- Научить использовать приобретённые знания для объяснения явлений окружающей среды;
- Научить грамотному использованию металлических изделий;
- Проверить знания о строении металлов и их физических свойствах.
Развивающее
- Развить умения проведения химического эксперимента с соблюдением правил Техники безопасности;
- Развить умение проектирования химического эксперимента с учётом его наглядности и доказательства характера образующихся продуктов реакции.
Воспитательные
- Воспитание чувства собственного достоинства;
- Логического и образного мышления;
- Воспитание коллективизма – способность работать в группе.
Тип урока
- Изучение нового материала.
Методы и приёмы
- Элементы проблемно-модульного обучения;
- Приём «выход за рамки урока» – при опросе используются видеофрагменты;
- Проектная деятельность;
- Опережающее задание группам учащихся;
- Групповая деятельность;
- Элементы деловой игры «заседание научного общества»;
- Обсуждения акварельных рисунков и картины.
Химический эксперимент
- Ученический демонстрационный эксперимент;
- Решение экспериментальных задач 1-4 типа;
- Лабораторные опыты с применением полу микро метода.
Оборудование
- Проблемный модуль «Общие химические свойства металлов»;
- Фрагменты популярных видеофильмов,в которых используются металлические изделия(«Подводная лодка»,«Властелин колец», «Титаник»,«Один дома-2».
- Картина «Роль металлов в ОВР»;
- Оборудование для демонстрационного эксперимента каждой группе вписано в проблемный модуль;
- Оборудования для лабораторных опытов: пластинка для капельного анализа, ч/б экран, гранулы Zn, стружки Cu, растворы H4 и HCl, растворы CuCl2, FeCl3, железная скрепка на медной проволочке, пробирка.
Подготовка к уроку
- За неделю до урока учащимся предлагается принести касеты с любимыми видеофильмами, в которых используются металлы и изделия из них.
- За неделю до урока класс делится на восемь экспериментальных групп, каждой из которых дается задание выполнить 1 учебный элемент из проблемного модуля (рис. 1, 2).
- Учащимся, умеющим рисовать, предлагается нарисовать картину «Роль металлов в О.В.Р.» (рис. 3).
Рис. 1
Рис. 2
Рис. 3
I. Вводное слово учителя
На прошлом уроке вы познакомились со строением и общими физическими свойствами металлов. Цель сегодняшнего урока познакомиться с общими химическими свойствами металлов и их ролью в окислительно-восстановительных реакциях.
Девиз урока: «Единственный путь, ведущий к знанию, — это деятельность». (Б. Шоу)
Поэтому для лучшего усвоения темы урока мы будем действовать не только головой, но и руками.
II. Проверка домашнего задания
В качестве проверки домашнего задания предлагаю вам видеоопрос: («Прием выхода за рамки») «Фантазия или реальность». Я показываю фрагмент фильма, в котором используются металлические изделия. А вы объясняете, возможно ли такое явление в действительности и на каком свойстве основано применение металлов в данном фрагменте.
(Возможные ответы: ковкость, пластичность, прочность, металлический блеск, тепло- и электропроводность, долговечность, твёрдость, эстетичность.)
– А теперь найдите ответы на вопросы, которые нельзя отобразить визуально:
- Почему нельзя использовать нож из алюминия?
- Литий – самый лёгкий металл, почему нельзя из него сделать самолёт?
- Почему в оцинкованном ведре нельзя варить борщ или щи?
III. Изучение нового материала
Полученные ответы свидетельствуют о том, что для рационального использования металлов следует учитывать не только физические, но и химические свойства металлов.
Для каждого металла характерны как индивидуальные, так и общие с другими представителями этого класса веществ, свойства. Задача нашего урока выявить общие химические свойства металлов и их роль в окислительно-восстановительных процессах. Сделаем это в форме заседания учёного совета. За неделю до урока вы разделились на творческие экспериментальные группы.
В каждой группе есть свой теоретик (он же научный руководитель), лаборант (экспериментатор) и ассистенты. У нас получилось 8 групп. Каждая группа получила задание – изучить одно из химических свойств металлов и спроектировать безопасное, наглядное и доказательное проведение демонстрационного эксперимента.
Сегодня мы заслушаем результаты вашей работы, посмотрим эксперимент, выполним лабораторные опыты и сделаем вывод.
Путеводителем в сегодняшнем заседании будет фрейм проблемы, который у каждого из вас лежит на столе. На листе фрейма вы видите, кроме цели урока и решаемой проблемы, опорный конспект по химическим свойствам металлов.
Далее слово предоставляется творческим группам учащихся, которые выполняют учебные элементы с 1 по 8. (Смотри проблемный модуль рис. 1, 2).
Краткое содержание ответов экспериментальных групп
Учебный элемент № 1.
Выполнение опыта
Демонстрируется медная пластинка на фоне черно-белого экрана; затем пластинку нагревают на пламени спиртовки до появления черного налета. После нагревания пластинка также демонстрируется на белом фоне.
Уравнение реакции
Вывод
Активные металлы,находящиеся в левой части ряда металлов окисляются кислородом воздуха при н.у. до образования оксидов и пероксидов.
Металлы средней активности, находящиеся в средней части ряда металлов окисляются кислородом воздуха как при н.у., так и при нагревании с образованием оксидов.
Благородные металлы находящиеся в конце ряда не окисляются кислородом воздуха.
Значение реакции
Вред: окисление металлов приводит к их разрушению, в следствии чего металлические изделия приходят в негодность и требуют замены.
Польза: Некоторые металлы покрываясь сверху оксидной пленкой сами защищают себя от дальнейшего окисления, поэтому изделия из них служат гораздо дольше (например: Al, Zn и др.)
Учебный элемент № 2.
Выполнение опыта
В фарфоровую чашку насыпать щепотку цинковой пыли и порошка серы, тщательно перемешать и растереть смесь пестиком.С помощью ложки для сжигания нагреть смесь на пламени спиртовки. Появляются искры, свидетельствующие о течении реакции цинка с серой.
Уравнение реакции
Вывод
Возможность взаимодействия металлов с различными неметаллами зависит от химической активности тех и других, а от условий их проведения. Продуктами таких реакций являются соли.
Применение
Соли полученные в таких реакциях широко применяются в различных областях деятельности человека: удобрения в сельском хозяйстве, мед.препараты, в строительстве и т.д.
Учебный элемент № 3.
Выполнение опыта
На подставке закрепляется асбестовая сетка; на нее горкой укладываются древесные стружки, поверх которых помещается кусочек натрия. Точно на натрий наносится 2-3 капли воды. В результате выделения тепла и света в начале реакции происходит воспламенение опилок и они быстро сгорают.
Уравнение реакции
Вывод
Активные металлы, находящиеся в ряду активных до Mg, реагтруют с водой с образованием щелочи и водорода при нормальных условиях. Металлы средней активности от Al до H2 реагируют с водой в более жестких условиях и образуют при этом оксиды и водород. Металлы после Н2 с водой не реагируют и водород не вытесняют.
Значение
Использовать приведенную реакцию для получения водорода и щелочи в лаборатории не рационально, так как данный эксперимент относительно опасен, а также стоимость щелочных металлов очень высока для использования их в качестве исходных продуктов.
Учебный элемент № 4.
Выполнение опыта
В стакан налить 1/3 воды, добавить несколько капель фенолфталеина и положить кусочек натрия. Сверху стакан накрыть перевернутой воронкой. При появлении из отверстия воронки густого дыма поднести к нему горящую спичку. При этом раздается резкий звук «пах», а раствор окрашивается малиновый цвет. Это доказывает образование щелочи и выделение водорода.
Уравнение реакции: (см. учебный элемент № 3).
Вывод
Так как активные металлы являются очень активными и реагируют с кислородом и водой, содержащихся в воздухе, поэтому хранят их под слоем керосина.
Нахождение в природе
Активные и средне активные металлы находятся только в соединениях, так как легко окисляются окружающей средой.
Учебный элемент № 5.
Выполнение опыта
А) (Одновременно с учащимися на местах) на пластинку для капельного анализа поместить 2 гранулы Zn и 2 медных стружки отдельно в 4 углубления. Нанести на каждый кусочек металла растворы серной кислоты и соляной кислоты (также отдельно).
Вывод
Цинк реагирует как с серной, так и с соляной кислотой, выделяя бесцветный газ; медь не реагирует с растворами кислот.
Б) В пробирку с газоотводной трубкой поместить гранулы цинка и налить раствор соляной кислоты. Закрыть пробкой. Выделяющийся газ собрать в другую пробирку, перевернутую вверх дном. Через некоторое время поднести горящую спичку к отверстию пробирки с собранным газом. Раздается звук «пах», который доказывает образование в реакции водорода.
Вывод
Металлы, стоящие в ряду активности металлов левее водорода, реагируют с растворами кислот с образованием соли и водорода.
Применение
Раствор соли, полученный действием Zn на раствор соляной кислоты, используется для обработки металлов перед пайкой.
Учебный элемент № 6.
Выполнение опыта
В стаканчик налить слабый раствор щелочи с фенолфталеином. В пробирку поместить медные стружки и залить концентрированным раствором серной кислоты, закрыть пробкой. Газоотводную трубку направить в раствор щелочи.
Выделяемый в реакции газ в момент пропускания его через раствор щелочи с фенолфталеином делают окраску раствора более бледной или она совсем исчезает.
Zn +2 H2SO4 = ZnSO4 + 2H2O + SO2
- SO2 + Na OH = NaHSO3
- SO2 + Na+ + OH- = Na+ + HSO3-
- SO2 + OH- = HSO3-
Вывод
- При взаимодействии концентрированной серной кислоты с металлами в роли окислителя выступает атом серы со степенью окисления +6, поэтому в результате реакции кроме соли образуется не водород, а соединения серы и вода;
- Количество электронов присоединяемой серой зависит от активности металла.
- S+6 + 2e =S+4
- S+6 +6e =S0
- S+6 + 8e =S-2
- Учебный элемент № 7.
- Выполнение опыта
Медную проволочку продеть через пробку и закрутить длинный конец в спираль, в пробирку налить концентрированный раствор азотной кислоты и опустить в нее закрученную в спираль медную проволочку и закрыть пробкой.
Если реакция не протекает, нагреть пробирку с содержимым на пламени спиртовки до появления бурого газа.
Когда пробирка наполнится этим газом, вытянуть медную проволоку через отверстие в пробке, прекращая тем самым соприкосновение меди с азотной кислотой.
Cu + 4 HNO3 (k) = Cu(NO3 )2 + 2H2 O + 2NO2
Вывод
При взаимодействии металлов с азотной кислотой никогда не выделяется водород, так как окислителем является атом азота со степенью окисления +5. В зависимости от активности металла и концентрации раствора кислоты азот может присоединять от 1 до 8 элементов (см. кластер, который был составлен на уроке «Специфические свойства азотной кислоты»)
Учебный элемент № 8.
Выполнение опыта: (одновременно с классом).
(См. в модуле учебный элемент № 8).
Вывод
Признаки химической реакции наблюдаются в стакане с хлоридом меди (||) и железным гвоздем. Металлы реагируют с растворами солей, если замещающий металл активнее того, что находится в соли. Определить это можно по вытеснительному ряду или ряду активности металлов, или электрохимическому ряду металлов, составленному Бекетовым на основе способности металлов вытеснять друг друга из солей.
Fe+ CuCl = FeCl + Cu
IV. Выводы
«Итак, мы заслушали отчёты экспериментальных групп и можем сделать некоторые выводы. Посмотрите на картину «Роль металлов в ОВР» (рис. 3). – Какова роль атомов металлов в ОВР? Какие частицы могут являться окислителями металлов?»
V. Домашнее задание
Мы ответили на вопросы поставленные в начале урока. Дома вам предстоит закрепить полученные знания с помощью § 44 и упр. 11 на стр. 120
15.12.2003
Химические свойства металлов
Все металлы, в зависимости от их окислительно-восстановительной активности объединяют в ряд, который называется электрохимическим рядом напряжения металлов (так как металлы в нем расположены в порядке увеличения стандартных электрохимических потенциалов) или рядом активности металлов:
Li, K, Ва, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Рt, Au
Наиболее химически активные металлы стоят в ряду активности до водорода, причем, чем левее расположен металл, тем он активнее. Металлы, занимающие в ряду активности, место после водорода считаются неактивными.
Взаимодействие с простыми веществами
- Металлы способны реагировать с простыми веществами, такими как кислород (реакция горения), галогены, азот, сера, водород, фосфором и углеродом. В реакцию взаимодействия с кислородом вступают все металлы (исключение составляют Au, Pt), в результате чего возможно образование трех различных продуктов — пероксидов, оксидов и надпероксидов:
- 4Li + O2 = 2Li2O (оксид лития)
- 2Na + O2 =Na2O2 (пероксид натрия)
- K + O2 = KO2 (надпероксид калия)
- Металлы средней активности (начиная с Al) и неактивные металлы реагируют с кислородом только при нагревании:
- 2Al + 3/2 O2 = Al2O3
- 2Cu + O2 = 2CuO
В реакцию взаимодействия с азотом способны вступать только активные металлы, в результате чего образуются азиды, причем при н.у. с азотом реагирует только литий, остальные активные металлы – только при нагревании:
- 6Li + N2 = 2Li3N (азид лития)
- Только активные металлы способны взаимодействовать с углеродом и водородом, причем в случае реакции с водородом – это только щелочные и щелочноземельные металлы:
- 2Li+2C = Li2C2 (карбид лития)
- 2Na + H2 = NaH (гидрид натрия)
- С серой реагируют все металлы кроме Au и Pt:
- 2K +S = K2S (сульфид калия)
- Также металлы способны взаимодействовать с галогенами и фосфором:
- 2Na + Cl2 = 2NaCl (хлорид натрия)
- 3Ca + 2P = Ca3P2 (фосфид кальция)
Все реакции взаимодействия с простыми веществами носят окислительно-восстановительный характер, металлы в них окисляются, проявляя свойства восстановителей, т.е. демонстрируют способность отдавать электроны:
- Fe + S = FeS
- Fe -2e = Fe2+ процесс окисления, железо — восстановитель
- S +2e = S2- процесс восстановления, сера – окислитель
Взаимодействие металлов друг с другом
Металлы взаимодействуют друг с другом, образуя интерметаллические соединения:
3Cu + Au = Cu3Au
Взаимодействие металлов с водой
- Активные металлы (щелочные и некоторые щелочноземельные металлы — Ca, Sr, Ba) способны взаимодействовать с водой с образованием гидроксидов:
- Ba + 2H2O = Ba(OH)2 + H2↑
- 2Na + 2H2O = 2NaOH + H2↑
- Металлы, характеризующиеся средней активностью (начиная с Al) вступают в реакцию с водой в более жестких условиях (наличие щелочной или кислотной среды и др. условия); при этом образуется соответствующий оксид и выделяется водород:
- Pb + H2O = PbO + H2↑
- Неактивные металлы с водой не реагируют.
- Реакции взаимодействия металлов с водой также относятся к ОВР и металлы в них являются восстановителями.
Взаимодействие металлов с кислотами
- Металлы, стоящие в ряду активности до водорода способны реагировать с кислотами:
- 2Al + 6HCl = 2AlCl3 + 3 H2↑
- Zn + 2HCl = ZnCl2 + 2H2↑
- Fe + H2SO4 = FeSO4 + H2↑
- Неактивные металлы взаимодействуют с кислотами при особых условиях. Так, концентрированная серная кислота способна растворять медь (1), а при взаимодействии меди с концентрированной азотной кислотой в зависимости от её концентрации (60% или 30%) образуются различные продукты реакции (2, 3):
- Cu + 2H2SO4 = CuSO4 + SO2↑ +2H2O (1)
- Cu + 4HNO3(60%) = Cu(NO3)2 + 2NO2↑ + 2H2O
- 3Cu +8HNO3(30%) = 3Cu(NO3)2 + 2NO↑ + 4H2O
Взаимодействие металлов с солями
Более активные металлы способны взаимодействовать с солями, образованными менее активными металлами, и вытеснять их (металлы) из солей:
3Na + AlCl3 = 3NaCl + Al
Примеры решения задач
Цель урока: Повторить и обобщить общие химические свойства металлов с учетом их положения в ЭХРНМ. — презентация
- 1
- 2 Цель урока: Повторить и обобщить общие химические свойства металлов с учетом их положения в ЭХРНМ
- 3 Задачи урока: Повторить общие химические свойства металлов Объяснить зависимость свойств металлов от их положения в ЭХРНМ Выполнить упражнения на написание уравнений химических реакций, характеризующих общие химические свойства металлов Провести диагностику и коррекцию знаний
- 4 Вспомним! Положение металлов в ПСХЭ Особенности строения атомов металлов (радиус атома, количество электронов на внешнем энергетическом уровне, электроотрицательность) Способность к принятию или отдаче электронов
- 5 Положение металлов в ПСХЭ
- 6 p n 0 1
7 Вывод: Атомы металлов – ……………. электроны с внешнего энергетического уровня, поэтому являются ………………………..
8 Атомы металлов – восстановители, а катионы металлов? Катионы металлов принимают электроны, и являются окислителями
9 Окислители металлов Атомы неметаллов в степени окисления = 0 в составе простых веществ неметаллов Атомы водорода в степени окисления = +1 В составе воды, кислот, щелочей Катионы металлов В составе солей
10 Металлы взаимодействуют 1.С неметаллами с образованием бинарных соединений (оксидов, гидридов, сульфидов, галогенидов и др.) 2.С водой с образованием щелочей или оксидов и выделением водорода 3.С растворами кислот с образованием солей и выделением водорода 4.С растворами солей с образованием новой соли и нового металла
11 Электрохимический ряд напряжений металлов. Стр. 201
12 4 правила ЭХРНМ 1. Чем левее стоит металл в ЭХРНМ тем более сильным восстановителем он является 2. Каждый металл способен вытеснять из растворов солей те металлы, которые в ЭХРНМ стоят правее его Опыт 1Опыт 1 2.
Каждый металл способен вытеснять из растворов солей те металлы, которые в ЭХРНМ стоят правее его Опыт 1Опыт 1 3. Металлы, находящиеся в ряду напряжений левее водорода, вытесняют его из кислот в растворе Опыт 2Опыт 2 3.
Металлы, находящиеся в ряду напряжений левее водорода, вытесняют его из кислот в растворе Опыт 2Опыт 2 4. Металлы, являющиеся самыми сильными восстановителями (щелочные и щелочноземельные ), в водных растворах взаимодействуют прежде всего с водой Опыт 3 Опыт 3 4.
Металлы, являющиеся самыми сильными восстановителями (щелочные и щелочноземельные ), в водных растворах взаимодействуют прежде всего с водой Опыт 3 Опыт 3
13 Металлы после водорода… 1.Взаимодействие с концентрированной серной кислотой при нагревании Cu + 2 H2SO4 = CuSO4 + 2 H2O + SO2
14 Металлы после водорода… 2.Взаимодействие с концентрированной и разбавленной азотной кислотой. Опыт — 4 Cu + 4 HNO 3 = Cu(NO 3 ) H 2 O + NO 2 3Cu + 8 HNO 3 = 3Cu(NO 3 ) H 2 O + 2NO
15 Металлы после водорода… 3. Взаимодействие золота с «царской водкой» Au + HNO3 + 4HCl = H[AuCl 4 ] + NO + 2H2O
16 Подведем черту… 1.Металл + кислород = оксид металла 2.Металл + хлор = хлорид металла 3.Металл + сера = сульфид металла 4.Металл + вода = щелочь (оксид) + H 2 5.Металл + кислота (р) = соль + H 2 6.Металл + соль (р) = соль + металл
17 Подведем черту… 7.Металл + серная кислота (к) = соль + вода + «Х», где «Х» — SO 2, S, H 2 S в зависимости от положения металла в ЭХРНМ 8.Металл + азотная кислота = соль + вода + «У» где «У» — NO 2, NO, N 2 O, N 2, NH 3 в зависимости от положения металла в ЭХРНМ и концентрации кислоты
18 Напишите реакции: калий + вода = гидроксид калия + водород кальций + вода = гидроксид кальция + водород цинк + вода = оксид цинка + водород олово + вода = оксид олова (II) + водород металлы, стоящие в ЭХРНМ до водорода, взаимодействуют с водой с образованием щелочи и водорода или с образованием оксида и водорода. Это зависит от их активности.
19 железо + соляная кислота = хлорид железа (II) + водород никель + серная кислота = сульфат никеля (II) + водород металлы, стоящие в ЭХРНМ до водорода, взаимодействуют с растворами кислот (кроме азотной) с образованием растворимой соли и водорода.
20 железо + сульфат меди (II) = медь + сульфат железа (II) медь + нитрат ртути (II) = ртуть + нитрат меди (II) металлы взаимодействуют с растворами солей. Согласно ЭХРНМ, каждый более активный металл вытесняет менее активный из раствора соли. НЕ БРАТЬ АКТИВНЫЕ МЕТАЛЛЫ!
21 Диагностика 1.Напишите реакции взаимодействия магния с кислородом, хлором, азотом, водой, соляной кислотой, хлоридом меди(II) 2.Напишите реакцию взаимодействия цинка с концентрированной серной кислотой при нагревании. 3.
Определите с какими из перечисленных веществ (H 2 SO 4(p), H 2 SO 4 (к), MgCl 2, CuSO 4 ) при обычных условиях взаимодействует железо.
Составьте уравнения возможных реакций, укажите в них окислитель и восстановитель, запишите процессы окисления и восстановления.
22 Решение диагностики: 1. 2Mg +O 2 = 2MgO Mg +Cl 2 = MgCl 2 3Mg +N 2 = Mg 3 N 2 Mg +2H 2 O = Mg(OH) 2 +H 2 Mg +2HCl = MgCl 2 +H 2 Mg +CuCl 2 = MgCl 2 + Cu 2. 4Zn +5H 2 SO 4(конц) = 4ZnSO 4 +4H 2 O + H 2 S 3. Fe + H 2 SO 4 = FeSO 4 + H 2 Fe + CuSO 4 = FeSO 4 + Cu
23 Домашнее задание Выполните задания диагностики для следующих металлов: 1 задание для лития Li 2 задание для ртути Hg и концентрированной азотной кислоты HNO 3 3 задание для цинка Zn






