- Обсуждение: «Кислоты — окислители»
- Химические свойства кислот — формулы, уравнения и примеры взаимодействия
- Склонность к диссоциации
- Специфическое окисление
- Восстановительные реакции
- Химические свойства
- Сферы применения
- 2.6. Характерные химические свойства кислот
- 1) Наличие атомов кислорода в кислоте
- 2) Основность кислоты
- 3) Летучесть
- 4) Растворимость
- 5) Устойчивость
- 6) Способность к диссоциации
- 7) Окисляющие свойства
- Химические свойства кислот
- 1. Способность к диссоциации
- 2. Взаимодействие кислот с металлами
- 3. Взаимодействие кислот с основными и амфотерными оксидами
- 4. Взаимодействие кислот с основаниями и амфотерными гидроксидами
- 5. Взаимодействие кислот с солями
- 6. Специфические окислительные свойства азотной и концентрированной серной кислот
- 7. Восстановительные свойства бескислородных кислот
- ПОИСК
- Давайте рассмотрим свойства
- и продукты их реакций
- Автор статьи — Саид Лутфуллин
- Свойства концентрированной серной кислоты — окислителя
Концентрированная серная кислота – бесцветная тяжелая маслянистая нелетучая жидкость. Не имеет запаха и тянет сказать: «без вкуса», но вкус у нее все же есть, пробовать не советую.
Разбавленная серная кислота ничем особым непримечательна. Свойства как и у других кислот. За исключением того, что она не реагирует со свинцом, так как образующийся сульфат свинца нерастворим. Нерастворимое вещество покрывает кусочек металла и «защищает его от реакции»
- Pb + H2SO4 ≠
- А вот концентрированная серная кислота – сильный окислитель (за счет атома серы в высшей степени окисления).
- Раз сера – окислитель, то она будет восстанавливаться:
- Глубина восстановления серы зависит от активности восстановителя:
- сильные восстановители восстанавливают серную кислоту до H2S,
- слабые — до SO2,
- восстановители средней активности – до S.
На практике образуются несколько продуктов в разных пропорциях. Преобладание того или иного продукта зависит от множества факторов: от вышеупомянутой активности восстановителя, температуры, концентрации кислоты (95%, 90%. 85%, 80%, 75% – это все концентрированная кислота). Но в реалиях школьной программы все схематично и пишем один единственный продукт.
1. Взаимодействие металлов в концентрированной серной кислотой.
Концентрированная серная кислота реагирует с металлами, даже стоящими после водорода. Но кроме платины и золота – эти металлы слишком малоактивны.
Схема этих реакций:

- Активные металлы восстанавливают серную кислоту до H2S:
8Li + 5H2SO4 конц → 4Li2SO4 + H2S ↑ + H2O
4Mg + 5H2SO4 конц → 4MgSO4 + H2S ↑ + H2O
- Металлы средней активности восстанавливают серную кислоту до S:
3Mn + 4H2SO4 конц → 3MnSO4 + S ↓ + 4H2O
3Zn + 4H2SO4 конц → t→ 3ZnSO4 + S ↓ + 4H2O
- Малоактивные металлы восстанавливают серную кислоту до SO2:
Cu + 2H2SO4 конц → CuSO4 + SO2 ↑ + 2H2O
2Ag + 2H2SO4 конц → Ag2SO4 + SO2 ↑ + 2H2O
Некоторые металлы (конкретно нужно запомнить — Fe, Al, Cr) при контакте с концентрированной серной кислотой покрываются защитной пленкой – и реакция не идет. Поэтому серную кислоту без всякой опасности перевозят в железных цистернах. Это явление называют пассивацией.
То, что железо, алюминий и хром пассивируются не означает, что реакция невозможна. Просто нужно нагреть – при нагревании от защитной пленки не остаётся и следа:

2. Взаимодействие неметаллов с концентрированной серной кислотой.
Не все неметаллы реагируют с концентрированной серной кислотой: лишь те, что проявляют восстановительные свойства. Поэтому кислород, азот и галогены не вступают в эти реакции.
Мы рассмотрим взаимодействие с фосфором, углеродом, бором, серой. Неметаллы – не такие активные восстановители как типичные металлы – поэтому серная кислота восстанавливается до SO2.
- Неметалл окисляется до высшей степени окисления: образуется оксид. Поскольку оксид неметалла – кислотный, то он тут же в момент получения реагирует с водой и образуется кислота:
- 2P + 5H2SO4 конц → 2H3PO4 + 5SO2 ↑+ 2H2O
- 2B + 3H2SO4 конц → 2H3BO3 + 3SO2 ↑
- Угольная кислота не образуется – получается углекислый газ:
- C + 2H2SO4 конц → CO2 ↑ + 2SO2 ↑+ 2H2O
- Концентрированная серная кислота окисляет серу:

3. Взаимодействие концентрированной серной кислоты с галогенидами.
Галогениды металлов – это соли галогеноводородов (HF, HCl, HBr, HI). Галогеноводороды – летучие кислоты, а HF еще к тому же и слабая.
- Поэтому серная кислота их вытесняет из солей:
- 2KF тв + H2SO4 конц → K2SO4 + 2HF↑
- 2NaCl тв + H2SO4 конц → Na2SO4 + 2HCl↑
Соли нужно брать твердые, не раствор. Тогда галогеноводороды будут вытесняться в виде газов.
А к фториду можно и в раствор прилить кислоты, так как фтороводородная кислота – слабая, она вытеснится. Только останется в растворе, вот и вся разница.
- С хлоридами и фторидами происходит простая реакция обмена, без изменения степеней окисления.
- Галоген окисляется до простого вещества. Сера восстанавливается:
-

А вот бромиды и иодиды – восстановители. После вытеснения галогеноводорода он тут же окисляется. Поэтому реакции концентрированной серной кислоты с бромидами и иодидами протекают с изменением степеней окисления.
- Бромоводород и иодоводород окисляются так же, как и их соли:
- 2HBr + H2SO4 конц → Br2 + SO2 ↑ + 2H2O
- 8HI + H2SO4 конц → 4I2 ↓+ H2S ↑ + 4H2O
- Азотная кислота — окислитель.
- Производство.
- Сырье для производства азотной кислоты – аммиак. Три последовательные реакции окисления:
- 1. Каталитическое окисление аммиака:
- 4NH3+5O2 → кат., t°→ 4NO+6H2
- Реакция экзотермическая, необратимая.
- 2. Окисление NO до NO2:
- 2NO+O2→2NO2
- Реакция экзотермическая, обратимая.
- 3. Поглощение NO2 водой и одновременно его окисление:
Реакция экзотермическая, обратимая – по этой же схеме азотная кислота разлагается при хранении. Поэтому с течением времени прозрачная изначально азотная кислота буреет. Бурый цвет кислоте придает, образующийся при разложении NO2.
Если растворять NO2 в воде без доступа кислорода, то азот диспропорционирует:
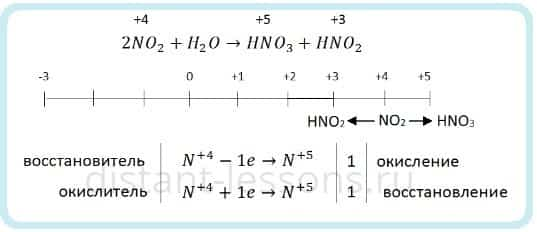
Поэтому оксид азота (IV) NO2 мы относим к кислотным. Хоть у него и нет соответствующей кислоты, при растворении его в воде образуются HNO3 и HNO2.
Азотная кислота – жидкость с резким запахом. Свежая азотная кислота бесцветная. При хранении она разлагается и за счет бурого NO2 приобретает желтоватый цвет.
Важно знать, что азотная кислота летучая, легкокипящая, поэтому и имеет запах. А раз она летучая, то ее можно вытеснить из соли нелетучей кислотой, например, концентрированной серной:
NaNO3 тв + H2SO4 → t → NaHSO4 + HNO3 ↑
Важно, чтобы нитрат был твердым, а серная кислота концентрированная – меньше воды. Чтобы азотная кислота испарялась, испаряется – значит покидает реакционную смесь, значит реакция идет до конца.
Химические свойства.
Свойства азотной кислоты в целом повторяют свойства концентрированной серной. Но с одной поправкой, в отличие от серной, азотная кислота и концентрированная, и разбавленная проявляет сильные окислительные свойства.
1. Взаимодействие с металлами.
До чего может восстанавливаться азот? Вспомним диаграмму степеней окисления азота:

Получиться может любой из этих продуктов. А на практике – несколько сразу. Мы рассмотрим упрощенный вариант: берем только преобладающий продукт и только два фактора, влияющие на глубину восстановления:
- Активность металла – чем активнее, тем глубже идет восстановление.
- Концентрация кислоты – разбавленная кислота восстанавливается глубже.
- Еще больше упрощая берем только четыре продукта: NH4NO3, N2O, NO, NO2.
- Наиболее глубокое восстановление дает разбавленная кислота и активный металл – NH4NO3.
- 4Ca + 10HNO3 разб → 4Ca(NO3)2 + NH4NO3 + 3H2O
Соответственно при взаимодействии концентрированной кислоты и малоактивного металла образуется NO2. Самое неглубокое восстановление.
Cu + 4HNO3 конц → Cu(NO3)2 + 2NO2 ↑+ 2H2O
Теперь нужно определить в каком случае будет N2O, а в каком NO. Фактор активности металла – решающий. С активным металлом и концентрированной кислотой будет N2O. А с малоактивным металлом и разбавленной кислотой образуется NO.
- 8Na + 10HNO3 конц → 8NaNO3 + N2O ↑ + 5H2O
- 3Cu + 8HNO3 разб → 3Cu(NO3)2 + 2NO ↑ + 4H2O

-
Концентрированная азотная кислота пассивирует Fe, Cr, Al, как и концентрированная серная.
- Чтобы провести реакцию нужно нагреть:
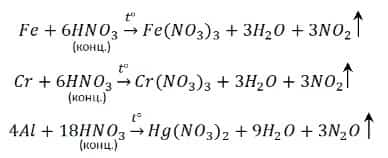
- С разбавленной кислотой эти металлы реагируют и без нагревания:
2. Взаимодействие с неметаллами (C, P, B, S).
Неметаллы окисляются до высших кислот. Реагирует и концентрированная, и разбавленная азотная кислота. Неметаллы – не очень хорошие восстановители, поэтому кислота восстанавливается как в реакции с малоактивными металлами (образуются N2O и NO2).
-
В отличие от серной кислоты, очень концентрированная азотная кислота (безводная) окисляет при нагревании иод до иодноватой кислоты (HIO3): - I2 + 10HNO3 конц → t → 2HIO3 + 10NO2 ↑ + 4H2O
3. Взаимодействие с галогенидами.
Эти реакции могут запутать, хотя ничего сложного в них нет. Вам нужно просто понять логику каждой из них.
На что следует опираться:
- Реакции могут быть либо окислительно-восстановительными, либо обменными.
- Помним, что фториды (F–) и хлориды (Cl–) – восстановители плохие, если быть точнее, то никакие. А бромиды (Br–) и иодиды (I–) – хорошие восстановители.
- HF – слабая кислота, HCl, HBr, HI – сильные.
- Фториды металлов – это соли слабых кислот, поэтому сильная азотная кислота вытесняет фтороводород. И не важно концентрированная или разбавленная – это простая реакция обмена/p>
- KF + HNO3 → HF + KNO3
Фтороводород не реагирует с азотной кислотой. Реакция обмена невозможна и окислительно-восстановительная тоже: фторид – слабый восстановитель.
Хлориды металлов и хлороводород не реагируют с азотной кислотой. Хлорид ион – слабый восстановитель – не возможна ОВР. Хлориды металлов не реагируют, потому что соляная кислота – сильная (предыдущая плавиковая – слабая, если помните).
Бромиды и иодиды вступают с азотной кислотой в окислительно-восстановительное взаимодействие. Сами окисляются до простых веществ. Азотная кислота восстанавливается до NO2 если концентрированная, разбавленная – до NO, то есть так, как будто взаимодействует с малоактивным металлом.
Обсуждение: «Кислоты — окислители»
(Правила комментирования)
Химические свойства кислот — формулы, уравнения и примеры взаимодействия
Время на чтение: 18 минут 
Склонность к диссоциации
В водных растворах кислоты свободно диссоциируют на катионы водорода и кислотные остатки. Этот процесс не занимает много времени. Все кислоты делятся на малодиссоциирующие и диссоциирующие.
Для корректного построения уравнения сильных одноосновных соединений может быть использована одна направленная вправо стрелка (→), либо знак равенства (=). Таким способом можно показать необратимость такой диссоциации.
К примеру, самое элементарное уравнение диссоциации соляной кислоты можно записать двумя способами: HCl → H+ + CL- или HCl = H+ + CL-. Оба варианта являются правильными.
Используемая стрелка нужна для того, чтобы наглядно показать, что обратный процесс объединения кислотных остатков с катионами водорода практически не происходит.
Если по условиям задачи нужно будет написать уравнение диссоциации одноосновного слабого соединения, тогда будет использоваться уже 2 стрелки (↔), которые будут направлены в разные стороны. Этот приём используется в химии для того, чтобы показать обратимость диссоциации слабых соединений.
Такой подход особенно актуален в том случае, когда ярко выражен обратный процесс объединения имеющихся катионов водорода с кислотными остатками.

Химический процесс может происходить ступенчато. В этом случае речь касается многоосновных веществ, у которых катионы водорода отрываются от молекул не одновременно, а по очереди.
Для выражения диссоциации понадобиться уже несколько уравнений, итоговое количество которых будет соответствовать основности кислот. Для лучшего понимания этого правила следует рассмотреть пример.
При использовании трехосновной фосфорной кислоты диссоциация протекает сразу в три ступени с поочерёдным открытием катионов Н+:
- Н3РО4 ↔ Н+ + Н2РО4-.
- Н2РО4 — ↔ Н+ + НРО42-.
- НРО42- ↔ Н+ + РО43-.
Для правильного решения аналогичных задач нужно понимать, что каждая последующая степень диссоциации всегда протекает в меньшей степени, нежели предыдущая. Такое явление основано на увеличении заряда кислотных остатков, из-за чего прочность связи между ними и положительными ионами только возрастает.
Среди многоосновных веществ в категорию исключений входит только H2SO4. Это связано с тем, что это соединение диссоциирует сразу по двум ступеням.
Специфическое окисление
Из уроков химии достоверно известно, что сила концентрации H2SO4 и HNO3 способна удивлять. Эти вещества воздействуют не только на металлы, которые расположены до водорода в ряду активности, но и на другие элементы после него (за исключением золота, платины).
Кислородсодержащие азотные и серные кислоты могут окислить не только серебро и медь, но и ртуть. Но нужно понимать, что некоторые металлы (Fe, Al, Cr) являются довольно активными, так как расположены до водорода, но они не реагируют на HNO3, H2SO4 без предварительного нагревания.
Это связано с пассивацией. На поверхности таких металлов образуется защитная плёнка, состоящая из твёрдых продуктов окисления. Благодаря этому молекулы H2SO4 и HNO3 не могут проникать вглубь металла для активации химической реакции.
Но если температура будет высокой, тогда окисление произойдёт.

Если речь идет о взаимодействии кислот с металлами, тогда обязательными продуктами будет соль и вода. Дополнительно выделяется третий продукт, формула которого зависит от активности металлов, температуры химической реакции. Каждая ситуация является индивидуальной.
Азотная и серная кислоты отличаются высокой окислительной способностью, что позволяет им вступать в химическую реакцию практически со всеми металлами ряда активности, а также с твёрдыми неметаллами.
Например, фосфор, углерод, сера. Наглядно увидеть список продуктов взаимодействия H2SO4, HNO3 с металлами можно увидеть в таблице кислот.
В 8 классе химия изучается не углублённо, но выучить названия химических элементов и их свойства нужно обязательно.
Восстановительные реакции
Окислители представляют собой частицы (атомы, ионы, молекулы), которые во время химической реакции принимают электроны. При этом степень окисления постепенно понижается, а окислители восстанавливаются.
Все известные бескислородные кислоты (за исключением HF) под воздействием различных окислителей проявляют восстановительные свойства, но это только благодаря химическому элементу, который входит в состав аниона.
К примеру, дихроматом калия, диоксидом марганца, перманганатом калия окисляются все галогеноводородные соединения. В категорию исключений входит только HF. А вот галогенид-ионы могут окисляться только до свободных галогенов.
Химическую реакцию можно оформить следующим образом:
- 4HCl + MnJ2 → MnCl2 + Cl2↑ + 2H2O.
- 16Br + 2KMnO4 → 2KBr + 2MnBr2 + 8H2O + 5Br2.
- 14Hl + K2Cr2O7 → 3l2↓ + 2Crl3 + 2Kl + 7H2O.

Иодоводород среди всех галогеноводородных соединений обладает наибольшей восстановительной активностью. Окислить его могут даже оксид и соли трёхвалентного железа. Не меньшей восстановительной активностью обладает сероводород H2S.
Для получения кислот электролизу подвергают растворы солей, образовавшиеся благодаря кислотному остатку. К примеру, электролиз раствора сульфата меди.
Химические свойства
Все существующие кислоты можно поделить на две категории: растворимые и нерастворимые. Некоторые из этих веществ могут самопроизвольно разлагаться и в водном растворе практически исчезают.
Речь касается неустойчивых соединений. Эту тему подробно изучают на уроках химии в 8 классе.
Все кислоты обладают определёнными физическими и химическими свойствами, которые нужно выучить для сдачи ЕГЭ:

- Многие виды кислот могут растворяться в воде, существенно повышая её кислотность. Для определения химического соединения в конкретном растворе используются специальные индикаторы: лакмусовая бумажка окрашивается в красный цвет.
- Кислоты взаимодействуют с атмосферными основаниями и оксидами, из-за чего образуется вода и соли. Из-за электролита такие реакции всегда проходят до конца. Растворению подвергаются многие оксиды.
- Кислоты могут вступать в реакцию с солями, но это только при условии образования газообразных либо малорастворимых веществ.
- Сильные кислоты взаимодействуют со щелочами. Реакция нейтрализации происходит на фоне того, что не только кислая, но и щелочная среда в сумме образуют нейтральную среду воды. Это интересная химическая реакция, которую можно записать следующим образом: Н+ + ОН- → Н2О.
Кислоты взаимодействуют с металлами, но для этого должны быть соблюдены определённые условия. В процессе химической реакции образуется соль и выделяется водород. В категорию исключений входят только те ситуации, когда металлы взаимодействуют с H2SO4 и HNO3.
Сферы применения
Химические вещества используются практически во всех отраслях современной промышленности. Но в настоящее время минеральные и органические кислоты применяются в следующих сферах:

- Борная кислота (H3BO3). Получила большой спрос в медицине как надёжное антисептическое средство. H3BO3 используется при пайке различных металлов, это вещество также добавляют в удобрения и применяют для борьбы с тараканами.
- В домашних условия при выпечке сдобных изделий не обойтись без лимонной и уксусной кислот, их также используют для удаления накипи с кранов, чайников.
- Хорошо всем известная аскорбиновая кислота, которая также известна как витамин С, применяется при простудных заболеваниях.
- Серная кислота (H2SO4). Активно используется в химической промышленности. H2SO4 используется для производства эффективных минеральных удобрений, лакокрасочных материалов. Часто используется в пищевой промышленности (например, пищевая добавка Е513), а также в качестве электролита, когда речь касается производства аккумуляторных батарей.
- Специальная хромовая смесь (раствор двухромовокислого калия в H2SO4) применяется в лабораторных условиях для очистки химической посуды. Это вещество является сильным окислителем, благодаря чему помогает максимально быстро и качественно удалить следы загрязнения органическими веществами. Хромовая смесь также используется в органическом синтезе.
- Азотная кислота (HNO3). Благодаря своим уникальным свойствам получила спрос в производстве взрывчатых веществ. Именно HNO3 используют при производстве востребованных в сельскохозяйственной отрасли азотосодержащих удобрений (например, калиевая и аммиачная селитра), а также для изготовления медикаментозных средств («Нитроглицерин»).

При использовании любой из кислот нужно соблюдать правила безопасности, так как такие вещества могут нанести серьёзный вред здоровью.
В 8 классе на уроках химии даётся общая информация по кислотам. Но учащимся нужно запомнить, что это сложные соединения, в составе которых содержатся атомы водорода, замещающиеся атомами металлов и кислотных остатков. Изучаемые химические элементы наделены определёнными свойствами. Например, могут взаимодействовать с оксидами, солями и металлами.
2.6. Характерные химические свойства кислот
Кислоты можно классифицировать исходя из разных критериев:
1) Наличие атомов кислорода в кислоте
| Кислородсодержащие | Бескислородные |
| H3PO4,HNO3,HNO2,H2SO4,H3PO4,H2CO3,H2CO3, HClO4 все органические кислоты (HCOOH, CH3COOH и т.д.) | HF, HCl, HBr, HI, H2S |
2) Основность кислоты
Основностью кислоты называют число «подвижных» атомов водорода в ее молекуле, способных при диссоциации отщепляться от молекулы кислоты в виде катионов водорода H+, а также замещаться на атомы металла:
| одноосновные | двухосновные | трехосновные |
| HBr, HCl, HNO3, HNO2, HCOOH, CH3COOH | H2SO4, H2SO3, H2CO3, H2SiO3 | H3PO4 |
3) Летучесть
Кислоты обладают различной способностью улетучиваться из водных растворов.
| Летучие | Нелетучие |
| H2S, HCl, CH3COOH, HCOOH | H3PO4, H2SO4, высшие карбоновые кислоты |
4) Растворимость
| Растворимые | Нерастворимые |
| HF, HCl, HBr, HI, H2S, H2SO3, H2SO4, HNO3, HNO2, H3PO4, H2CO3, CH3COOH, HCOOH | H2SiO3, высшие карбоновые кислоты |
5) Устойчивость
| Устойчивые | Неустойчивые |
| H2SO4, H3PO4, HCl, HBr, HF | H2CO3, H2SO3 |
6) Способность к диссоциации
| хорошо диссоциирующие (сильные) | малодиссоциирующие (слабые) |
| H2SO4, HCl, HBr, HI, HNO3, HClO4 | H2CO3, H2SO3, H2SiO3 |
7) Окисляющие свойства
| слабые окислители (проявляют окислительные свойства за счет катионов водорода H+) | сильные окислители (проявляют окислительные свойства за счет кислотообразующего элемента) |
| практически все кислоты кроме HNO3 и H2SO4 (конц.) | HNO3 любой концентрации, H2SO4 (обязательно концентрированная) |
Химические свойства кислот
1. Способность к диссоциации
- либо в таком виде: HCl = H+ + Cl—
- либо в таком: HCl → H+ + Cl—
- По сути направление стрелки говорит нам о том, что обратный процесс объединения катионов водорода с кислотными остатками (ассоциация) у сильных кислот практически не протекает.
- В случае, если мы захотим написать уравнение диссоциации слабой одноосновной кислоты, мы должны использовать в уравнении вместо знака две стрелки . Такой знак отражает обратимость диссоциации слабых кислот — в их случае сильно выражен обратный процесс объединения катионов водорода с кислотными остатками:
- CH3COOH CH3COO— + H+
Многоосновные кислоты диссоциируют ступенчато, т.е. катионы водорода от их молекул отрываются не одновременно, а по очереди. По этой причине диссоциация таких кислот выражается не одним, а несколькими уравнениями, количество которых равно основности кислоты. Например, диссоциация трехосновной фосфорной кислоты протекает в три ступени с поочередным отрывом катионов H+ :
- H3PO4 H+ + H2PO4—
- H2PO4— H+ + HPO42-
- HPO42- H+ + PO43-
Следует отметить, что каждая следующая ступень диссоциации протекает в меньшей степени, чем предыдущая. То есть, молекулы H3PO4 диссоциируют лучше (в большей степени), чем ионы H2PO4— , которые, в свою очередь, диссоциируют лучше, чем ионы HPO42-. Связано такое явление с увеличением заряда кислотных остатков, вследствие чего возрастает прочность связи между ними и положительными ионами H+.
Из многоосновных кислот исключением является серная кислота. Поскольку данная кислота хорошо диссоциирует по обоим ступеням, допустимо записывать уравнение ее диссоциации в одну стадию:
H2SO4 2H+ + SO42-
2. Взаимодействие кислот с металлами
Седьмым пунктом в классификации кислот мы указали их окислительные свойства. Было указано, что кислоты бывают слабыми окислителями и сильными окислителями. Подавляющее большинство кислот (практически все кроме H2SO4(конц.
) и HNO3) являются слабыми окислителями, так как могут проявлять свою окисляющую способность только за счет катионов водорода.
Такие кислоты могут окислить из металлов только те, которые находятся в ряду активности левее водорода, при этом в качестве продуктов образуется соль соответствующего металла и водород. Например:
H2SO4(разб.) + Zn ZnSO4 + H2
2HCl + Fe FeCl2 + H2
Что касается кислот-сильных окислителей, т.е. H2SO4 (конц.) и HNO3, то список металлов, на которые они действуют, намного шире, и в него входят как все металлы до водорода в ряду активности, так и практически все после.
То есть концентрированная серная кислота и азотная кислота любой концентрации, например, будут окислять даже такие малоактивные металлы, как медь, ртуть, серебро.
Более подробно взаимодействие азотной кислоты и серной концентрированной с металлами, а также некоторыми другими веществами из-за их специфичности будет рассмотрено отдельно в конце данной главы.
3. Взаимодействие кислот с основными и амфотерными оксидами
- Кислоты реагируют с основными и амфотерными оксидами. Кремниевая кислота, поскольку является нерастворимой, в реакцию с малоактивными основными оксидами и амфотерными оксидами не вступает:
- H2SO4 + ZnO ZnSO4 + H2O
- 6HNO3 + Fe2O3 2Fe(NO3)3 + 3H2O
- H2SiO3 + FeO ≠
4. Взаимодействие кислот с основаниями и амфотерными гидроксидами
HCl + NaOH H2O + NaCl
3H2SO4 + 2Al(OH)3 Al2(SO4)3 + 6H2O
5. Взаимодействие кислот с солями
- Данная реакция протекает в случае, если образуется осадок, газ либо существенно более слабая кислота, чем та, которая вступает в реакцию. Например:
- H2SO4 + Ba(NO3)2 BaSO4↓ + 2HNO3
- CH3COOH + Na2SO3 CH3COONa + SO2↑ + H2O
- HCOONa + HCl HCOOH + NaCl
6. Специфические окислительные свойства азотной и концентрированной серной кислот
Как уже было сказано выше, азотная кислота в любой концентрации, а также серная кислота исключительно в концентрированном состоянии являются очень сильными окислителями. В частности, в отличие от остальных кислот они окисляют не только металлы, которые находятся до водорода в ряду активности, но и практически все металлы после него (кроме платины и золота).
Так, например, они способны окислить медь, серебро и ртуть.
Следует однако твердо усвоить тот факт, что ряд металлов (Fe, Cr, Al) несмотря на то, что являются довольно активными (находятся до водорода), тем не менее, не реагируют с концентрированной HNO3 и концентрированной H2SO4 без нагревания по причине явления пассивации — на поверхности таких металлов образуется защитная пленка из твердых продуктов окисления, которая не позволяет молекулами концентрированной серной и концентрированной азотной кислот проникать вглубь металла для протекания реакции. Однако, при сильном нагревании реакция все таки протекает.
В случае взаимодействия с металлами обязательными продуктами всегда являются соль соответствующего метала и используемой кислоты, а также вода. Также всегда выделяется третий продукт, формула которого зависит от многих факторов, в частности, таких, как активность металлов, а также концентрация кислот и температура проведения реакций.
Высокая окислительная способность концентрированной серной и концентрированной азотной кислот позволяет им реагировать не только практическим со всеми металлами ряда активности, но даже со многими твердыми неметаллами, в частности, с фосфором, серой, углеродом. Ниже в таблице наглядно представлены продукты взаимодействия серной и азотной кислот с металлами и неметаллами в зависимости от концентрации:
7. Восстановительные свойства бескислородных кислот
Все бескислородные кислоты (кроме HF) могут проявлять восстановительные свойства за счет химического элемента, входящего в состав аниона, при действии различных окислителей. Так, например, все галогеноводородные кислоты (кроме HF) окисляются диоксидом марганца, перманганатом калия, дихроматом калия. При этом галогенид-ионы окисляются до свободных галогенов:
- 4HCl + MnO2 MnCl2 + Cl2↑ + 2H2O
- 16HBr + 2KMnO4 2KBr + 2MnBr2 + 8H2O + 5Br2
- 14НI + K2Cr2O7 3I2↓ + 2Crl3 + 2KI + 7H2O
Среди всех галогеноводородных кислот наибольшей восстановительной активностью обладает иодоводородная кислота. В отличие от других галогеноводородных кислот ее могут окислить даже оксид и соли трехвалентного железа.
- 6HI + Fe2O3 2FeI2 + I2↓ + 3H2O
- 2HI + 2FeCl3 2FeCl2 + I2↓ + 2HCl
- Высокой восстановительной активностью обладает также и сероводородная кислота H2S. Ее может окислить даже такой окислитель, как диоксид серы:
- 2H2S + SO2 3S↓+ 2H2O
ПОИСК
Ртуть по своим свойствам сильно отличается от цинка и кадмия. При взаимодействии ртути с кислотами-окислителями в условиях избытка кислоты образуется соль ртути(II), а при избытке ртути — соль ртути (I) [c.229]
Кислоты-окислители, например НЫОз, переводят все три металла в раствор [c.228]
Сульфат-ионы SO4- вследствие их симметричного строения (тетраэдрическая форма при sp -гибридизации атомных орбита-лей серы) в нейтральных и щелочных растиорах не проявляют окислительных свойств. В кислотной среде (разбавленная серная кислота) окислителем будут не сульфат-ионы, а катионы оксония. [c.218]
При взаимодействии металлов с азотной кислотой никогда не выделяется водород и в концентрированной, и в разбавленной азотной кислоте окислителем выступает азот со степенью окисления +5. [c.112]
В кислородсодержащих кислотах — окислителях кремний пассивируется и растворяется лишь в смеси кислот плавиковой и азотной [c.411]
Взаимодействие металлов с хлороводородной (соляной) кислотой. Окислителем в соляной кислоте, так же как и в воде, является ион водорода.
Стандартный электродный потенциал водородного электрода приравнен к нулю. Поэтому принципиально все активные металлы и металлы средней активности должны реагировать с кислотой.
Так оно и есть, однако проявляется пассивация свинца [c.331]
Лавсан имеет высокую механическую прочность и температуру размягчения (260°С), термо-, влаго-, светостоек, устойчив к действию щелочей, кислот, окислителей. Из него делают пленки, волокна, лаки для изоляции и различные изделия. Из полимеров, получаемых [c.339]
Под действием кислот-окислителей эти металлы пассивируются, [c.244]
Соляная кислота окислителем не является. [c.218]
Темно-коричневый моносульфид 8п5 выпадает в осадок при действии НгЗ на растворы, содержащие 5п2+. Осадок 5п5 не растворяется Е1 разбавленных кислотах, но растворим в концентрированной НС) и в кислотах окислителях. 5п5 не реагирует с сульфидом аммония, но растворяется в растворе дисульфида аммония [c.386]
Если в маточных растворах содержатся сильные кислоты, щелочи, ангидриды и хлорангидриды кислот, окислители, разрушающие фильтровальную бумагу, то для фильтрования пользуются стеклянными тиглями с пористым дном (рис. 27) или стеклянными воронками, в которые впаяны стеклянные пластинки. По размерам пор стеклянные фильтры делятся на четыре но- Л мера. Чем больше номер фильтра, тем меньше сечение пор. [c.23]
Взаимодействие кислот окислителей с металлами и неметаллами. 1. В пробирку с газоотводной трубкой поместите медные стружки и прилейте 2—3 мл концентрированной азотной кислоты, слегка подогрейте. Выделяющийся бурый газ поглощается водой. Обнаружьте в образовав- [c.57]
Кислоты-окислители переводят марганец в раствор также в виде аквакатиона марганца (П) рений (и, по-видимому, технеций) дают соединения со степенью окисления ( + УП) [c.241]
Цинк и кадмий вытесняют водород нз кислот ртуть растворяется только в кислотах-окислителях, причем если кислота а избытке, го образуются соли Hg . при недостатке — соли Hgj [c.563]
Реакционная способность элементов (VA группы усиливается при повышении температуры. Так, при нагревании они реагируют с металлами и неметаллами, а также с кислотами-окислителями, например [c.203]
Следует обратить внимание на то, что взаимодействие металлов с кислотами-окислителями (такими, как азотная кислота, в которой металлом восстанавливается не ион Н , а атом К , точнее-анион КОз) не подчиняется ряду напряжений (К в нем отсутствует). Эти реакции зависят от силы восстановителя и окислителя (у последнего сила больше, чем у иона Н» ). Например, азотная кислота окисляет не только металлы, стоящие до водорода, но и медь, серебро, ртуть [c.159]
Ванадий можно перевести в раствор с помощью кислот-окислителей [c.235]
В кислотах-окислителях хром пассивируется (образуется пленка очень устойчивого оксида СггОз). Молибден и вольфрам с кислотами-неокислителями в водном растворе не реагируют они могут быть переведен.ы в раствор при действии смеси концентрированных азотной и фтороводородной кислот [c.238]
Металлы семейства платины переводятся в раствор только под воздействием кислот-окислителей (концентрированная азотная кислота, царская водка и др.), например [c.244]
Под действием концентрированных кислот — окислителей на некоторых металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и не реагируют с ней) такие металлы как Ве, Bi, Со, Ре, М и КЬ, а в концентрированной азотной кислоте-металлы А1, Ве, В1, Со, Сг, Ре, ЫЬ, №, РЬ, ТЬ и и. [c.158]
При действии кислот — окислителей железо окисляется до Fe (П1) [c.129]
Фторэластомеры этого типа растворимы в перфторнрованных растворителях, но не растворяются и не набухают почти во всех органических жидкостях, не взаимодействуют с кислотами, окислителями, восстанавливающими агентами. В отличие от сополимеров на основе винилиденфторида рассматриваемые фторкаучуки устойчивы к основаниям. [c.511]
При нагревании хром растворяется также в разбавленной серной кислоте, но не взаимодействует с азотной и концентрированиой серной кислотами. Это объясняется тем, что кислоты-окислители пассивируют хром, образуя на его поверхности очень плотный слой химически малоактивной окиси хрома СГ2О3. [c.371]
Только для этих элементов известны сульфиды состава ЭгЗ . Это черные твердые вещества, растворяются в кислотах окислителях (при этом происходит окисление S- и образование НЭО4). [c.550]
Нормальный электродный потенциал серебра равен 4-0,799 а, т. с. значительно положительнее.
потенциала водородного электрода, и по этой причине серебро является термодинамически устойчивым материалом в иеокислительных средах, в том числе в неаэрированных растворах соляной и плавиковой кислот.
Наличие в растворах этих кислот окислителей оказывает ускоряющее влияние на коррозию серебра. [c.275]
Сочетание атомов углерода разных гибридных состояний в единой полимерной структуре порождает множество аморфных форм углерода. Типичным примером аморфного углерода является так называемый стеклоуглерод. В нем беспорядочно связаны между собой структурные фрагменты алмаза, графита и карбина.
Его получают термическим разложением некоторых углеродистых веществ. Стеклоуглерод — новый конструкционный материал с уникальными свойствами, не присущими обычным модификациям углерода.
Стеклоуглерод тугоплавок (остается в твердом состоянии вплоть до 3700°С), по сравнению с большинством других тугоплавких материалов имеет небольшую плотность (до 1,5 г см ), обладает высокой механической прочностью, электропроводен. Стеклоуглерод весьма устойчив во многих агрессивных средах (расплавленных щелочах и солях, кислотах, окислителях и др.).
Изделия из стеклоуглерода самой различной формы (трубки, цилиндры, стаканы и пр.) получают при непосредственном термическом разложении исходных углеродистых веществ, в соответствующих формах или прессованием стеклоуглерода.
Уникальные свойства стеклоуглерода позволяют использовать его в атомной энергетике, электрохимических производствах, для изготовления аппаратуры для особо агрессивных сред. Стекловидное углеродистое волокно, обладая низким удельным весом, высокой прочностью на разрыв и повышенной термостойкостью, может найти применение в космонавтике, авиации и других областях. [c.450]
Труднорастворимые соли меди (II). 1. Сульфид. В пробирку с 1—2 мл раствора сульфата или хлорида меди прилейте сероводородной воды. Наблюдайте выпадение черного осадка. Испытайте его взаимодействие с кислотами-окислителями HNO3, H2SO4 (конц.) при нагревании. [c.270]
Расположена в ряду напряжений до водорода, водород из кислот не вытесняет. С кислотами-окислителями см. пп. 5.10. (с HNOJ), 4.5.4. (с Н ЗО . [c.313]
Темно-коричневый моносульфш олова SnS выпадает в осадок при действии HjS на растворы, содержащие Sn. Осадок SnS не растворяется в разбавленных кислотах, но растворим в конц. НС1 и в кислотах-окислителях. Сульфид SnS не реагирует с сульфидом аммония, но растворяется в растворе дисульфида аммония [c.390]
Все сульфиды Аа, Sb, Б1 нерастворимы а воде и кислотах, не являющихся окислителями, но растворяются в кон1(ентрированных кислотах-окислителях [c.426]
Это черные твердые вецкества, растворяются в кислотах-окислителях (при этом происходит окислеиие У и образование НЭО ). [c.526]
Концентрированные кислоты — окислители (НМОз, Н2504) пассивируют железо (причины те же, что и у алюминия или хрома).
Пассивированное железо при обычных условиях не реагирует с разбавленными кислотами, не вытесняет из них водорода, не вытесняет медь из раствора сульфата меди.
Очищенное от окиснон пленки железо вытесняет металлы РЬ, 5п, Си, Ад, Н и Аи из растворов их солей. [c.352]
В ряду напряжений мышьяк, сурьма и висмут располагаются между водородом и медью. Поэтому они могут растворяться только в кислотах-окислителях — HNO3, концентрированной H2SO4 и др. [c.189]
Точнее, восстанавливается только электроноактивная частица (атом или ион). Если она входит в состав молекулы сложного вещества, то говорят о восстановлении всего вещества. Например, во многих реакциях HNO3, претерпевшая химическое превращение, переходите N0.
При этом восстанавливается только азот (окислительное число азота 4-5 в HNO3 становится равным 4-2 в N0). Однако на- практике говорят о восстановлении азотной кислоты до окиси азота. Азотная кислота — окислитель, но сама окисляться не может. Аналогично и для случаев окисления.
[c.106]
Халькогениды титана(IV), образующиеся при прямом синтезе из простых веществ, взятых в стехиометрических количествах, малорастворимы в воде.
Объясните, почему они ме выпадают из водного раствора солей титана (IV) при добавлении растворимых сульфидов.
В учебниках есть указание на то, что данные халькогениды растворимы в концентрированных растворах кислот-окислителей (H2SO4, HNO3) и щелочей (NaOH, КОН). Составьте уравнения всех описанных реакций. [c.132]
Область применения метода. Кулоиометрическое титрование может применяться во всех случаях, где используются методы обычного объемного анализа.
Различие состоит в том, что при ку-лопометрическом титровании могут применяться малоустойчивые реактивы соединения урана (V), меди (I), серебра (II), титана (III), олова (II), бром, хлор и др., с которыми очень трудно работать нри обычных способах объемного анализа.
Можно использовать микрокулопометрию, когда анализ проводят в малых объемах (0,01 мл). В этом случае при использовании сравнительно разведенных растворов кислот, окислителей или восстановителей можно определять до 10 —10 г-иона вещества. [c.73]
HNO3, то ка его поверхности образуется оксидная (Fe) пленка, которая не растворяется и кислотах — окислителях. Икая окислительная pe/ui обусловливает и другой результат реакций. [c.93]
РЬЗе и РЬТе представляют собой темные кристаллические вещества, устойчивые при обычных температурах и диссоциирующие при нагревании на РЬ и 8е(Те) устойчивы к плавиковой и соляной кислотам и к растворам щелочей кислотами-окислителями (НЫОз, Н2504) перевод дятся в соответствующие соли свинца и окислы 5е и Те. [c.206]






