- 1. Типичные свойства кислот:
- 2. Специфические свойства азотной кислоты как окислителя
- Урок 24. Выделение водорода в реакциях кислот с металлами – HIMI4KA
- Азотная кислота
- Окислительные свойства азотной кислоты | Дистанционные уроки
- Обсуждение: «Окислительные свойства азотной кислоты»
- ПОИСК
- Особенности взаимодействия серной и азотной кислот с металлами
Азотная кислота – бесцветная гигроскопичная жидкость, c резким запахом, «дымит» на воздухе, неограниченно растворимая в воде. ткип. = 83oC.. При хранении на свету разлагается на оксид азота (IV), кислород и воду, приобретая желтоватый цвет:
- 4HNO 3 = 4NO 2 + 2H 2 O + O 2 .
- Азотная кислота ядовита.
В растворе — сильная кислота; нейтрализуется щелочами, гидратом аммиака, реагирует с основными оксидами и гидроксидами, солями слабых кислот. Сильный окислитель; реагирует с металлами, неметаллами, типичными восстановителями.
Концентрированная кислота пассивирует Al, Be, Bi, Со, Cr, Fe, Nb, Ni, Pb, Th, U; не реагирует с Au, Ir, Pt, Rh, Та, W, Zr. Не разрушает диоксид кремния.
Смесь концентрированных HNO3 и HCl («царская водка») обладает сильным окислительным действием (превосходит чистую HNO 3 ), переводит в раствор золото и платину. Еще более активна смесь концентрированных HNO3 и HF.
M r = 63, 01; d = 1, 503 (25) ; t пл = -41, 6 o C; t кип +82,6 o C (разл.).


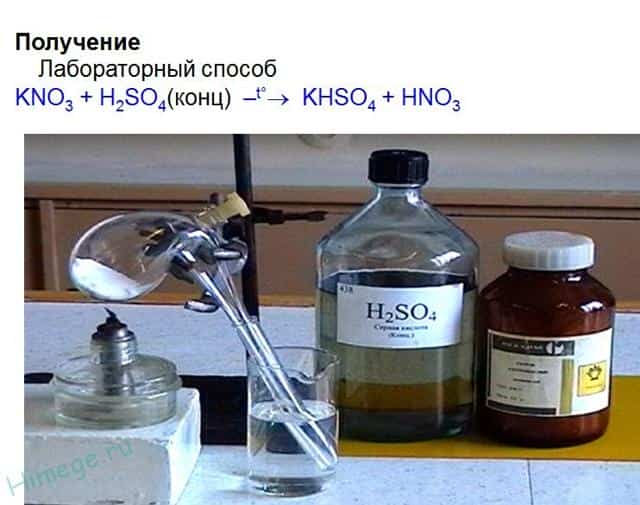
1. Типичные свойства кислот:
- 1) Взаимодействует с основными и амфотерными оксидами:
- 2HNO 3 + CuO = Cu(NO 3 ) 2 + H 2 O
- 6HNO 3 + Al 2 O 3 = 2Al(NO 3 ) 3 + 3H 2 O
- 2) С основаниями, амфотерными гидроксидами:
- HNO 3 + NaOH = NaNO 3 + H 2 O
- 2HNO 3 + Zn(OH) 2 = Zn(NO 3 ) 2 + 2H 2 O
- 3) Вытесняет слабые кислоты из их солей:
- 2HNO 3 + Na 2 CO 3 = 2NaNO 3 + H 2 O + CO 2
- 2HNO 3 + Na 2 SiO 3 = H 2 SiO 3 ↓+ 2NaNO 3
2. Специфические свойства азотной кислоты как окислителя
1) Взаимодействие азотной кислоты с металлами В качестве окислителя выступает азот в степени окисления +5, а не водород. В результате реакций образуется продукт восстановления нитрат-иона, соль и вода.
Глубина восстановления нитрат-иона зависит от концентрации кислоты и от положения металла в электрохимическом ряду напряжений металлов. Возможные продукты взаимодействия металлов с азотной кислотой приведены в таблице ниже.
Чем активнее металл и выше степень разбавления кислоты, тем глубже происходит восстановление нитрат-ионов азотной кислоты .
-
-
- 4 HN +5 O 3( конц .) + Cu 0 = Cu +2 (NO 3 ) 2 + 2 N +4 O 2 + 2 H 2 O
- N +5 + 1e → N +4 2 окислитель, пр-с восстановления
- Cu 0 – 2e → Cu +2 1 восстановитель, пр-с окисления
- 8 HN +5 O 3( разб .) + 3 Cu 0 = 3 Cu +2 (NO 3 ) 2 + 2 N +2 O + 4 H 2 O
- N +5 + 3e → N +2 2 окислитель, пр-с восстановления
- Cu 0 – 2e → Cu +2 3 восстановитель, пр-с окисления
- 2) Проявляет окислительные свойства при взаимодействии с неметаллами:
- S + 6HNO 3 (конц) = H 2 SO 4 + 6NO 2 + 2H 2 O;
- B + 3HNO 3 = H 3 BO 3 + 3NO 2 ;
- 3P + 5HNO 3 + 2H 2 O = 5NO + 3H 3 PO 4 .
- 3) Азотная кислота окисляет сложные вещества:
- 6HI + 2HNO 3 = 3I 2 + 2NO + 4H 2 O;
- FeS + 12HNO 3 = Fe(NO 3 ) 3 + H 2 SO 4 + 9NO 2 + 5H 2 O.
- 4) Ксантопротеиновая реакция: Азотная кислота окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук – «ксантопротеиновая реакция»).
Реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляют концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака (в щелочной среде) окраска переходит в оранжевую.
Появление окрашивания свидетельствует о наличии ароматических аминокислот в составе белка. 
- 5) Окислительные свойства «царской водки»:
- Смесь концентрированных азотной и соляной кислот в объемном соотношении 1 : 3 обладает еще большей окислительной активностью, они могут растворять даже золото и платину:
- HNO 3 + 4HCl + Au = H[AuCl 4 ] + NO + 2H 2 O;
- 4HNO 3 + 18HCl + Pt = 3H 2 [PtCl 6 ] + 4NO + 8H 2 O
4HNO 3 = 4NO 2 + 2H 2 O + O 2 (комн., на свету).
HNO 3 + H 2 O = NO 3 – + H 3 O + .
HNO 3 (разб.) + NaOH = NaNO 3 + H 2 O ,
HNO 3 (разб.) + NH 3 · H 2 O = NH 4 NO 3 + H 2 O.
- 2HNO 3 (2-3%-я) + 8H 0 (Zn, разб. H 2 SO 4 ) = NH 4 NO 3 + 3H 2 O,
- 2HNO 3 (5%-я) + 8H 0 (Mg, разб. H 2 SO 4 ) = N 2 O ↑ + 5H 2 O,
- HNO 3 (30%-я) + 3H 0 (Zn, разб. H 2 SO 4 ) = NO 2 ↑ H 2 O,
HNO 3 (60%-я) + 2H 0 (Zn, разб. H 2 SO 4 ) = HNO 2 + H 2 O. (кат Pd)
2HNO 3 (конц.) +Ag = AgNO 3 + NO 2 ↑ + H 2 O.
- 8HNO 3 (разб.) + 3Cu = 3Cu(NO 3 ) 2 + 2NO↑ + 4H 2 O
- 10HNO 3 (разб.) + 4Mg = 4Mg(NO 3 ) 2 +N 2 O↑ + 5H 2 O (примесь H 2 )
- 12HNO 3 (разб.) + 5Sn — t —5Sn(NO 3 ) 2 + N 2 ↑ + 6H 2 O (примесь NO)
30HNO 3 (оч. разб.) + 8Al = 8Al(NO 3 ) 3 + 3 NH 4 NO 3 + 9H 2 O (примесь H 2 )
12HNO 3 (оч. разб.) + 5Fe = 5Fe(NO 3 ) 2 + N 2 ↑ + 6H 2 O (0-10 o C),
4HNO 3 (разб.) + Fe = Fe(NO 3 ) 3 + NO↑ + 2H 2 O.
4HNO 3 (конц., гор.) + Hg = Hg(NO 3 ) 2 + 2NO 2 ↑ + 2H 2 O,
8HNO 3 (разб., хол) + 6Hg = 3Hg 2 (NO 3 ) 2 + 2NO ↑ + 4H 2 O.
6HNO 3 (конц.) + S = H 2 SO 4 + 6NO 2 ↑ + 2H 2 O (кип.),
2HNO 3 (конц.) + 6HCl(конц.) = 2NO↑ + 3Cl 2 ↑ + 4H 2 O (100-150 o C).
HNO 3 (конц.) + 4HCl(конц.) + Au = H[AuCl 4 ] + NO↑ + 2H 2 O.
4HNO 3 (конц.) + 18HCl(конц.) + 3Pt = 3H 2 [PtCl 6 ] + 4NO↑ + 8H 2 O
4HNO 3 (конц.) + 18HF(конц.) + 3Si = 3H 2 [SiF 6 ] + 4NO↑ + 8H 2 O.
4HNO 3 (дымящ.) + P 4 O 10 = 2N 2 O 5 + 4HPO 3 (в атмосфере O 2 +O 3 )
Урок 24. Выделение водорода в реакциях кислот с металлами – HIMI4KA
Архив уроков › Химия 8 класс
В уроке 24 «Выделение водорода в реакциях кислот с металлами» из курса «Химия для чайников» познакомимся с рядом активности металлов, а также больше узнаем о кислотах в химических реакциях.

Характерное химическое свойство кислот — выделение из них водорода в реакциях с некоторыми металлами. Атомы металлов замещают атомы водорода в молекулах кислот, в результате чего водород выделяется в виде газа.
В пробирку с хлороводородной кислотой опустим кусочек цинка. На поверхности металла образуются, а затем выделяются из раствора пузырьки газа. Соберем этот газ в пробирку и поднесем ее к пламени спиртовки (рис. 100). Мы услышим хлопок.
Это свидетельствует о наличии в пробирке водорода.
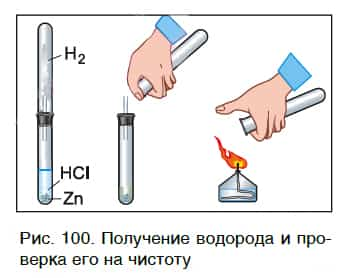
Каплю образовавшегося раствора поместим на стеклянную пластинку и подогреем ее в пламени спиртовки. После испарения воды на пластинке остается вещество белого цвета. Опытным путем можно установить, что состав этого вещества выражается формулой ZnCl2.
Теперь мы можем записать уравнение реакции цинка с кислотой:
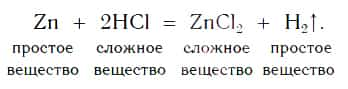
На рисунке 101 дана схема этой реакции. Из уравнения и поясняющей его схемы видим, что атомы цинка замещают атомы водорода в кислоте. В результате из простого вещества цинка и сложного вещества хлороводородной кислоты образуются два новых: сложное вещество ZnCl2 и простое вещество водород Н2.
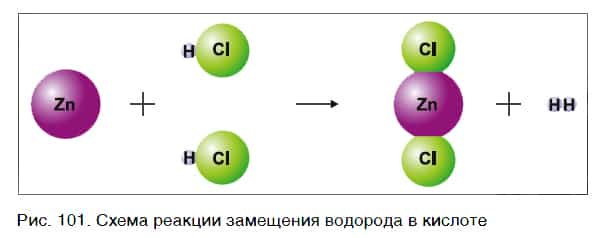
Так же протекают реакции алюминия, железа, других металлов и с раствором серной кислоты:
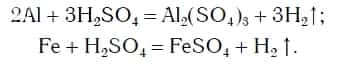
Эти химические реакции подтверждают, что кислоты являются сложными веществами, состоящими из атомов водорода, способных замещаться на атомы металла, и кислотных остатков.
При проведении опыта вы убедились, что алюминий энергично вытесняет водород из раствора хлороводородной кислоты. С железом реакция вытеснения водорода протекает менее энергично, а с медью вовсе не идет.
По интенсивности вытеснения водорода из кислот металлы можно разместить в ряд:
![]()
Его называют рядом активности или вытеснительным рядом металлов.
Чем левее расположен металл в вытеснительном ряду до водорода (Н2), тем активнее он вытесняет водород из кислот. Металлы, стоящие в ряду правее водорода, из кислот водород не вытесняют.
Зная расположение металлов в вытеснительном ряду, заранее можно предсказать:
- Будут ли реагировать металлы с кислотами с выделением водорода;
- Насколько активно будут протекать эти реакции.
Для получения водорода из кислот в лаборатории или школьном кабинете химии необходимо брать металлы, которые в вытеснительном ряду стоят до водорода. Но не каждый металл подходит для этих целей.
Активные металлы натрий и калий реагируют с кислотами со взрывом, а реакции кислот с оловом и свинцом протекают медленно. Наиболее подходящими металлами для практического получения водорода являются цинк и алюминий.
Как вы убедились, при проведении реакций этих металлов с раствором хлороводородной кислоты они протекают спокойно и достаточно быстро.
Краткие выводы урока:
- Кислоты — сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков.
- Металлы, стоящие в вытеснительном ряду до водорода, вытесняют его из кислот.
- В лаборатории водород получают в реакции металлов с кислотами.
Надеюсь урок 24 «Выделение водорода в реакциях кислот с металлами» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Азотная кислота
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.
- В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
- NH3 + O2 → (кат. Pt) NO + H2O
- KNO3 + H2SO4(конц.) → KHSO4 + HNO3↑
- Кислотные свойства
- CaO + HNO3 → Ca(NO3)2 + H2O
- HNO3 + NaOH → NaNO3 + H2O
- Na2CO3 + HNO3 → NaNO3 + H2O + CO2↑
- Термическое разложение
- Реакции с неметаллами
- Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2, если разбавленная — до NO.
- HNO3(конц.) + C → CO2 + H2O + NO2
- HNO3(конц.) + S → H2SO4 + NO2 + H2O
- HNO3(разб.) + S → H2SO4 + NO + H2O
- HNO3(конц.) + P → H3PO4 + NO2 + H2O
- Реакции с металлами
- Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием нитрата и преимущественно NO2.
- Cu + HNO3(конц.) → Cu(NO3)2 + NO2 + H2O
- С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
- Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
- В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2, NO, N2O, атмосферный газ N2, NH4NO3.
- Al + HNO3(конц.) ⇸ (реакция не идет)
- При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так как оксидная пленка на поверхности металлов разрушается.
- Al + HNO3 → (t) Al(NO3)3 + NO2 + H2O
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии выпадения осадка, выделения газа или образования слабого электролита.

При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в темном месте. HNO3 → (hv) NO2 + H2O + O2
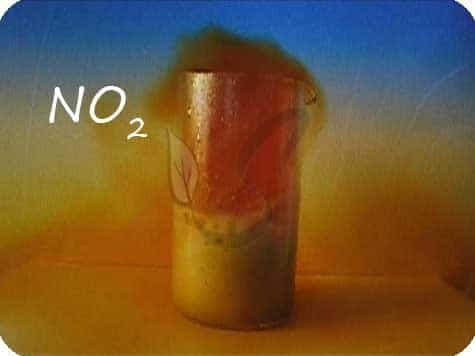
В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка с азотной кислотой в различных концентрациях.
Zn + HNO3(70% — конц.) → Zn(NO3)2 + NO2 + H2O
Zn + HNO3(35% — ср. конц.) → Zn(NO3)2 + NO + H2O
Zn + HNO3(20% — разб.) → Zn(NO3)2 + N2O + H2O
Zn + HNO3(10% — оч. разб.) → Zn(NO3)2 + N2 + H2O
Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.
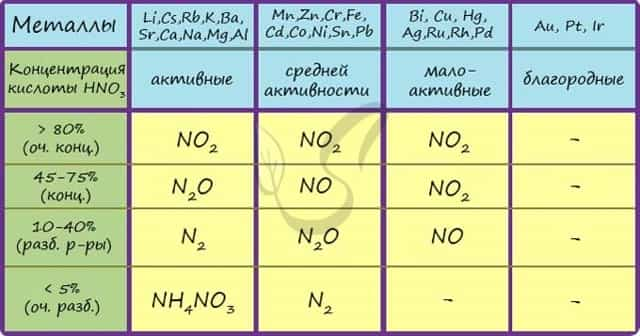
Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит за счет оксидной пленки, которой покрыты данные металлы.
- Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
- Fe + HNO3(разб.) → Fe(NO3)2 + N2O + H2O
- В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.
- MgO + HNO3 → Mg(NO3)2 + H2O
- Cr(OH)3 + HNO3 → Cr(NO3)3 + H2O
- Нитрат аммония получают реакция аммиака с азотной кислотой.
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная кислота — до +2.
Fe + HNO3(разб.) → Fe(NO3)2 + N2O + H2O
Fe + HNO3(конц.) → Fe(NO3)3 + NO + H2O
- Реакции с металлами, основаниями и кислотами
- Hg(NO3)2 + Mg → Mg(NO3)2 + Hg
- Pb(NO3)2 + LiOH → Pb(OH)2 + LiNO3
- AgNO3 + KCl → AgCl↓ + KNO3
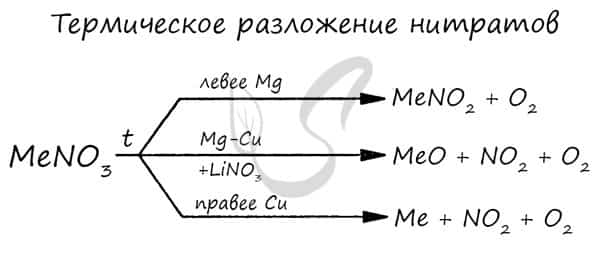
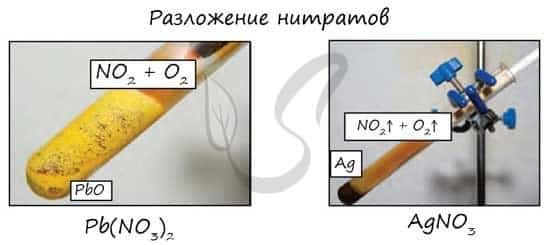
- Разложение нитратов
- Pb(NO3)2 → (t) PbO + NO2 + O2
- NaNO3 → (t) NaNO2 + O2
- Cu(NO3)2 → (t) CuO + NO2 + O2
- PtNO3 → (t) Pt + NO2 + O2
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).

Ba(NO3)2 + Na2SO4 → BaSO4 + NaNO3
Нитраты разлагаются в зависимости от активности металла, входящего в их состав.
Окислительные свойства азотной кислоты | Дистанционные уроки
Окислительные свойства азотной кислоты.
ОВР в статье специально выделены цветом. Обратите на них особое внимание. Эти уравнения могут попасться в ЕГЭ.

- автор статьи — Саид Лутфуллин
- Азотная кислота – в любом виде (и разбавленная, и концентрированная) является сильным окислителем.
Причем, разбавленная восстанавливается глубже, чем концентрированная.
Окислительные свойства обеспечиваются азотом в высшей степени окисления +5
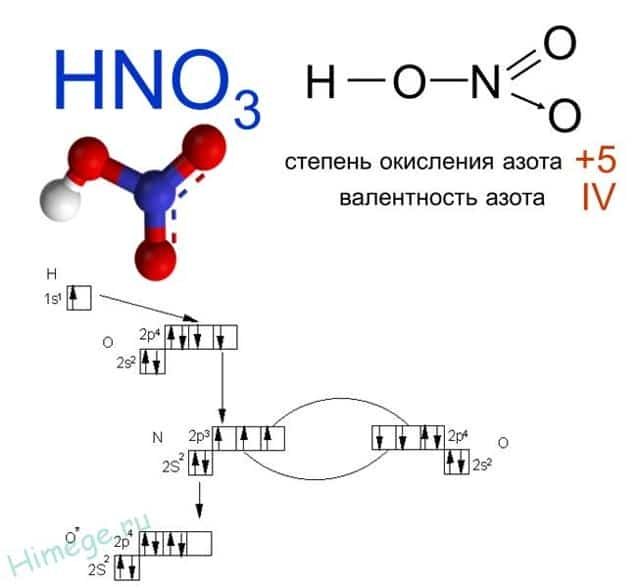
Какая валентность у азота в этом соединении? Вопрос очень хитрый, многие отвечают на него корректно. У азота в азотной кислоте валентность IV.
Атом азота не может образовать больше ковалентных связей, посмотрите на электронную диаграмму:
- Три связи с каждым атомом кислорода, и четвертая как бы распределяется, образуется полуторная связь. Таким образом, валентность азота IV, а степень окисления +5
- Первое самое интересное свойство: взаимодействие с металлами.
Водород при взаимодействии с металлами никогда не выделяется
- Схема реакции азотной кислоты (и разбавленной, и концентрированной) с металлами:
- HNO3 + Ме → нитрат + H2O + продукт восстановленного азота
- Два нюанса:
1. Алюминий, железо и хром с концентрированной азотной кислотой в нормальных условиях не реагируют, из-за пассивации. Нужно нагреть.
2. С платиной и золотом концентрированная азотная кислота не реагирует вообще.
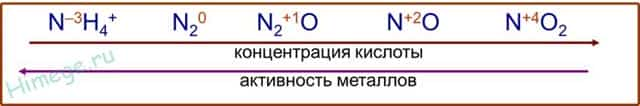
- Чтобы понять до чего вообще может восстанавливаться азот, посмотрим на диаграмму его степеней окисления:
- Азот +5 – окислитель, будет восстанавливаться, то есть понижать степень окисления.
Все возможные продукты восстановления азотной на диаграмме обведены красным.
(Не все конечно, такие реакции вообще что угодно дать могут, но в ЕГЭ образуются только эти).
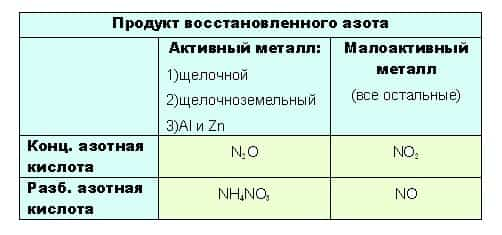
Определить какой именно продукт будет образовываться можно чисто логически:
- до таких низких степеней окисления как -3 или +1, с образованием продуктов NH4NO3 или N2O соответственно, азот восстанавливают только достаточно сильные, активные металлы: щелочные — 1-я группа главная подгруппа, щелочноземельные, а так же Al и Zn. Как ранее уже было сказано, разбавленная кислота восстанавливается глубже, поэтому при взаимодействии активных металлов с конц. азотной кислотой образуется N2O, а при взаимодействии с разб. азотной кислотой NH4NO3.
- 4Ba + 10HNO3(конц.) → 4Ba(NO3)2 + 5H2O + N2O↑
- 4Ba + 10HNO3(разб.) → 4Ba(NO3)2 + 3H2O + NH4NO3
- 8Li + 10HNO3(конц.) → 8LiNO3 + 5H2O + N2O↑
- 8Li + 10HNO3(разб.) → 8LiNO3 + 3H2O + NH4NO3
- 8Al + 30HNO3(конц.) (t)→ 8Al(NO3)3 + 15H2O + 3N2O↑
8Al + 30HNO3(разб.) → 8Al(NO3)3 + 9H2O + 3NH4NO3
Остальные металлы восстанавливают азотную кислоту до +2 или +4, с образованием продуктов соответственно: NO или O2.
Разбавленная кислота восстанавливается глубже
- при взаимодействии с ней металлов, не отличающихся особой активностью, будет образовываться NO. Ну а с конц. азотной NO2:
Cu + 4HNO3(конц.) → Cu(NO3)2 + 2H2O + 2NO2↑
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 4H2O + 2NO↑
- Fe + 6HNO3(конц.) (t)→ Fe(NO3)3 + 3H2O + 3NO2↑
- Fe + 4HNO3(разб.) → Fe(NO3)3 + 2H2O + NO↑
- (обратите внимание, что железо окисляется до высшей степени окисления)
- Ag + 2HNO3(конц.) → AgNO3 + H2O + NO2↑
- 3Ag + 4HNO3(разб.) → 3AgNO3 + 2H2O + NO↑
- Если тяжело сразу понять всю логичность выбора, вот таблица:
- Азотная кислота окисляет неметаллы до высших оксидов.
- Так как неметаллы – не такие сильные восстановители, как активные металлы, азот может восстановиться только до +4, образовав NO2 или NO соответственно.
- При окислении неметаллов концентрированной азотной кислотой образуется бурый газ (NO2), а если кислота разбавленная, то образуется NO. Схемы реакций следующие:
- неметалл + HNO3(разб.) → соединение неметалла в высшей степени окисления + NO
- неметалл + HNO3(конц.) → соединение неметалла в высшей степени окисления + NO2
- C + 4HNO3(конц.) → CO2↑ + 2H2O + 4NO2↑
- 3C + 4HNO3(разб.) → 3CO2↑ + 2H2O + 4NO↑
- (угольная кислота не образуется, так как она не стабильна)
- P + 5HNO3(конц.) → H3PO4 + H2O + 5NO2↑
- 3P + 5HNO3(разб.) + 2H2O → 3H3PO4 + 5NO↑
- B + 3HNO3(конц.) → H3BO3 + 3NO2↑
- B + HNO3(разб.) + H2O → H3BO3 + NO↑
S + 6HNO3(конц.) → H2SO4 + 2H2O + 6NO2↑
S + 2HNO3(разб.) → H2SO4 + 2NO↑
- концентрированная азотная кислота окисляет сероводород. Окисление идет глубже при нагревании:
2HNO3(конц.) + H2S → S↓ + 2NO2 + 2H2O
H2S + 8HNO3(конц.) → H2SO4 + 8NO2↑ + 4H2O
- концентрированная азотная кислота окисляет сульфиды до сульфатов:
CuS + 8HNO3(конц.) → CuSO4 + 4H2O + 8NO2↑
- азотная кислота настолько сурова, что может окислить даже ГАЛОГЕН. Только один – иод. Разбавленная восстанавливается глубже: до +2, концентрированная до +4. А вот иод окисляется не до высшей степени окисления +7 (слишком круто), а до +5, образуя иодноватую кислоту HIO3:
10HNO3(конц.) + I2 (t)→ 2HIO3 + 10NO2↑ + 4H2O
10HNO3(разб.) + 3I2 (t)→ 6HIO3 + 10NO↑ + 2H2O
- концентрированная азотная кислота реагирует с хлоридами и фторидами. Только следует понимать, что с фторидами и хлоридами протекает обычная реакция ионного обмена с вытеснением галогеноводорода и образованием нитрата:
NaCl(тв.) + HNO3(конц.) → HCl↑ + NaNO3
NaF(тв.) + HNO3(конц.) → HF↑ + NaNO3
- А вот с бромидами и иодидами (и с бромоводородами, и с иодоводородами) протекает ОВР. В обоих случаях образуется свободный галоген, а азот восстанавливается до NO2:
8HNO3(конц.) + 6KBr(тв.) → 3Br2 + 4H2O + 6KNO3 + 2NO2↑
4HNO3(конц.) + 2NaI(тв.) → 2NaNO3 + 2NO2↑ + 2H2O + I2↓
- Образовавшийся иод окисляется дальше до иодноватой кислоты, поэтому реакцию можно записать сразу:
- 7HNO3(конц.) + NaI → NaNO3 + 6NO2↑ + 3H2O + HIO3
- То же самое происходит при взаимодействии с иодо- и бромоводородами:
- 2HNO3(конц.) + 2HBr → Br2 + 2NO2↑ + 2H2O
- 6HNO3(конц.) + HI → HIO3 + 6NO2↑ + 3H2O
Реакции с золотом, магнием, медью и серебром
Обсуждение: «Окислительные свойства азотной кислоты»
(Правила комментирования)
ПОИСК
Составить уравнения реакций взаимодействия разбавленной азотной кислоты с металлами (в скобках указана валентность) а) цинком (И) б) медью (II) в) алюминием (III) г) натрием (I).
Составить уравнения реакций взаимодействия концентрированной азотной кислоты с металлами д) медью (II) е) цинком (И) ж) кальцием (И), [c.99]
Fe+2H l=Es» lj+Hj 2Ре+ЗС1=2Е » Оз Большую часть подобных реакций удобнее рассматривать с помощью метода электронно-ионного баланса.
Однако мы продемонстрируем, что при хорошем владении методом электронного баланса Вы вполне сможете подобрать коэффициенты для таких реакций. Как пример рассмотрим взаимодействие азотной кислоты с металлами.
Известно, что в этих реакциях не выделяется водород, поскольку окислительная способность азота в степени окисления +5 значительно выше, чем протона Н . При этом азотная кислота [c.97]
Написать уравнения соответствующих реакций. Сделать общие выводы о характере взаимодействия азотной кислоты с металлами. [c.179]
Чем существенно отличается действие разбавленной азотной кислоты на металлы от действия соляной и разбавленной серной кислот Какие ионы являются окислителем в первом случае и какие — во втором Приведите примеры реакций. [c.125]
Переходя к рассмотрению возможных вариантов реакций между менее концентрированными растворами азотной кислоты и металлами с меньшим алгебраическим значением нормального электродного потенциала [c.187]
Что представляет собой бурый газ, выделяющийся при действии концентрированной азотной кислоты на металлы Из каких молекул он состоит Почему его окраска усиливается при повышении температуры и ослабляется при ее понижении Будет ли этот газ подчиняться закону Бойля — Мариотта, если подвергать его сжатию при постоянной температуре Составить уравнения реакций, происходящих при растворении этого газа в воде и в растворе щелочи. [c.230]
Выполнение работы. В две пробирки — одну с концентрированной хлороводородной кислотой (6 н.), другую с концентрированной -азотной кислотой (плотность 1,2 г/см ) опустить по кусочку металлического хрома или феррохрома.
Наблюдать в первой пробирке выделение газа (какого ) и появление синей окраски раствора, характерной для ионов Сг +. Реагирует ли металл с кислотой во второй пробирке Слить азотную кислоту, промыть металл дистиллированной водой и добавить хлороводородную кислоту (6 н.).
Протекает ли реакция в этом случае Какое действие оказала азотная кислота на хром [c.229]
Специфические свойства азотной кислоты рассмотрены в курсе неорганической химии. Теперь ознакомимся с окислительными свойствами азотной кислоты более подробно. Может возникнуть вопрос чем объясняется характер взаимодействия азотной кислоты с металлами, т. е.
почему в этих реакциях вместо водорода преимущественно выделяются различные оксиды азота и даже азот и аммиак (При действии наиболее активных металлов на разбавленные водные растворы азотной кислоты происходит и частичное выделение водорода.
) Все это связано с исключительно сильными окислительными свойствами атома азота со степенью окисления — -5, который, окисляя атомы металлов, изменяет свою степень окисления до +4, +2, +1 и даже до О и —3 (табл. 30, с. 136). Рассмотрим примеры. [c.135]
В лаборатории оксид азота(IV) можио получить термическим разложением нитрата свинца (соли азотной кислоты) и по реакции концентрированной азотной кислоты с металлами [c.151]
Чем существенно отличается действие разбавленной азотной кислоты на металлы от действия соляной и разбавленной серной кислот Какой атом или ион является окислителем в первом случае и какой во втором Составьте уравнения реакций взаимодействия разбавленной азотной кислоты с ртутью и с кальцием, приняв во внимание положение этих металлов в ряду напряжений, [c.227]
При реакциях азотной кислоты с металлами практически никогда не выделяется водород. Например, в реакции [c.241]
Иллюстрацией к этой схеме могут быть следующие реакции взаимодействия азотной кислоты с металлами [c.352]
Ярким примером протекания параллельных реакций может служить взаимодействие металлов с азотной кислотой. Рис. 10.
7 иллюстрирует сказанное и одновременно показывает условность рассуждений о продуктах реакции азотной кислоты с металлами всегда образуется смесь таких продуктов восстановления кислоты, и лишь в некоторых случаях можно сказать о наличии преимущественного пути. [c.224]
В три пробирки (одну с конц. хлороводородной кислотой (6 н), вторую с конц. азотной кислотой, третью — с конц. серной кислотой) опустить по кусочку металлического хрома. Наблюдать в первой пробирке вьщеление газа (какого ), появление синей окраски раствора, характерной для ионов и ее быстрое изменение.
Протекает ли реакция во второй и в третьей пробирках Во второй пробирке слить азотную кислоту, промыть металл дистиллированной водой и добавить хлороводородную кислоту (6 н.). Протекает ли реакция в этом случае Какое действие оказала азотная кислота на хром Составить уравнения протекающих реакций. [c.
42]
Аммиак и азотная кислота, вообще, являются любимыми темами вступительного экзамена.
Редкий билет не содержит задач, связанных с восстановительными свойствами аммиака, термическим разложением солей аммония или реакциями азотной кислоты с металлами или неметаллами.
В вузах, где химия является профилирующим экзаменом, часто встречаются задания на написание окислительно-восстановительных реакций с участием азотной кислоты или оксидов азота со сложными веществами. [c.108]
НЫОз —сильная кислота и сильный окислитель. Поэтому она взаимодействует почти со всеми металлами.
При взаимодействии азотной кислоты с металлами водород, как правило, не выделяется он окисляется, образуя воду.
Кислота же, в зависимости от концентрации и активности металла, может восстанавливаться до N02, N0, N20, N2 или NHэ. Третьим продуктом реакции является соль азотной кислоты. [c.228]
Решение. 1. Медь окисляется кислотой до наиболее характерной для этого металла степени окисления +2, т. е. образуется соль нитрат меди (II) Си(КО,)а. Продуктом восстановления разбавленной азотной кислоты малоактивным металлом является оксид азота (II) N0. Записываем схему реакции [c.88]
В этом разделе мы рассмотрели термодинамический подход, к определению наиболее вероятных продуктов окислительно-восста-новительных реакций, но не касались вопроса об их кинетике.
Общие соображения в этом отношении сводятся к тому, что быстрее идут гомогенные реакции в растворе, а медленными стадиями могут оказаться образование или разрушение твердой фазы или молекул газа. Зачастую образование тех или иных продуктов в реальных условиях будет определяться скоростью осаждения твердых продуктов или улетучивания газообразных.
Ярким примером влияния кинетических факторов на состав образующихся продуктов служат реакции азотной кислоты с металлами (разд. 23.6). [c.216]
Действие азотной кислоты на металлы. Почти все металлы разъедаются азотной кислотой. Такие металлы, как Си, Ад, Нд, В1, требуют для начала реакции присутствия азотистой кислоты при их взаимодействии с азотной кислотой не выделяется аммиак. [c.425]
Двуокись азота можно получить с примесью окиси азота, действуя неразведенной азотной кислотой на металлы, лучше всего на медные стружки. Эта реакция автокаталитическая. Двуокись азота — продукт реакции, но вместе с тем и ее катализатор.
Если заранее двуокись азота в азотной кислоте отсутствует, действие азотной кислоты на медные стружки вначале совершенно незаметно лишь с течением времени, по мере накопления окислов азота, растворение меди в азотной кислоте начинается и некоторое время идет во все ускоряющемся, темпе. [c.440]
Азотная кислота, особенно концентрированная, — сильный окислитель. Она окисляет серу до серной кислоты, фосфор — сначала до фос- фористой, а затем До фосфорной кислот.
Особенно энергично взаимодействует азотная кислота с металлами только золото, платина и некоторые металлы платиновой грзтгны не реагируют с ней.
Большинство реакций, в которые вступает айотная кислота, сопровождается выделением окиси азота, например [c.643]
Азотная кислота, как одноосновная, имеет только средние соли, называемые нитратами. Они получаются при действии азотной кислоты на металлы, их окислы или гидраты.
Большинство нитратов хорошо растворимо в воде, устойчиво при обычных температурных условиях. При нагревании сухие соли азотной кислоты разлагаются с выделением кислорода. Состав других продуктов реакции зависит от природы металла.
При нагревании нитратов натрия или калия образуются соли азотистой кислоты — нитриты [c.198]
Палит и Дар исследовали влияние на реакции азотной кислоты с металлами нескольких десятков веществ. Некоторые из них (мышьяковистая кислота, окись мышьяка, четыреххлористый углерод, фталевый ангидрид и др.) уве- [c.90]
При реакциях азотной кислоты с металлами реакции описываются схемами [c.68]
Таким образом, действие азотной кислоты на металлы сострит в том, что она их окисляет, сама же превращается, смотря по температуре, концентрации, в которой взята, по природе металла и по различным другим обстоятельствам, или в низшие степени соединения азота с кислородом, или в газообразный азот, или даже в аммиак.
Подобно металлам и другим простым телам, окисляются азотною кислотою и многие сложные тела, напр., низшие степени окислевия превращаются в высшие. Так, мышьяковистая кислота переходит в мышьяковую, закись железа в окись, сернистая кислота в серную, сернистые металлы М 5 в сернокислые соли М 50 и т. п.
, словом, азотною кислотою производится окисление, от нее отнимается кислород и передается многим другим телам. Некоторые тела окисляются крепкою азотною кислотою столь быстро и с таким отделением тепла, что происходит вспышка и воспламенение. Так, скипидар 0 Н воспламеняется, если его влить в дымящую азбтную кислоту.
По способности окислять, азотная кислота, конечно, способна отнимать водород от многих веществ.
Так, она разлагает иодистый водород, выделяя иод и образуя воду, и если в стклянку с газообразным иодистым водородом влить дымящейся азотной кислоты, то идет быстрая реакция, сопровождаемая пламенем и выделением фиолетовых ларов иода и бурых — окислов азота. [c.197]
При реакциях азотной кислоты с металлами окислителем является Водород не выделяется ни при каких условиях. [c.210]
Приведенные схемы иллюстрируют наиболее типичные случаи взаимодействия азотной кислоты с металлами и неметаллами. Вообще же, окислительновосстановительные реакции, идуш 1е с участием HNO3, протекают сложно. [c.439]
Другой косвенный метод [72] основан на вытеснении ионами серебра эквивалентного количества ионов меди из бензольного раствора комплексного соединения тетраметилтиурамдисульфида меди (тиурамат) и обесцвечивании окраски последнего.
Реакцию можно проводить в широком интервале pH раствора (от 1 до 12). Чувствительность определения 0,5 мкг серебра. Определению мешают ртуть и свободная азотная кислота, другие металлы в 1000-кратном избытке не мешают. Метод применен для анализа свинца.
[c.115]
Такие объяснения были слишком общими и поэтому они не могли быть применены для рассмотрения конкретных реакций, интересовавших в то время химиков-прак-тиков. Именно поэтому они и приступили к исследованию наиболее часто встречавшихся в тогдашней химической практике превращений — реакций замещения.
Так, знаменитый немецкий химик и технолог Иоганн Глаубер (1604—16ЬЬ) в 1656 г. установил, что серная кислота вытесняет азотную и соляную из их соединений и что кислоты по-разному растворяют металлы. По его наблюдениям азотная кислота растворяет металлы в следующей последовательности серебро, ртуть, медь, железо, олово, свинец. В этом.
Глаубер видел проявление различного химического сродства кислоты к металлам. [c.97]
Палладий растворим в азотной кислоте. Платиновые металлы могут быть переведены в растворимое состояние сплавлением со щелочами в присутствии окислителей (МагОг, КМОз).
Так, при сплавлении рутения с едким кали в присутствии нитрата калия образуется смесь легко растворимых в воде солей — рутената калия КгКи04 и перрутената калия ККи04.
Происходящие при этом реакции могут быть выражены следующими уравнениями [c.401]
Ход определения. Навеску 0,5 г анализируемой пробы растворяют в смеси 5 мл концентрированной соляной кислоты я Б мл концентрированной азотной кислоты. Реакция протекает бурно, по окончании ее ополаскивают стенки стакана (и стекло, которым он был покрыт) водой и разбавляют до 50—60 мл.
На каждые 0,5 г сплава прибавляют 3 г винной кислоты и нейтрализуют раствор концентрированным раствором аммиака по метиловому красному. Затем снова подкисляют раствор добавлением 10 мл 10%-ного раствора соляной кислоты и осаждают цинк вместе с другими 1яжелыми металлами раствором сульфида натрия и карбоната натрия (50 г безводного карбоната натрия и 100 г сульфида натрия в 1 л).
Для осаждения сульфидов и одновременной нейтрализации раствора обычно достаточно прибавления 15 мл этого раствора. Вводят немного фильтровальной бумажной массы, нагревают до кипения и оставляют на несколько минут. Затем фильтруют и промывают осадок горячей водой, содержащей в 100 мл 3 мл осаждающего реактива.
Осадок на фильтре растворяют в 15 мл горячей соляной кислоты (1 1) и фильтрат собирают в стакан, в котором проводилось осаждение. Фильтр промывают 4—5 раз горячей водой. К фильтрату добавляют 2—3 г хлорида аммония и бромной воды до окрашивания раствора, кипятят в течение 2 мин., подщелачивают аммиаком и после добавления бумажной массы снова кипятят. Осадок, содержащий железо, алюминий и т.п.
, отфильтровывают и основательно промывают горячим 1 %-ным раствором хлорида аммония. К фильтрату в колбе для титрования прибавляют 5 мл концентрированного раствора аммиака, [c.481]
Опыт 439. Восстановление концентрированной азотной кислоты медью. В зависимости от условий (концентрация, природа восстановителя, температура) азотная кислота НМОд может восстанавливаться до N0.2, N203. N0, К аО, N-2, ННз. Чтобы восстановление ее шло глубже, надо брать более разбавленную кислоту, применять сильный восстановитель и реакцию вести на холоду.
Концентрированная азотная кислота восстанавливается металлами до диоксида азота, разбавленная — до моноксида азота, а в случае наиболее активных металлов (Са, Mg, 2п и др.) — до оксида азота (I) ЫзО. Очень разбавленная азотная кислота такими металлами восстанавливается до аммиака (который с избытком кислоты образует соль — нитрат аммония). [c.
295]
По исследованию Монтемартини продукты, выделяющиеся при действии азотной кислоты на металлы (и количество их), находятся в непосредственной связи как с концентрацией азотной кислоты, так и со способностью металлов разлагать воду.
Металлы, разлагающие воду лишь при высокой температуре, при реакции на азотную кислоту дают NO-, N-0 и NO металлы же, разлагающие воду при менее высокой температуре, кроме указанных продуктов, дают еще №0, N и NH.
Наконец, металлы, разлагающие воду при обыкновенной температуре, кроме того развивают еще и водород. [c.518]
Об особенностях реакций азотной кислоты с металлами см. гл. VIII, 8. [c.228]
Как получить двуокись азота 4. Рассказать о свойствах двуокиси азота. 5. Выразить уравнением процесс, происходящий при растворении двуокиси азота в воде. 6. Рассказать о составе, строении и физических свойствах азотной кислоты. 7. Какие химические процессы происходят при получении азотной кислоты из аммиака Выразить их уравнениями реакций. 8. Как получают азотную кислоту из аммиака 9.
Как получают азотную кислоту в лабораторных условиях Привести уравнение реакции и условия ее осуществления. 10. Рассказать о химических свойствах азотной кислоты. И. Чем объясняются сильные окислительные свойства азотной кислоты Привести примеры, доказывающие эти свойства. 12. В чем особенность действия азотной кислоты на металлы 13.
Какие газы выделяются при действии на медь азотной кислотька) концентрированной, б) разбавленной Привести уравнения реакций. 14. Что такое царская водка Для чего ее применяют 15. Рассказать о применении азотной кислоты и о ее значении в народном хозяйстве. 16. Как называют соли азотной кислоты Примеры. 17. Привести формулы селитр, их названия и применение. 18.
Написать уравнение реакции, происходящей при нагревании азотнокислого [c.167]
Особенности взаимодействия серной и азотной кислот с металлами
- Разбавленная и концентрированная серная кислота обладает различными окислительно-восстановительными свойствами. В разбавленной серной кислоте окислителем является ион водорода, поэтому разбавленная серная кислота взаимодействует только с активными металлами, которые вытесняют из разбавленной серной кислоты водород, и не взаимодействует с малоактивными металлами (смотрите ряд активности – ряд напряжений металлов):
- Zn + H2SO4(разб.) → H2 + ZnSO4,
- Cu + H2SO4(разб.) → реакция не протекает
В концентрированной серной кислоте окислителем является ион SO , поэтому концентрированная серная кислота взаимодействует как с активными, так и малоактивными металлами, кроме золота и платиновых металлов. Нужно помнить, что концентрированная серная кислота пассивирует (делает пассивными) некоторые активные металлы, например железо. При взаимодействии металлов с концентрированной серной кислотой водорода не выделяется, металлы восстанавливают ион SO до различных состояний в зависимости от активности металла, площади поверхности его соприкосновения с кислотой, концентрации кислоты:
- H2S + Н2О+ соль металла и серной
- активный металл + H2SO4(конц.) S + Н2О+ кислоты (сульфат металла)
- SО2 + Н2О+
Малоактивный металл + H2SO4(конц.) → SО2 + Н2О + сульфат металла.
При взаимодействии некоторых неметаллов с концентрированной серной кислотой ион SO восстанавливается до SО2.
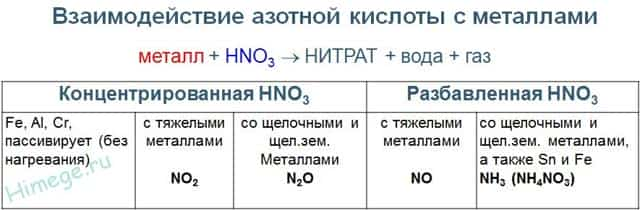
Разбавленная и концентрированная азотная кислота взаимодействует с активными металлами, кроме золота и платиновых металлов. В азотной кислоте окислителем является ион NO , поэтому при взаимодействии металлов с азотной кислотой водород не выделяется, а образуются различные продукты восстановления иона NO в зависимости от активности металла и концентрации кислоты. Концентрированная азотная кислота пассвирует некоторые активные металлы (алюминий, хром, железо и др.). Реакции протекают по схемам:
NH3 + H2O соль металла
NH4NO3 + H2O + и азотной
активный + НNO3(разб.). N2 + H2O кислоты – нитрат металла,
металл N2O + H2O
Малоактивный металл + HNО3(разб.). → NO + H2O + нитрат металла.
Активный металл + HNО3(конц.). → NO + H2O + нитрат металла.
Малоактивный металл + HNО3(конц.). → NO2 + H2O + нитрат металла.
При взаимодействии металлов с концентрированной азотной кислотой возможно образование и некоторых других продуктов окисления металлов.
Заказать ✍️ написание учебной работы






