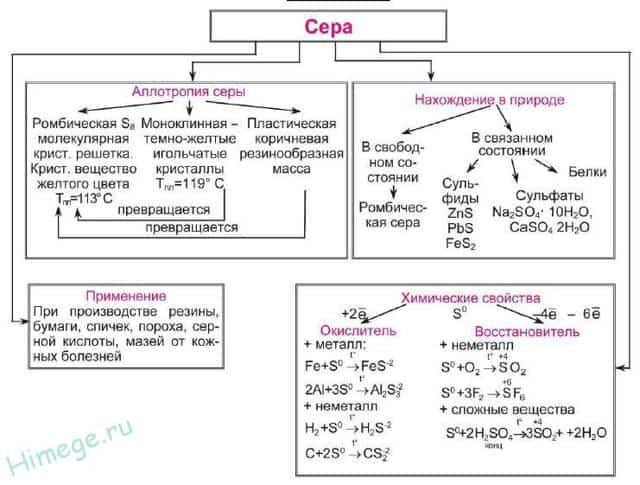
- Нахождение серы в природе
- Аллотропные модификации серы
- Получение серы
- Химические свойства серы
- Сероводород H2S и сульфиды- химические свойства
- Соединения серы +4: сернистый газ, сернистая кислота и её соли сульфиты.
- Серная кислота – химические свойства и промышленное производство
- Биологическая роль р-элементов VIA группы. Применение их соединений в медицине
- Реакции, взаимодействие серы. Уравнения реакции серы с веществами
- Реакции, взаимодействие серы с неметаллами. Уравнения реакции:
- Реакции, взаимодействие серы с металлами и полуметаллами. Уравнения реакции:
- Реакции, взаимодействие серы с оксидами. Уравнения реакции:
- Реакции, взаимодействие серы с солями. Уравнения реакции:
- Реакции, взаимодействие серы с кислотами. Уравнения реакции:
- Реакции, взаимодействие серы с водородсодержащими соединениями. Уравнения реакции:
- Реакции, связанные с изменением молекулярного состава серы:
- Сера (S)
- Сера, как простое вещество
- Химические свойства серы
- Аллотропные модификации серы
- α-сера
- β-сера
- Пластическая сера
- Получение и применение серы
- Химические свойства серы
- 2.3.2. Химические свойства кислорода и серы
- Химические свойства серы
- ПОИСК
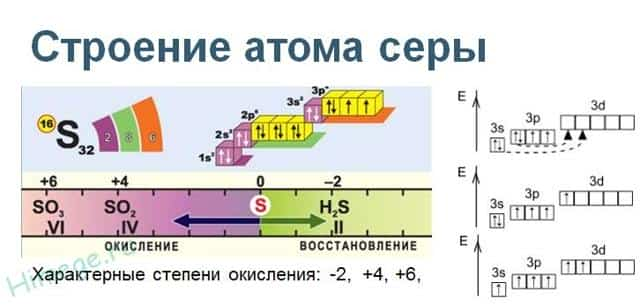
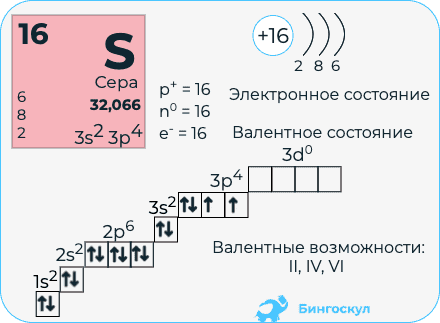
Сера расположена в ВИа группе Периодической системы химических элементов Д.И. Менделеева. На внешнем энергетическом уровне атома серы содержится 6 электронов, которые имеют электронную конфигурацию 3s 2 3p 4 .
В соединениях с металлами и водородом сера проявляет отрицательную степень окисления элементов -2, в соединениях с кислородом и другими активными неметаллами – положительные +2, +4, +6. Сера – типичный неметалл, в зависимости от типа превращения может быть окислителем и восстановителем.
 Нахождение серы в природе
Нахождение серы в природе
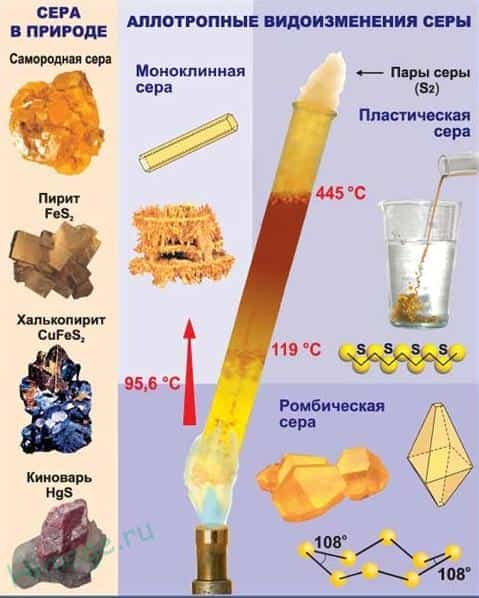
- Сера встречается в свободном (самородном) состоянии и связанном виде.
- Важнейшие природные соединения серы:
- FeS 2 — железный колчедан или пирит,
- ZnS — цинковая обманка или сфалерит (вюрцит),
- PbS — свинцовый блеск или галенит,
- HgS — киноварь,
- Sb 2 S 3 — антимонит.
Кроме того, сера присутствует в нефти, природном угле, природных газах, в природных водах (в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды). Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
Аллотропные модификации серы
Аллотропия — это способность одного и того же элемента существовать в разных молекулярных формах (молекулы содержат разное количество атомов одного и того же элемента, например, О 2 и О 3 , S 2 и S 8 , Р 2 и Р 4 и т.д).
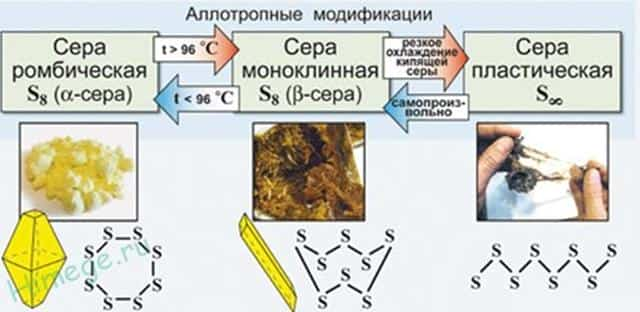
Сера отличается способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны S 8 , образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета.
- Открытые цепи имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую).
- 1) ромбическая — S 8
- t°пл. = 113°C; r = 2,07 г/см 3
- Наиболее устойчивая модификация.
- 2) моноклинная — темно-желтые иглы
- t°пл. = 119°C; r = 1,96 г/см 3
- Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
- 3) пластическая — коричневая резиноподобная (аморфная) масса
- Неустойчива, при затвердевании превращается в ромбическую
Получение серы
- Промышленный метод — выплавление из руды с помощью водяного пара.
- Неполное окисление сероводорода (при недостатке кислорода):
2H 2 S + O 2 → 2S + 2H 2 O
2H 2 S + SO 2 → 3S + 2H 2 O
Химические свойства серы
- Окислительные свойства серы ( S 0 + 2ē → S -2 )
- 1) Сера реагирует со щелочными металлами без нагревания:
- 2Na + S → Na 2 S
- c остальными металлами (кроме Au, Pt) — при повышенной t°:
- 2Al + 3S –→ Al 2 S 3
- Zn + S –→ ZnS
- 2) С некоторыми неметаллами сера образует бинарные соединения:
- H 2 + S → H 2 S
- 2P + 3S → P 2 S 3
- C + 2S → CS 2
- Восстановительные свойства сера проявляет в реакциях с сильными окислителями: ( S — 2ē → S +2 ; S — 4ē → S +4 ; S — 6ē → S +6 )
- 3) c кислородом:
- S + O 2 – t° → S +4 O 2
- 2S + 3O 2 – t °; pt → 2S +6 O 3
- 4) c галогенами (кроме йода):
- S + Cl 2 → S +2 Cl 2
- S + 3F 2 → SF 6
- Со сложными веществами:
- 5) c кислотами — окислителями:
- S + 2H 2 SO 4 (конц) → 3S +4 O 2 + 2H 2 O
- S + 6HNO 3 (конц) → H 2 S +6 O 4 + 6NO 2 + 2H 2 O
- Реакции диспропорционирования:
- 6) 3S 0 + 6KOH → K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O
- 7) сера растворяется в концентрированном растворе сульфита натрия:
- S 0 + Na 2 S +4 O 3 → Na 2 S 2 O 3 тиосульфат натрия
-
-

Сероводород H2S и сульфиды- химические свойства
Соединения серы +4: сернистый газ, сернистая кислота и её соли сульфиты.
Серная кислота – химические свойства и промышленное производство
Биологическая роль р-элементов VIA группы. Применение их соединений в медицине
Реакции, взаимодействие серы. Уравнения реакции серы с веществами
Сера реагирует, взаимодействует с неметаллами, металлами, полуметаллами, оксидами, кислотами, солями и пр. веществами.
- Реакции, взаимодействие серы с неметаллами
- Реакции, взаимодействие серы с металлами и полуметаллами
- Реакции, взаимодействие серы с оксидами
- Реакции, взаимодействие серы с солями
- Реакции, взаимодействие серы с кислотами
- Реакции, взаимодействие серы с водородсодержащими соединениями
- Реакции, связанные с изменением молекулярного состава серы
Реакции, взаимодействие серы с неметаллами. Уравнения реакции:
- 1. Реакция взаимодействия серы и водорода:
- H2 + S → H2S (t = 150-200 °C).
- Реакция взаимодействия водорода и серы происходит с образованием сероводорода.
- 2.
Реакция взаимодействия серы и кислорода:
- S + O2 → SO2 (t°).
Реакция взаимодействия серы и кислорода происходит с образованием оксида серы (IV). Образуется также примесь оксид серы (VI) SO3.
Данная реакция представляет собой сгорание серы на воздухе.
3. Реакция взаимодействия серы и фтора:
S + 3F2 → SF6.
Реакция взаимодействия серы и фтора происходит с образованием фторида серы (VI). Реакция протекает при комнатной температуре.
4. Реакция взаимодействия серы и красного фосфора:
4P + 9S → P4S9 (t = 550 °C, р).
Реакция взаимодействия красного фосфора и серы происходит с образованием нонасульфида тетрафосфора. Реакция протекает при избыточном давлении. Образуется также примесь P4S7.
Реакции, взаимодействие серы с металлами и полуметаллами. Уравнения реакции:
- 1. Реакция взаимодействия серы и кальция:
- Ca + S → CaS (t = 150 °C).
- Реакция взаимодействия кальция и серы происходит с образованием сульфида кальция.
- 2. Реакция взаимодействия серы и кобальта:
- Co + S → CoS (t ≈ 650 °C).
Реакция взаимодействия кобальта и серы происходит с образованием сульфида кобальта.
В результате реакции также образуются CoS2, Co3S4, Co9S8.
- 3. Реакция взаимодействия серы и калия:
- 2K + S → K2S (t = 100-200 °C).
- Реакция взаимодействия калия и серы происходит с образованием сульфида калия.
- 4. Реакция взаимодействия серы и лития:
- 2Li + S → Li2S (t > 130 °C).
- Реакция взаимодействия лития и серы происходит с образованием сульфида лития.
- 5. Реакция взаимодействия серы и натрия:
- 2Na + S → Na2S (t > 130 °C).
- Реакция взаимодействия натрия и серы происходит с образованием сульфида натрия.
- 6. Реакция взаимодействия серы и рубидия:
- 2Rb + S → Rb2S (t = 100-130 °C).
- Реакция взаимодействия рубидия и серы происходит с образованием сульфида рубидия.
- 7. Реакция взаимодействия серы и серебра:
- 2Ag + S → Ag2S (t > 200°C).
- Реакция взаимодействия серебра и серы происходит с образованием сульфида серебра.
- 8. Реакция взаимодействия серы и меди:
- 2Cu + S → Cu2S (t = 300-400 °C).
- Реакция взаимодействия меди и серы происходит с образованием сульфида меди.
- 9. Реакция взаимодействия серы и железа:
- Fe + S → FeS (t = 600-950°C).
- Реакция взаимодействия железа и серы происходит с образованием сульфида железа.
- 10. Реакция взаимодействия серы и цинка:
- Zn + S → ZnS (t = 130 °C).
- Реакция взаимодействия цинка и серы происходит с образованием сульфида цинка.
- 11. Реакция взаимодействия серы и таллия:
- 2Tl + S → Tl2S (t = 320 °C).
Реакция взаимодействия таллия и серы происходит с образованием сульфида таллия. Реакция протекает в атмосфере водорода.
Реакции, взаимодействие серы с оксидами. Уравнения реакции:
1. Реакция взаимодействия серы и оксида углерода (II):
CO + S → COS (t ≈ 350 °C).
Реакция взаимодействия оксида углерода (II) и серы происходит с образованием оксосульфида углерода. Катализатором может выступать углерод.
Реакции, взаимодействие серы с солями. Уравнения реакции:
- 1. Реакция взаимодействия серы и сульфита натрия:
- Na2SO3 + S → Na2S2O3 (t°)
- или
- 8Na2SO3 + S8 → 8Na2S2O3 (t°).
Реакция взаимодействия сульфита натрия и серы происходит с образованием тиосульфата натрия. Реакция происходит в кипящем водном растворе.
- 2. Реакция взаимодействия серы и сульфида калия:
- K2S + S → K2S2 (t°).
- Реакция взаимодействия сульфида калия и серы происходит с образованием дисульфида калия.
- 3. Реакция взаимодействия серы и трисульфида гадолиния:
- Gd2S3 + S → 2GdS2.
- Реакция взаимодействия трисульфида гадолиния с серой происходит с образованием сульфида гадолиния.
- 4. Реакция взаимодействия серы и сульфида таллия (I):
- Tl2S + 2S → Tl2S3.
- Реакция взаимодействия сульфида таллия (I) и серы происходит с образованием трисульфида таллия (I).
- 5. Реакция взаимодействия серы и сульфида бора (III):
- B2S3 + 2S → B2S5.
- Реакция взаимодействия сульфида бора (III) с серой происходит c образованием сульфида бора (V).
- 6. Реакция взаимодействия серы и трисульфида диванадия:
- V2S3 + 2S → V2S5.
- Реакция взаимодействия трисульфида диванадия с парами серы происходит с образованием сульфида ванадия.
Реакции, взаимодействие серы с кислотами. Уравнения реакции:
С концентрированными кислотами-окислителями сера реагирует только при длительном нагревании.
Реакции, взаимодействие серы с водородсодержащими соединениями. Уравнения реакции:
- 1. Реакция взаимодействия серы и гидрида рубидия:
- 2RbH + S → Rb2S + H2S (t = 300-350 °C).
- Реакция взаимодействия гидрида рубидия и серы происходит с образованием сульфида рубидия и сероводорода.
- 2. Реакция взаимодействия серы и йодоводорода:
- 2HI + S → I2 + H2S (t ≈ 500 °C).
- Реакция взаимодействия йодоводорода и серы происходит с образованием йода и сероводорода.
- 3. Реакция взаимодействия серы и селеноводорода:
- H2Se + S → Se + H2S.
Реакция взаимодействия селеноводорода и серы происходит с образованием селена и сероводорода. В ходе реакции используется насыщенный раствор селеноводорода.
Реакция медленно протекает при комнатной температуре.
- 4. Реакция взаимодействия серы и гидрида натрия:
- 2NaH + 2S → Na2S + H2S (t = 350-400 °C).
- Реакция взаимодействия гидрида натрия и серы происходит с образованием сульфида натрия и сероводорода.
- 5. Реакция взаимодействия серы и гидрида лития:
- 2LiH + 2S → Li2S + H2S (t = 300-350 °C).
- Реакция взаимодействия гидрида лития и серы происходит с образованием сульфида лития и сероводорода.
- 6. Реакция взаимодействия серы и гидрида калия:
- 2KH + 2S → K2S + H2S (t = 350 °C).
- Реакция взаимодействия гидрида калия и серы происходит с образованием сульфида калия и сероводорода.
Реакции, связанные с изменением молекулярного состава серы:
- 1. Реакция изменения молекулярного состава серы:
- S8 → S6 → S4 (t°).
- S4 → S2 (t = 800-1400 °C).
- S2 → S (t = 1700 °C).
- Реакция происходит при нагревании.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
Сера (S)
- Обозначение — S (Sulphur);
- Период — III;
- Группа — 16 (VIa);
- Атомная масса — 32,066;
- Атомный номер — 16;
- Радиус атома = 127 пм;
- Ковалентный радиус = 102 пм;
- Распределение электронов — 1s22s22p63s23p4;
- t плавления = 112,8°C;
- t кипения = 444,674°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 2,58/2,44;
- Степень окисления: +6; +4; +2; +1; 0; -1; -2;
- Плотность (н. у.) = 2,070 г/см3;
- Молярный объем = 15,5 см3/моль.
Соединения серы:
Точное время открытия человеком серы неизвестно — данное вещество было известно человеку еще с доисторических времен. Природная сера является светло-желтым порошкообразным веществом, массовая доля серы в земной коре составляет 0,03%.
В природе сера встречается, как в виде самородков, так и в виде разнообразных соединений: сульфидов (FeS2; FeCuS2) и сульфатов (BaSO4), входящих в состав разнообразных минералов (пирит, медный колчедан, гипс, барит). Также сера в виде соединений присутствует в природных углеводородах: нефте, газе, угле.
Сера является биогенным элементом — в организме человека массовая доля серы составляет 0,16%, сера входит в состав белков, аминокислот, гормонов.
Сера в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером «16», относится к 16(VIa) группе (см. Атомы 16(VIa) группы).
Атом серы содержит 16 электронов, при этом у серы, как и у атома кислорода, на внешнем энергетическом уровне находится 6 валентных электронов (см. Электронная структура атомов).
В отличие от кислорода, атом серы способен образовывать не только 2 (H2S) ковалентные связи, но и 4 (H2SO3) или 6 (H2SO4) (см. Ковалентная связь). Данное свойство объясняется наличием у атома серы свободного d-подуровня, на который могут переходить 1 или 2 электрона с s- или р-подуровня (см. Атомы 16(VIa) группы).
Сера, как простое вещество
Молекула S2 имеет строение, аналогичное O2.
В отличие от кислорода, сера может образовывать зигзазообразные цепи, но наиболее устойчивыми являются циклические молекулы серы, имеющие форму короны, в которую входят 8 атомов (S8) — α-сера. «Короны» с меньшим числом атомов менее устойчивы. Кроме этого, молекулы серы могут образовывать открытые цепи (S∞).
В ромбической модификации S8 — 8 атомов серы соединены между собой одинарными ковалентными связями — это твердые кристаллы желтого цвета, нерастворимые в воде, но хорошо растворяющиеся в органических растворителях, например, в сероуглероде.
Сера при высоких температурах может существовать в газообразном состоянии:
- S8
- S6 — 450°C
- S4 — 650°C
- S2 — 900°C
- S — 1500°C
Химические свойства серы
- Сера является типичным активным неметаллом.
- В воде сера практически не растворяется (даже не смачивается водой), а в органических растворителях сера растворяется хорошо.
- При взаимодействии с другими веществами сера может выступать, как в роли окислителя, так и в роли восстановителя, в зависимости от окислительно-восстановительных свойств веществ, с которыми сера вступает в реакцию:
- окислителем сера является в реакциях с простыми веществами-восстановителями, имеющими меньшую электроотрицательность, чем сера — это водород, металлы, некоторые неметаллы: S0+2e- → S-2
- восстановителем сера является в реакциях с кислородом, галогенами, кислотами-окислителями S0-2e- → S+2 S0-4e- → S+4 S0-6e- → S+6
Реакции, в которых сера является окислителем:
- с металлами сера реагирует при нагревании с образованием сульфидов: Fe0+S0 = Fe+2S-2 2Na0+S0 = Na2+1S-2
- с водородом: S0+H20 = H2+1S-2;
- с фосфором: 3S0+2P0 = P2+3S3-2
- с углеродом: C0+2S0 = C+4S2-2
Реакции, в которых сера является восстановителем:
- с кислородом: S0 + O20 = S+4O2-2
- с хлором: S0 + Cl20 = S+2Cl2-1
- с фтором: S0 + 3F20 = S+6F6-1
Взаимодействие серы со сложными веществами:
- реагирует, как восстановитель с кислотами-окислителями при нагревании: S0 + 2H2S+6O4 = 3S+4O2↑ + 2H2O S0 + 2HN+5O3 = H2S+6O4 + 2N+3O↑ S0 + 6HN+5O3 = H2S+6O4 + 6N+4O2↑ + 2H2O
- в реакциях диспропорционирования с растворами щелочей при нагревании сера выступает и окислителем, и восстановителем: 3S0 + 6NaOH = 2Na2S-2 + Na2S+4O3 + 3H2O
Аллотропные модификации серы
α-сера
Рис. Ромбическая α-сера.
α-сера:
- кристаллическое вещество желтого цвета;
- устойчиво при комнатной температуре;
- состоит из циклических молекул S8.
- температура плавления = 112,8°C;
- плотность = 2,06 г/см3.
β-сера
Рис. Моноклинная β-сера.
β-сера:
- темно-желтые кристаллы;
- устойчиво при температуре 95°C и выше;
- от альфа-серы отличается ориентацией кольцевых молекул в узлах кристаллической решетки;
- температура плавления = 119,3°C;
- плотность = 1,957 г/см3.
Пластическая сера
 Рис. Пластическая сера.
Рис. Пластическая сера.
Пластическая сера:
- резиноподобное вещество темно-коричневого цвета;
- образуется при резком охлаждении расплавленной серы;
- состоит из открытых цепных полимерных молекул (S∞);
- плотность = 2,046 г/см3.
Получение и применение серы
Способы получения серы:
- промышленным способом получения серы является очищение самородной серы от примесей расплавлением перегретым водяным паром;
- окислением сероводорода кислородом: 2H2S + O2 = 2S + 2H2O;
- восстановлением оксида серы (IV) углеродом: SO2 + C = S + CO2;
- разложением пирита (FeS2): FeS2 = S + FeS;
- разложением сероводорода: H2S = H2 + S.
Применение серы:
- как ингредиент для получения серной кислоты;
- в качестве инсектицида;
- для вулканизации каучука;
- в производстве пороха, спичек, лекарственных препаратов, красителей.
Химические свойства серы
Химические свойства серы добавить в закладки
Сера на наружном энергетическом уровне содержит 6 электронов, из которых два непарные. Так же как и кислород располагается в VI группе главной подгруппе периодической системы химических элементов. Впрочем, по сравнению с атомами кислорода атомы серы имеют больший радиус, меньшее значение электроотрицательности. В связи с этим может проявлять восстановительные и окислительные свойства. В качестве восстановителя формирует соединения со степенями окисления +2, +4, +6. По отношению к водороду и металлам сера показывает окислительные свойства со степенью окисления –2.
I. Окислительные свойства
- Взаимодействует с металлами
- При обычных условиях реагирует со щелочными, щелочноземельными металлами, медью, ртутью, серебром. Mg + S → MgS Hg + S → HgS
- С такими металлами как цинк, алюминий и железо реакция протекает при повышенных температурах. Смесь порошков серы и алюминия или порошков серы и цинка при поджигании реагирует мгновенно с ослепительной вспышкой. Образуются в виде белых порошков сернистый алюминий или сернистый цинк. При этом часть продуктов реакции в виде мельчайших частичек выбрасывается в воздух, образуя белое облачко. Zn + S → ZnS 2Al + 3S → Al2S3 Соединения серы с металлами называют сульфидами.
- Сера взаимодействует также с водородом. При медленном пропускании водорода в пробирку с кипящей жидкой серой у отверстия газоотводной трубки ощущается запах тухлых яиц. Это – запах газообразного соединения серы с водородом – сероводорода.
H2 + S → H2S↑
II. Восстановительные свойства
- При взаимодействии со сложными веществами, с выраженными окислительными свойствами, сера проявляет себя восстановителем.
- S + 6HNO3 → H2SO4 + 6NO2↑ + 2H2O 3S + 6NaOH → 2Na2S + Na2SO3 +3H2O S + 2H2SO4 = 3SO2 + 2H2O 3S + 2 KClO3 = 3SO2 + 2 KCl
- По механизму реакции диспропорционирования сера реагирует со щелочами:
- 3S + 6KOH = K2SO3 + 2K2S + 3H2O
- Сера легко соединяется с кислородом. При воспламенении в воздухе она горит синим пламенем с образованием бесцветного диоксида серы. При этом возникает резкий характерный запах.
- S + O2 → SO2↑
- При внесении горящей серы в кислород сгорание ее ускоряется, и пламя становиться ярко-синим.
- Сера может быть получена в процессе реакций:
- SO2 + 2CO = S + 2CO2 Na2S2O3 + 2HCl = S + SO2 + 2NaCl + H2O
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства кислот
- Характерные химические свойства солей: средних, кислых, оснóвных; комплексных ( на примере соединений алюминия и цинка)
- Взаимосвязь различных классов неорганических веществ
2.3.2. Химические свойства кислорода и серы
Химический элемент кислород может существовать в виде двух аллотропных модификаций, т.е. образует два простых вещества. Оба этих вещества имеют молекулярное строение. Одно из них имеет формулу O2 и имеет название кислород, т.е. такое же, как и название химического элемента, которым оно образовано.
Другое простое вещество, образованное кислородом, называется озон. Озон в отличие от кислорода состоит из трехатомных молекул, т.е. имеет формулу O3.
Поскольку основной и наиболее распространенной формой кислорода является молекулярный кислород O2, прежде всего мы рассмотрим именно его химические свойства.
Химический элемент кислород находится на втором месте по значению электроотрицательности среди всех элементов и уступает лишь фтору. В связи с этим логично предположить высокую активность кислорода и наличие у него практически только окислительных свойств.
Действительно, список простых и сложных веществ, с которыми может реагировать кислород огромен. Однако, следует отметить, что поскольку в молекуле кислорода имеет место прочная двойная связь, для осуществления большинства реакций с кислородом требуется прибегать к нагреванию.
Чаще всего сильный нагрев требуется в самом начале реакции (поджиг) после чего многие реакции идут далее уже самостоятельно без подвода тепла извне.
Среди простых веществ не окисляются кислородом лишь благородные металлы (Ag, Pt, Au), галогены и инертные газы.
Сера сгорает в кислороде с образованием диоксида серы:
Фосфор в зависимости от избытка или недостатка кислорода может образовать как оксида фосфора (V), так и оксид фосфора (III):
Взаимодействие кислорода с азотом протекает в крайне жестких условиях, в виду того что энергии связи в молекулах кислорода и особенно азота очень велики. Также свой вклад в сложность протекания реакции делает высокая электроотрицательность обоих элементов. Реакция начинается лишь при температуре более 2000 oC и является обратимой:
Не все простые вещества, реагируя с кислородом образуют оксиды. Так, например, натрий, сгорая в кислороде образует пероксид:
а калий – надпероксид:
Чаще всего, при сгорании в кислороде сложных веществ образуется смесь оксидов элементов, которыми было образовано исходное вещество. Так, например:
Однако, при сгорании в кислороде азотсодержащих органических веществ вместо оксида азота образуется молекулярный азот N2. Например:
При сгорании в кислороде хлорпроизводных вместо оксидов хлора образуется хлороводород:
Озон является более сильным окислителем, чем кислород. Обусловлено это тем, что одна из кислород-кислородных связей в молекуле озона легко рвется и в результате образуется чрезвычайно активный атомарный кислород. Озон в отличие от кислорода не требует для проявления своих высоких окислительных свойств нагревания. Он проявляет свою активность при обычной и даже низкой температурах:
- PbS + 4O3 = PbSO4 + 4O2
- Как было сказано выше, серебро с кислородом не реагирует, однако, реагирует с озоном:
- 2Ag + O3 = Ag2O + O2
- Качественной реакцией на наличие озона является то, что при пропускании исследуемого газа через раствор иодида калия наблюдается образование йода:
- 2KI + O3 + H2O = I2↓ + O2 + 2KOH
Химические свойства серы
Сера как химический элемент может существовать в нескольких аллотропных модификациях. Различают ромбическую, моноклинную и пластическую серу.
Моноклинная сера может быть получена при медленном охлаждении расплава ромбической серы , а пластическая напротив получается при резком охлаждении расплава серы, предварительно доведенного до кипения.
Пластическая сера обладает редким для неорганических веществ свойством эластичности – она способна обратимо растягиваться под действием внешнего усилия, возвращаясь в исходную форму при прекращении этого воздействия. Наиболее устойчива в обычных условиях ромбическая сера и все иные аллотропные модификации со временем переходят в нее.
Молекулы ромбической серы состоят из восьми атомов, т.е. ее формулу можно записать как S8. Однако, поскольку химические свойства всех модификаций достаточно схожи, чтобы не затруднять запись уравнений реакций любую серу обозначают просто символом S.
Сера может взаимодействовать и с простыми и со сложными веществами. В химических реакциях проявлет как окислительные, так и восстановительные свойства.
- Окислительные свойства серы проявляются при ее взаимодействии с металлами, а также неметаллами, образованными атомами менее электроотрицательного элемента (водород, углерод, фосфор):
- Как восстановитель сера выступает при взаимодействии с неметаллами, образованными более электроотрицательными элементами (кислород, галогены), а также сложными веществами с ярко выраженной окислительной функцией, например, серной и азотной концентрированной кислотами:
Также сера взаимодействует при кипячении с концентрированными водными растворами щелочей. Взаимодействие протекает по типу диспропорционирования, т.е. сера одновременно и понижает, и повышает свою степень окисления:
ПОИСК
Взаимодействие с металлами. Сера, как типичный неметалл, взаимодействует со многими металлами, образуя сульфиды [c.
132]
С большинством металлов сера реагирует при нагревании, но в реакции со ртутью взаимодействие происходит уже при комнатной температуре.
Это обстоятельство используется в лабораториях для удаления разлитой ртути, пары которой являются сильным ядом. [c.293]
Взаимодействие с простыми веществами. Бериллий, магний и щелочноземельные металлы легко взаимодействуют с кислородом и серой, образуя оксиды и сульфиды, например [c.234]
При комнатной температуре молибден устойчив на воздухе и в кислороде. С водородом молибден не взаимодействует, поэтому спекание заготовок из молибдена производят в атмосфере водорода. Молибден взаимодействует с азотом, который придает металлу хрупкость. Со фтором молибден взаимодействует при обычной температуре, с хлором—при 250° С, с бромом — при 450° С с парами йода не взаимодействует при температурах до 800° С пары воды разрушают молибден при 700°С. Азотирование молибдена начинается при 1500° С. При действии СО наблюдается цементация молибдена при 1400° С, а в СО2—-заметное окисление при 1200° С. Сера взаимодействует с молибденом при красном калении, а H2S — при 1200° С. [c.292]
К химической коррозии также относится коррозия в среде неэлектролитов. Органические жидкости, не обладающие электропроводимостью, исключают возможность протекания электрохимических реакций.
К таким жидкостям относятся органические растворители (бензол, толуол, тетрахлорид углерода), жидкое топливо (мазут, бензин, керосин) и некоторые неорганические вещества (бром, расплав серы, жидкий фто-роводород). В этих средах коррозию вызывает реакция между металлом и коррозионной средой.
Наибольшее практическое значение имеет коррозия металлов в нефти и нефтепродуктах. Коррозионноактивными составляющими нефти являются сера, сероводород, сероуглерод, тиофены, тиолы и т. п. Сероводород образует сульфиды с железом, свинцом, медью и их сплавами.
При взаимодействии меркаптанов с никелем, серебром, медью и свинцом получаются производные тиолов — тиолаты. Сера взаимодействует с медью и серебром с образованием сульфидов. Повышение температуры ускоряет коррозию металлов в нефти наличие воды в нефти резко ускоряет процесс, вызывая электрохимическую коррозию. [c.52]
В атмосфере фтора и хлора эти металлы Самовоспламеняются Взаимодействие их с жидким бромом сопровождается взрывом. При нагревании они легко взаимодействуют с серой, водородом и другими неметаллами. С металлами образуют большей частью интерметаллические соединения. [c.535]
Металлы или окислы металлов могут взаимодействовать с серой или сероводородом по реакции [c.203]
Магний — активный металл. Легко взаимодействует с галогенами при нагревании сгорает на воздухе, окисляется серой и азотом.
С соответствующими металлами образует эвтектические смеси, твердые растворы и интерметаллические соединения, которые входят в состав его сплавов.
Наиболее важный сплав магния — так называемый электрон (3—10% А1, 0,2—3% Zn, остальное Mg), который из-за прочности и малой плотности (1,8 г/см ) применяют в ракетной технике и авиастроении. [c.570]
Затем по уравнениям (4) и (2) вычислим количества серы и сульфида металла (II), взаимодействующих в реакциях (4) и (2), они составляют 0,2 моля серы (6,4 г) и 0,4 моля МеЗ. [c.187]
С большинством металлов сера реагирует при нагревании, но в реакции со ртутью взаимодействие происходит уже при комнатной температуре. Это обстоятельство ис- [c.194]
Щелочные металлы энергично взаимодействуют с галогенами, а при нагревании — с серой. [c.127]
При нагревании сера довольно легко окисляется кислородом, галогенами, при сплавлении взаимодействует с металлами. Сера с водой и разбавленными кислотами не реагирует. При кипячении в щелочных растворах она диспропорционирует [c.324]
Элементы ПА-группы, как и щелочные металлы, легко взаимодействуют не только с кислородом, но и с другими элементарными окислителями — галогенами, серой, азотом, образуя соединения в основном с ионным характером связи. [c.205]
При взаимодействии с металлами сера проявляет окислительные свойства [c.293]
Окисление щелочных металлов серой идет очень энергично при растирании металла с серным цветом происходит взрыв. Состав продуктов, образующихся при взаимодействии щелочных металлов с серой зависит от исходного соотношения реагентов. В случае избытка щелочного металла образуется сульфид, а при избытке серы — полисульфиды 2К-f-S— -КгЗ 2K + JiS—>K2S . [c.225]
Из-за малой активности золото и серебро на воздухе не изменяются. С кислородом непосредственно (при нагревании) соединяется только Си с серой — Си и особенно Ag. С водородом, азотом и углеродом все три металла не взаимодействуют.
Полученные искусственно нитриды и карбиды Си и Ag — весьма непрочные соединения. Наиболее легко металлы 1Б группы взаимодействуют с галогенами для Си и Ад получены фториды, хлориды, бромиды и йодиды для Аи — фториды и хлориды. [c.
551]
Азот и его соединения. Азот N (15 25 2р ) —типичный элемент УА подгруппы периодической системы, один из важнейших элементов питания растений и обязательная составная часть белков. Азот — типичный неметалл (кислотообразователь).
При комнатной температуре молекулярный азот взаимодействует только с литием. Но активность его возрастает при повышении температуры. Он взаимодействует со многими металлами, серой, фосфором, мышьяком, кремнием и др., образуя нитриды (Эл Ыц).
При достаточно высоких температурах он взаимодействует с кислородом воздуха. [c.182]
Содержание серы в виде различных соединений или в чистом виде обусловливает высокую корродирующую активность нефти и нефтепродуктов в процессе транспорта, хранения и переработки, а также при использовании топлив в двигателях машин. Кроме того, сера, взаимодействуя с металлами, образует пирофоры, т. е. вещества, способные самовозгораться на воздухе, что довольно часто наблюдается в резервуарах. [c.16]
Диффундирующий в металл водород взаимодействует с окислами, углеродом (или, точнее, с цементитом), серой, фосфором и рядом других элементов, образуя водяные пары, метан, сероводород и т. д.
Эти продукты, например водяной пар или метан, приводят к нарушению структуры, понижают прочность металла, придают ему хрупкость и способствуют его разрушению.
Такие процессы могут протекать в установках для синтеза аммиака, гидрирования углей при производстве бензина и в ряде других случаев,, когда водород применяется при повышенной температуре и давлении.
Наклеп или укрупнение зерен металла способствует повышению его хрупкости и преждевременному разрушению. Действие водорода сопровождается также обезуглероживанием металла. Влияние водорода усиливается при температуре выше 350°С и тогда мало зависит от содержания углерода в сплаве. [c.84]
В отличие от остальных щелочных металлов, лнтий взаимодействует с азотом уже при комнатной тем пературе Куски металла покрываются в атмосфере азота серо черной мелкокристаллической губчатой массой нитрида лнтия [c.236]
Удаление из металла серы, которая содержится в виде сульфидов железа FeS и марганца MnS, основано на взаимодействии указанных соединений с известью в шлаке с образованием нерастворимого в металле сульфида кальция aS по реакциям [c.218]
Сера — поливалентный, химически очень активный элемент. В соединениях она проявляет валентность от 2— до 6+. При нагревании сера взаимодействует почти со всеми металлами, кислородом, водородом и галогенами (кроме иода). При температуре около 360 °С на воздухе загорается. Чистая сера не ядовита. Однако некоторые ее соединения, в частности сероводород, ядовиты. [c.259]
Катализаторы гидроочистки. Для предварительной гидроочистки сырья риформинга в основном применяют алюмокобальтмолибденовый катализатор, в отдельных случаях используют алюмоникельмолибденовый.
Активными компонентами катализаторов являются соединения кобальта, молибдена, которые наносят на окись алюминия в виде окислов.
Во время пуска установки катализатор восстанавливается водородсодержащим газом, в результате трехокись молибдена переходит в двуокись, а кобальт или никель восстанавливаются частично до металла.
При подаче сырья присутствующие в нем соединения серы взаимодействуют с активными центрами катализатора и превращаются в сульфиды. В такой форме катализатор обладает несколько большей активностью. Характеристика катализаторов гидроочистки приведена ниже [c.12]
В результате адсорбции металлами серы происходит модификация поверхностных свойств металлов. Адсорбция серы на больщинстве металлов характеризуется очень высокой энергией взаимодействия и изменением электронных и структурных свойств поверхности. Один из наиболее плодотворных методов экспериментального определения энергии связи Ме—5 состоит в вычислении тепловых эффектов на основании изотерм адсорбции сероводорода из потока водорода при разных температурах с помощью уравнения Вант-Гоффа. Уровень тепловых эффектов адсорбции показывает, что взаимодействие серы с поверхностью достаточно велико для проникновения ее атомов в кристаллическую решетку металла. Следует отметить, что еще в конце 40-х годов с помощью измерений магнитной восприимчивости было показано, что электроны из сульфида металла вступают в -зону металла, образуя при адсорбции прочную координационную связь [401]. Процесс может сопровождаться заполнением частичного дефицита или дырок в -зоне металла вследствие перекрытия с х-зоной. [c.148]
Вместе с тем в целом ряде случаев отсутствует прямая связь между термической стабильностью и эффективностью их противоизносного действия. Это объясняется тем, что помимо адсорбционной опособности и химической активности необходимо учитывать также свойства химически модифицированных слоев их состав, строение и толщину.
Например, фосфиты наиболее эффективно взаимодействуют с металлом при 160 °С [258]. Эксперименты, проведенные с трибутилтритиофосфатом, показывают, что на стали фосфор связывается значительно интенсивнее, чем сера.
Так, взаимодействие металла с фосфором отмечается уже при комнатной температуре, тогда как сера взаимодействует с металлом при температуре выше 100 °С [258]. [c.260]
Сведения о катализаторах гидрокрекинга весьма ограничены. По патентным данным , наиболее распространены катализаторы гидрокрекинга, содержащие в качестве гидрирующих компонентов металлы VI и VII групп периодической системы элементов, их сульфиды или окислы, осажденные на различных носителях (в зависимости от направленности процесса).
Катализаторы содержат также активирующие добавки — другие металлы, серу, галогены. Роль канадого из компонентов катализатора не может считаться до конца ясной, тем более, что несомненно взаимодействие активного агента с добавками и носителем, а также изменение всего катализатора в целом под влиянием среды, компонентов сырья и высокой температуры.
[c.319]
Производство стекла и изделий из него (рис. 56)—сложный процесс, который состоит из ряда химических реакций, совершающихся при взаимодействии между компонентами расплавленной стекольной массы и множеством металлических и неметаллических элементов.
В частности, окислы металлов (сера, мышьяк и другие примеси), часто присутствующие в топливе, вступают во взаимодействие со стеклом и изделиями из него при повышенных температурах во время их производства или обработки. Такие соединения влияют на механические и оптические свойства стекла, т. е. оказывают неблагоприятное воздействие на качество продукции.
В частности, большинство окислов металла образуют окрашивающие соединения, влияющие на прозрачность и оттенки стеклоиродукции. [c.275]
ШЛАК — расплав оксидов, силикатов, сульфидов и др., который при охлаждении превращается в стекловидную массу. Ш. образуется при металлургических процессах выплавки металлов в результате взаимодействия флюсов (8102, СаСОц, СаРг) с пустой породой (СаСОд, 8102, глина, оксиды металлов, сера, фосфор и др.). Ш.
всплывает на поверхность расплавленного металла и удаляется из не-чи до выливания металла. Ш. предохраняет металл от вред1юго воздействия газон, освобождает металл от серы, фосфора и других примесей. Ш. используют для изготовления строительных материалов, цемента, как удобрение (см. Томасшлак), при строительстве дорог, с лечебными целями.
[c.287]
При взаимодействии концеитрнроваппой серной кислоты, особенно ири нагревании, с активными металлами сера может восстанавливаться до степени окисления [c.195]
Золото, серебро, их сплавы, другие драгоценные металлы слабо взаимодействуют с обычными коррозионно-активными компонентами воздуха, земли и водной среды. В сухом и чистом воздухе серебро и его ысо-копробные сплавы длительное время остаются внешне неизменными.
Поверхность серебра постепенно покрывается тонкой оксидной плецкой, которая достаточно хорошо защищает компактный металл. Во влажном воздухе в присутствии даже следовых количеств сульфидной серы происходит достаточно быстрое потускнение серебра, вызванное образованием оксида и сульфида серебра.
То же характерно и для низкопробных сплавов золота. [c.174]
Химически активный металл Легко соединяется с водородом, галогенами, серой и азотом, при нагревании восстанавливает окислы почти всех металлов При взаимодействии с горячей водой возможно воспламенение При взаимодействии с жидким или газообразным аммиаком образуется комплексный аммиакат, самовос-пламеияющийся на воздухе [c.118]
Следовательно, между заместителями в разных кольцах нет существенного прямого взаимодействия.
Корреляционный анализ показывает, что замещенное пятичленпое ароматическое кольцо (—С5Н4Х) и реакционный центр (железо) взаимодействуют аналогично взаимодействию w-замещенного фенильного кольца (— gH X) п реакционного центра (карбоксил), отделенного от ядра препятствующей сопряжению СПз-группой.
Отсюда вытекает предположение, что па реакционную способность железа в реакции окисления замещенных ферроценов не оказывают влияния эффекты, подобные эффекту сопряжения между замещенным ароматическим ядром и реакционным центром в других реакционных сериях.
Взаимодействие 2р-я-орбиталей колец друг с другом и с 4s- и Зй-орбиталями металла носит а-характер. Поэтому ароматическое пятичленпое кольцо не передает эффекты, подобные эффекту сопряжения, на железо п в другое кольцо. Корреляционный анализ [c.21]
Стронций 5г, мягкий металл серого цвета, быстро тускнеющий иа воздухе. Ат. вес 87,63 плотн. 2630 кг/м т. пл. 770° С т. кип. 1380° С уд., электр. сопр. 30,7-10″ ом-см теплота сгорания до 5гО 1600 ккал1кг. В химическом отношении близок к кальцию.
Быстро окисляется на воздухе более энергично, чем кальций, разлагает воду и взаимодействует со многими элементами. При 380° С взаимодействует с азотом. Самовозгорается в мелкораздробленном состоянии, особенно во влажном воздухе, в присутствии масла и при хранении в больших количествах [37]. Тушение см.
Металлы. Средства тушения. [c.240]
Свободная сера сообш ает топливам сильные коррозионные свойства, особенно по отношению к меди.
С помош ью радиоактивных изотопов установлено, что при контакте с металлами сера проникает глубоко в их толщу вследствие химического взаимодействия, а не только образует пленку химических веществ на поверхности металла [71, 81].
Сероводород — тоже коррозионно-агрессивный агент, поражающий как цветные, так и черные металлы. К тому же он сильно токсичен. [c.30]






