- Реакции водорода с простыми веществами
- Реакции водорода со сложными веществами
- Химические свойства водорода
- 2.3.1. Химические свойства водорода и галогенов
- Взаимодействие водорода с простыми веществами
- с металлами
- с неметаллами
- Взаимодействие водорода со сложными веществами
- с оксидами металлов
- c оксидами неметаллов
- c кислотами
- c солями
- Химические свойства галогенов
- Взаимодействие галогенов с простыми веществами
- Взаимодействие галогенов с неметаллами
- водородом
- фосфором
- серой
- Взаимодействие галогенов с металлами
- Реакции галогенов со сложными веществами
- Реакции замещения с галогенами
- Взаимодействие галогенов с водой
- Взаимодействие галогенов с растворами щелочей
- Какие свойства водорода типичны для металлов неметаллов? — Экобаланс
- Сходство водорода с другими элементами
- Восстановительные свойства водорода
- Взаимодействие водорода с оксидами неметаллов
Архив уроков › Химия 8 класс
В уроке 22 «Химические свойства водорода» из курса «Химия для чайников» узнаем с какими веществами реагирует водород; выясним, какими химическими свойствами обладает водород.

Водород вступает в химические реакции с простыми и сложными веществами. Однако при обычных условиях водород малоактивен. Для его взаимодействия с другими веществами необходимо создать условия: повысить температуру, применить катализатор и др.
Реакции водорода с простыми веществами
При нагревании водород вступает в реакции соединения с простыми веществами — кислородом, хлором, азотом, серой.
Если поджечь на воздухе чистый водород, выходящий из газоотводной трубки, он горит ровным, еле заметным пламенем. Теперь поместим трубку с горящим водородом в банку с кислородом (рис. 95).
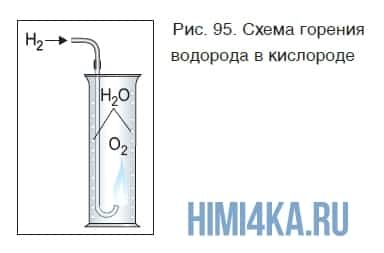
Горение водорода продолжается, при этом на стенках банки видны капли воды, образующейся в результате реакции:
При горении водорода выделяется много теплоты. Температура кислородно-водородного пламени достигает больше 2000 °С.
Химическая реакция водорода с кислородом относится к реакциям соединения. В результате реакции образуется оксид водорода (вода). Это значит, что произошло окисление водорода кислородом, т. е. эту реакцию мы можем назвать и реакцией окисления.
Если же в пробирку, опрокинутую вверх дном, собрать немного водорода методом вытеснения воздуха, а затем поднести к ее отверстию горящую спичку, то раздастся громкий «лающий» звук небольшого взрыва смеси водорода с воздухом. Такую смесь называют «гремучей».
На заметку: Способность водорода в смеси с воздухом образовывать «гремучий газ» часто являлась причиной катастроф на воздушных шарах, заполненных водородом. Нарушение герметичности оболочки шара приводило к пожару и даже взрыву. В наше время воздушные шары заполняют гелием или постоянно нагнетаемым горячим воздухом.
В атмосфере хлора водород сгорает с образованием сложного вещества — хлороводорода. При этом протекает реакция:
Реакция водорода с азотом происходит при повышенной температуре и давлении в присутствии катализатора. В результате реакции образуется аммиак NH3:
Если струю водорода направить на расплавленную в пробирке серу, то у ее отверстия ощутится запах тухлых яиц. Так пахнет газ сероводород H2S — продукт реакции водорода с серой:
На заметку: Водород способен не только растворяться в некоторых металлах, но и реагировать с ними. При этом образуются химические соединения, называемые гидридами (NaH — гидрид натрия). Гидриды некоторых металлов используют как горючее в ракетных двигателях на твердом топливе, а также при получении термоядерной энергии.
Реакции водорода со сложными веществами
Водород реагирует при повышенной температуре не только с простыми, но и со сложными веществами. Рассмотрим в качестве примера его реакцию с оксидом меди(II) CuO (рис. 96).
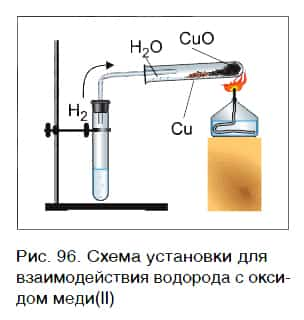
Пропустим водород над нагретым порошком оксида меди(II) CuO. По мере протекания реакции цвет порошка изменяется с черного на коричнево красный. Это цвет простого вещества меди Cu. В ходе реакции на холодных частях пробирки появляются капельки жидкости. Это еще один продукт реакции — вода H2O. Отметим, что в отличие от простого вещества меди вода — сложное вещество.
Уравнение реакции оксида меди(II) с водородом:
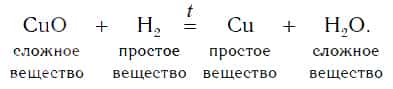
Водород в реакции с оксидом меди(II) проявляет способность отнимать у оксида металла кислород, тем самым восстанавливать металл из этого оксида. В результате происходит восстановление меди из сложного вещества CuO до металлической меди (Cu).
Реакции восстановления — это реакции, в ходе которых сложные вещества отдают атомы кислорода другим веществам.
Вещество, отнимающее атомы кислорода, называют восстановителем. В реакции с оксидом меди(II) восстановитель — водород. Так же реагирует водород и с оксидами некоторых других металлов, например PbO, HgO, MoO3, WO3 и др. Окисление и восстановление всегда взаимосвязаны между собой. Если одно вещество (Н2) окисляется, то другое (CuO) — восстанавливается, и наоборот.
Краткие выводы урока:
- При нагревании водород реагирует с кислородом, хлором, азотом, серой.
- Восстановление — это отдача атомов кислорода сложными веществами другим веществам.
- Процессы окисления и восстановления взаимосвязаны между собой.
Надеюсь урок 22 «Химические свойства водорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Химические свойства водорода


Средняя оценка: 4.3
Всего получено оценок: 768.
Средняя оценка: 4.3
Всего получено оценок: 768.
Водород – это газ, именно он находится на первом месте в Периодической системе. Название этого широко распространенного в природе элемента в переводе с латыни означает «порождающий воду». Так какие физические и химические свойства водорода нам известны?
При обычных условиях водород не имеет ни вкуса, ни запаха, ни цвета.
Рис. 1. Формула водорода.
Поскольку атом имеет один энергетический электронный уровень, на котором могут находиться максимум два электрона, то для устойчивого состояния атом может как принять один электрон (степень окисления -1), так и отдать отдать один электрон (степень окисления +1), проявляя постоянную валентность I. Именно поэтому символ элемента водорода помещают не только в IA группу (главную подгруппу I группы) вместе со щелочными металлами, но и в VIIA группу (главную подгруппу VII группы) вместе с галогенами. Атомам галогенов тоже не хватает одного электрона до заполнения внешнего уровня, и они, как и водород, являются неметаллами. Водород проявляет положительную степень окисления в соединениях, где он связан с более электроотрицательными элементами-неметаллами, а отрицательную степень окисления – в соединениях с металлами.
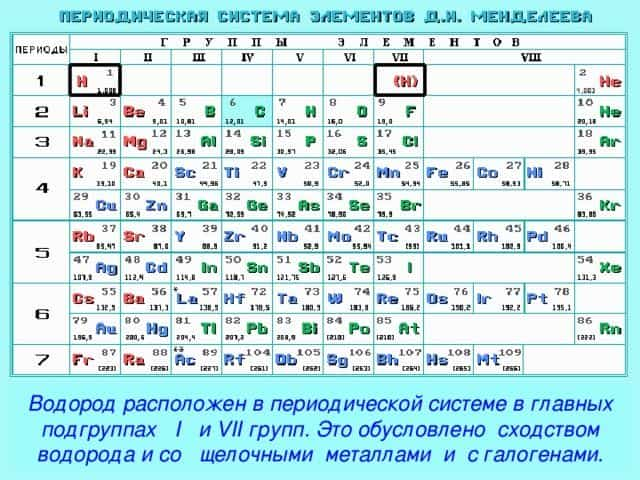 Рис. 2. Расположение водорода в периодической системе.
Рис. 2. Расположение водорода в периодической системе.
У водорода есть три изотопа, каждый из которых имеет собственное название: протий, дейтерий, тритий. Количество последнего на Земле ничтожно.
- В простом веществе H2 связь между атомами прочная (энергия связи 436 кДж/моль), поэтому активность молекулярного водорода невелика. При обычных условиях он взаимодействует только с очень активными металлами, а единственным неметаллом, с которым водород вступает в реакцию, является фтор:
- С другими простыми (металлами и неметаллами) и сложными (оксидами, органическими неопределенными соединениями) веществами водород реагирует либо при облучении и повышении температуры, либо в присутствии катализатора.
- Водород горит в кислороде с выделением значительного количества теплоты:
Смесь водорода с кислородом (2 объема водорода и 1 объем кислорода) при поджигании сильно взрывается и поэтому носит название гремучего газа. При работе с водородом следует соблюдать правила техники безопасности.
 Рис. 3. Гремучий газ.
Рис. 3. Гремучий газ.
- В присутствии катализаторов газ может реагировать с азотом:
- – по этой реакции при повышенных температурах и давлении в промышленности получают аммиак.
- В условиях высокой температуры водород способен реагировать с серой, селеном, теллуром. а при взаимодействии с щелочными и щелочноземельными металлами происходит образование гидридов:
- – в данном случае водород играет роль окислителя.
- Водород имеет особенность при повышении температуры восстанавливать оксиды многих металлов, в результате чего образуется вода. Например:
- – в данном процессе водород является восстановителем
Водород – самый распространенный элемент в космосе. В учебной статье рассматриваются химические свойства водорода и взаимодействие с металлами этого газа. В нормальных условиях он способен реагировать с очень малым количеством металлов и неметаллов, а при измененных условиях вступает в реакции с азотом, серой, селеном, щелочными металлами, а также способен восстанавливать оксиды.
Чтобы попасть сюда — пройдите тест.
Средняя оценка: 4.3
Всего получено оценок: 768.
А какая ваша оценка?
Гость завершил
Тест по произведению «12»с результатом 10/10
Гость завершил
Тест «Биография Мономаха»с результатом 4/10
Гость завершил
Тест по произведению «12»с результатом 6/10
Гость завершил
Тест «Детство»с результатом 12/14
Гость завершил
Тест «Детство»с результатом 14/14
Гость завершил
Тест «Мцыри»с результатом 16/18
Гость завершил
Тест «Недоросль»с результатом 6/18
Гость завершил
Тест «Гроза»с результатом 13/19
Гость завершил
Тест «Дубровский»с результатом 13/16
Гость завершил
Тест «Судьба человека»с результатом 11/12
Гость завершил
Тест «Мертвые души»с результатом 5/19
Не подошло? Напиши в х, чего не хватает!
2.3.1. Химические свойства водорода и галогенов
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s1. С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов.
Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов.
Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
- Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
- Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
- При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
- В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
| F2 | Светло-желтый газ с резким раздражающим запахом |
| Cl2 | Желто-зеленый газ с резким удушливым запахом |
| Br2 | Красно-бурая жидкость с резким зловонным запахом |
| I2 | Твердое вещество с резким запахом, образующее черно-фиолетовые кристаллы |
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns2np5, где n – номер периода таблицы Менделеева, в котором расположен галоген.
Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике.
Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
F2 > Cl2 > Br2 > I2
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ.
Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены.
К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
- При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
- Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
- Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
- Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5).
При этом происходит образование пентафторида фосфора:
- При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
- При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
- Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
- Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
- Остальные галогены реагируют со всеми металлами кроме платины и золота:
Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
- Аналогичным образом, бром вытесняет серу из растворов сульфидов и сероводорода:
- Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
- Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
- а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
Какие свойства водорода типичны для металлов неметаллов? — Экобаланс
22 октября 2021
Водород – неметалл, имеет молекулярное строение. Характерно двойственное положение в периодической системе химических элементов – расположен в I и VII группах. Проявляет свойства как окислителя, так и восстановителя. При определенных условиях и с определенными элементами он может проявлять себя как металл и как неметалл.
Сходство водорода с другими элементами
Ниже представлены сходства водорода с другими элементами.
Сходство с металлами:
- Одинаковая конфигурация внешнего электронного уровня;
- В большинстве соединений способен проявлять степень окисления +1;
- Обладает хорошо выраженными восстановительными свойствами, то есть способен отдавать электроны и восстанавливать другие элементы;
- Типичны реакции замещения.
Сходство с неметаллами:
- Атом водорода может присоединять электроны, то есть обладает окислительными свойствами;
- Образуя химические соединения с металлами, приобретает степень окисления -1;
- Молекула водорода представляет собой газообразное вещество из двух атомов;
Рассмотрим на примерах химические свойства водорода как восстановители и как окислителя.
Восстановительные свойства водорода
Для водорода типична реакция горения с кислородом. Причем при нормальных условиях данная реакция не протекает. Необходимым условием является нагрев и чем больше нагревание, тем реакция протекает энергичнее. При смеси двух объемов водорода и одного объема кислорода образуется «гремучий газ» и происходит взрыв.
Типичны реакции с неметаллами:
- Взаимодействует с серой, продуктом реакции является сероводород. Реакция происходит, когда водород проходит через расплавленную серу.H2 + S → H2S↑
- При нагревании водород может вступать в реакцию с азотом с образованием аммиака. Главным условием этой реакции является высокая температура и давление, а также наличие катализатора.3H2 + N2 → 2NH3↑
- Из галогенов при обычной температуре водород реагирует лишь с фтором.H2 + F2 → 2HFС хлором реагирует только на свету, образуя хлороводород, с бромом реакция протекает менее энергично, с йодом не идет до конца даже при высоких температурах.H2 + Cl2 → 2HCl
Взаимодействие водорода с оксидами неметаллов
Взаимодействие водорода с оксидами неметаллов протекают при нагревании с оксидами азота, углерода и галогенов. К примеру, реакция с оксидом углерода (II) протекает при высоких температурах и продуктом реакции является метанол, а смесь СО и Н2 называется «синтез-газ»2H2 + CO → CH3OH
Водород способен восстанавливать металлы из их оксидов. Предпосылкой такой реакции является расположение металла в электрохимическом ряду напряжений справа от алюминия.CuO + H2 → Cu + H2OВодород является универсальным восстановителем, который используется в большинстве процессов химического синтеза для получения чистых веществ.
Свободный хлор очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов.
Н2 + Cl2 = 2HCl(г)+185 кДж.
Галогеноводороды – это типичные кислоты-неокислители. Но так как в их состав входят атомы галогенов в низших степенях окисления, то эти кислоты способны окисляться.
Источники:
- https://bingoschool.ru/manual/ximicheskie-svojstva-vodoroda
- https://interneturok.ru/lesson/chemistry/11-klass/osnovnye-metally-i-nemetally/vodorod-galogeny
- https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/himicheskie-svojstva-vodoroda-i-galogenov