- Обсуждение: «Щелочноземельные металлы»
- Щёлочноземельные металлы — основные свойства, характеристика и список элементов
- Положение в периодической системе Менделеева
- Электронное строение и закономерности изменения свойств
- Физические свойства щелочноземельных металлов
- Химические свойства
- Нахождение в природе
- Способ получения
- Качественные реакции
- Применение щелочноземельных металлов
- Бериллий, магний, щелочноземельные металлы
- Варианты ответов
- Варианты ответов
- Варианты ответов
- Варианты ответов
- Варианты ответов
- Варианты ответов
- Гдз химия 9 класc габриелян о.с. , остроумов и.г., сладков с.а., 2018, §17 общая характеристика элементов iiа группы
- Щелочноземельные металлы (9-й класс)
- Ход урока
- 1. Организационный момент.
- 2. Вводное слово учителя
- 3. Актуализация знаний
- 4. Лабораторная работа по виртуальной лаборатории
- 5. Подведение итогов урока, выставление оценок
- 5. Рефлексия.
- 6. Домашнее задание
- Литература
- Щелочноземельные металлы: общая характеристика, строение; свойства и получение — урок. Химия, 9 класс
- Проверочная работа по теме "Щелочные и щелочноземельные металлы"
Давайте разберем эти металлы точно по подобию щелочных металлов.
Щелочноземельными эти металлы называют, т.к. они содержатся во всех минералах земли — поэтому «земельные», а «щелочные» — т.к. они придают воде щелочную реакцию.
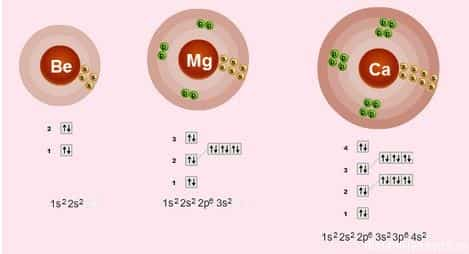
- Строение электронных оболочек
- Электронное строение внешнего слоя у всех этих элементов одинаково – на нем всего 2 электрона на s-подуровне:
- n S2
-
Что это означает?
- Валентности элементов = 2, т.е. каждый атом может образовывать 2 связи.
- Степень окисления элементов = +2 – металлические свойства – это способность отдавать электроны
- Сверху вниз в подгруппе радиус атома увеличивается, следовательно, электроны все слабее притягиваются к ядру атома, следовательно, сверху вниз металлические свойства увеличиваются – Ba более сильный металл, чем Be.
- Как следствие этого сверху вниз в подгруппе усиливаются восстановительные свойства.
- Физические свойства щелочно-земельных металлов
-
Общие характеристики:
- все металлы сероватого цвета,
- твердые, ножом, как щелочные металлы, их уже, конечно, не порежешь ????
- плотность больше 1,
- на воздухе элементы достаточно устойчивы, но покрываются оксидной пленкой,
- окрашивают пламя в разный цвет (это используют для получения разных цветов пламени в пиротехнике):
-
Ca — в кирпично-красный - Sr – в красный
- Ba– в желтый
- Химические свойства металлов
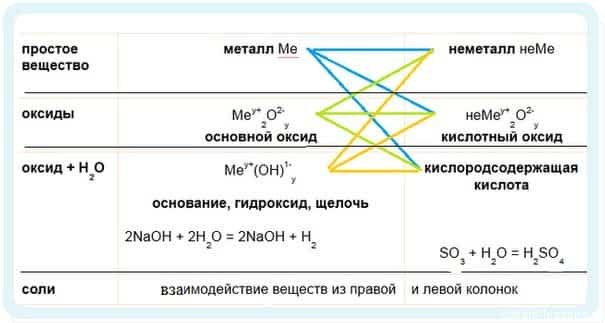
- Имеет смысл рассмотреть химические свойства по таблице классификации неорганических соединений.
-
1. Идем по синим стрелочкам — взаимодействие металлов:
- Металлы традиционно проявляют металлические — восстановительные свойства.
-
2. Идем по зеленым стрелочкам — реакции для оксидов
-
3. Идем по оранжевым стрелочкам
- Обратите внимание, что гидроксиды щелочноземельных металлов либо малорастворимы, либо нерастворимые, поэтому их образование может служить качественной реакцией.
- Be(OH)2 — амфотерный гидроксид, он может реагировать как с основаниями, так и с кислотами!
3. Щелочноземельные металлы с водородом также образуют гидриды.
Как мы уже говорили, сверху вниз в подгруппе металлические свойства элементов возрастают. Водород, хоть и находится в первой группе при реакции с щелочноземельными металлами будет проявлять отрицательную степень окисления.
Как определить качественные реакции? Загляните в таблицу растворимости!
-
Be(OH)2 — гелеобразный белый осадок;
Сa(OH)2 — белый осадок;
Mg(OH)2 — белесый осадок;
Фториды — белесо-бесцветные осадки;
Сульфиты и сульфаты — белые осадки.
Как видите, цвета осадков не отличаются цветовым разнообразием ???? - Получение щелочно-земельных металлов
-
Обычно щелочноземельные металлы получают электролизом расплавов их солей: - CaCl2 (электролиз) → Ca + Cl2
-
[TESTME 24]
Обсуждение: «Щелочноземельные металлы»
(Правила комментирования)
Щёлочноземельные металлы — основные свойства, характеристика и список элементов
Щёлочноземельные металлы получили свое название за счет своих оксидов, которые сообщают воде щелочные реакции. Изучая химию, очень часто приходится взаимодействовать со сложными и непонятными названиями. Но если разобраться и понять что к чему, то изучать предмет легко и интересно.
Однако при написании формул стоит быть внимательным, не забывая про коэффициенты и признаки реакций.
Положение в периодической системе Менделеева
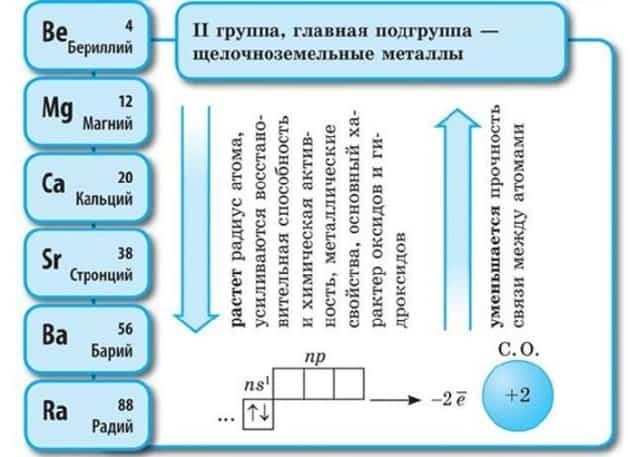
Щелочноземельные металлы – это химические элементы второй группы периодической системы химических элементов таблицы Менделеева:
- бериллий Be;
- магний Mg;
- кальций Ca;
- стронций Sr;
- барий Ba;
- радий Ra.
Электронное строение и закономерности изменения свойств
Атомы данных металлов на внешнем энергетическом уровне имеют 2 s-электрона. Отсюда следует, что максимальная степень окисления +2.
- Также могут иметь нулевую степень окисления, но не отрицательную, так как металлы не могут иметь данную степень.
- Общая конфигурация внешнего энергетического уровня nS2:

В периоде от Be до Ra металлические свойства, восстановительные, электроотрицательные увеличиваются, а неметаллические, окислительные свойства и радиус атома уменьшается.
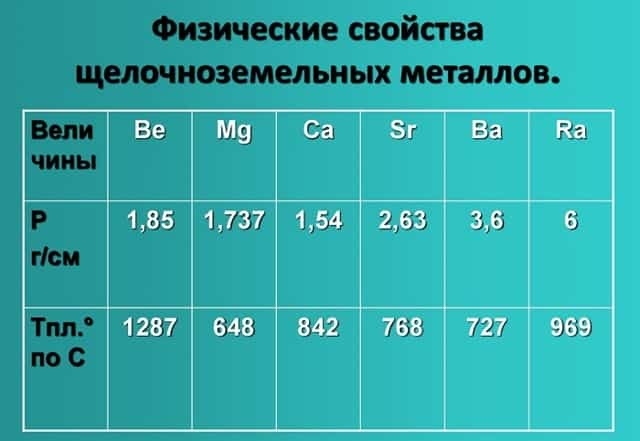
Физические свойства щелочноземельных металлов
- Физические свойства данной группы имеют следующие характеристики: светло-серый — темно-серый цвет, твердые вещества, не растворимые и нелетучие, без запаха, тепло-электропроводимые, имеют характерный металлический блеск.
- Показатели плотности и температуры плавления представлены в таблице:
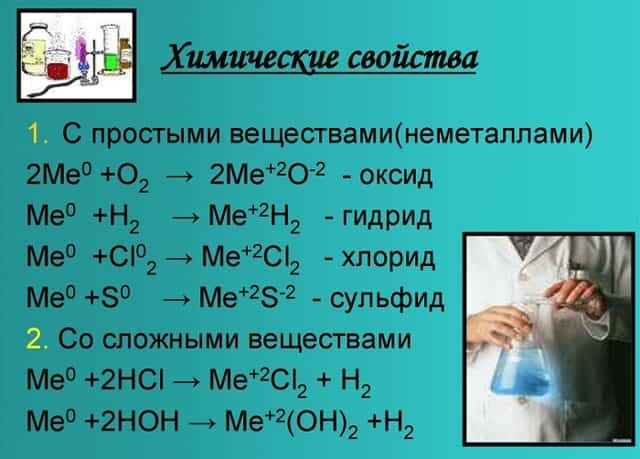
Химические свойства
Оксиды и гидроксиды щёлочноземельных металлов усиливают основные свойства при движении вниз по второй группе. Следовательно, бериллий имеет меньшие основные свойства, чем радий.
- Эти вещества взаимодействуют с любыми растворами кислот от сильной до слабой, а также с образованием солей, образуя белый осадок.
- 4Ca + 5H2SO4 (конц) = 4CaSO4 + H2S + 4H2O.
- С кислородом образуют реакцию горения и оксид:
- 2Mg + O2 = 2MgO.
- Металлы, стоящие в главной подгруппе второй группы (кроме бериллия) реагируют с водой. При проведении данных реакций выделяется водород (H2):
- Mg + 2H2O = Mg(OH)2 + H2,
- Вa + 2H2O = Вa(OH)2 + H2.
- Также реагируют с неметаллами:
- Bа + Cl2 = BаCl2 — хлорид бериллия;
- Ca + Br2 = CaBr2 — бромид кальция;
- Sr + H2 = SrH2 — гидрид стронция.
- Химические свойства щелочноземельных металлов показаны на картинке:
Нахождение в природе
Все металлы данного типа встречаются на земле, но не в чистом виде. Часто они представлены в виде минеральных солей. Самый распространённый считается кальций, магний немного уступает, затем идет барий и стронций.
Бериллий и радий являются самыми редкими, однако последний металл в больших количествах находится в урановых рудах.

Способ получения
- Магний, кальций и стронций получают электролизом расплавов солей.
- Барий получают с помощью восстановления оксида.
- При нагревании фторида бария получают сам металл.
Качественные реакции
- Одна из качественных реакций-окрашивание пламени.
- Список возможных цветов пламени при нагревании данных элементов:
- Ca — темно-оранжевый;
- Sr — насыщенный красный;
- Ba — светло-зеленый или классический зеленый.

Металлы данного типа при взаимодействии с щелочами, оксидами или растворами солей выпадают в белый осадок.
Применение щелочноземельных металлов
Бериллий из-за своей прочности добавляют в различные сплавы металлов, также препятствует коррозии. Используется в изготовлении рентгеновских аппаратов.
Магний и кальций активно использует для лекарственных средств, поскольку данные металлы играют большую роль в жизнедеятельности организма. Также в медицине используют радий, но для облучения кожи и злокачественных образований.
Стронций и барий добавляют в различный сплавы, которые работают в агрессивной среде и имеют сверхсильную проводимость.
Данные металлы играют огромную роль в жизни человека, выполняют различные функции и имеют ряд определенных свойств. Они содержатся в земной коре, поэтому довольно широко используются. Однако это не говорит о том, что их нужно расходовать безгранично.
Бериллий, магний, щелочноземельные металлы
Будьте внимательны! У Вас есть 10 минут на прохождение теста. Система оценивания — 5 балльная. Разбалловка теста — 3,4,5 баллов, в зависимости от сложности вопроса. Порядок заданий и вариантов ответов в тесте случайный. С допущенными ошибками и верными ответами можно будет ознакомиться после прохождения теста. Удачи!
Варианты ответов
Какие названия характерны для CaCO3?
Варианты ответов
- мрамор
- гипс
- мел
- известняк
Гидроксид калия реагирует с:
Варианты ответов
Варианты ответов
- атомы щелочноземельных элементов имеют возможность принимать 2 электрона
- металлические свойства в главной подгруппе IIA группы сверху вниз усиливаются
- атомы щелочноземельных металлов имеют на внешнем уровне 2 электрона
- щелочноземельные металлы в химических реакциях являются окислителями
Расположите элементы в порядке увеличения радиусов атомов: Sr, Mg, Ba, Be, Ca.
Ответ следует записать: CA SR…
Варианты ответов
- 2CaSO4 · H2O
- MgSO4
- BaSO4
- Ca3(PO4)2
- CaCO3
Варианты ответов
- BeSO4
- MgSO4
- CaSO4
- SrSO4
- BaSO4
Запишите название радиоактивного элемента IIA группы, который является и самым тяжёлым в этой группе.
Укажите сумму коэффициентов в уравнении химической реакции получения титана из оксида титана (IV) методом магниетермии.
Сохранить этот тест в личном кабинете и раздать его своим ученикам
Чтобы добавить комментарий зарегистрируйтесь или войдите на сайт
Лицензия на осуществление образовательной деятельности №5251 от 25.08.2017 г.
Гдз химия 9 класc габриелян о.с. , остроумов и.г., сладков с.а., 2018, §17 общая характеристика элементов iiа группы
Гдз химия 9 класc габриелян о.с. , остроумов и.г., сладков с.а., 2018, §17 общая характеристика элементов iiа группы
Другие задания смотри здесь…
|
ПРОВЕРЬТЕ СВОИ ЗНАНИЯУпражнение 1. Сравните общие характеристики щелочных и щёлочноземельных металлов. Укажите тип связи и тип кристаллической решётки в простых веществах, образованных этими металлами.На внешнем энергетическом уровне атомы всех щелочных металлов имеют по одному электрону, а атомы щелочно-земельных металлов ― по два электрона. Для щелочных и щёлочноземельных металлов характерна металлическая связь и металлическая кристаллическая решетка, а отсюда и все типичные для металлов свойства: металлический блеск, пластичность, тепло- и электропроводность. Металлические свойства щелочных металлов возрастают от лития к цезию, а щёлочноземельных ― от кальция к барию. Максимальная степень окисления щелочных металлов равна +1, а щёлочноземельных ― +2. Формула высших оксидов щелочных металлов Me2O, а щёлочноземельных ― MeO. Все они являются основными оксидами, следовательно, взаимодействует с водой, кислотами и кислотными оксидами. Гидроксиды щелочных металлов имеют формулу MeOH, а щёлочноземельные ― Me(OH)2. Данные гидроксиды являются растворимыми основаниями – щёлочами, следовательно, взаимодействует с кислотами, кислотными оксидами и солями.
Упражнение 2. Перечислите общие химические свойства щёлочноземельных металлов. Подчеркните особенности взаимодействия этих металлов с водой.
Щелочные и щёлочноземельные металлы взаимодействуют с неметаллами, водой, кислотами, оксидами менее активных металлов. В результате реакции щелочных и щёлочноземельных металлов с водой образуются щелочь и водород. Реакция в общем виде взаимодействия щелочных металлов с водой:
2Me + 2H2O = 2MeOH + H2↑
Реакция в общем виде взаимодействия щёлочноземельных металлов с водой:
Me + 2H2О = Me(OH)2 + H2↑
ПРИМЕНИТЕ СВОИ ЗНАНИЯ
Упражнение 1. С помощью какой химической реакции можно доказать, что в состав минералов кальция — известняка, мрамора, кальцита — входит карбонат этого металла? Взаимодействием с сильной кислотой, вследствие чего выделяется углекислый газ, то есть раствор «вскипает». Напишите уравнение реакции в молекулярной и ионной формах.
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O CaCO3 + 2H+ + 2Cl- → Ca2+ + 2Cl+ + CO2↑ + H2O
CaCO3 + 2H+ → Ca2+ + CO2↑ + H2OУпражнение 2. Охарактеризуйте свойства оксида кальция как основного оксида. Ответ подтвердите уравнениями химических реакций в молекулярной и ионной формах.Взаимодействует с водой: CaO + H2O = Ca(OH)2Взаимодействует с кислотными оксидами:
CaO + CO2 = CaCO3
Взаимодействует с кислотами:
CaO + 2HСl = CaCl2 + H2O
CaO + 2H+ + 2Cl- ⟶ Ca2+ + 2Cl- + H2O CaO + 2H+ → Ca2+ + H2O
Упражнение 3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения, для реакций обмена запишите ионные уравнения:
а) Ca → CaCl2 → CaCO3 → CaO → Ca(OH)2 → Ca(NO3)2 → CaF2;Ca + 2HCl = CaCl2 + H2↑CaCl2 + Na2CO3 = 2NaCl + CaCO3↓Ca2+ + 2Cl- + 2Na+ + CO32- → 2Na+ + 2Cl- + CaCO3↓Ca2+ + CO32- → CaCO3↓ CaCO3↓ = CaO + CO2↑ CaO + H2O = Ca(OH)2Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2OCa2+ + 2OH- + 2H+ + 2NO3- → Ca2+ + 2NO3- + 2H2OH+ + OH- → H2O Ca(NO3)2 + 2KF = 2KNO3 + CaF2↓Ca2+ + 2NO3- + 2К+ + 2F- → 2К+ + 2NO3- + CaF2↓ Ca2+ + 2F- → CaF2↓
б) BaCO3 → BaO → Ba(OH)2 → BaCl2 → Ba3(PO4)2.
BaCO3 = BaO + CO2↑ (при t0)BaO + H2O = Ba(OH)2Ba(OH)2 + 2HCl = BaCl2 + 2H2OBa2+ + 2OH- + 2H+ + 2Cl- → Ba2+ + 2Cl- + 2H2OH+ + OH- → H2O
3BaCl2 + 2Na3PO4 = 6NaCl + Ba3(PO4)2↓
3Ba2+ + 6Cl- + 6Na+ + 2PO43- → 6Na+ + 6Cl- + Ba3(PO4)2↓3Ba2+ + 2PO43- → Ba3(PO4)2↓Упражнение 4. При обработке 9,8 г смеси карбоната, гидроксида и сульфата кальция выделилось 0,896 л газа (н.у.) и осталось 2,1 г твёрдого остатка. Вычислите массовую долю компонентов в смеси.Дано: V(CO2)=0,896 л, m(смеси)=9,8 г, m(тв. остатка)=2,1 гНайти: ω(СaCO3)-?, ω(Сa(OH)2)-?, ω(СaSO4)-?Решение1. Количество вещества углекислого газа объемом 0,896 л рассчитываем по формуле: ʋ=V/VM, где VM=22,4 л/моль.ʋ(Н2О)=V(CO2)/VM=0,896 л : 22,4 л/моль=0,04 моль2. Составим химические уравнения:CaCO3 + HCl = CaCl2 + CO2↑ + 2H2OCa(OH)2 + 2HCl = CaCl2 + 2H2OCaSO4 + HCl ≠ По уравнению реакции 1 моль карбоната кальция реагирует с выделением 1 моль углекислого газа, количество вещества одинаковое, поэтому:ʋ(СаСО3)=ʋ(СО2)=0,04 мольПоскольку СаСl2 растворимая соль, поэтому твердый остаток ― это соль CaSO4, то есть m(СаSО4)=2,1 г 3. Массу карбоната кальция количеством вещества 0,04 моль рассчитываем по формуле: m=ʋ•M, где M=Mr г/моль.M(СаСО3)=100 г/мольm(СаСО3)=ʋ(СаСО3)•M(СаСО3)=0,04 моль • 100 г/моль=4 г4. Рассчитываем массу гидроксида кальция:m(Ca(OH)2)=m(смеси)-m(CaCO3)-m(CaSO4)=9,8 г — 4 г — 2,1 г=3,7 г5. Рассчитываем массовую долю компонентов смеси.ω(СаСО3)=(m(СаСО3):m(смеси))•100%=(4 г : 9,8 г)•100%=40,8%ω(Са(ОН)2)=(m(Са(ОН)2):m(смеси))•100%=(3,7 г : 9,8 г)•100%=37,6%ω(СаSО4)=(m(СаSО4):m(смеси))•100%=(2,1 г : 9,8 г)•100%=21,4%Ответ: 40,8% CaCO3, 37,6% Ca(OH)2, 21,4% CaSO4
Упражнение 5. Какую массу соды (безводный карбонат натрия Na2CO3) необходимо добавить к 100 л жёсткой воды, содержащей 610 мг/л гидрокарбонат-ионов, для её полного умягчения?
Дано: V(H2O)=100 л, ρ(HCO3-)=610 мг/л=0,61 г/лНайти: m(Na2CO3)-?Решение1. Рассчитываем массу гидрокарбонат-ионов:m(HCO3-)=ρ(HCO3-)•V(Н2О)=0,61 г/л • 100 л=61 г2. Количество вещества гидрокарбонат-ионов рассчитываем по формуле: ʋ=m/M, где M=Mr г/моль.
M(HCO3-)=61 г/мольʋ(HCO3-)=m(HCO3-)/M(HCO3-)=61 г : 61 г/моль=1 моль3.
Составим химическoе уравнениe в общем виде:Na2CO3 + Ме2+ + 2HCO3−=2NaHCO3 + MeCO3↓По уравнению реакции с 1 моль карбоната натрия реагирует 2 моль гидрокарбонат-ионов, то есть количество вещества карбоната натрия в 2 раза меньше количества вещества гидрокарбонат-ионов, поэтому: ʋ(Na2СО3)=ʋ(HCO3-):2=1 моль:2=0,5 моль4. Массу карбоната натрия количеством вещества 0,5 моль рассчитываем по формуле: m=ʋ•M, где M=Mr г/моль.M(Nа2СО3)=106 г/мольm(Nа2СО3)=ʋ(Nа2СО3)•M(Na2СО3)=0,5 моль • 106 г/моль=53 гОтвет: 53 г
Используйте дополнительную информацию и выразите мнение
Вопрос 1. Щелочные металлы получают электролизом расплавов их гидроксидов — щелочей. Для получения щёлочноземельных металлов используют электролиз расплавов их солей. Как вы думаете, почему для этих целей не годятся гидроксиды щёлочноземельных металлов? Поскольку при расплавлении (нагрев от пропускания электрического тока) гидроксиды шёлочноземельных металлов разлагаются с образованием соответствующих оксидов металла, а не простого вещества металла. Напишите уравнение электролиза расплава хлорида кальция: CaCl2(распл.) ⟶ Ca + Cl2↑ (над ⟶ напишите электролиз)Другие задания смотри здесь…
Щелочноземельные металлы (9-й класс)
Класс: 9
- Тип урока: изучение нового материала.
- Вид урока: комбинированный урок
- Задачи урока:
- Обучающие: формирование знаний учащихся о щелочноземельных элементах как типичных металлах, понятия о взаимосвязи строения атомов со свойствами (физическими и химическими).
- Развивающие: развитие умений исследовательской деятельности, умения добывать информацию из различных источников, сравнивать, обобщать, делать выводы.
- Воспитывающие: воспитание устойчивого интереса к предмету, воспитание таких нравственных качеств как аккуратность, дисциплина, самостоятельность, ответственное отношение к порученному делу.
- Методы: проблемные, поисковые, лабораторная работа, самостоятельная работа учащихся.
- Оснащение: компьютер, таблица по технике безопасности, диск “Виртуальная лаборатория по химии”, презентация.
Ход урока
1. Организационный момент.
2. Вводное слово учителя
Мы изучаем раздел, металлы, и вы знаете, что металлы имеют большое значение в жизни современного человека. На предыдущих уроках мы познакомились с элементами I группы главной подгруппы – щелочными металлами.
Сегодня приступаем к изучению металлов II группы главной подгруппы — щелочноземельных металлов.
Для того чтобы усвоить материал урока, нам необходимо вспомнить наиболее важные вопросы, которые рассматривали на предыдущих уроках.
3. Актуализация знаний
Беседа.
— Где находятся щелочные металлы в периодической системе Д.И. Менделеева?
Ученик:
— В периодической системе щелочные металлы расположены в I группе главной подгруппе, на внешнем уровне 1 электрон, который щелочные металлы легко отдают, поэтому во всех соединениях они проявляют степень окисления +1. С увеличением размеров атомов от лития к францию энергия ионизации атомов уменьшается и, как правило, возрастает их химическая активность.
- Учитель:
- — Физические свойства щелочных металлов?
- Ученик:
— Все щелочные металлы серебристо-белого цвета с незначительными оттенками, лёгкие, мягкие и легкоплавкие. Их твёрдость и температура плавления закономерно снижаются от лития к цезию.
Учитель:
— Знания Химических свойств щелочных металлов проверим в виде небольшой проверочной работы по вариантам:
- I вариант: Напишите уравнения реакции взаимодействия натрия с кислородом, хлором, водородом, водой. Укажите окислитель и восстановитель.
- I I вариант: Напишите уравнения реакции взаимодействия лития с кислородом, хлором, водородом, водой. Укажите окислитель и восстановитель.
- I I I вариант: Напишите уравнения реакции взаимодействия калия с кислородом, хлором, водородом, водой. Укажите окислитель и восстановитель.
- Учитель: Тема нашего урока “Щелочноземельные металлы”
- Задачи урока: Дать общую характеристику щелочноземельным металлам.
- Рассмотреть их электронное строение, сравнить физические и химические свойства.
- Узнать о важнейших соединениях этих металлов.
- Определить области применения этих соединений.
- — Наш план урока написан на доске, будем работать соответственно плана, просмотрим презентацию.
- Положение металлов в периодической системе Д.И. Менделеева.
- Строение атома щелочных металлов.
- Физические свойства.
- Химические свойства.
- Применение щелочноземельных металлов.
Беседа.
Учитель:
Исходя, из полученных ранее знаний ответим на следующие вопросы: Для ответа воспользуемся периодической системой химических элементов Д.И. Менделеева .
- 1. Перечислите щелочноземельные металлы
- Ученик:
- — Это магний, кальций, стронций, барий, радий.
- Учитель:
2. Почему данные металлы назвали щелочноземельными?
- Ученик:
- Происхождение этого названия связано с тем, что их гидроксиды являются щелочами, а оксиды по тугоплавкости сходны с оксидами алюминия и железа, носившими ранее общее название «земли»
- Учитель:
3. Расположение щелочноземельные металлы в ПСХЭ Д.И. Менделеева.
Ученик:
— II группа главная подгруппа. У металлов II группы главной подгруппы на внешнем энергетическом уровне содержится по 2 электрона, находящихся на меньшем удалении от ядра, чем у щелочных металлов.
Поэтому их восстановительные свойства хотя и велики, но все же менее, чем у элементов I группы.
Усиление восстановительных свойств также наблюдается при переходе от Mg к Ba, что связано с увеличением радиусов их атомов, во всех соединениях проявляют степень окисления +2.
Учитель: Физические свойства щелочноземельных металлов?
Ученик:
— Металлы II группы главной подгруппы — это серебристо-белые вещества, хорошо проводящие тепло и электрический ток. Плотность их возрастает от Be к Ba, а температура плавления, наоборот, уменьшается. Они значительно тверже щелочных металлов. Все, кроме бериллия, обладают способностью окрашивать пламя в разные цвета.
- Проблема: В каком виде щелочноземельные металлы встречаются в природе?
- Почему в природе щелочноземельные металлы в основном существуют в виде соединений?
- Ответ: В природе щелочноземельные металлы находятся в виде соединений, потому что обладают высокой химической активностью, которая в свою очередь, зависит от особенностей электронного строения атомов (наличие двух неспаренных электронов на внешнем энергетическом уровне)
- Физкультминутка – отдых глазам.
- Учитель:
— Зная общие физические свойства, активность металлов, предположите химические свойства щелочноземельных металлов. С какими веществами взаимодействуют щелочные металлы?
Ученик:
— Щелочноземельные металлы взаимодействуют как с простыми веществами, и сложными. Активно взаимодействуют почти со всеми неметаллами ( с галогенами, водородом, образуя гидриды). Из сложных веществ с водой – образуя растворимые в воде основания – щелочи и с кислотами.
Учитель:
— А теперь на опытах убедимся, в правильности наших предположениях о химических свойствах щелочноземельных металлов.
4. Лабораторная работа по виртуальной лаборатории
Цель: провести реакции, подтверждающие химические свойства щелочноземельных металлов.
Повторяем правила техники безопасности для работы со щелочноземельными металлами.
- работать в вытяжном шкафу
- на подносе
- сухими руками
- брать в малых количествах
Работаем с текстом, который читаем по виртуальной лаборатории.
Опыт № 1.Взаимодействие кальция с водой.
Опыт № 2. Горение магния, кальция, стронция, бария
Записать уравнения реакции и наблюдения в тетрадь.
5. Подведение итогов урока, выставление оценок
5. Рефлексия.
Что запомнилось на уроке, что понравилось.
6. Домашнее задание
§ 12 упр.1(б) упр.4
Литература
- Рудзитис Г.Е., Фельдман Ф.Г. Химия 9.- Москва.: Просвещение, 2001
- Габриелян О.С. Химия 9.-Москва.:Дрофа, 2008
- Габриелян О.С., Остроумов И.Г. Настольная книга учителя. Химия 9.
-Москва.:Дрофа 2002
- Габриелян О.С. Контрольные и проверочные работы. Химия 9.-Москва.:Дрофа, 2005.
- Коллекция Виртуальной лаборатории. Учебное электронное издание
29.03.
2010
Щелочноземельные металлы: общая характеристика, строение; свойства и получение — урок. Химия, 9 класс
Щелочноземельными металлами называют (4) химических элемента (I)(I)(A) группы Периодической системы Д. И. Менделеева, начиная с кальция:
кальций (Ca), стронций (Sr), барий (Ba), радий (Ra).
Электронное строение атомовНа внешнем энергетическом уровне атомы металлов (IIA) группы имеют два электрона.
Поэтому для всех щелочноземельных металлов характерна степень окисления (+2).
Этим объясняется сходство их свойств.
Для металлов (I)(I)(A) группы (сверху вниз) характерно:
- увеличение радиуса атомов;
- усиление восстановительных, металлических свойств.
Из щелочноземельных металлов кальций наиболее широко распространён в природе, а радиоактивный радий — менее всего.
- Все щелочноземельные металлы обладают высокой химической активностью, поэтому встречаются в природе только в виде соединений.
- Основными источниками кальция являются его карбонаты CaCO3 (мел, мрамор, известняк).
- В свободном виде простые вещества представляют собой типичные металлы от серого до серебристого цвета.
Физические свойства простых веществВ твёрдом агрегатном состоянии атомы связаны металлической связью. Это обусловливает общие физические свойства простых веществ металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
- Тем не менее, металлы (I)(I)(A) группы имеют разные значения температуры плавления, плотности и других физических свойств.
- Щелочноземельные металлы обладают высокой химической активностью, реагируют с кислородом, водородом, другими неметаллами, оксидами, кислотами, солями.
- Они являются сильными восстановителями.
- Щелочноземельные металлы активно реагируют с:
- водой, образуя соответствующие гидроксиды и выделяя водород:
- кислотами, легко растворяясь в их растворах с образованием соответствующих солей:
- Ba+2HCl=BaCl2+H2↑;
- с неметаллами, образуя оксиды или соответствующие соли (гидриды, галогениды, сульфиды и др.):
- Bа+Cl2=BаCl2,
- Bа+S=BаS.
Щелочноземельные металлы получают в основном электролизом расплавов галогенидов. Чаще используются хлориды металлов.
При этом на катоде восстанавливаются катионы, а на аноде окисляются анионы.
Суммарное уравнение реакции электролиза расплава хлорида кальция:
CaCl2=эл. токCa+Cl2↑.
Проверочная работа по теме "Щелочные и щелочноземельные металлы"
Тестирование проводится после изучения темы «Щелочные и щелочноземельные металлы» в 9 классе с целью проверки знаний учащихся.
- ТЕСТ № 1
- Щелочные металлы и их соединения
- 1. Электронное строение внешнего энергетического уровня атомов
- щелочных металлов:
- А) …S1 В) …S2P1
- Б) …S2 Г) …S2P2
- 2. Степень окисления щелочных металлов:
- А) — 1 В) — 2
- Б) +1 Г) +2
- 3. Вид связи в кристалле натрия:
- А) ковалентная полярная В) ионная
- Б) ковалентная неполярная Г) металлическая
- 4. Выберите ряд элементов, относящихся к щелочным металлам:
- А) Ca, Zn, Cl В) Li, Na, Rb
- Б) Mg, K, Al Г) Cr, Mn, Co
- 5. Самый лёгкий щелочной металл:
- А) Na В) K
- Б) Li Г) Cs
- 6. Укажите характеристики, одинаковые для всех щелочных металлов
- А) число валентных электронов
- Б) сильные восстановительные свойства
- В) радиус атома
- Г) число энергетических уровней в атоме
- 7. Наиболее ярко выраженные металлические свойства у:
- А) лития В) калия
- Б) натрия Г) рубидия
- 8. Какие щелочные металлы, сгорая на воздухе, образуют
- оксиды состава R2O?
- А) Li В) К
- Б) Na Г) Cs
- 9. Способ получения натрия и калия:
- А) алюмотермия В) электролиз
- Б) магниетермия Г) пиролиз
- 10. С какими из перечисленных веществ реагируют щелочные металлы:
- А) S В) H2O
- Б) Cl2 Г) Fe
- ТЕСТ № 2
- Бериллий, магний и щелочноземельные металлы
-
Электронное строение внешнего энергетического уровня атомов щелочноземельных металлов.
А). . . S1 В). . . S2P1
Б). . . S2 Г). . . S2P2
-
Степень окисления бериллия, магния и щелочноземельных металлов.
А) +2 В) +4
Б) — 2 Г) — 4
-
Вид связи в кристалле бария:
А) ковалентная полярная В) металлическая
Б) ковалентная неполярная Г) ионная
-
Выберите ряд элементов, относящихся к щелочноземельным металлам:
А) Ba, Sr, Ca В) Mg, K, Al
Б) Na, K, Li Г) Ca, Mg, Ве
-
Является радиоактивным металлом
А) магний В) стронций
Б) барий Г) радий
-
В ряду Be → Mg → Ca → Sr → Ba → Ra
- А) металлические свойства ослабевают
- Б) металлические свойства усиливаются
- В) не металлические усиливаются
- Г) радиусы атомов уменьшаются
-
Наиболее ярко выраженные металлические свойства у:
- А)Mg B)Ra
- Б)Ва Г)Са
- 8. С какими из перечисленных веществ реагируют щелочноземельные металлы:
- А) S В) H2O
- Б) Cl2 Г) Fe
- 9. Где применяется соединения магния MgSO4
- А)в машиностроении Б)для получения серной кислоты
- В)для получения стекла Г)в строительстве
- 10. Природный мел- это:
- А) CaSO4 Б) MgSO4
- В)CaCO3 Г)ВаSO4






