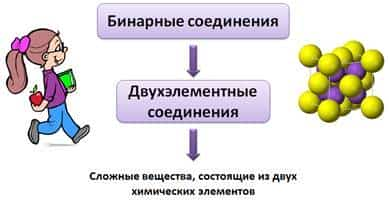
Бинарные соединения еще называют двухэлементными соединениями, потому что «би» от лат. – два. Т.е. бинарные соединения – это сложные вещества, состоящие из двух химических элементов.
Например, при изучении ионной и ковалентной связи, мы встречали такие соединения. При образовании молекулы NaCl, Na отдаёт свой электрон атому Cl, при этом они оба превращаются в ионы Na+ и Cl-.
Ионное соединение
При образовании молекулы HCl, общая пара электронов смещена к атому Cl, т.к. он более электроотрицательный и на атомах появляются частичные заряды: на атоме H+δ, на атоме Cl-δ.
Если предположить, что электрон от Н полностью перешёл к атому Cl, то их заряды будет не частичные, а +1 и –1: H+1 и Cl-1.
Эти условные заряды и называют степенью окисления.
Ковалентная полярная связь
Значения степеней окисления ставят над символом элемента арабской цифрой, впереди которой ставят «+» или «-». Например, MgCl2, степень окисления Mg (+2), Cl (–1). Следует различать степени окисления и заряды ионов. Например, в молекуле NaCl, степень окисления Na (+1), а Cl (–1). В зарядах этих ионов цифры опускают и записывают ионы Na+, Cl-.
Степени окисления
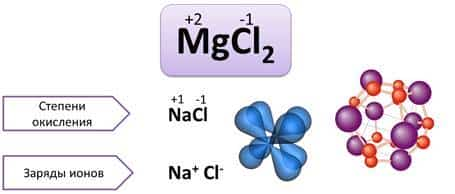
Степень окисления – это условный заряд атомов химического элемента в соединении, если предположить, что оно состоит только из ионов.
Степень окисления может быть положительной, отрицательной и нулевой. Положительную степень окисления имеют как металлы, так и неметаллы, кроме фтора, гелия и неона. Максимальная степень окисления равна номеру группы. Т.е. у N высшая степень окисления равна +5, т.к. он находится в V группе.
Отрицательную степень окисления имеют только неметаллы, т.к. они присоединяют электроны до завершения внешнего уровня. Минимальная степень окисления равна № группы – 8. Т.о. у N минимальная степень окисления будет 5 – 8 = –3. Кроме максимальной и минимальной степени окисления есть еще промежуточная степень окисления.
Например, у N она равна +3.
Нужно знать, что степень окисления простых веществ равна 0, т.е. у N2, H2, S8, Cu, O3 и др. простых веществ она – .
Степень окисления F всегда –1, потому что он самый электроотрицательный элемент и принимает электроны при образовании химической связи. Например, в соединении NaF, у F степень окисления (–1).
У кислорода степень окисления –2, потому что он второй элемент по электроотрицательности, исключение cоставляет соединение кислорода с фтором, где его степень окисления +2. Например, в соединении CaO, степень окисления О (–2), а в соединении OF2, степень окисления О (+2).
У металлов степень окисления всегда положительная, т.к. они отдают электроны другим атомам. Степень окисления металлов А групп численно совпадает с валентностью. Например, в соединении Na2O степень окисления Na (+1), т.к.
он является металлом, значит, у него только положительная степень окисления, а 1, потому что он является металлом I A группы, значит, и валентность его – единица. Аналогично и в соединении BaS, степень окисления Ва (+2), т.к.
он металл II A группы, в соединении Al2O3, степень окисления Al (+3), т.к. это металл III А группы.
Степень окисления Н всегда (+1), за исключением его соединений с металлами, где у него степень окисления (–1). Например, CaH2, KH, LiH, в этих соединениях у водорода степень окисления (–1).
Как было сказано, валентность численно совпадает со степенью окисления. Однако не всегда. Степень окисления имеет знак заряда, а валентность – нет.
Валентность – это число связей, которыми атом связан с другими атомами, а степень окисления – это условный заряд атомов.
Сравним валентность и степень окисления у азота (N2). Степень окисления равна 0, т.к. это простое вещество, а вот валентность равна III, потому что атом азота связан с другим атомом азота тройной связью.
Или в пероксиде (Н2О2) степень окисления О (–1), а валентность равна II, т.к. О связан двумя связями с атомами водорода: Н – О – О – Н.
А в ацетилене (С2Н2) степень окисления С (–1), а валентность IV:
Н – С ≡ С – Н.
Учитывая, что суммарная степень окисления равна 0, можно найти степени окисления элементов в соединении, а также составить формулу соединения, зная степени окисления.
Определим степени окисления элементов в соединении Fe2O3. Степень окисления О нам известна (–2). Следовательно, три атома О будут иметь общий заряд (–6), т.к. (–2) · 3 = –6. Тогда общий заряд двух атомов железа будет равен (+6), помните, что суммарный заряд равен 0. Значит, степень окисления одного атома Fe будет (+3), т.к. (+6) ׃ 2 = +3.
Составим формулу соединения Al с C. Для этого запишем символы элементов Al, C. Углерод на втором месте, потому что он более электроотрицательный. Al – элемент III A группы.
Он является металлом, поэтому он отдаст свои 3 электрона и получит степень окисления (+3), а С – элемент IV A, он примет еще 4 электрона для завершения своего внешнего уровня, на котором уже есть 4 электрона, при этом получит степень окисления (–4).
Запишем значения степеней окисления в формулу сверху. Теперь найдем наименьшее общее кратное. Оно будет 12. Затем НОК разделим на абсолютные значения степеней окисления и получим соответствующие индексы.
12 : 3 = 4, значит индекс у Al – 4, 12 : 4 = 3, значит индекс у С – 3. Следовательно, формула будет Al4C3.
Чтобы дать название бинарному соединению нужно сделать следующим образом: сначала называют более электроотрицательный элемент – это неметалл.
Его латинское название стоит в именительном падеже и употребляется с суффиксом – ид. Например: оксид, хлорид, сульфид, нитрид.
Второе слово обозначает элемент менее электроотрицательный, его название стоит в родительном падеже.
Например, назовём следующие соединения: Na2S, K2O, BaCl2, Mg3N2.
Na2S – сульфид натрия, K2O – оксид калия, BaCl2 – хлорид бария, Mg3N2– нитрид магния. Если элемент имеет переменную степень окисления, то после названия в скобках римскими цифрами указывают степень окисления. Например, назовём следующие соединения: MnO2, CO2, P2O5.
MnO2 – оксид марганца (IV), CO2 – оксид углерода (IV), P2O5 – оксид фосфора (V).
Название бинарного соединения

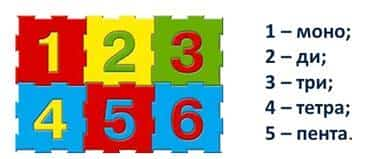
В некоторых случаях, число атомов элементов обозначают при помощи названий числительных на греческом языке. Т.е. 1 – моно, 2 – ди, 3 – три, 4 – тетра, 5 – пента и т.д. Например, СО – монооксид углерода, или оксид углерода (II); СО2 – диоксид углерода, или оксид углерода (IV).
Для того чтобы химики всего мира понимали друг друга, необходимо было создать единую терминологию и номенклатуру, т.е. названия веществ. Впервые в 1785 г. такими учеными, как А. Лавуазье, А. Фуркруа, Л.
Гитоном де Мерво и К. Бертолле, были разработаны принципы номенклатуры. В настоящее время принципы номенклатуры и терминологии разрабатывает Международный союз теоретической и прикладной химии (ИЮПАК).
Степень окисления
Степень окисления
При изучении ионной и ковалентной полярной химической связи вы знакомились со сложными веществами, состоящими из двух химических элементов. Такие вещества называют би парными (от лат. би — «два») или двухэлементными.
Вспомним типичные бпнарные соединения, которые мы привели в качестве примера для рассмотрения механизмов образования ионной и ковалентноЙ полярной химической связи: NaHl — хлорид натрия и НСl — хлороводород. В первом случае связь ионная: атом натрия передал свой внешний электрон атому хлора и превратился при этом в ион с зарядом -1. а атом хлора принял электрон и превратился в ион с зарядом -1. Схематически процесс превращения атомов в ионы можно изобразить так:
В молекуле же НСl связь образуется за счет спаривания не-спаренных внешних электронов и образования общей электронной пары атомов водорода и хлора.
Правильнее представлять образование ковалентной связи в молекуле хлороводорода как перекрывание одноэлектронного s-облака атома водорода с одноэлектронным p-облаком атома хлора:
При химическом взаимодействии общая электронная пара смещена в сторону более электроотрицательного атома хлора:

Такие условные заряды называются степенью окисления. При определении этого понятия условно предполагают, что в ковалентных полярных соединениях связующие электроны полностью перешли к более электроотрицательному атому, а потому соединения состоят только из положительно и отрицательно заряженных ионов.
Степень окисления — это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентно-полярные) состоят только из ионов.Степень окисления может иметь отрицательное, положительное или нулевое значения, которые обычно ставятся над символом элемента сверху, например:
Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов пли к которым смещены общие электронные пары, то есть атомы более электроотрицательных элементов. Фтор всегда имеет степень окисления -1 во всех соединениях. Кислород, второй после фтора по значению элекгроотрицательности элемент, почти всегда имеет степень окисления -2, кроме соединений со фтором, например:
Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, то есть атомы менее электроотрицательных элементов. Металлы всегда имеют положительную степень окисления. У металлов главных подгрупп:
I группы во всех соединениях степень окисления равна +1,II группы равна +2. III группы — +3, например:

В соединениях суммарная степень окисления всегда равна нулю. Зная это и степень окисления одного из элементов, всегда можно найти степень окисления другого элемента по формуле бинарного соединения. Например, найдем степень окисления хлора в соединении Сl2О2. Обозначим степень окисления -2кислорода: Сl2О2. Следовательно, семь атомов кислорода будут иметь общий отрицательный заряд (-2) • 7 =14. Тогда общий заряд двух атомов хлора будет равен +14, а одного атома хлора:
(+14):2 = +7.
Аналогично, зная степени окисления элементов, можно составить формулу соединения, например карбида алюминия (соединения алюминия и углерода). Запишем знаки алюминия н углерода рядом АlС, причем сначала знак алюминия, так как это металл. Определим по таблице элементов Менделеева число внешних электронов: у Аl — 3 электрона, у С — 4. Атом алюминия отдаст свои 3 внешних электрона углероду и получит при этом степень окисления +3, равную заряду иона. Атом углерода, наоборот, примет недостающие до «заветной восьмерки» 4 электрона и получит при этом степень окисления -4.
Запишем эти значения в формулу: АlС, и найдем наименьшее общее кратное для них, оно равно 12. Затем рассчитаем индексы:
Знать степени окисления элементов необходимо и для того, чтобы уметь правильно называть химическое соединение.
Названия бинарных соединений состоят из двух слов — названий образующих их химических элементов. Первое слово обозначает электроотрицательную часть соединения — неметалл, его латинское название с суффиксом -ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть — металл или менее электроотрицательный элемент, его название всегда стоит в родительном падеже.
Если же электроположительный элемент проявляет разные степени окисления, то это отражают в названии, обозначив степень окисления римской цифрой, которая ставится в конце.

Чтобы химики разных стран понимали друг друга, потребовалось создание единой терминологии и номенклатуры веществ. Принципы химической номенклатуры были впервые разработаны французскими химиками А. Лавуазье, А.Фурктуа, Л.Гитоном и К.Бертолле в 1785г. В настоящее время Международный союз теоретической и прикладной химии (ИЮПАК) координирует деятельность ученых рядных стран и издает рекомендации по номенклятурс веществ и терминологии, используемой к химии.
Химия. 11 класс
Валентность
Способность атомов присоединять к себе строго определённое число других атомов характеризуется с помощью валентности.
Наиболее просто объяснить, что такое валентность, можно на примере соединений с ковалентными связями. В таких соединениях валентность атомов отдельного элемента принято определять числом образованных ковалентных связей.
- Например, валентность кислорода в молекулах воды , пероксида водорода , метаналя равна двум.
- Валентность азота в простом веществе и аммиаке равна трём, а в ионе аммония — четырём:
- Прогнозируя число возможных валентностей атома какого-либо элемента в различных соединениях, мы указываем валентные возможности атома. Валентные возможности атома определяются:
- а) числом неспаренных валентных электронов, способных принять участие в образовании химических связей по обменному механизму;
- б) числом внешних атомных орбиталей (вакантных или заполненных), способных образовать химическую связь по донорно-акцепторному механизму.
Рассмотрим валентные возможности атома фосфора с учётом числа его неспаренных электронов.
Электронная конфигурация валентного слоя атома фосфора в основном состоянии — 3s23p33d0, что даёт ему возможность образовать только три связи по обменному механизму: 15P
Но атом фосфора способен образовать и пять связей, если один 3s-электрон перевести в возбуждённое состояние. При этом электронная конфигурация атома фосфора будет иметь вид 3s13p33d1:
Применяя аналогичные построения, можно прийти к заключению, что атом серы может проявлять валентности 2, 4, 6, а атом хлора — 1, 3, 5, 7.
Рассмотрим валентные возможности азота, атомы которого, как и атомы фосфора, имеют пять электронов на внешнем электронном уровне.
Исходя из электронной конфигурации его валентного слоя 2s22p3 и электронно-графической схемы , делаем заключение, что атомы азота могут проявлять валентность 3, так как имеют три неспаренных электрона.
Пятивалентное состояние для него невозможно из-за отсутствия свободных орбиталей на втором уровне. Однако у атома азота на внешнем уровне имеются четыре орбитали (ячейки). Поэтому он может образовать четыре ковалентные связи, что мы наблюдаем в случае иона аммония:
Таким образом, максимальная валентность атомов азота равна 4.
Максимальная валентность не только азота, но и других элементов второго периода не может превышать четырёх, так как на внешней электронной оболочке атомов этих элементов имеются только четыре орбитали.
Почему нельзя расширить валентные возможности элементов второго периода, предоставив электронам возможность перейти на 3-й энергетический уровень? Это объясняется тем, что разница в энергии между 2-м и 3-м энергетическими уровнями гораздо больше, чем между подуровнями одного энергетического уровня, и затраты энергии на возбуждение не компенсируются энергией образования новых связей.
Степень окисления. Составление формул по степени окисления
Степень
окисления. Составление формул по степени окисления.
- Курова
Ольга Геннадьевна, - учитель
химии МБОУ СОШ № 6 г. Торжка - Цели урока.
- Дидактические:
- опираясь на знания учащихся, повторить понятия “химическая формула”;
- способствовать формированию у учащихся понятия “степень окисления” и умению определять степень окисления элементов по формулам веществ;
- акцентировать внимание школьников на возможности интеграции курсов химии, математики.
Развивающие:
- продолжить формирование умений формулировать определения;
- разъяснять смысл изученных понятий и объяснять последовательность действий при определении степени окисления по формуле вещества;
- способствовать обогащению словарного запаса, развитию эмоций, творческих способностей;
- развивать умение выделять главное, существенное, сравнивать, обобщать, развивать дикцию, речь.
Воспитательные:
- воспитывать чувство товарищества, умение работать коллективно;
- повысить уровень эстетического воспитания учащихся;
- ориентировать учащихся на здоровый образ жизни.
Планируемые
результаты обучения:
- Учащиеся должны уметь формулировать определение “степень окисления”, знать атомы с постоянной степенью окисления, определять по ней степень окисления атомов других элементов в бинарных соединениях,
- Уметь разъяснять смысл понятия “степень окисления” и последовательность действий при ее определении атомов элементов по формулам веществ.
Понятия, впервые
вводимые на уроке: степень окисления, значения степени окисления..
- Организационные
формы: беседа,
индивидуальные задания, самостоятельная работа. - Средства обучения:
алгоритм
определения степени окисления - Демонстрационное
оборудование: шаростержневые модели молекул хлороводорода, воды,
аммиака, метана. - Оборудование для
учащихся:
на каждом столе “Алгоритм определения степени окисления”. - Опережающее
задание: индивидуальное
задание – подготовить сообщение на тему “Эволюция понятия “степень окисления”. - Ход урока
I. Ориентировочно-мотивационный
этап.
1. Фронтальная беседа с учащимися
по пройденной теме “Химическая формула”.
Задание:Чтение
формул, отработка информации по ним. (Демонстрация учителем формул,
отпечатанных на отдельных листах).
2. Индивидуальная работа по карточкам
трёх учащихся по теме “Расчеты по формуле”. Учащиеся проводят расчеты
относительной молекулярной массы, массовых соотношений, массовой доли. (Выполняют
решение на доске). Анализируют и оценивают учащиеся класса.
Карточка № 1.
Рассчитайте относительную молекулярную массу, массовые соотношения, массовые доли
веществ: NaCl, K2O. Необходимые данные – в ПС
Карточка № 2. Рассчитайте
относительную молекулярную массу, массовые соотношения, массовые доли веществ:
CuO, SO2.
Карточка № 3. Рассчитайте
относительную молекулярную массу, массовые соотношения, массовые доли веществ:
CH4, NO.
3. Самостоятельная работа учащихся
в тетрадях.
Задача
информационно-вычислительного характера (условие записано в раздаточном
материале).
Эффективность зубных паст в профилактике
кариеса можно сравнить по содержанию в них активного фтора, способного
взаимодействовать с зубной эмалью. Зубная паста “Флюорит” (производство Россия)
содержит, как указано на упаковке, SnF2, а зубная паста “DENT”
(производство Болгария) содержит NaF. Вычислите, какая из этих двух паст более
сильнодействующее средство для профилактики кариеса.
Проверка: решения
у пяти первых учащихся, обсуждение и решение у доски — один
учащийся.
II.
Операционно-исполнительный этап.
1. Объяснение учителя. Постановка
проблемы.
Понятие степени окисления.
– До сих пор мы пользовались
готовыми формулами, приведёнными в учебнике. Химические формулы можно вывести
на основании данных о составе веществ. Но чаще всего при составлении химических
формул учитываются закономерности, которым подчиняются элементы, соединяясь
между собой.
- Задание: сравните
качественный и количественный состав в молекулах: HCl , H2O, NH3,
CH4. - Беседа с
учащимися: - – Что общего в составе молекул?
- Предполагаемый
ответ: Наличие
атомов водорода. - – Чем они отличаются друг от друга?
- Предполагаемый
ответ:
- HCl – один атом хлора удерживает один атом водорода,
- H2O – один атом кислорода удерживает два атома водорода,
- NH3 – один атом азота удерживает три атома водорода,
- CH4 – один атом углерода удерживает четыре атома водорода.
- Демонстрация шаростержневых
моделей. - Проблема: Почему
различные атомы удерживают различное количество атомов водорода? - (Выслушиваем
варианты ответов учащихся).
Вывод: У атомов
разная способность удерживать определённое количество других атомов в
соединениях. Это можно определить по степени окисления элементов в молекуле.
Степень окисления в неорганической химии
Степень окисления (с.о.) – условный заряд атома
(или группы атомов) в соединении, вычисленный из предположения, что оно состоит
только из ионов.
- Ионы – это положительно (катионы) или
отрицательно (анионы) заряженные частицы, образованные в результате отдачи или
присоединения электронов нейтральными атомами или группами атомов. - Запись в тетради:
- Степень окисления может быть
положительная у металлов и неметаллов, когда атом отдает все валентные
электроны, обозначается (+ n), где n – номер группы. - Записи на доске и
в тетрадях:
| +1 -1 H Cl | +1 -2 H2O | +1 -3 H3N | I IV H4C |
Степень окисления водорода
постоянная с неметаллами и равна +1, степень окисления кислорода (-2).
Правила определения степеней окисления
1. В простом веществе степень окисления атомов равна 0.
2. Сумма степеней окисления в нейтральном соединении равна 0, в
многоатомном ионе равна заряду иона.
3. В бинарном соединении степень окисления более
электроотрицательного атома обозначают со знаком «–», а менее
электроотрицательного – со знаком «+».
- 4. Cтепени окисления атомов некоторых элементов в соединениях:
- а) фтора (F) –1;
- б) металлов Iа группы (Li, Na, K, Rb, Cs) +1, металлов IIа группы
(Be, Mg, Ca, Sr, Ba) +2, алюминия (Al) +3; - в) водорода (Н) в соединениях с металлами –1, в остальных
соединениях +1; - г) кислорода (О) во фториде OF2 +2, в пероксиде O2F2
+1, в остальных пероксидах (содержат группу –О–О–) –1, в остальных соединениях
–2.
5. Суммарная степень окисления атомов элементов гидроксильной
группы OH –1, группы NH4 +1.
6. Суммарная степень окисления атомов элементов кислотного остатка
(продукта «отрыва» одного или нескольких ионов H+ от кислоты)
отрицательна и равна числу «оторванных» ионов Н+.
Программа деятельности № 1.«Определение степени окисления атома по
формуле вещества»
| Программа деятельности | Пример выполнения |
| 1) Запиши известные значения с.о. атомов | +1 –2 K2Cr2O7 |
| 2) Вычисли суммарные с.о. атомов каждого элемента, для этого: а) умножь значения их с.о. на число атомов в химической формуле; б) сложи полученные результаты | а) У K: (+1)•2 = +2, у О: (–2)•7 = –14; б) cуммарная с.о. K и О:+2 – 14 = –12 |
| 3) Определи суммарную с.о. для атомов того элемента, у которого с.о. неизвестна (она равна по величине и противоположна по знаку числу, полученному в п. 2) | Суммарная с.о. (2Сr) = +12 |
| 4) Рассчитай искомую с.о., для этого раздели величину, полученную в п. 3, на число атомов этого элемента | с.о. (Сr) = (+12)/2 = +6, +1 +6 –2 K2Cr2O7 |
Программа деятельности № 2.«Составление эмпирической формулы
вещества по степеням окисления атомов или зарядам ионов»
| Программа деятельности | Примеры выполнения | |
| 1) Запиши знаки химических элементов, образующих соединение*, проставь с.о. атомов или заряды ионов | +3 –2 СrO | Na+(PO4)3– |
| 2) Для с.о. или зарядов ионов найди наименьшее общее кратное (НОK) | НОK (2•3) = 6 | НОK (1•3) = 3 |
| 3) Рассчитай число атомов или ионов в соединении, для этого раздели НОK на значение с.о. или заряда иона | 6 : 3 = 2, 6 : 2 = 3,Сr2O3 | 3 : 1 = 3 3 : 3 = 1,Na3PO4 |
*Если бинарное соединение состоит из атомов металла и неметалла,
то на первое место в формуле ставят символ металла; если бинарное соединение
состоит из атомов двух неметаллов, то на первом месте пишут символ элемента,
который стоит левее в ряду:
Rn, Xe, Kr, B, Si, C, Sb, As, P, N, H, Te, Se, S, At, I, Br, Cl,
O, F.
III.
Оценочно-рефлексивный этап.
Первичная проверка усвоения знаний.
В течение трёх минут необходимо
выполнить одно из трёх заданий по выбору. Выбирайте только то задание, с
которым вы справитесь. Задание в раздаточном материале.
- Репродуктивный уровень (“3”). Определите степень окисления атомов химических элементов по формулам соединений: NH3, Au2O3, SiH4, CuO.
- Прикладной уровень (“4”). Из приведённого ряда выпишите только те формулы, в которых атомы металлов имеют степень окисления (+2): MnO, Fe2O3 , CrO3, CuO, K2O, СаH2.
- Творческий уровень (“5”).Найдите закономерность в последовательности формул: N2O, NO, N2O3 и проставьте степень окисления над каждым элементом.
Проверка
выборочная. Консультант из числа учащихся по готовому
шаблону проверяет тетради учащихся.
Работа над
ошибками.
Ответы на обратной стороне доски.
Проверь себя
Упражнение 1. Запиши символы:
а) неметаллов с постоянной с.о. ………………………………….………………… ;
б) металлов с постоянной с.о. ……………………………………………………….. .
Упражнение 2. Стрелками укажи c.о.
атомов кислорода и водорода в веществах:
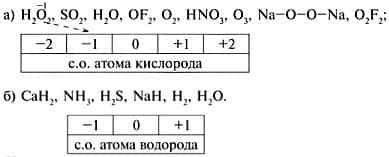
Упражнение 3. Составь формулы
кислотных остатков и определи суммарную с.о. атомов элементов.
| Kислота | Kислотные остатки | с.о. |
| H2SO4 | HSO4 | –1 |
| SO4 | –2 | |
| H3PO4 | H2PO4 | …………… |
| HPO4 | ……………. | |
| PO4 | …………… | |
| HNO3 | …………… | …………… |
| H2SO3 | …………… | …………… |
| …………… | …………… | |
| H2CO3 | …………… | …………… |
| …………… | …………… |
- Упражнение 4. Определи степени
окисления атомов элементов, входящих в состав веществ: - а) AlCl3, H2Se, CaH2, SiF4,
AlN, XeO4, LiH, SF6, NH3, NF3, N2O5,
N2H4, O2F2, P4O10,
I2O5, Ca2Si; - б) HСlO, KHF2, K2CO3, KСlO3,
HСlO4, NH4OH, NaClO2, H3PO4,
K2Cr2O7, NH2OH, MgOHCl, Cl2.
Упражнение 5. Проставь степени
окисления атомов металлов и суммарные с. о. атомов элементов кислотных остатков
следующих солей (формулы кислот см. в приложении, табл. 2):
- a) MnSO4, LiNO2, PbSiO3, Fe(NO3)3;
- б) Fe2(SO4)3, Hg(NO3)2,
Zn3(PO4)2, Cd(HCO3)2; - в) Fe3(PO4)2, SnHPO4,
Pb(HSO4)2, Cu(NO3)2; - г) Ag2SO3, Cu(NO2)2,
Fe(H2PO4)2, ZnSO3; - д) Fe(OH)2Cl, AlOH(NO3)2, Сu2(OH)2CO3,
Ca3(PO4)2.
Упражнение 6. В клетках таблицы
вместо точек запиши формулы бинарных соединений АхВy,
состоящих из атомов элементов в указанных с. о.
| Элемент А | +1 Na | +2 Ba | +3 Al | +5 P | +3 P | +4 C |
| Элемент В | ||||||
| –2 O | …………. | …………. | …………. | …………. | …………. | …………. |
| –1 Cl | …………. | …………. | …………. | …………. | …………. | …………. |
| –2 S | …………. | …………. | …………. | …………. | …………. | …………. |
| –1 Br | …………. | …………. | …………. | …………. | …………. | …………. |
Упражнение7. Проанализируй формулы
веществ: H2SO4, SO2, Na2S, SO3,
H2S, K2SO3. Раздели их:
- а) на две группы:
- 1) ………………………………………. ; 2) ………………………………………… ;
- б) на три группы:
1) ………………………………………. ; 2) …………………..……………………. ;
3) ……………………….……………… .
Укажи критерии классификации в каждом случае:
а) ……………………………………….…………………………………………………… ;
б) ……………………………………………………………………………………………. .
4. Упражнение:определить
степень окисления элементов в веществах (тренажёр: ученики цепочкой
выходят к доске). Задание в раздаточном материале.
SiH4, CrO3, H2S,
CO2, CO, SO3, SO2, Fe2O3,
FeO, HCl, HBr, Cl2O5, Cl2O7, РН3,
K2O, Al2O3, P2O5, NO2,
N2O5, Cr2O3, SiO2, B2O3,
SiH4, Mn2O7, MnO, CuO, N2O3.
IV. Подведение
итогов урока.
Беседа с учащимися:
- Какую проблему мы поставили в начале урока?
- К какому выводу мы пришли?
- Дать определение “степени окисления”.
- Чему равна степень окисления водорода? Кислорода?
- Как определить степень окисления атома в соединении?
Оценка работы учащихся в целом и
отдельных учащихся.
Домашнее задание:
О.С. Габриелян Химия 8 класс § 17, в 1-3
– Благодарю за урок. До свидания.
Степень окисления | это… Что такое Степень окисления?
Сте́пень окисле́ния (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Представления о степени окисления положены в основу классификации и номенклатуры неорганических соединений.
Содержание
|
Описание
Степень окисления соответствует заряду иона или формальному заряду атома в молекуле или в химической формальной единице, например:
Степень окисления указывается сверху над символом элемента. В отличие от указания заряда иона, при указании степени окисления первым ставится знак, а потом численное значение, а не наоборот:
Степень окисления атома в простом веществе равна нулю, например:
Алгебраическая сумма степеней окисления атомов в молекуле всегда равна нулю:
Понятие степени окисления вполне применимо и для нестехиометрических соединений (КС8, Mo5Si3, Nb3B4 и др.).
Например в известной реакции обжига пирита:
4FeS2 +11O2 = 2Fe2O3 + 8SO2
удобнее всего принять в исходном соединение степень окисления у железа +3 (хотя реально атом железа смещает от себя 2 электрона, то есть степень окисления железа +2), а у серы −3/2 (!), что совсем не противоречит определению степени окисления, как условной единицы и позволяет так же просто, как и в случае других окислительно-восстановительных процессов, уравнять реакцию.
Суммарная степень окисления атомов в молекуле всегда равна нулю.
Условность
Следует помнить, что степень окисления является сугубо условной величиной, не имеющей физического смысла, но характеризующей образование химической связи межатомарного взаимодействия в молекуле.
Степень окисления в ряде случаев не совпадает с валентностью. Например, в органических соединениях углерод всегда четырёхвалентен, а степень окисления атома углерода в соединениях метана CH4, метилового спирта CH3OH, формальдегида HCOH, муравьиной кислоты HCOOH и диоксида углерода CO2, соответственно, равна −4, −2, 0, +2 и +4.
Степень окисления зачастую не совпадает с фактическим числом электронов, которые участвуют в образовании связей. Обычно это молекулы с различными электрондефицитными химическими связями и делокализацией электронной плотности.
Например, в молекуле азотной кислоты степень окисления центрального атома азота равна +5, тогда как формальная валентность — 4, а координационое число — 3.
В молекуле озона, имеющей сходное с SO2 строение, атомы кислорода характеризуется нулевой степенью окисления.
Истинные заряды атомов в соединениях, определённые экспериментальным путём, также не совпадают со степенями окисления этих элементов.
Например, заряды атомов водорода и хлора в молекуле хлороводорода HCl, в действительности, равны соответственно +0,17 и −0,17, хотя их степени окисления в этом соединении равны +1 и −1, а в кристаллах сульфида цинка ZnS заряды атомов цинка и серы равны соответственно +0,86 и −0,86, вместо степеней окисления +2 и −2.[1]
См. также
- Валентность
- Координационное число
Примечания
ПОИСК
В органической химии в соответствии с общим определением реакциями восстановления принято называть реакции, протекающие с уменьшением суммарной степени окисления атомов углерода или гетероатомов реакционного центра субстрата.
Органические соединения восстанавливаются в процессах присоединения по кратным связям водорода, металлов, гидридов металлов и гидридов электроположительных металлоидов (бора, кремния, фосфора), замещения электроотрицательного гетероатома, гетероатомной или углеродной группировки на атом водорода или металла, элиминирования электроотрицательных атомов или гетероатомных групп, связанных с атомами реакционного центра через электроотрицательные атомы, и сочетания с предшествующим (или одновременным) разрывом связей между атомами углерода или гетероатомами и атомами более электроотрицательных элементов. Отдельные примеры таких реакций приведены ниже. [c.10] В гидроксиламине суммарная степень окисления азота равна [c.163]
Здесь иа восстановительную активность гидразина оказывает влияние сдвоенность атомов азота, суммарная степень окисления кото- [c.252]
Изогипсическими принято считать также реакции, в которых образуются связи между углеродными атомами или гетероатомами органических субстрата и реагента с сохранением суммарной степени окисления этих атомов [c.12]
Суммарная степень окисления углерода меняется до -Ы4,0. В свою очередь, для образования биомассы должно быть восстановлено определенное количество нитрата, а именно 0,56 моль N0 [c.128]
Сернистый газ, поступающий на контактирование при 45— 50 «С, нагревается в межтрубном пространстве наружного теплообменника 4 до 230—240 °С горячими контактными газами, движущимися противотоком по внутренним трубам теплообменника.
Далее газ последовательно проходит в межтрубном пространстве теплообменников 3, 2, 1 (начиная с нижнего), где нагревается до температуры начала реакции (около 440°С), и далее поступает сверху в первый слой катализатора. Здесь окисляется большая часть сернистого ангидрида (около 70%), так как концентрации ЗОг и Ог в газе велики и соответственно высока скорость реакции.
Температура газа в первом слое повышается до 590—600 °С, далее он охлаждается до 450—460 °С в трубах промежуточного теплообмена 1 и поступает во второй слой катализатора, где окисляется еще около 20% 50г. Затем газ охлаждается в теплообменнике 2 до 440°С и проходит через третий слой катализатора, где окисляется около 6% ЗОг.
После охлаждения в теплообменнике 3 до 415—418 °С газ проходит четвертый слой катализатора, здесь окисляется еще 2% ЗОг. Таким образом, суммарная степень окисления ЗОг в ЗОз составляет около 98%. В третьем и четвертом слоях катализатора реакция протекает значительно медленнее, так как концентрации реагирующих веществ малы и степень окисления приближается к равновесной.
Поэтому в третьем и четвертом слоях помещают в два раза больше катализатора, чем в верхних слоях. Для снижения гидравлического сопротивления в третьем и четвертом слоях катализаторной массы нижняя часть контактного аппарата расширена. [c.113]
Обычно определяют общее содержание азота и суммарную степень окисления. [c.687]
Наиболее примитивным способом извлечения энергии из внешних энергетических ресурсов, в частности из глюкозы, является брожение.
Брожение — это окислительно-восстановительный процесс, в котором суммарная степень окисления продуктов реакций не отличается от степени окисления исходных веществ. Роль окислителя (аккумулятора электронов) играет какая-либо органическая молекула, образующаяся в ходе брожения.
Существуют два типа брожения — гликолиз и спиртовое брожение. Процесс гликолиза выражается суммарным уравнением [c.418]
С указанной точки зрения степень окисления водорода в Н в НаО одинакова и равна + 1. Степень окисления кислорода в воде и в Мп07 тоже одинакова и равна —2. Поскольку заряд иона (суммарная степень окисления) для МпОТ равен —1, то на долю марганца [c.252]
С указанной точки зрения степень окисления водорода в Н+ и в Н2О одинакова и равна + 1. Степень окисления кислорода в воде и в МПО4 тоже одинакова и равна —2. Поскольку заряд иона (суммарная степень окисления) для МПО4- равен —1, то на долю марганца приходится степень окисления +1. Реакцию окисления с по- [c.291]
На рнс. 11-3 видно также, что среди соединений, для которых характерна одна н та же суммарная степень окисленности, например для-уксусной кислоты и сахаров, степень окисленности отдельных атомов углерода может очень сильно различаться.
В сахаре, например, каждый атом углерода можно рассматривать как происщедщий непосредственно из формальдегида, однако в уксусной кислоте один конец окислен до карбонильной группы, а другой восстановлен до метильной группы. Такие внутренние окисл1ительно-восстановительные реакции (гл. 7, разд.
И, 6) играют важную роль в химических манипуляциях, необходимых для сборки углеродных скелетов, в которых нуждается клетка. Студентам целесообразно располож,ить другие соединения таким же образом, как это сделано на рис.
11-3, -и посмотреть, как меняется суммарная степень окисленности соединения по мере продвижения вдоль метаболического пути. [c.473]
НЫМИ числами 8 и 4 и суммарной степенью окисления 8.) Следует заметить, что в структурах сложных оксидов позиции с различными координационными числамп не обязательно заняты атомами разных металлов.
Как только что было отмечено, в некоторых простых оксидах ионы одного сорта занимают две кристаллографически неэквивалентные позиции такое же яв ление наблюдается в структурах некоторых сложных оксидов В структуре граната (разд. 13.6.5) ионы металла занимают по зиции с КЧ 4, 6 и 8.
В структурах некоторых гранатов ноны од ного сорта распределены по позициям с КЧ 4 и 6, в других гра натах — с КЧ 6 н 8. Одиако маловероятно, чтобы все три тппа позиций в кристалле были заняты ионами одного сорта.
Структуры, принадлежащие ко второму основному классу, могут быть охарактеризованы как структуры, свойственные исключительно сложным оксидам. [c.290]
Смотреть страницы где упоминается термин Суммарная степень окисленности: [c.37] [c.290] [c.20] [c.13]
Биохимия Том 3 (1980) — [ c.473 ]
Окисления степень
© 2022 chem21.info Реклама на сайте






