- Положение в периодической системе Менделеева
- Электронное строение и закономерности изменения свойств
- Физические свойства щелочноземельных металлов
- Химические свойства
- Нахождение в природе
- Способ получения
- Качественные реакции
- Применение щелочноземельных металлов
- Щелочноземельные металлы
- Способы получения
- Применение щелочноземельных металлов
- Щелочные и щелочноземельные металлы
- Щелочноземельные металлы
- Применение и биологическая роль щелочноземельных металлов и их соединений
- Распространение и использование щёлочноземельных металлов
- Щелочные и щелочноземельные металлы
- Щелочноземельные металлы: общая характеристика, строение; свойства и получение — урок. Химия, 9 класс
Щёлочноземельные металлы получили свое название за счет своих оксидов, которые сообщают воде щелочные реакции. Изучая химию, очень часто приходится взаимодействовать со сложными и непонятными названиями. Но если разобраться и понять что к чему, то изучать предмет легко и интересно.
Однако при написании формул стоит быть внимательным, не забывая про коэффициенты и признаки реакций.
Положение в периодической системе Менделеева
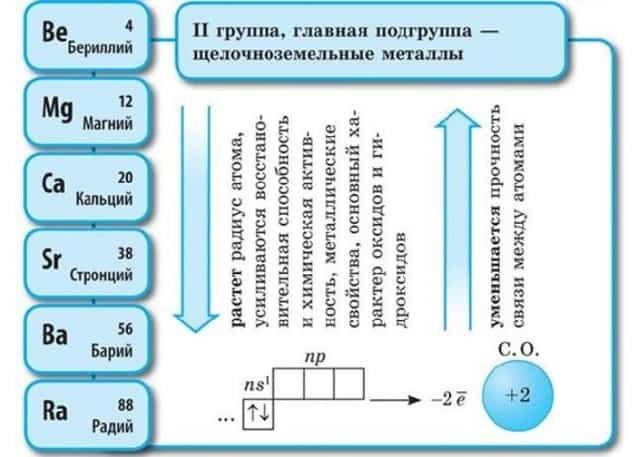
Щелочноземельные металлы – это химические элементы второй группы периодической системы химических элементов таблицы Менделеева:
- бериллий Be;
- магний Mg;
- кальций Ca;
- стронций Sr;
- барий Ba;
- радий Ra.
Электронное строение и закономерности изменения свойств
Атомы данных металлов на внешнем энергетическом уровне имеют 2 s-электрона. Отсюда следует, что максимальная степень окисления +2.
- Также могут иметь нулевую степень окисления, но не отрицательную, так как металлы не могут иметь данную степень.
- Общая конфигурация внешнего энергетического уровня nS2:

В периоде от Be до Ra металлические свойства, восстановительные, электроотрицательные увеличиваются, а неметаллические, окислительные свойства и радиус атома уменьшается.
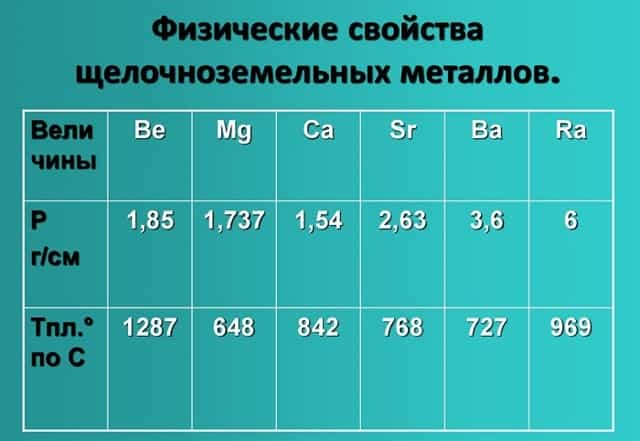
Физические свойства щелочноземельных металлов
- Физические свойства данной группы имеют следующие характеристики: светло-серый — темно-серый цвет, твердые вещества, не растворимые и нелетучие, без запаха, тепло-электропроводимые, имеют характерный металлический блеск.
- Показатели плотности и температуры плавления представлены в таблице:
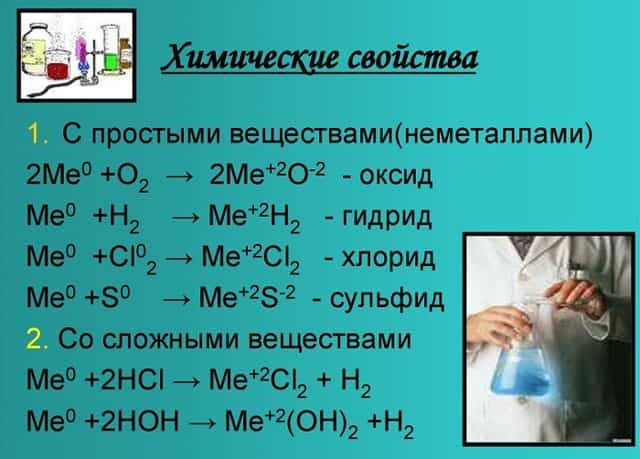
Химические свойства
Оксиды и гидроксиды щёлочноземельных металлов усиливают основные свойства при движении вниз по второй группе. Следовательно, бериллий имеет меньшие основные свойства, чем радий.
- Эти вещества взаимодействуют с любыми растворами кислот от сильной до слабой, а также с образованием солей, образуя белый осадок.
- 4Ca + 5H2SO4 (конц) = 4CaSO4 + H2S + 4H2O.
- С кислородом образуют реакцию горения и оксид:
- 2Mg + O2 = 2MgO.
- Металлы, стоящие в главной подгруппе второй группы (кроме бериллия) реагируют с водой. При проведении данных реакций выделяется водород (H2):
- Mg + 2H2O = Mg(OH)2 + H2,
- Вa + 2H2O = Вa(OH)2 + H2.
- Также реагируют с неметаллами:
- Bа + Cl2 = BаCl2 — хлорид бериллия;
- Ca + Br2 = CaBr2 — бромид кальция;
- Sr + H2 = SrH2 — гидрид стронция.
- Химические свойства щелочноземельных металлов показаны на картинке:
Нахождение в природе
Все металлы данного типа встречаются на земле, но не в чистом виде. Часто они представлены в виде минеральных солей. Самый распространённый считается кальций, магний немного уступает, затем идет барий и стронций.
Бериллий и радий являются самыми редкими, однако последний металл в больших количествах находится в урановых рудах.

Способ получения
- Магний, кальций и стронций получают электролизом расплавов солей.
- Барий получают с помощью восстановления оксида.
- При нагревании фторида бария получают сам металл.
Качественные реакции
- Одна из качественных реакций-окрашивание пламени.
- Список возможных цветов пламени при нагревании данных элементов:
- Ca — темно-оранжевый;
- Sr — насыщенный красный;
- Ba — светло-зеленый или классический зеленый.

Металлы данного типа при взаимодействии с щелочами, оксидами или растворами солей выпадают в белый осадок.
Применение щелочноземельных металлов
Бериллий из-за своей прочности добавляют в различные сплавы металлов, также препятствует коррозии. Используется в изготовлении рентгеновских аппаратов.
Магний и кальций активно использует для лекарственных средств, поскольку данные металлы играют большую роль в жизнедеятельности организма. Также в медицине используют радий, но для облучения кожи и злокачественных образований.
Стронций и барий добавляют в различный сплавы, которые работают в агрессивной среде и имеют сверхсильную проводимость.
Данные металлы играют огромную роль в жизни человека, выполняют различные функции и имеют ряд определенных свойств. Они содержатся в земной коре, поэтому довольно широко используются. Однако это не говорит о том, что их нужно расходовать безгранично.
Щелочноземельные металлы
К понятию щелочноземельных металлов относится часть элементов II группы системы Менделеева: бериллий, магний, кальций, стронций, барий, радий. Четыре последних металла имеют наиболее ярко выраженные признаки щелочноземельной классификации, поэтому в некоторых источниках бериллий и магний не включают в список, ограничиваясь четырьмя элементами.
Свое название металла получили благодаря тому, что при взаимодействии их оксидов с водой образуется щелочная среда.
Физические свойства щелочноземельных металлов: все элементы имеют серый металлический цвет, при нормальных условиях имеют твердую структуру, с ростом порядкового номера увеличивается их плотность, имеют очень высокую температуру плавления.
В отличие от щелочных металлов, элементы данной группы не режутся ножом (за исключением стронция). Химические свойства щелочноземельных металлов: имеют два валентных электрона, активность растет с повышением порядкового номера, в реакциях выступают в качестве восстановителя.

Характеристика щелочноземельных металлов свидетельствует об их высокой активности. В особенности это относится к элементам с большим порядковым номером. Например, бериллий в нормальных условиях не ступает во взаимодействие с кислородом и галогенами.
Для запуска механизма реагирования его необходимо нагреть до температуры свыше 600 градусов по Цельсию. Магний в нормальных условиях имеет на поверхности оксидную пленку и также не реагирует с кислородом. Кальций окисляется, но достаточно медленно.
А вот стронций, барий и радий окисляются практически мгновенно, поэтому их хранят в безкислородной среде под керосиновым слоем.
Все оксиды усиливают основные свойства с ростом порядкового номера металла. Гидроксид бериллия представляет собой амфотерное соединение, которое не реагирует с водой, но хорошо растворяется в кислотах.
Гидроксид магния является слабой щелочью, нерастворимой в воде, но реагирующей с сильными кислотами. Гидроксид кальция — сильное, малорастворимое в воде основание, реагирующее с кислотами. Гидроксиды бария и стронция относятся к сильным основаниям, хорошо растворимым в воде.
А гидроксид радия — это одна из сильнейших щелочей, которая хорошо реагирует с водой и практически всеми видами кислот.
Способы получения
Получают гидроксиды щелочноземельных металлов путем воздействия воды на чистый элемент. Реакция протекает при комнатных условиях (кроме бериллия, для которого требуется повышение температуры) с выделением водорода. При нагревании все щелочноземельные металлы реагируют с галогенами.
Полученные соединения используются в производстве большого ассортимента продукции от химических удобрений до сверхточных деталей микропроцессора.
Соединения щелочноземельных металлов проявляют такую же высокую активность, как и чистые элементы, поэтому их используют во многих химических реакциях.

Чаще всего это происходит при реакциях обмена, когда необходимо вытеснить из вещества менее активный металл. В окислительно-восстановительных реакциях принимают участие в качестве сильного восстановителя. Двухвалентные катионы кальция и магния придает воде так называемую жесткость.
Преодоление этого явления происходит путем осаждения ионов при помощи физического воздействия или добавления в воду специальных смягчающих веществ. Соли щелочноземельных металлов образуются путем растворения элементов в кислоте либо в результате реакций обмена.
Полученные соединения имеют прочную ковалентную связь, поэтому обладают невысокой электропроводностью.
В природе щелочноземельные металлы не могут находиться в чистом виде, так как быстро вступают во взаимодействие с окружающей средой, образую химические соединения. Они входят в состав минералов и горных пород, содержащихся в толще земной коры.
Наиболее распространен кальций, немного уступает ему магний, довольно часто встречаются барий и стронций. Бериллий относится к редким металлам, а радий — к очень редким. За все время, которое прошло с момента открытия радия, во всем мире было добыто всего полтора килограмма чистого металла.
Как и большинство радиоактивных элементов, радий имеет изотопы, коих у него насчитывается четыре штуки.

Получают щелочноземельные металлы путем разложения сложных веществ и выделения из них чистого вещества. Бериллий добывают путем восстановления его из фторида при воздействии высокой температуры. Барий восстанавливает из его оксида. Кальций, магний и стронций получают путем электролиза их хлоридного расплава.
Сложнее всего синтезировать чистый радий. Его добывают путем воздействия на урановую руду. По подсчетам ученых в среднем на одну тонну руды приходится 3 грамма чистого радия, хотя встречаются и богатые месторождения, в которых содержится целых 25 грамм на тонну.
Для выделения металла используются методы осаждения, дробной кристаллизации и ионного обмена.
Применение щелочноземельных металлов
Спектр применения щелочноземельных металлов очень обширен и охватывает многие отрасли. Бериллий в большинстве случаев используется в качестве легирующей добавки в различные сплавы.
Он повышает твердость и прочность материалов, хорошо защищает поверхность от воздействия коррозии.
Также благодаря слабому поглощению радиоактивного излучения бериллий используется при изготовлении рентгеновских аппаратов и в ядерной энергетике.
Магний используют как один из восстановителей при получении титана. Его сплавы отличаются высокой прочностью и легкостью, поэтому используются при производстве самолетов, автомобилей, ракет.
Оксид магния горит ярким ослепительным пламенем, что нашло отражение в военном деле, где он используется для изготовления зажигательных и трассирующих снарядов, сигнальных ракет и светошумовых гранат.
Является одним из важнейших элементов для регуляции нормального процесса жизнедеятельности организма, поэтому входит в состав некоторых лекарств.

Кальций в чистом виде практически не применяют. Он нужен для восстановления других металлов из их соединений, а также в производстве препаратов для укрепления костной ткани.
Стронций используют для восстановления других металлов и в качестве основного компонента для производства сверхпроводящих материалов. Барий добавляют во многие сплавы, которые предназначены для работы в агрессивной среде, так как он обладает отличными защитными свойствами.
Радий используется в медицине для кратковременного облучения кожи при лечении злокачественных образований.
Щелочные и щелочноземельные металлы


Средняя оценка: 4.6
Всего получено оценок: 1356.
Средняя оценка: 4.6
Всего получено оценок: 1356.
Наиболее активными среди металлической группы являются щелочные и щелочноземельные металлы. Это мягкие лёгкие металлы, вступающие в реакции с простыми и сложными веществами.
Активные металлы занимают первую и вторую группы периодической таблицы Менделеева. Полный список щелочных и щелочноземельных металлов:
- литий (Li);
- натрий (Na);
- калий (K);
- рубидий (Rb);
- цезий (Cs);
- франций (Fr);
- бериллий (Be);
- магний (Mg);
- кальций (Ca);
- стронций (Sr);
- барий (Ba);
- радий (Ra).
Рис. 1. Щелочные и щелочноземельные металлы в таблице Менделеева.
Электронная конфигурация щелочных металлов – ns1, щелочноземельных металлов – ns2. Соответственно, постоянная валентность щелочных металлов – I, щелочноземельных – II.
За счёт небольшого количества валентных электронов на внешнем энергетическом уровне активные металлы проявляют мощные свойства восстановителя, отдавая внешние электроны в реакциях.
Чем больше энергетических уровней, тем меньше связь с внешних электронов с ядром атома. Поэтому металлические свойства возрастают в группах сверху вниз.
Из-за активности металлы I и II групп находятся в природе только в составе горных пород. Чистые металлы выделяют с помощью электролиза, прокаливания, реакции замещения.
Щелочные металлы имеют серебристо-белый цвет с металлическим блеском. Цезий – серебристо-жёлтый металл. Это наиболее активные и мягкие металлы. Натрий, калий, рубидий, цезий режутся ножом. По мягкости напоминают воск.
 Рис. 2. Разрезание натрия ножом.
Рис. 2. Разрезание натрия ножом.
Щелочноземельные металлы имеют серый цвет. По сравнению со щелочными металлами являются более твёрдыми, плотными веществами. Ножом можно разрезать только стронций. Самый плотный металл – радий (5,5 г/см3).
Наиболее лёгкими металлами являются литий, натрий и калий. Они плавают на поверхности воды.
Щелочные и щелочноземельные металлы реагируют с простыми веществами и сложными соединениями, образуя соли, оксиды, щёлочи. Основные свойства активных металлов описаны в таблице.
| Взаимодействие | Щелочные металлы | Щелочноземельные металлы |
| С кислородом |
Самовоспламеняются на воздухе. Образуют надпероксиды (RO2), кроме лития и натрия. Литий образует оксид при нагревании выше 200°C. Натрий образует смесь пероксида и оксида.
|
На воздухе быстро образуются защитные оксидные плёнки. При нагревании до 500°С самовоспламеняются.
|
| С неметаллами |
|
|
| С галогенами |
Бурно реагируют с образованием галогенидов: 2Na + Cl2→ 2NaCl |
|
| С водой |
Образуются щёлочи. Чем ниже металл расположен в группе, тем более активно протекает реакция. Литий взаимодействует спокойно, натрий горит жёлтым пламенем, калий – со вспышкой, цезий и рубидий взрываются.
|
|
| С кислотами |
Со слабыми и разбавленными кислотами реагируют с взрывом. С органическими кислотами образуют соли.
|
|
| Со щелочами | – |
Из всех металлов реагирует только бериллий: Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2 |
| С оксидами | – |
Вступают в реакцию все металлы, кроме бериллия. Замещают менее активные металлы: 2Mg + ZrO2 → Zr + 2MgO |
 Рис. 3. Реакция калия с водой.
Рис. 3. Реакция калия с водой.
Щелочные и щелочноземельные металлы можно обнаружить с помощью качественной реакции. При горении металлы окрашиваются в определённый цвет. Например, натрий горит жёлтым пламенем, калий – фиолетовым, барий – светло-зелёным, кальций – тёмно-оранжевым.
Щелочные и щелочноземельные – наиболее активные металлы. Это мягкие простые вещества серого или серебристого цвета с небольшой плотностью. Литий, натрий, калий плавают на поверхности воды. Щелочноземельные металлы более твёрдые и плотные, чем щелочные. На воздухе быстро окисляются.
Щелочные металлы образуют надпероксиды и пероксиды, оксид образует только литий. Бурно реагируют с водой при комнатной температуре. С неметаллами реагируют при нагревании. Щелочноземельные металлы вступают в реакцию с оксидами, вытесняя менее активные металлы.
Со щелочами реагирует только бериллий .
Чтобы попасть сюда — пройдите тест.
- Светлана-Анатольевна Мамахай
Средняя оценка: 4.6
Всего получено оценок: 1356.
А какая ваша оценка?
Гость завершил
Тест «Судьба человека»с результатом 11/12
Гость завершил
Тест «Хамелеон»с результатом 8/10
Гость завершил
Тест «Железная дорога»с результатом 9/10
Гость завершил
Тест «Алые паруса»с результатом 8/12
Гость завершил
Тест «Судьба человека»с результатом 11/12
Гость завершил
Тест «Матрёнин двор»с результатом 9/11
Гость завершил
Тест «Мцыри»с результатом 14/18
Не подошло? Напиши в х, чего не хватает!
Щелочноземельные металлы
- Щелочноземельные металлы отличаются химической активностью, поэтому в чистом виде не встречаются. Входят в состав минералов. Больше всего на Земле кальция — он содержится в мраморах, гранитах, известняках. Барий и радий встречаются редко. Радий всегда сопутствует урановым рудам.СвойстваВсе элементы — твердые вещества, ножом можно резать только стронций. Все — серебристо-серые, обладают такими классическими металлическими свойствами, как электропроводность и теплопроводность.Химическая активность возрастает по мере увеличения размера атома, от бериллия к радию. Бериллий покрывается на воздухе оксидной пленкой и дальше уже вступает в реакции только со фтором или при очень высоких температурах. Магний тоже окисляется на поверхности и далее ведет себя достаточно пассивно. Кальций постепенно весь окисляется во влажном воздухе, горит, стоит его слегка нагреть, растворяется в воде. Барий, стронций и радий на воздухе взаимодействуют не только с кислородом, но и с азотом, поэтому для хранения их помещают в герметичные емкости и заливают керосином.
Кальций окись Магний металлический (стружка) Магнесальт (бишофит) Щелочноземельные металлы растворяются в кислотах, образуют соли. С водой образуют щелочи, сила которых растет от магния к радию. Все, кроме бериллия и магния, легко реагируют с неметаллами.Cа и Mg являются важными биогенными элементами. Кальций нужен для скелета, зубов животных и людей, работы мышц; регулирует свертываемость крови.Магний содержится в живых клетках, он есть в хлорофилле, способствует функционированию ферментных реакций, нервной системы, синтезу нуклеиновых кислот. В очень небольших количествах в нашем организме есть и стронций. Барий, радий, бериллий и их соединения токсичны для всего живого.Применение
- Бериллий входит в состав большого количества минералов, например, изумруда, аквамарина, гелиодора. Используется при выпуске сплавов, в том числе для атомных станций; топлива для ракет.
- Кальций — составная часть многих стройматериалов. Востребован в производстве огнеупорных материалов, топлива, лекарственных веществ.
- Магний — легкий металл, хорошо поддающийся обработке ковкой, прокатом и т.п. Обладает восстановительными свойствами, востребованными в металлотермии. Входит в состав многих современных магниевых сплавов; из них изготавливают листы, профили, детали, для которых имеет значение вес, например, корпуса ноутбуков, смартфонов. Магниевые сплавы нужны в авиационной, автомобильной, электронной, космической, военной, приборостроительной отраслях. Магний содержится в магнезите, бишофите (магнесальте), карналлите, доломите и др. Соли магния определяют жесткость воды, их много в морской воде.
- Стронций и его соли содержатся как примеси во многих минералах. Промышленное значение имеют целестин и стронцианит. Основные сферы применения — радиоэлектроника; металлургия (легирование сплавов, удаление серы из сталей, чугуна, меди); атомная энергетика; пиротехника (окрашивает пламя в ярко-красный цвет); производство магнитных материалов, чистого урана, сверхпроводящей керамики; изготовление вакуумных приборов, химических источников тока. Изотоп стронция применяется в медицине как средство против злокачественных опухолей.
- Барий добывают из таких минералов, как барит, витерит. Соединения бария применяются в атомной энергетике, вакуумных приборах, для получения оптических линз, стекол для урановых стержней, пьезоэлектрических приборов, сверхпроводящей керамики; источников тока; металлических жидких теплоносителей. Сульфат бария не водорастворим, поэтому не токсичен. Используется в рентгеноскопии как контрастное вещество.
- Радий — самый редкий элемент из группы щелочноземельных металлов. К настоящему времени, ученые всего мира смогли получить лишь 1,5 кг чистого вещества. Радиоактивен. Востребован в ядерных исследованиях, в медицинских целях для облучения опухолей. В 70-х годах на основе радия часто делали светящиеся краски для подсветки элементов приборов, стрелок и т.п. Сейчас от этой практики отказались, так как радий очень опасен для человека, даже в микроскопических дозах.
Применение и биологическая роль щелочноземельных металлов и их соединений
Щелочноземельные металлы: общая характеристика, строение; свойства и получение
Щелочноземельными металлами называют 4 химических элемента IIA группы Периодической системы Д. И. Менделеева, начиная с кальция:
- кальций Ca, стронций Sr, барий Ba, радий Ra.
- Электронное строение атомов
- На внешнем энергетическом уровне атомы металлов IIA группы имеют два электрона.
- Поэтому для всех щелочноземельных металлов характерна степень окисления +2.
- Этим объясняется сходство их свойств.
- Для металлов IIA группы (сверху вниз) характерно:
- увеличение радиуса атомов;
- уменьшение электроотрицательности;
- усиление восстановительных, металлических свойств.
- Нахождение в природе
- Из щелочноземельных металлов кальций наиболее широко распространён в природе, а радиоактивный радий — менее всего.
- Все щелочноземельные металлы обладают высокой химической активностью, поэтому встречаются в природе только в виде соединений.
- Основными источниками кальция являются его карбонаты CaCO3 (мел, мрамор, известняк).
В свободном виде простые вещества представляют собой типичные металлы от серого до серебристого цвета.
Физические свойства простых веществ
В твёрдом агрегатном состоянии атомы связаны металлической связью. Это обусловливает общие физические свойства простых веществ металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
- Тем не менее, металлы IIA группы имеют разные значения температуры плавления, плотности и других физических свойств.
- Химические свойства
- Щелочноземельные металлы обладают высокой химической активностью, реагируют с кислородом, водородом, другими неметаллами, оксидами, кислотами, солями.
- Они являются сильными восстановителями.
- Щелочноземельные металлы активно реагируют с:
- водой, образуя соответствующие гидроксиды и выделяя водород:
- Ba+2H2O=Ba(OH)2+H2↑⏐;
- кислотами, легко растворяясь в их растворах с образованием соответствующих солей:
- Ba+2HCl=BaCl2+H2↑;
- с неметаллами, образуя оксиды или соответствующие соли (гидриды, галогениды, сульфиды и др.):
- 2Ca+O2=2CaO,
- Ca+H2=CaH2,
- Bа+Cl2=BаCl2,
- Bа+S=BаS.
- Получение
Щелочноземельные металлы получают в основном электролизом расплавов галогенидов. Чаще используются хлориды металлов.
- При этом на катоде восстанавливаются катионы, а на аноде окисляются анионы.
- Суммарное уравнение реакции электролиза расплава хлорида кальция:
- CaCl2=Ca+Cl2↑.
- Оксиды и гидроксиды щелочноземельных металлов
- Оксиды
- Щелочноземельные металлы образуют оксиды общей формулы ЭО:
- CaO, SrO, BaO, RaO.
- Все оксиды обладают выраженными основными свойствами.
- В ряду от оксида кальция к оксиду бария основные свойства усиливаются.
- Оксиды щелочно-земельных металлов реагируют с:
- водой:
- CaO+H2O=Ca(OH)2.
- Обрати внимание!
Реакция взаимодействия оксида кальция с водой протекает с выделением большого количества теплоты. Её называют реакцией гашения извести, так как оксид кальция входит в состав негашёной извести, а гидроксид кальция — гашёной извести.
- кислотными оксидами:
- CaO+CO2=CaCO3.
- кислотами:
- BaO+2HCl=BaCl2+H2O.
- Гидроксиды
- Щелочноземельные металлы при их взаимодействии (или их оксидов) с водой образуют основные гидроксиды (основания).
- Сила оснований увеличивается в группе сверху вниз.
- Гидроксиды щелочноземельных металлов являются сильными основаниями, растворимыми в воде— щелочами.
- Гидроксиды щелочноземельных металлов проявляют все характерные свойства оснований, взаимодействуя с кислотными (и амфотерными) оксидами, кислотами (и амфотерными гидроксидами), солями.
- При нагревании гидроксиды разлагаются на соответствующий оксид и воду:
- Ca(OH)2−→−tCaO+H2O.
Гидроксид кальция является сильным основанием, но малорастворим в воде. Его насыщенный раствор называется известковой водой.
- На воздухе раствор постепенно мутнеет, так как поглощает углекислый газ, из которого образуется карбонат кальция:
- Ca(OH)2+CO2=CaCO3⏐↓+H2O.
- Эта реакция используется как качественная реакция для обнаружения углекислого газа.
- Соли щелочноземельных металлов
- Получение солей
- Соли щелочноземельных металлов можно получить при взаимодействии оксидов или гидроксидов металлов с соответствующими кислотами:
- CaO+2HCl=CaCl2+H2O,
- Ba(OH)2+2HCl=BaCl2+H2O.
- Соли бескислородных кислот образуются при непосредственном взаимодействии простых веществ:
- Ca+S=CaS,
- 2Ba+I2=2BaI2.
- Важнейшие соли кальция: его карбонаты и сульфаты.
- Карбонат кальция CaCO3 (мел, мрамор, известняк),
- гидрокарбонат кальция Ca(HCO3)2,
- сульфат кальция CaSO4 и его кристаллогидраты:
- CaSO4⋅2H2O (гипс), CaSO4⋅,5H2O (алебастр).
- Химические свойства
- Соли щелочноземельных металлов реагируют с кислотами, солями.
- При нагревании разлагаются:
- CaCO3−→−tCaO+CO2.
- Качественный анализ
- Обрати внимание!
- Соединения кальция окрашивают пламя в кирпично-красный цвет.
- Ионы бария можно обнаружить в растворе с помощью раствора серной кислоты или её солей. При этом образуется нерастворимый сульфата бария, который выпадает в осадок:
Качественная реакция на ионы бария:
- Применение и биологическая роль щелочноземельных металлов и их соединений
- Кальций
- Металлический кальций используется в производстве стали, чугуна, для их очистки от кислорода, серы и фосфора, для получения сплавов.
Благодаря химической активности металлический кальций также находит применение в восстановлении некоторых тугоплавких металлов (титан, цирконий и др.) из их оксидов.
Распространение и использование щёлочноземельных металлов

Распространение и использование щёлочноземельных металлов. Доклад по химии. 9 класс.
Щёлочноземельные металлы – металлы 2А подгруппы или же по старой системе
классификации — элементы главной подгруппы II, таблицы Менделеева.
Название их происходит от двух слов. Щелочь — едкое химическое соединение, гидроксид щелочных металлов. И земля, как раньше назывались нерастворимые сыпучие породы.
Распространённость металлов этой подгруппы сильно различается. Наиболее распространённый щелочноземельный металл — это кальций. Его содержание в земной коре, по разным оценкам, от 2% до 13%. Второе место занимает магний с содержанием примерно 2.3% от массы земной коры.
А также, в земной коре в больших количествах присутствуют барий (0.04%) и стронций (0,038%). Но, самым редким из всех металлов данной подгруппы является Радий (2*10^-10). Он настолько редок, что существует лишь в качестве небольшого скопления в урановой руде.
Бериллий же содержится в земной коре в количестве, немно большем чем, радий – 2*10^-4.
Стоит отметить, что ни один из щелочных металлов не присутствует в природе чистом виде, ведь все они имеют высокую химическую активность.
Применение данных металлов широкое.
Магний часто используют для восстановления титана, в медицинской отрасли. А также магний используется в военной отрасли, для изготовления сигнальных ракет, трассирующих снарядов и светошумовых гранат. Ведь магний горит очень ярким пламенем.
Бериллий часто используют для улучшения твердости сплавов. Ввиду его способности поглощать слабое радиоактивное излучение бериллий применяют также в рентгеновских аппаратах и ядерной физике.
Кальций и магний используются в медицине в составе лекарственных препаратов.
Радий используется в медицине для радоновых ванн, а также для облучения злокачественных опухолей. А также он раньше добавлялся в краски, для получения эффекта свечения, например на ёлочных игрушках, самолётах и др. Сейчас с этой целью его не применяют, так как это вредно для огранизма человека.
Стронций добавляется в сплавы и спользуется в магнитах. А также используется в пиротехнике, в зажигательных составах для окрашивания пламени в красный цвет.
Барий используется в вакуумных приборах, в оптике для изготовления линз. А также в пиротехнике, для окрашивания пламени в зелёный цвет.
Щелочные и щелочноземельные металлы
Щелочными металлами называют химические элементы I группы главной подгруппы Периодической системы элементов Менделеева. Это литий Li, натрий Na. Названы они так потому, что их гидроокиси — наиболее сильные щелочи. Химически очень активны, причем их активность возрастает от Li к Fr.
Примером наиболее распространенного соединения одного из щелочных металлов является поваренная соль (хлорид натрия) NaCl. Широко известна сода (карбонат натрия) Na2CO3. Широко известен щелочной элемент К. Он входит в состав калийных удобрений. Вместе с азотными и фосфорными удобрениями это основные удобрения, применяемые в сельском хозяйстве.
Реже встречаются упоминания о литиевых электрических батарейках, цезиевых фотоэлементах, рубидиевых часах. Элементы IA группы являются типичными металлами.
С элемента IA группы начинается каждый период в таблице Менделеева. Это означает, что именно у атомов этих элементов начинается заполнение следующего энергетического уровня. Поэтому на внешнем уровне у атомов всех щелочных металлов находится по одному электрону (2s1).
Они обладают электронной проводимостью. При переходе от Li к Fr , т.е. при движении сверху вниз по группе, у атомов возрастает число энергетических уровней, следовательно, увеличивается размер атомов, ослабевает связь внешнего электрона с ядром.
Это значит, что валентный электрон атома щелочного металла все легче может перейти на орбитали атома другого элемента, а эта способность «отдавать» электроны есть свойство восстановителя.
Восстановительная способность щелочных металлов и их химическая активность возрастают с увеличением их порядкового номера.
Заметим, что при переходе от элемента к элементу слева направо по периоду уменьшаются размеры атомов и усиливается прочность связи внешних электронов с ядрами. Следовательно, щелочные металлы являются самыми сильными восстановителями каждый в своем периоде.
Элементы группы IA являются типичными металлами, у которых металлические (с химической точки зрения — восстановительные свойства) свойства выражены наиболее ярко.
Щелочные металлы как простые вещества. Атомы щелочных металлов имеют по одной валентной орбитали, содержащей один электрон.
Поэтому эти атомы могут соединяться между собой с образованием двухатомных молекул, которые и обнаружены в газообразном состоянии металлов — элементов IA группы.
Однако в твердом состоянии простые вещества, образованные этими элементами, тем не менее построены не из двухатомных молекул, а из атомов.
ЭТО ТОЛЬКО ПЕРВАЯ СТРАНИЦА скачать всё
скачать4 страницы
10kb
Щелочноземельные металлы: общая характеристика, строение; свойства и получение — урок. Химия, 9 класс
Щелочноземельными металлами называют (4) химических элемента (I)(I)(A) группы Периодической системы Д. И. Менделеева, начиная с кальция:
кальций (Ca), стронций (Sr), барий (Ba), радий (Ra).
Электронное строение атомовНа внешнем энергетическом уровне атомы металлов (IIA) группы имеют два электрона.
Поэтому для всех щелочноземельных металлов характерна степень окисления (+2).
Этим объясняется сходство их свойств.
Для металлов (I)(I)(A) группы (сверху вниз) характерно:
- увеличение радиуса атомов;
- усиление восстановительных, металлических свойств.
Из щелочноземельных металлов кальций наиболее широко распространён в природе, а радиоактивный радий — менее всего.
- Все щелочноземельные металлы обладают высокой химической активностью, поэтому встречаются в природе только в виде соединений.
- Основными источниками кальция являются его карбонаты CaCO3 (мел, мрамор, известняк).
- В свободном виде простые вещества представляют собой типичные металлы от серого до серебристого цвета.
Физические свойства простых веществВ твёрдом агрегатном состоянии атомы связаны металлической связью. Это обусловливает общие физические свойства простых веществ металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
- Тем не менее, металлы (I)(I)(A) группы имеют разные значения температуры плавления, плотности и других физических свойств.
- Щелочноземельные металлы обладают высокой химической активностью, реагируют с кислородом, водородом, другими неметаллами, оксидами, кислотами, солями.
- Они являются сильными восстановителями.
- Щелочноземельные металлы активно реагируют с:
- водой, образуя соответствующие гидроксиды и выделяя водород:
- кислотами, легко растворяясь в их растворах с образованием соответствующих солей:
- Ba+2HCl=BaCl2+H2↑;
- с неметаллами, образуя оксиды или соответствующие соли (гидриды, галогениды, сульфиды и др.):
- Bа+Cl2=BаCl2,
- Bа+S=BаS.
Щелочноземельные металлы получают в основном электролизом расплавов галогенидов. Чаще используются хлориды металлов.
При этом на катоде восстанавливаются катионы, а на аноде окисляются анионы.
Суммарное уравнение реакции электролиза расплава хлорида кальция:
CaCl2=эл. токCa+Cl2↑.