- Виды оксидов
- Номенклатура оксидов
- Названия некоторых оксидов: таблица
- 2. Взаимодействие с кислотными оксидами и кислотами
- Химические свойства кислотных оксидов
- 1. Взаимодействие с водой
- 3. Взаимодействие с амфотерными оксидами и гидроксидами
- 2. Окисление простых веществ — неметаллов
- 3. Разложение гидроксидов
- 4. Окисление сложных веществ
- Оксиды щелочных металлов
- Гидроксиды щелочных металлов (щелочи)
- Получение и применение щелочей
- Соли щелочных металлов
- ПОИСК
- Оксиды и пероксиды щелочных металлов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
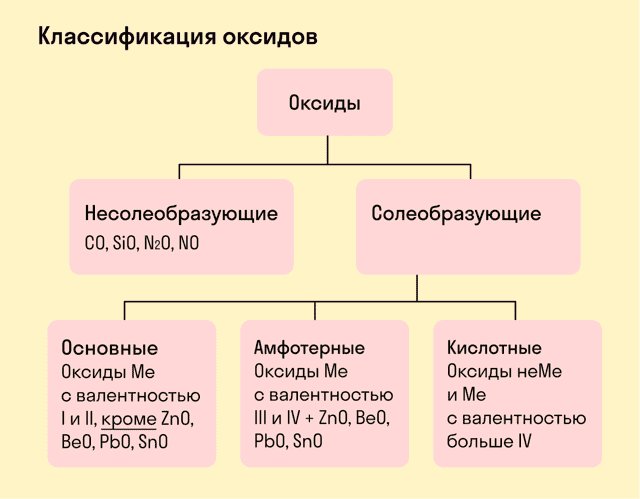
Виды оксидов
- Все оксиды делятся на солеобразующие и несолеобразующие.
- Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
- К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
- Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
- Солеобразующие оксиды делятся на три группы:
-
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na+12O, Ca+2O, Ba+2O.
-
- Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
- К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
- Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
- Примеры амфотерных оксидов: Al+32O3, Fe2+3O3.
-
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S+6O3, N2+5O5, Mn2+7O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
Например:
- CrO (оксид хрома (II)) — проявляет основные свойства;
- Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
- CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
Номенклатура оксидов
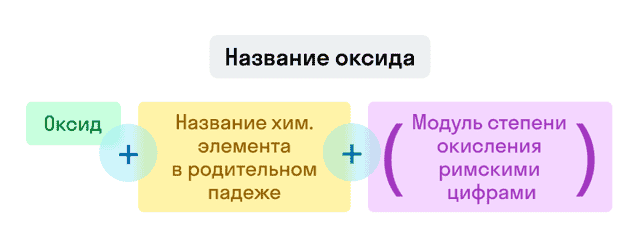
Названия оксидов строятся по систематической номенклатуре следующим образом:
-
Пишем слово «оксид».
-
Указываем название второго химического элемента в родительном падеже.
-
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
- Fe2O3 — оксид железа (III). Читается: феррум два о три.
- Na2O — оксид натрия. Читается: натрия два о.
- SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
| H2O | Вода | Оксид водорода |
| CO2 | Углекислый газ | Оксид углерода (IV), диоксид углерода |
| CO | Угарный газ | Оксид углерода (II), монооксид углерода |
| SO3 | Серный газ | Оксид серы (VI), триоксид серы |
| SO2 | Сернистый газ | Оксиды серы (IV), диоксид серы |
| SiO2 | Кварц, горный хрусталь, песок кварцевый, речной и морской | Оксид кремния |
| Al2O3 | Глинозем | Оксид алюминия |
| Fe2O3 | Гематит (крокус) | Оксид железа (III) |
| CaO | Негашеная известь | Оксид кальция |
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Например: 4Al + 3O2 = 2Al2O3
Не взаимодействуют с кислородом: платина, золото и палладий.
- Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
- 4Cr + 3O2 = 2Cr2O3
- При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
- При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
- 4P + 5O2 (избыток) = 2P2O5
- При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
- 4P + 3O2 (недостаток) = 2P2O3
- Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
- S + O2 = SO2
- Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
- N2 + O2 = 2NO
Галогены (элементы VIIA группы) вовсе не взаимодействуют с кислородом, так же как и инертные газы (элементы VIIIA группы).
3. Разложение гидроксидов
- Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
- Гидроксид (кислота) = оксид + вода
- Например:
- H2SO3 = SO2↑ + H2O
- H2CO3 = CO2↑ + H2O
- Ag(OH) = Ag2O + H2O
- NH4OH = NH3↑ + H2O
- Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
- Например:
4. Окисление сложных веществ
- Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
- Например:
- 2H2S + 3O2 = 2SO2 + 2H2O
- 4NH3 + 5O2 = 4NO + 6H2O
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Например, Li2CO3 = Li2O + CO2↑
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Летняя перезагрузка
Бесплатный телеграм-марафон для мам и пап. Узнайте, как провести семейное лето с пользой, и подготовьтесь к нему уже сейчас!

Оксиды щелочных металлов
Оксиды щелочных металлов являются типичными основными оксидами, обладая всеми их свойствами. Им соответствуют сильные основания (щелочи).
Оксиды щелочных металлов высокореакционны, их основные свойства усиливаются от лития к цезию.
- реагируют с водой с образованием хорошо растворимых гидроксидов: Na2O+H2O = 2NaOH
- реагируют с кислотными оксидами с образованием солей: K2O+CO2 = K2CO3
- реагируют с кислотами с образованием соли и воды: K2O+H2SO4 = K2SO4+H2O
Получение оксидов щелочных металлов:
- оксид лития получают прямой реакцией с кислородом:4Li+O2 = 2Li2O
- оксиды остальных щелочных металлов, кроме лития, получают косвенными реакциями:Na2O2+2Na = 2Na2O
Гидроксиды щелочных металлов (щелочи)
- LiOH — гидроксид лития
- NaOH — г-д натрия (едкий натр или каустическая сода)
- KOH — г-д калия (едкое кали)
- RbOH — г-д рубидия
- CaOH — г-д кальция
Растворимость в воде и сила оснований возрастает в ряду от LiOH к CaOH, что обусловлено увеличением размера атома металла, а, значит, и поляризуемости связи Me-OH.
Физические свойства щелочей:
- не имеют цвета;
- гигроскопичны;
- хорошо растворимы в воде;
- проявляются сильные оснОвные свойства.
Химические свойства щелочей:
- В водных растворах щелочи практически полностью диссоциируют: CaOH ↔ Ca++OH-
- Легко взаимодействуют с минеральными кислотами (реакция нейтрализации), образуя соль и воду: NaOH+HCl = NaCl+H2O
- Хорошо поглощают влагу и углекислый газ из воздуха, что нашло применение в осушении газов: 2NaOH+CO2 = Na2CO3+H2O
- Реагируют с солями (если один из продуктов реакции выпадает в осадок, то реакция идет не до конца): 2NaOH+CaCl2 = 2NaCl+Ca(OH)2↓
- Взаимодействуют с амфотерными гидроксидами: NaOH+Al(OH)3 = Na[Al(OH)4]
- Водные растворы щелочей взаимодействуют с хлором и бромом: 2NaOH+Cl2 = NaCl+NaClO+H2O
Получение и применение щелочей
- В промышленности гидроксид лития, натрия, калия получают из водных растворов хлоридов методом электролиза: 2NaCl → 2NaOH+Cl2↑+H2↑
- Карбонатный метод получения щелочей: Na2CO3+Ca(OH)2 = 2NaOH+CaCO3↓
- Взаимодействием металлов или их оксидов с водой: K+H2O = 2KOH+H2↑ Li2O+H2O = 2LiOH
Применение щелочей:
- производство красок, мыла, искусственных волокон, бумаги;
- очистка нефтепродуктов;
- в реакциях химического синтеза;
- для осушки газов и органических жидкостей;
- в текстильной и кожевенной промышленности;
- в качестве электролитов в аккумуляторах.
Соли щелочных металлов
Реагируя с кислотами, щелочные металлы образуют хорошо растворимые в воде соли (за исключением солей лития). Наибольшее практическое применение нашли соли калия и натрия.
Применение солей щелочных металлов:
- NaCl (хлорид натрия, поваренная или каменная соль) есть в каждом доме на столе, о важности этой пищевой приправы говорит хотя бы тот факт, что в войну в первую очередь запасались спичками и солью; применяется в производстве хлора, соляной кислоты, соды, хлорной извести, едкого натра и проч.;
- Na2CO3 (сода, углекислая сода) — карбонат натрия применяется в производстве алюминия, стекла, моющих средств, искусственных волокон, для очистки нефтепродуктов;
- NaHCO3 (питьевая или пищевая сода) гидрокарбонат натрия является настоящим спасением для людей, страдающих изжогой, незаменимый компонент при выпечке хлеба и производстве кондитерских изделий, компонент огнетушителей, широко применяется в производстве безалкогольных напитков и минеральных вод;
- NaSO4 сульфат натрия применяют в производстве стекла, при окраске х/б тканей, для получения серной кислоты, соды, в медицине глауберова соль применяется, как слабительное средство.
- KCl хлорид калия широко применяется в качестве минерального удобрения в сельском хозяйстве.
ПОИСК
Главную подгруппу второй группы составляют бериллий, магний, кальций, стронций, барий и радий, названные щелочноземельными металлами. Это название возникло из-за аналогии окислов типичных элементов этой группы (СаО, SrO, баО), во-первых, окислам щелочных элементов, во-вторых, окиси алюминия— типичному, представителю окислов, издавна называемых землями .
Электронные конфигурации щелочноземельных элементов приведены в табл. 1. [c.326] Среди металлов лишь золото, платина и рутений при любых условиях устойчивы по отношению к сере. При комнатной температуре сера окисляет щелочные и щелочноземельные металлы, медь, серебро и ртуть с образованием сульфидов.
При поджигании магниевой стружкой смесь порошков алюминия и серы бурно реагирует [c.114]
В двухступенчатом процессе получения водорода паровой конверсией бензина применяют два разных последовательно расположенных катализатора (по одному на каждой ступени).
Первый (по ходу реагентов) катализатор содержит небольшое количество никеля (менее 5%), нанесенного на прокаленную при высокой температуре окись алюминия. Второй катализатор, объем которого составляет 80% от общей загрузки, содержит в пять раз больше никеля, чем первый. В этот катализатор введено также до 0,5% окислов щелочных металлов.
В качестве носителя этого катализатора используют материал, не обладающий кислотными свойствами (спеченный корунд, окись алюминия). [c.45]
Считается общепризнанным, что окислы щелочных и щелочноземельных металлов, введенные в состав катализаторов конверсии углеводородов, способны понижать склонность этих контактов к науглероживанию в условиях иХ эксплуатации. [c.48]
Известно, что окислы щелочных металлов летучи в условиях этого процесса.
Содержание окиси калия в продуктах конверсии бензина составляет пять частей на миллион частей бензина при наличии 6,5% этого окисла в составе катализатора, помещенного в верхней части реактора, составляющей 3/4 общего его объема.
Нижнюю часть реактора предлагается заполнить катализатором, содержащим менее 1% окиси натрия. Применение такой комбинации катализаторов позволило исключить отложение углерода в реакционной зоне. [c.48]
Среди этих катализаторов преобладают смешанные, но довольно часто встречаются и нанесенные контакты. В качестве носителя чаще всего используют окись алюминия с различными добавками, значительно реже — окись магния. Окись алюминия в количественном отношении является основным компонентом таких катализаторов.
Окислы щелочноземельных металлов (кальция и магния) входят в количестве более 5% в состав почти всех катализаторов рассматриваемого типа. Окислы щелочных металлов (калия, натрия) вводятся в катализатор в количестве до 5% (предпочтительно— менее 0,5%).
Входящие в состав некоторых катализаторов окислы железа кремния следует рассматривать как загрязнения, сопутствующие вводимым компонентам. [c.49]
Электропроводность стекол, содержащих окислы щелочных металлов, можно рассчитать из коэффициентов диффузии ионов этих металлов, так как последние связаны с электропроводностью уравнением Эйнштейна [c.326]
Наиболее активно окисляются щелочные и щелочноземельные металлы, причем в зависимости от условий образуются оксиды и пероксиды [c.112]
При сокращенном анализе силиката обычно определяют потерю при прокаливании, SiO , Fe O., Al O,, TiO , aO, MgO, SO и сумму окислов щелочных металлов (KaO+Na O). Иногда щелочные металлы не определяют в этом случае находят их приблизительное содержание, вычитая из 100% сумму процентного содержания всех остальных окислов. [c.460]
Сухой остаток, представляющий собой хлористые соли калия и натрия, взвешивают по весу остатка вычисляют содержание окислов щелочных металлов. [c.473]
Определение калня кобальтинитритом. В том случае, если необходимо определить не только сумму окислов щелочных металлов, но каждый металл в отдельности, остаток хлоридов растворяют в воде и осаждают калий или натрий соответствующим реактивом. Второй щелочной металл определяют по разности. [c.475]
Окислы щелочных и щелочноземельных элементов обладают ярко выраженной основной природой — они [c.113]
Отношение к другим элементарным окислителям. Галогены, сера, азот, фосфор, водород и др. при определенных условиях относительно легко окисляют щелочные металлы с образованием галидов, сульфидов, нитридов, фосфидов, гидридов и др. (см. гл. I).
Эти реакции протекают с выделением большого количества тепла, часто в форме горения, а иногда со взрывом (например, калий при взаимодействии с бромом).
Менее активно взаимодействуют щелочные металлы с азотом и лишь литий соединяется с ним при обыкновенной температуре, но лучше при слабом нагревании [c.36]
Учитывая, что поляризующее действие увеличивается с ростом заряда и уменьшением размера иона, можно объяснить, почему, например, окислы щелочных и щелочноземельных металлов образуют при действии воды основания, а окислы элементов концов периодов с небольшим радиусом иона и большим зарядом в растворе дают кислую реакцию. К сожалению, приходится констатировать, что к расчетам кислотно-основных свойств на основе электростатической модели следует относиться с большой осторожностью, так как часто они не учитывают всего многообразия действующих факторов, и поэтому не оправдываются. Например, аналогичные расчеты, проведенные для i[Mg(H20)6 +, [Т1(Н20)б +, [Л1(Н20)бР+, показывают, что в ряду аквакомплексов кислотность должна возрастать. Однако, как видно из табл. 81, [Т1(Н20)бР+ является более сильной кислотой, чем [Л1(Н20)в +. [c.284]
Хотя в настоящее время разработаны различные пути снижения скорости коксообразования (гидрирование молекулярным водородом ненасыщенных углеводородов — предшественников кокса, модификация катализаторов окислами щелочных металлов Се, К, использование цепных ингибиторов коксообразования, например меркаптанов, и т. п.), все еще остается необходимой окислительная регенерация катализатора. Она осуществляется путем выжигания кокса воздухом, смесью воздуха с азотом или паровоздушной смесью основными продуктами такой газификации углеродистых отложений являются СО, СО2, Н2О. [c.95]
При комнатной температуре вода окисляет щелочные и щелочноземельные металлы (кроме магния) [c.141]
Этим методом нельзя получить окислы щелочных металлов н только с очень большим трудом можно получить окислы щелочноземельных металлов, гак как их разложение происходит при слишком высоких температу-рах..В то же время окислы ртути и серебра получаются сразу вместо оснований при попытке получения соответствующих гидроксидов [c.221]
Нельзя пользоваться этим методом для получения окислов щелочных и благородных металлов, так как соли щелочных металлов не разлагаются при нагревании с образованием окислов, а окислы благородных или малоактивных (ртуть) металлов сами разлагаются при нагревании. [c.221]
Большинство основных окислов не распадается при нагревании, исключение составляют окислы ртути, серебра и благородных металлов. Основные окислы могут вступать в реакции с кислотными и амфотерными окислами, с кислотами. Окислы щелочных и щелочноземельных металлов реагируют с водой [c.222]
С помощью этой реакции в большинстве случаев можно отличить основные окислы от других типов окислов. Основные окислы (за исключением окислов щелочных и [c.222]
Водород окисляет щелочные металлы и образует гидриды—соединения с ионной связью, представляющие собой соли [c.190]
Соотношение между коэффициентами т, п и р зависит главным образом от температуры. В твердых растворах атомы Ti могут замещаться атомами Мп, Mg, А1 и других металлов, входящих в состав концентратов.
Вследствие этого температура плавления шлаков колеблется в широких пределах — от 1400 до 1700°. Увеличение содержания в них низших окислов титана повышает температуру плавления.
Наиболее низкоплавки шлаки, содержащие окислы щелочных и щелочноземельных металлов. [c.249]
В качестве промоторов в смешанные катализаторы ввгдчт окислы щелочных металлов (калия и натрия). Для повышения стабильности катализатора в глиноземный носитель вводят 0,5—10 мас.%. окиси титана, что позволяет снизить содержание сажи в газе при конверсии высших углеводородов в 1,5—2 раза, увеличить степень конверсии бензина. Повышению активности катализатора способствует введение в него небольшого количества (1,3%) окиси марганца. На основе имеющихся данных нельзя сделать определенные выводы о сущности положительного влияния промоторов катализаторов. Невозможно с полной определенностью ответить на вопрос, являются ли применяемые промоторы модификаторами или промоторами. Нет пока возможности установить, ускоряют они собственно реакцию конверсии углеводородов или только газификацию образовавшегося в процессе углерода или лишь предотвращают образование последнего. [c.19]
В составе многих применяемых в этом процессе никель-алюми-ниевых катализаторов содержатся добавки окислов щелочных металлов, окись хрома и многие другие трудновосстанавливаемые и тугоплавкие окислы металлов.
Роль этих добавок заключается в предотвращении или замедлении отложения углерода на катализаторе в процессе конверсии бензина.
С целью предотвращения зауг-лероживания катализатора предлагается также подавать смесь углеводородного сырья с водяным паром на катализатор при температуре равной или более 350° С. Для этого же реко.
мендуется рециркулировать часть образующего газа с таким расчетом, чтобы объемное соотношение возвращаемого газа и исходных реагентов было равно 2—10. Использование последнего приема позволило увеличить пробег катализатора без понижения активности почти в три раза (с 200 до 550 ч). [c.44]
С то же целью производят осернение катализатора. Не исключено, по нашему мнению, что одна из функций вводимых в катализатор добавок (окислов щелочных, щелочноземельных металлов и др ) состоит в ограничении активности катализатора.
Смысл такого ограничения становится понятным, если принять во внимание, что на чрезмерно активном катализаторе должны интенсивно протекать побочные реакции углеобразования.
В пользу высказанного предположения о роли добавок указывает возможность создания незауглероживающегося (в условиях процесса конверсии бензина) никель-алюминиевого катализатора, в составе которого полностью отсутствуют те добавки, которые обычно используются для подавления углеобразования (см. табл. 30, № 21).
Подавление избыточной активности в данном случае, возможно, достигается за сче серы, которую вводят в катализатор с применяемым в качестве сырья сульфатом никеля и полностью не удаляют в процессе изготовления катализатора. [c.49]
М 0, 4,5 КаО, 43,2 А12О3. Количество окислов щелочных и щелочноземельных металлов составляет 50—250% (по отношению кЗтОа в катализаторе). Катализатор применяют при паровой конверсии углеводородов [c.61]
Никелевый катализатор, промотированпый окислами щелочных и щелочноземельных металлов, содержит 10%NiO, 1% СаО и прокаленную окись алюминия. Применяют в виде колец [c.102]
Катализатор, для которого не характерно коксообразо-вание, состоит из 35—40% окислов никеля или кобальта, металлов группы платины (0,01—0,1%) и тугоплавкого носителя.
В состав носителя входят тугоплавкие окислы щелочноземельного металла, силикаты или алюмикаты (А1, 51, Т1, 2г, Сг, Мо и др.) и гидравлическое связующее. В носитель введены не связанные с ним окислы щелочного металла и меди (0,1— 10 мас.% в расчете на СиО).
Медь вводят в катализатор в качестве промотора. Катализатор получает смешением указанных компонентов в водной среде для образования вязкой пасты с последующим добавлением связующего, формовкой, сушкой и прокаливанием.
Щелочные металлы вводят в готовый катализатор погружением его в водный раствор соединений щелочного металла. Таким же образом в катализатор [c.166]
Внутренняя, или растительная, зола образуется из минеральных веществ растений, которые послужили материалом для формирования данного топлива. Она состоит преимущественно из окислов щелочных и щелочноземельных металлов. Растительная зола растворяется в 107о-ной НС1 и частично в воде.
Зольность различных древесных видов составляет около 1 % и редко превышает 3%. Болотные растения имеют самое высокое содержание минеральных веществ. Зольность мхов колеблется от 3,18 до 19,92%, а пресноводных и морских водорослей — от 10 до 30%), причем в некоторых случаях достигает 60%. [c.
98]
Существенное значение имеют промотирующие добавки. Окислы щелочных металлов повышают стойкость катализатора к закоксовыванию окислы титана, циркония и кремния повышают его термостойкость. Незначительная добавка (0,01-0,1%) металлов платиновой грушш заметно повып1ает активность и стабильность катализатора. [c.40]
Полярная двойная связь, сопряженная с карбонильной группой, может окисляться щелочным пероксидом водорода. При этом первоначальный акт взаимодействия рассматривается как нуклеофильная атака гидронероксианиона (ООН) на разрыхляющую орбиталь (я= ) [c.119]
Подавляющее большинство основных окислов непосредственно с водой не взаимодействует. Только окислы щелочных и щелочноземельных металлов, присоединяя воду, образуют основания. Из приведенных выше окислов СаО, СиО, FejOa, ВаО являются основными окислами, из них только СаО и ВаО непосредственно взаимодействуют с водой [c.429]
Окислы щелочной группы понижают вязкость и температуру плавления стекла, а также его твердость. Окислы щелочноземельной группы повышают химическую стойкость стекла, а окислы кислотной группы (SiOa, а иногда AI2O3, В2О3, Р Ог, и др.) сообщают стеклу высокую термическую, химическую и механическую стойкость. [c.446]
В реакциях окисления — восстановления вода обычно играет роль среды.
Под действием сильных восстановителей при обыкновенной температуре и в особенности при повышенной температуре вода проявляет окислительнь е свойства, например, окисляет щелочные и щелочноземельные металлы (на холоду), железо, углерод н др. (при температуре накалнвання). Уравнения реакций были рассмотрены выше. [c.627]
Из стекол общего типа дгМагО 1/В2О3 гЗЮг кислотной обработкой могут быть вымыты окислы щелочного металла и бора, причем образуется пористое стекло, сохраняющее форму исходного. Диаметр пор в таком стекле (состоящем после обработки примерно на 96% из ЗЮг) может равняться 15—20 А. Подобно цеолитам, оно обладает большой сорбционной активностью. [c.599]
Окисление аминов в зависимости от условий реакции приводит к широкому спектру продуктов. Первичные амины окисляются щелочным раствором перманганата калия с образованием продуктов окисления соответствующего спирта. [Ы. В. Спирт, соответствующий первичному амину, не обязательно должен быть первичным, например (СНз)2СНМН2 и (СНз)2СНОН.] [c.104]
Другие элементарные окислители (галогены, сера, фосфор) также довольно легко окисляют щелочные металлы до галогенидов, сульфидов, фосфидов все реакции протекают с выделением теплоты. С азотом при обычной температуре взаимодействует только литий и получается 1штрид Ь1зМ. Нагревая щелочные металлы в струе газообразного водорода, получают гидриды [c.287]
Таллаты. Амфотерные свойства гидроокиси таллия (III) выражены слабее, чем 1п(0Н)з. На рис. 77 приведена диаграмма растворимости системы гидрат окиси таллия — едкий натр — вода при 25°С [1601.
За эв-тонической точкой раствор, очевидно, находится в равновесии с таллатом натрия. Сухим путем (нагревая смесь TI2O3 с окислами щелочных металлов в токе кислорода) получают таллаты МеТЮг, МезТЮз и некоторые другие.
Водой, а также влагой воздуха они разлагаются. [c.328]
Оксиды и пероксиды щелочных металлов
Общая характеристика металлов.
Металлы – это элементы, проявляющие в своих соединениях только положительные степени окисления, и в простых веществах которые имеют металлические связи. Металлическая кристаллическая решетка — решетка, образованная нейтральными атомами и ионами металлов, связанными между собой свободными электронами.
У металлов в узлах кристаллической решетки находятся атомы и положительные ионы. Электроны, отданные атомами, находятся в общем владении атомов и положительных ионов. Такая связь называется металлической.
Для металлов наиболее характерны следующие физические свойства: металлический блеск, твердость, пластичность, ковкость и хорошая проводимость тепла и электричества. Теплопроводность и электропроводность уменьшается в ряду металлов:
Аg Сu Аu Аl Мg Zn Fе РЬ Hg
Многие металлы широко распространены в природе. Так, содержание некоторых металлов в земной коре следующее: алюминия — 8,2%; железа — 4,1%; кальция — 4,1%; натрия — 2,3%; магния — 2,3%; калия — 2,1%; титана — 0,56%.
Большое количество натрия и магния содержится в морской воде: — 1,05%, — 0,12%. В природе металлы встречаются в различном виде: — в самородном состоянии: серебро , золото , платина , медь , иногда ртуть
— в виде оксидов: магнетит Fe3O4, гематит Fe2О3 и др.
— в виде смешанных оксидов: каолин Аl2O3 • 2SiO2 • 2Н2О, алунит (Na,K)2O • АlО3 • 2SiO2 и др. — различных солей: сульфидов: галенит PbS, киноварь НgS,
- хлоридов: сильвин КС1, галит NaCl, сильвинит КСl• NаСl, карналлит КСl • МgСl2 • 6Н2О, сульфатов: барит ВаSO4, ангидрид Са8О4 фосфатов: апатит Са3(РО4)2, карбонатов: мел, мрамор СаСО3, магнезит МgСО3.
- Железным рудам всегда сопутствуют марганец, никель, кобальт, молибден, титан, германий, ванадий.
Многие металлы часто сопутствуют основным природным минералам: скандий входит в состав оловянных, вольфрамовых руд, кадмий — в качестве примеси в цинковые руды, ниобий и тантал — в оловянные.
Элементы I группы Li, Na, K, Rb, Cs, Fr
Общая характеристика: К элементам главной подгруппы I-ой группы Периодической системы относятся Li, Na, K, Rb, Cs, Fr. Их принято называть щелочными металлами. История открытия химических элементов IA группы.
Эти металлы в своих рядах являются первыми, т.е. именно у них начинается заполнение электронами нового электронного слоя. Их валентную электронную конфигурацию можно в общем виде обозначить так: ns1, где n — номер периода, в котором находится металл. Плотность, температура плавления, температура кипения простых веществ элементов IA группы.
Щелочные металлы имеют серебристо-белый цвет, а цезий — золотисто-желтый. Хранят щелочные металлы под слоем керосина или бензола. Металлические К, Rb, Cs самопроизвольно загораются на воздухе.
- Первый потенциал ионизации, сродство к электрону и электроотрицательность по Полингу атомов элементов IA группы.
- При комнатной температуре щелочные металлы находиться в твердом (кристаллическом) состоянии, хотя все они имеют очень невысокую температуру плавления. Первые три металла легче воды и плавают на ее поверхности, вступая в бурную реакцию:
- 2 Me + 2 H2O = 2 MeOH + H2.
Щелочные металлы самые активные из всех металлов. Поэтому иногда говорят, что атомы щелочных металлов «стремятся отдавать свой валентный электрон, чтобы приобрести устойчивую электронную оболочку инертного газа». Это не совсем так: чтобы у атома щелочного металла отнять электрон и превратить его в положительно заряженный ион:
Me — e + ПИ = Me+
необходимо затратить достаточно большую энергию ПИ (потенциал ионизации). При переходе от Li к Cs она уменьшается и поэтому активность металла, т.е. способность к химическому взаимодействию — увеличивается.
И уж совсем неожиданны данные о сродстве к электрону (СЭ) у атомов щелочных металлов: изолированные атомы щелочных металлов «с удовольствием», т.е.
с выделением энергии (СЭ) присоединяют к себе электрон:
Me + e = Me- + СЭ.
Отсюда следует очень важный вывод, что поведение изолированных атомов щелочных металлов — это одно, а их поведение в молекулах, т.е.
при взаимодействии с атомами других химических элементов — это качественно другая ситуация.
В молекулах атомные орбитали преобразовываются в молекулярные орбитали, валентные электроны атомов в молекуле находятся в совместном пользовании или сильно смещаются к одному из атомов вплоть до образования ионной связи.
Типичные степени окисления элементов IA группы в различных соединениях +1. Таким образом, имеются две степени окисления у элементов IA группы: 0 — в молекулах Ме2 и в металлическом состоянии и +1 — в соединениях ( ярко выраженная ионная связь. Очень высокая химическая активность щелочных металлов обусловлена низкими ПИ, легко разрушаемой кристаллической структурой и малой плотностью.
- Получение
- Li, Na, K (Ме) получают электролизом расплавов их хлоридов или гидроксидов:
- 2KCl = 2K+ + 2Cl-, катод 2K+ + 2e = 2K; анод 2Cl- -2e = Cl2.
- Температуры плавления хлоридов и гидроксидов щелочных металлов, oС
| Анион | Li | Na | K | Rb | Cs |
| Cl- | 610 | 801 | 776 | 723 | 645 |
| OH- | 473 | 322 | 405 | 385 | 343 |
- Гидроксиды МеОН имеют меньшую, чем у хлоридов, температуру плавления, они термически вполне устойчивы, а при электролизе из расплавов идет процесс:
- 4МеOH = 4Ме + 2H2O + O2.
- Используя относительно меньшую, чем у Al, Si, Ca, Mg, температуру кипения, можно получать щелочные металлы восстановлением их из оксидов, хлоридов, карбонатов при высоких температурах:
- 3Li2O + 2Al 6Li + Al2O3, 4NaCl + 3CaO + Si 4Na + 2CaCl2 + CaSiO3.
Свойства: Щелочные металлы — очень сильные восстановители. Они энергично реагируют с большинством неметаллов, разлагают воду и бурно взаимодествуют с кислотами. В общем виде (обозначая атом щелочного металла просто Ме) эти реакции будут выглядеть так:
- 2Me + H2 = 2MeH (гидриды), 2Me + Г2 = 2MeГ (галогениды), 2Me + S = Me2S (сульфиды), 3Me + P = Me3P (фосфиды), 6Me + N2 = 2Me3N (нитриды), 2Me + 2H2O = 2MeOH + H2.
- Гидриды щелочных металлов реагируют с водой и кислородом:
- MeH + H2O = MeOH + H2, 2MeH + O2 = 2 MeOH.
- Из солей щелочных металлов с галогенами гидролизуются только фториды:
- MeF + H2O = MeOH + HF.
- Li используют в некоторых сплавах и для получения трития в термоядерном синтезе. Na и K применяют для получения Ti, Zr, Nb, Ta:
- TiCl4 + 4Na = Ti + 4NaCl.
Li, Na, и K используют в реакциях органического синтезах. Na эффективен при осушке органических растворителей. Сs применяется для изготовления фотоэлементов, так как у его атомов самое малое значение ПИ из всех химических элементов.
Оксиды и пероксиды щелочных металлов
Атомы щелочных металлов (Ме) в соединениях одновалентны. Поэтому общая формула оксидов — Me2O, пероксидов — Me2O2. Приведем перечень всех соединений щелочных металлов с кислородом:
- · Li2O,
- · Na2O, Na2O2 (пероксид),
- · K2O, K2O2 (пероксид), KO2 (надпероксид), KO3 (озонид),
- · Rb2O, Rb2O2 (пероксид), RbO2 (надпероксид),
- · Cs2O, Cs2O2 (пероксид), CsO2 (надпероксид).
- Литий не образует пероксидов, у Na — один пероксид, у K, Rb и Cs есть надпероксиды типа MeO2, у калия известен озонид. Все это надо учитывать при изучении взаимодействия щелочных металлов с кислородом и озоном:
- 4 Li + O2 2 Li2O, 2 Na + O2 Na2O2, K + O2 = KO2.
- Оксиды щелочных металлов можно получить из надпероксидов:
- 2МеO2 Ме2O2 + О2
- и пероксидов:
- Ме2O2 + 2Ме 2 Ме2O.
- Li2О обычно получают при нагревании его карбоната:
- Li2CO3 Li2O + CO2.
- Оксиды щелочных металлов, растворяясь в воде, дают щелочи:
- Ме2O + H2O = 2 МеOH.
- Пероксиды и надпероксиды также реагируют с водой:
- Ме2O2 + 2 H2O = 2 МеOH + H2O2, 2 МеO2 + 2 H2O = 2 МеOH + H2O2 + O2,
- с кислотными оксидами и кислотами:
- Me2O + SO3 = Me2SO4, Me2O + 2HNO3 = 2MeNO3 + H2O, Me2O2 + H2SO4 = Me2SO4 + H2O2, 4MeO2 + 2CO2 = 2Me2CO3 + 3O2.
- Пероксиды и надпероксиды являются сильными окислителями:
- Me2O2 + 2FeSO4 + 2H2SO4 ® Fe2(SO4)3 + Me2SO4 + 2H2O,
- но могут и сами окисляться:
- 5Me2O2 + 2KMnO4 +8H2SO4 ® 2MnSO4 + 5Me2SO4 + K2SO4 + 8H2O + 5O2 .
- Надпероксид калия поглощает СО2 и регенерирует кислород:
- 4KO2 + 2H2O + 2CO2 = 4KHCO3 + O2.
- Гидроксиды
- Гидроксиды имеют общую формулу МеОН.
- Получение
- Гидроксиды получают с помощью обменных реакций из сульфатов и карбонатов:
- Me2SO4 + Ba(OH)2 = BaSO4¯ + 2 MeOH, Me2CO3 + Ca(OH)2 = CaCO3¯ + 2 MeOH,
- электролизом водных растворов хлоридов щелочных металлов:
- 2 МеCl + 2 H2O = 2 МеOH + H2 + Cl2, катод: 2H+ + 2e = H2; анод: 2Cl- — 2e = Cl2.
- Свойства
Галогениды щелочных металлов в воде полностью диссоциируют на ионы — это самые сильные основания. Твердые щелочи очень гигроскопичны и это позволяет использовать их в качестве эффективных осушителей. Они энергично взаимодействуют с кислотными и амфотерными оксидами и гидроксидами, с многоосновными кислотами могут давать кислые соли.
- 2Al + 2 MeOH + 6 H2O = 2Me[Al(OH)4] + 3H2, Cl2 + 2MeOH = MeCl + MeClO + H2O, MeOH + HCl = MeCl + H2O, NH4Cl + MeOH = MeCl + NH3 + H2O, CuCl2 + 2MeOH = Cu(OH)2¯ + 2MeCl, NaH2PO4 + NaOH = Na2HPO4 + H2O, 2 MeOH + CO2 = Me2CO3 + H2O, 2 MeOH + H2SO4 = Me2SO4 + 2 H2O.
- Натриевые соли очень широко используются в химической промышленности, их применение рассматривается в соответствующих группах неметаллов.
- Калийные соли используют как удобрение и при получении стекла.