- 1. Нахождение металлов в природе
- 2. Получение активных металлов
- 3. Получение малоактивных и неактивных металлов
- 3.1. Обжиг сульфидов
- 3.2. Восстановление металлов углем
- 3.3. Восстановление металлов угарным газом
- 3.4. Восстановление металлов более активными металлами
- 3.5. Восстановление металлов из оксидов водородом
- 4. Производство чугуна
- Алюминий и его химия | ChemToday – химический портал
- Геохимия алюминия
- Способы получения
- Химические свойства алюминия
- Алюмотермия
- Отношение к кислотам
- Отношение к щелочам. Амфотерность
- Нестабильные соединения
- Одновалентный алюминий
- ПОИСК
- Большая Рнциклопедия Нефти Рё Газа
- 1.1.2 Алюмотермия
Понятие о металлургии: общие способы получения металлов
Металлургия — это наука о промышленных способах получения металлов. Различают черную и цветную металлургию.
Черная металлургия — это производство железа и его сплавов (сталь, чугун и др.).
Цветная металлургия — производство остальных металлов и их сплавов.
Широкое применение находят сплавы металлов. Наиболее распространенные сплавы железа — чугун и сталь.
Чугун — это сплав железа, в котором содержится 2-4 масс. % углерода, а также кремний, марганец и небольшие количества серы и фосфора.
Сталь — это сплав железа, в котором содержится 0,3-2 масс. % углерода и небольшие примеси других элементов.
Легированные стали — это сплавы железа с хромом, никелем, марганцем, кобальтом, ванадием, титаном и другими металлами. Добавление металлов придает стали дополнительные свойства. Так, добавление хрома придает сплаву прочность, а добавление никеля придает стали пластичность.
Основные стадии металлургических процессов:
- Обогащение природной руды (очистка, удаление примесей)
- Получение металла или его сплава.
- Механическая обработка металла
1. Нахождение металлов в природе
Большинство металлов встречаются в природе в виде соединений. Наиболее распространенный металл в земной коре — алюминий. Затем железо, кальций, натрий и другие металлы.
| Нахождение металлов в природе | ||
| Активные металлы — в виде солей | Металлов средней активности — в виде оксидов и сульфидов | Малоактивные металлы -в виде простых веществ |
| Хлорид натрия NaCl |
2. Получение активных металлов
Активные металлы (щелочные и щелочноземельные) классическими «химическими» методами получить из соединений нельзя.
Такие металлы в виде ионов — очень слабые окислители, а в простом виде — очень сильные восстановители, поэтому их очень сложно восстановить из катионов в простые вещества.
Чем активнее металл, тем сложнее его получить в чистом виде — ведь он стремится прореагировать с другими веществами.
- Получить такие металлы можно, как правило, электролизом расплавов солей, либо вытеснением из солей другими металлами в жестких условиях.
- Натрий в промышленности получают электролизом расплава хлорида натрия с добавками хлорида кальция:
- 2NaCl = 2Na + Cl2
- Калий получают пропусканием паров натрия через расплав хлорида калия при 800°С:
- KCl + Na = K↑ + NaCl
- Литий можно получить электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
- 2LiCl = 2Li + Cl2
- Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
- Са + 2CsCl = 2Cs + CaCl2
- Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
- MgCl2 → Mg + Cl2
- Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
- CaCl2 → Ca + Cl2
- Барий получают из оксида восстановлением алюминием в вакууме при 1200 °C:
- 4BaO+ 2Al = 3Ba + Ba(AlO2)2
- Алюминий получают электролизом раствора оксида алюминия Al2O3 в криолите Na3AlF6:
- 2Al2O3 → 4Al + 3O2
3. Получение малоактивных и неактивных металлов
Металлы малоактивные и неактивные восстанавливают из оксидов углем, оксидом углерода (II) СО или более активным металлом. Сульфиды металлов сначала обжигают.
3.1. Обжиг сульфидов
- При обжиге сульфидов металлов образуются оксиды:
- 2ZnS + 3O2 → 2ZnO + 2SO2
- Металлы получают дальнейшим восстановлением оксидов.
3.2. Восстановление металлов углем
Чистые металлы можно получить восстановлением из оксидов углем. При этом до металлов восстанавливаются только оксиды металлов, расположенных в ряду электрохимической активности после алюминия.

- Например, железо получают восстановлением из оксида углем:
- 2Fe2O3 + 6C → 2Fe + 6CO
- ZnO + C → Zn + CO
- Оксиды металлов, расположенных в ряду электрохимической активности до алюминия, реагируют с углем с образованием карбидов металлов:
- CaO + 3C → CaC2 + CO
3.3. Восстановление металлов угарным газом
Оксид углерода (II) реагирует с оксидами металлов, расположенных в ряду электрохимической активности после алюминия.

Например, железо можно получить восстановлением из оксида с помощью угарного газа:
2Fe2O3 + 6CО → 4Fe + 6CO2
3.4. Восстановление металлов более активными металлами
Более активные металлы вытесняют из оксидов менее активные. Активность металлов можно примерно оценить по электрохимическому ряду металлов:

Восстановление металлов из оксидов другими металлами — распространенный способ получения металлов. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
- Например, цезий взрывается на воздухе.
- Алюмотермия – это восстановление металлов из оксидов алюминием.
- Например: алюминий восстанавливает оксид меди (II) из оксида:
- 3CuO + 2Al = Al2O3 + 3Cu
- Магниетермия – это восстановление металлов из оксидов магнием.
- CuO + Mg = Cu + MgO
- Железо можно вытеснить из оксида с помощью алюминия:
- 2Fe2O3 + 4Al → 4Fe + 2Al2O3
- При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
- Активные металлы вытесняют менее активные из растворов их солей.
- Например, при добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
- 2AgNO3 + Cu = Cu(NO3)2 + 2Ag
- Медь покроется белыми кристаллами серебра.
- При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
- CuSO4 + Fe = FeSO4 + Cu
- При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
- Pb(NO3)2 + Zn = Pb + Zn (NO3)2
3.5. Восстановление металлов из оксидов водородом
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Как правило, взаимодействие оксидов металлов с водородом протекает в жестких условиях – под давлением или при нагревании.
CuO + H2 = Cu + H2O
4. Производство чугуна
Чугун получают из железной руды в доменных печах.
Печь последовательно загружают сверху шихтой, флюсами, коксом, затем снова рудой, коксом и т.д.
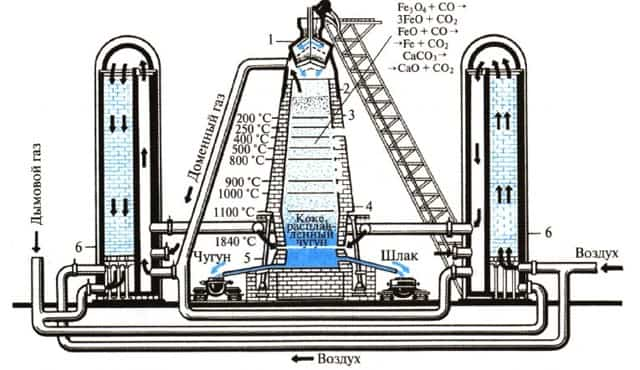
1- загрузочное устройство, 2 — колошник, 3 — шахта, 4 — распар, 5 — горн, 6 — регенератор
Доменная печь имеет форму двух усеченных конусов, соединенных основаниями. Верхняя часть доменной печи — колошник, средняя — шахта, а нижняя часть — распар.
В нижней части печи находится горн. Внизу горна скапливается чугун и шлак и отверстия, через которые чугун и шлак покидают горн: чугун через нижнее, а шлак через верхнее.
Наверху печи расположено автоматическое загрузочное устройство. Оно состоит из двух воронок, соединенных друг с другом. Руда и кокс сначала поступают в верхнюю воронку, а затем в нижнюю.
Из нижней воронки руда и кокс поступают в печь. во время загрузки руды и кокса печь остается закрытой, поэтому газы не попадают в атмосферу, а попадают в регенераторы. В регенераторах печной газ сгорает.
- Шихта — это железная руда, смешанная с флюсами.
- Снизу в печь вдувают нагретый воздух, обогащенный кислородом, кокс сгорает:
- C + O2 = CO2
- Образующийся углекислый газ поднимается вверх и окисляет кокс до оксида углерода (II):
- CO2 + С = 2CO
- Оксид углерода (II) (угарный газ) — это основной восстановитель железа из оксидов в данных процессах. Последовательность восстановления железа из оксида железа (III):
- Fe2O3 → Fe3O4 (FeO·Fe2O3) → FeO → Fe
- Последовательность восстановления оксида железа (III):
- 3Fe2O3 + CO → 2Fe3O4 + CO2
- Fe3O4 + CO → 3FeO + CO2
- FeO + CO → Fe + CO2
- Суммарное уравнение протекающих процессов:
- Fe2O3 + 3CO → 2Fe + 3CO2
При этом протекает также частичное восстановление примесей оксидов других элементов (кремния, марганца и др.). Эти вещества растворяются в жидком железе.
Чтобы удалить из железной руды тугоплавкие примеси (оксид кремния (IV) и др.). Для их удаления используют флюсы и плавни (как правило, известняк CaCO3 или доломит CaCO3·MgCO3). Флюсы разлагаются при нагревании:
- CaCO3 → CaO + CO2
- и образуют с тугоплавкими примесями легкоплавкие вещества (шлаки), которые легко можно удалить из реакционной смеси:
- CaO + SiO2 → CaSiO3
Алюминий и его химия | ChemToday – химический портал
Здравствуй, уважаемый читатель! Сейчас мы будем разбираться с таким интереснейшим элементом, как алюминий, и подробно узнаем о его свойствах.
Алюминий является самым распространенным металлом, находящимся в соединениях в составе земной коры, следом за ним идёт железо.
Но несмотря на этот факт, алюминий — не самый дешёвый в производстве металл (самый дешёвый — свинец) и на его получение тратится значительно больше энергии, чем на производство железа. Немного позже вы узнаете почему.
Алюминий — уникальный металл в том смысле, что изготавливать из него можно почти всё что угодно: фольгу, банки для напитков, кружки, ложки, крючки для одежды — он необычайно ковкий. Однако, из-за этой ковкости его трудно использовать в несущих деталях конструкций, например арматуры или газовых баллонов, для изготовления которых используются более твёрдые материалы.
Алюминиевая коллекционная монета
Чтобы узнать, как можно получать алюминий, нужно узнать о том, в каком виде он встречается в природе.
Геохимия алюминия
Самый распространенный минерал алюминия — это его оксид Al2O3. В природе он встречается в разных минералах, из которых самый распространённый — боксит Al2O3 * xH2O:
Боксит
Включения других элементов в состав минерала делают его необычайно красивым. Прекрасные рубин, сапфир, топаз, аквамарин представляют из себя минералы, состоящие в основном из оксида алюминия, цвет которых обеспечивается за счет примесей — соединений хрома(II и III), железа, титана, марганца и многих других.
- Рубин
 Сапфир
Сапфир Топаз
Топаз
 Озеро близ города Кыштым (Челябинская область), цвет которого вызван наличием каолиновой глины, в состав которой входит алюминий
Озеро близ города Кыштым (Челябинская область), цвет которого вызван наличием каолиновой глины, в состав которой входит алюминий
Вместе с кремнием алюминий образует группу самых распространённых в земной коре минералов. Их объединяют под общим названием — алюмосиликаты, подчёркивая наличие алюминия и кремния (silicium) в их составе.
Аквамарин
Способы получения
Как мы уже выяснили, всё или почти всё, что из себя представляет природный алюминий, — это его оксид Al2O3. Алюминий — очень активный металл, поэтому его извлечь из оксида непросто.
Приведём некоторые цифры: энергия Гиббса сродства к кислороду, то есть образования оксида, составляет около -300 кДж/моль! А электродный потенциал реакции восстановления алюминия(3+) составляет -1,7 В, что ставит его рядом с бериллием и марганцем.
Поэтому одним из самых распространённых способов для его получения служит электролиз расплава.
Сам оксид алюминия (корунд) чрезвычайно тугоплавкий, поэтому к нему добавляют гексафторалюминат натрия — природный минерал криолит.
Криолит
- Он имеет формулу Na3[AlF6] — это комплексное соединение, которое можно получить из водного оксида алюминия по следующей реакции:
- На территории России криолит встречается в непригодном для получения алюминия виде (загрязнённом), поэтому для электролиза расплава его получают по вышеприведённой реакции.
- Вместе с ним к оксиду алюминия добавляют также фторид кальция CaF2, и в результате смесь начинает плавиться при 950оС.
- В расплавленную смесь погружают графитовые электроды и создают напряжение, в результате чего происходит процесс электролиза, который в данном случае точно описать довольно сложно, поэтому ограничимся приблизительными реакциями.
- Вместе с этим графитовые электроды довольно быстро сгорают при такой высокой температуре и количестве кислорода, который выделяется на них:
- Суммируя всё вышесказанное, в процессе электролиза расплава на катоде выделяется алюминий, который из-за большей, нежели расплав, плотности собирается на дне жидким слоем; на аноде же выделяется кислород. Выглядит это вживую вот так:
(2Al(OH)_3 + 3Na_2CO_3 + 18HF = 2Na_3[AlF_6] + 3CO_2uparrow + 9H_2O) (Al_2O_3 = AlO^+ + AlO_2^-)
(quad ominus 3AlO^+ + 3overline{e} = Aldownarrow + Al_2O_3)
(quad oplus 2AlO_2^- — 2overline{e} = [O] + Al_2O_3) (C + O_2 = CO_2uparrow) Ванна электролиза расплава
Химические свойства алюминия
Алюмотермия
Как мы уже сказали, алюминий — активный металл. Настолько активный, что может применяться как восстановитель железа, марганца, хрома и других подобных металлов, при этом переходя в очень стабильный оксид. Данный метод получения других металлов из их оксидов реакцией с алюминиевой пудрой носит название алюмотермия, или реакция термит:
(3Fe_3O_4 + 8Al = 4Al_2O_3 + 9Fe)
(3MnO_2 + 4Al = 3Mn + 2Al_2O_3)
(Cr_2O_3 + 2Al = 2Cr + Al_2O_3) Термит
Как вы уже заметили, в своём оксиде алюминий находится в степени окисления +3. И да, действительно, это самая устойчивая для алюминия степень окисления. Однако для него существует ещё одна ненулевая степень окисления! И это +1, о которой мы поговорим чуть позже.
Для начала отметим реакции алюминия со многими простыми веществами (при нагревании), элементы которых окружают алюминий в таблице Менделеева:
(4Al + 3C = Al_4C_3 quad ext{t = }1500^oC)
(2Al + N_2 = 2AlN quad t > 800^oC)
(2Al + 3S = Al_2S_3 quad t > 700^oC)
Многие из образующихся в подобных реакциях соединения легко гидролизуются:
(Al_2S_3 + 6H_2O = 3H_2Suparrow + 2Al(OH)_3downarrow, ext{быстро})
(AlN + 4HCl = AlCl_3 + NH_4Cl, ext{медленно})
Отношение к кислотам
- Алюминий не реагирует с концентрированными азотной и серной кислотами — то есть пассивируется.
- Однако с разбавленными кислотами-неокислителями (то есть разбавленной серной, соляной) реагирует с умеренной скоростью из-за довольно инертной плёнки оксида на поверхности, которая медленно «съедается» кислотой:
- Гидроксид алюминия очень легко взаимодействует с кислотами, образуя соли алюминия:
(2Al + 6HCl = 2AlCl_3 + 3H_2uparrow) (Al(OH)_3 + 3HCl = AlCl_3 + 3H_2O)
Отношение к щелочам. Амфотерность
Алюминий — амфотерный металл. Это значит, что он и его соединения проявляют как кислотные, так и основные свойства.
- Например, он реагирует с раствором щелочи:
- Экспериментально замечено, что эта реакция идет с большей скоростью, нежели алюминия с кислотой, а значит мы можем сделать вывод, что кислотные свойства алюминия выражены сильнее, чем основные.
- Помимо реакции с кислотой, гидроксид алюминия также легко растворяется и в растворе щёлочи!
(2Al + 2NaOH + 6H_2O = 2Na[Al(OH)_4] + 3H_2uparrow) (Al(OH)_3 + NaOH = Na[Al(OH)_4])
В результате этих реакций образуется комплексное соединение — тетрагидроксоалюминат натрия, которое имеет переменный состав, сильно зависящий от pH.
В водных растворах при pH 13-14 (сильнощелочных средах) существуют тетрагидроксоалюминат-ионы, а при понижении pH (подкислении среды) между ионами начинают происходить процессы полимеризации через кислородные мостики.
Например, охарактеризовано существование и строение ионов следующих составов:
([Al_{13}O_4(OH)_{24}(H_2O)_{12}]^{7+},quad [Al_{13}(OH)_{35}]^{4+})
А вместе с однозарядными катионами (катионами щелочных металлов и аммония) образует устойчивые кристаллизующиеся соединения квасцы (название происходит от слова кислый, так как соединения алюминия гидролизуются и растворы солей имеют кислую реакцию среды):
((NH_4)_2SO_4 + Al_2(SO_4)_3 + 24H_2O = 2NH_4Al(SO_4)_2 * 12H_2O)
В их структуре присутствуют тетраэдрические гексаакваионы [Al(H2O)6]3+.
Прекрасные кристаллы алюмокалиевых квасцов
При сплавлении со щелочами алюминий образует соль мета- или ортоалюминиевой кислоты. При этом также могут образоваться алюминаты более сложного состава:
(Al(OH)_3 + NaOH = NaAlO_2 + 2H_2O)
(NaAlO_2 + Na_2O = Na_3AlO_3)
Нестабильные соединения
Говоря о неустойчивых соединениях алюминия, начнём с гидрида. Обменной реакцией алан (гидрид алюминия) может быть получен в эфирном растворе:
(3LiH + AlCl_3 = 3LiCl + AlH_3downarrow)
Продукт этой реакции — твёрдое белое полимерное вещество. Структурные фрагменты [Al2H6] напоминают бораны, и из эфирных растворов может осаждаться также сольват AlH3 * xEt2O.
Выше 150оС алан разлагается на простые вещества:
(2AlH_3 = 2Al + 3H_2uparrow)
Одновалентный алюминий
Вот мы и дошли до места, где упомянем соединения алюминия в степени окисления +1. Да, они немногочисленны, но сказать о них стоит.
Выше 1000 градусов Цельсия существует оксид Al2O, получаемый реакцией обычного оксида с кремнием:
(Al_2O_3 + 2Si = Al_2Ouparrow + 2SiO)
А при нагревании фторида алюминия(III) с металлическим алюминием образуется субфторид алюминия — синий газ:
(AlF_3 + 2Al = 3AlFuparrow)
Так как подобные соединения являются летучими и легко разлагаются, их можно использовать в транспортных реакциях для очистки алюминия.
Это такие реакции, где в одной части прибора из грязного источника получается летучий оксид или субфторид, а в другой части прибора, скажем, на раскалённой проволоке, этот неустойчивый газ разлагается, образуя высокочистый алюминий.
- Также известен сульфид:
- Эти соединения необходимо получать в инертной атмосфере.
- Любите химию!
(Al_2S_3 + 4Al = 3Al_2S)
ПОИСК
АЛЮМИНОТЕРМИЯ (алюмотермия)— способ получения металлов и их сплавов, а также неметаллов восстановлением их оксидов металлическим алюминием. А, основана на том, что соединение кислорода с алюминием сопро- [c.
18]
Для сварки рельсов по методу алюмотермии используют порошок алюминия и оксид железа РедО . Составьте термохимическое уравнение, если при образопании 1 кг железа выдадилось 6340 кДж теплоты. [c.
35]
Алюмотермией получают феррованадий, феррониобий и ферротантал. Чистый металлический ванадий может быть попучен методом восстановления У Об кальцием в стальной бомбе. Образующиеся частицы металлического ванадия после промывки сплавляются в слиток в вакуумной печи. Полученный таким образом металл содержит до 99,9% ванадия и обладает хорошей пластичностью. Ниобий и тантал можно получить термическим разложением пентаиодидов или пентахлоридов при 2000 С или восстановлением металлическим натрием или калием. [c.371]
На этом свойстве А1 основан метод восстановления металлов (Сг, Мп, W, V и др.) из их оксидов — метод алюмотермии, открытый Н. Н. Бекетовым (1859). [c.277]
Относительно чистый хром получают методом алюмотермии [c.373]
Металлический алюминий служит в основном для производства сплавов. Сплавы алюминия менее устойчивы к коррозии из-за возникновения гальванических микроэлементов в местах включений примесей.
Алюминий идет на производство кабелей, фольги, зеркал, серебристой краски. Способность алюминия восстанавливать металлы из оксидов при высоких температурах послужила основой метода алюмотермии, т. е.
восстановления тугоплавких металлов, например хрома или марганца, из их оксидов [c.152]
По содержанию в земной коре хром относится к довольно распространенным элементам. Основной рудой хрома является Хромистый железняк РеО-СггОз. Элементарный хром можно получить методом алюмотермии из оксида хрома (III) [c.273]
Эксперимент 9.3. Проведение алюмотермии [c.145]
Алюмотермией называют реакции, протекающие между окислами металлов и алюминием, с образованием соответствующего свободного металла п окиси алюминия. Алюмотермией можно получить только те металлы, теплота образования окислов которых меньше теплоты образования окиси алюминия. Этим способом получают в промышленности такие металлы, как Сг, Мп, Т], [c.334]
В некоторых случаях (при низких температурах) исходным указателем возможного направления реакции является значение тепловых эффектов реакций образования сложных веществ из простых. Хорошо известный пример — реакция алюмотермии [c.55]
Получение марганца алюмотермией. В фарфоровый тигель возьмите 10 г пиролюзита и прокалите его при температуре 800 С в течение 1 ч. Полученный продукт охладите и перемешайте в ступке с 3 частями порошкообразного алюминия.
Смесь поместите в фарфоровый тигель, уплотните ее, вставьте посредине магниевую ленту, зачищенную наждачной бумагой, и сверху насыпьте 10 частей зажигательной смеси. Зажигательную смесь приготовьте, осторожно свешивая в стакане 10 частей пероксида бария с 1 частью магния (или алюминия).
Тигель закройте асбестовой крышкой с отверстием для магниевой ленты, поставьте на песочную баню (опыт проводите в вытяжном шкафу), погрузив стенки тигля в песок на /з глубины. Затем длинной лучинкой подожгите магниевую ленту (опыт проводите в присутствии преподавателя).
Наблюдайте бурную реакцию восстановления марганца алюминием. После охлаждения тигель разбейте и выньте королек металла. [c.120]
Эта особенность алюминия широко используется для получения различных металлов из окислов путем восстановления их алюминием. Впервые метод восстановления металлов из их окислов алюминием был применен русским ученым Н. Н. Бекетовым и получил название алюмотермии. [c.334]
Последняя из приведенных здесь реакций лежит в основе процесса алюмотермии. [c.119]
Хром может быть получен с помощью реакции алюмотермии [c.113]
Высокий электроотрицательный потенциал алюминия и значительное сродство к кислороду обусловили его применение в качестве раскислителя сталей, восстановителя при получении ряда материалов методом алюмотермии. [c.477]
Проведите реакцию алюмотермии (разд. 50.1,1.3). [c.587]
В промышленности иногда применяется и неорганическое топливо. Так. при обжиге некоторых руд и в алюмотермии используется тепло, полученное в результате сжигания серы и алюминия, но все эти вещества не являются топливом в общетехническом смысле этою понятия. [c.4]
I) А1+р з04— АЬОз+Ре — реакция алюмотермии. В качестве окислителя выступают ионы железа Ре + и РеЗ+, а атомы алюминия являются сильнейшим восстановителем. [c.411]
Хром легко пассивируется, поэтому широко используется в ка- естве гальванических защитных покрытий и для получения корро- ионностойких сталей.
Молибден применяется для изготовления химической аппаратуры, вольфрам — в электротехнической промышленности (в частности, для производства ламп накаливания). 4олибден и вольфрам применяются в качестве катализаторов.
Относительно чистый хром получают методом алюмотермии [c.550]
Вычислите термодинамические характеристики АЯ°298, AS°298, ЛС°298 процссса алюмотермии при стандартной температуре и 1000°С [c.113]
Вследствие высокого сродства к кислороду (ДС /== —1582кДж/моль А12О3) алюминий активно восстанавливает многие металлы из оксидов алюмотермия). При этом реакция обычно сопровождается выделением большого количества тепла и повышением температуры до 1200— 3000 С. Алюмотермия применяется в производстве марганца, хрома, ванадия, вольфрама, ферросплавов. [c.452]
В промышленности используют два типа скелетных никелевых катализаторов — катализатор Бага [193] и никель Ренея [194]. Оба получают из сплава N1 с А1, однако, если никель Ренея представляет собой мелкодисперсный порошок, состоящий из чистого никеля, то катализатор Бага — кусочки никель-алюминиевого сплава (65—75% N1 и 35—25% А1).
Исходные сплавы получают чаще всего пирометаллургическими способами — сплавлением компонентов или алюмотермией. В последнее время используют методы порошкообразной металлургии — спекание предварительно спрессованных смесей никелевых и алюминиевых порошков в восстановительной или инертной атмосфере при 660—700 °С.
Реакции между двумя твердыми телами с образованием новой твердой фазы включают процесс диффузии, поскольку реагирующие вещества разделяются образующимся продуктом реакции [174].
Реагирующие вещества сохраняют постоянную активность с обеих сторон реакционной поверхности раздела фаз, в связи с чем скорость переноса материала определяется скоростью нарастания толщины диффузионного слоя продукта и выражается формулой [c.166]
При восстановлении 80 г оксида жепеза (1Л) алюминием (реакция алюмотермии) выделяется 42 6,3 кДж. При сгорании 5,4 г металлического алюминия выделяется 167,3 кДж. На основании этих данных вычислить теплоту образования оксида железа (111). [c.46]
Кобальт обычно получают переработкой полиметаллических руд. Рядом последовательных пйрометаллургических операций выделяют С03О4, который затем восстанавливают углем, водородом, иногда методом алюмотермии.
Особо чистый кобальт получают электролитическим рафинированием, а также термическим разложением некоторых его соединений.
Основная масса производимого кобальта используется для получения сплавов его применяют для электролитического покрытия металлических деталей. [c.596]
Благодаря большому отрицательному значению ДО (АЬОз) возможна алюмотермия — выделение металлов из их оксидов при действии алюминия. Этот весьма общий метод получения металлов был предложен Н. Н. Бекетовым в 1859 г. Алюмотермию используют для лабораторного получения многих металлов (Мп, Сг, У, V и др.) и в ряде случаев в промышленности (получение Са, 5г, Ваидр.). [c.343]
Кобальт обычно получают переработкой полиметаллических руд. Рядом последовательных пирометаллургических операций выделяют С03О4, который затем восстанавливают углем, водородом, иногда методом алюмотермии. Особо чистый кобальт получают электролитическим рафинированием, а также термическим разложением некоторых его соединений.
[c.634]
Наряду с сродством к фтору бор обладает также очень сильным сродством к кислороду (см. получение элементов из их оксидов алюмотермией в разд. 36.2). Соединения бора с кислородом обычно можно получить путем окисления бора кислородом воздуха. Гидролиз галогенидов бора (ВС1з и др.), в которых [c.573]
Применение основа легких сплавов, применяемых в авто- и самолетостроении, судо- и вагоностроении, моторо- и машиностроении и т. д., раскислитель стали, в алюмотермии (с. 152). [c.183]
Опыт 15. Алюмотермия (ТЯГА ). Термит — сухую смесь порошков Рсз04 (257о) и А1 (75%) — внесите в тигель из термостойкого материала, насыпьте в середину зажигательную смесь и укрепите в ней магниевую ленту.
(Зажигательная смесь готовится из порошка А1 и ЫагОг или ВаОг в соотношении 1 1.) Установите тигель за защитным экраном на асбестовом листе и подожгите ленту магния. Объясните наблюдаемое.
Какое практическое значение находит термит [c.94]
Опыт 2. Получение марганца методом алюмотермии. Приготовьте МП3О4. Для этого 40 г тонкоизмельченного МпОг поместите в тигель и нагревайте при 800° С в муфельной печи в течение часа. После охлаждения полученный МП3О4 разотрите в порошок и тщательно перемешайте с 10 г порошка алюминия. Смесь поместите в шамотный тигель, покройте слоем 10 г зажигательной смеси. В смесь вставьте магниевую ленту. Тигель поставьте а вытяжной шкаф, магниевую ленту подожгите горящей лучинкой, закрепленной в длинную стеклянную трубку. Объясните энергичное течение реакции. По охлаждении металлический порошок отделите от шлака и сдайте лаборанту. [c.139]
Значительное количество алюминия расходуется для получения металлов методом алюмотермии.
Соединение алюминия с кислородом, как указывалось, сопровождается очень большим выделением теплоты, намного превышающим таковое для других металлов.
В связи с этим при накаливании смеси оксида с порошком алюминия происходит бурная реакция, сопровождающаяся выделением свободного металла. Например, при поджигании особым запалом термита (смеси А1 и Рез04) [c.282]
Наибольшие количества металлического хрома получают из хромита. Для этого предварительной обработкой получают окись хрома СггОз, а затем алюмотерми-ческим способом восстанавливают металлический хром (см. 3, гл. XVni).
Отметим, что металлический хром можно получить не только алюмотермией, но также восстанавливая СггОз при нагревании с кремнием, кальцием, водородом, а также электролитическим восстановлением расплавов солей хрома. [c.
339]
Теплота образования V2O5 равна 1050 1 Цж/моль, а АЬОз— 1652 кДж/моль. Определите тепловой эффект реакции получения ванадия методом алюмотермии. [c.26]
Большая Рнциклопедия Нефти Рё Газа
Cтраница 1
Алюмотермия 394, 424 Амальгама 404 Аметист 376 Амиды 339 Аммиак 340 Аммиакаты 144, 145 Аммины 144, 145 Аммония соли 340, 341 Аммофос 351 Амфолит 212, 222 Амфотерность 310 Английская соль 405 Андрианов К. А. 381 Анизотропия 109 Анион 252 Аниониты 201 Анод 240 Антимониды 359 Антимония 360 Антихлор 330 Аргиродит 376 Арсенаты 360 Арсениды 359 Арсениты 359 Арсенопирит 356 Арсин 359 Аррениус С. [1]
Алюмотермией поэтому часто пользуются для сварки друг с другом металлических ( стальных) частей. Методом алюмотермии удобно сваривать стыки трамвайных рельсов. [2]
Алюмотермией называют реакции, протекающие между окислами металлов и алюминием, с образованием соответствующего свободного металла и окиси алюминия. Алюмотермией можно получить только те металлы, теплота образования окислов которых меньше теплоты образования окиси алюминия. [3]
Метод алюмотермии широко используется для получения многих чистых металлов: железа, хрома, марганца, титана и др. Можно ли методом металлотермии получать алюминий. [4]
- АЛЮМР�НОТЕРМР�РЇ ( алюмотермия) — СЃРїРѕСЃРѕР± получения металлов Рё неметаллов ( Р° также сплавов) восстановлением РёС… кислородных соединений металлич. [5]
- Описанный опыт алюмотермии возможен в большой аудитории. [6]
- Проведите реакцию алюмотермии ( разд. [7]
- С помощью алюмотермии получают многие металлы из их оксидов. [8]
- С помощью алюмотермии получают многие металлы из их окси-дои. [9]
- Его получают методом алюмотермии. [10]
- Какой процесс называется алюмотермией. [11]
Так, с помощью алюмотермии получают многие металлы из их оксидов. Подобные реакции начинаются лишь после сильного нагрева смеси реагентов, что необходимо для преодоления высокого барьера активации ( с. [12]
Поэтому железо в реакции алюмотермии восстанавливается до металла, а алюминий окисляется до окиси.
При алюмотермии развивается высокая температура ( 1300 С), железо плавится, а по окончании реакции оно застывает в виде слитка, сваривающего железные детали, например два рельса, подлежащих соединению. [13]
В чем заключается сущность процесса алюмотермии. [14]
Дисилицид урана USi2 получают методом алюмотермии. Соединение представляет собой металлический микрокристаллический порошок, растворимый только в HF.
Под действием расплавленных щелочей или щелочных карбонатов при температуре красного каления USi2 превращается в силикат и уранат.
Дисилицид урана горит в кислороде при 800 С и реагирует с хлором при 500 С. [15]
Страницы: 1 2 3 4
1.1.2 Алюмотермия
К пирометаллургическим
способам относится металлотермия.
Металлотермия
(от металлы и греч . therme — жар, тепло),
металлургические процессы, основанные
на восстановлении металлов из их
соединений (оксидов, галогенидов и др.)
более активными металлами, и протекающие
с выделением теплоты (напр., алюминотермия,
магниетермия).
Впервые металлотермические
реакции изучил и подробно описал Н. Н.
Бекетов (1865г.). В
настоящее время применяется восстановление
алюминием – алюминотермия и восстановление
кремнием — силикотермия.
Эти процессы используются главным
образом при получении безуглеродистых
ферросплавов хрома, ванадия, титана,
вольфрама и др [2].
Различают
внепечные, электропечные и вакуумные
металлотермические процессы.
Алюминотермия,
алюминотермический процесс — получение
металлов и сплавов восстановлением
окислов металлов алюминием.
Шихта (из порошкообразных материалов)
засыпается в плавильную шахту или тигель
и поджигается с помощью запальной смеси.
Если при восстановлении выделяется
много теплоты, осуществляется внепечная
алюминотермия,
без подвода тепла извне, развивается
высокая температура (1900-2400о
С). Процесс протекает с большой скоростью,
образующиеся металл и шлак хорошо
разделяются.
Если теплоты выделяется
недостаточно, в шихту вводят подогревающую
добавку или проводят плавку в дуговых
печах.
Соединение
алюминия с кислородом сопровождается
громадным выделением тепла, значительно
большим, чем у многих других
металлов.
В виду этого при накаливании смеси
оксида соответствующего
металла с
порошком алюминия происходит бурная
реакция, ведущая к
выделению из взятого
оксида свободного металла.
Метод
восстановления при помощи Al (алюминотермия)
часто применяют для получения ряда
элементов (Cr, Mn, V, W и др.) в свободном
состоянии.
Алюмотермией
иногда пользуются для сварки отдельных
стальных частей, в частности стыков
трамвайных рельсов. Применяемая смесь
(“термит”) состоит обычно из тонких
порошков Аl
(75%)
и Fе3O4
(25%),
которая поджигается при помощи запала
из смеси Al и BaO2
(зажигательная
смесь готовится из порошка Аl и Na2O2
или ВаO2
в соотношении 1:1).
Основная реакция идет по уравнению:
8Al+3Fe3O4=4Al2O3+9Fe+3350кДж. Для
успешного течения алюмотермического
процесса без внешнего подогрева
необходимо, чтобы реакция восстановления
выделила достаточное количество тепла.
По правилу Жемчужного приход тепла на
1г шихты
(теплопроизводительность шихты q)
ориентировочно должен составлять не
менее (550кал·4,1868) Дж.
Если теплопроизводительность
ниже этой нормы, то без подогрева извне
процесс не получает развития.
Согласно второму
закону термодинамики, самопроизвольно
протекают процессы, идущие с уменьшением
свободной энергии (G298
0). В первом приближении величину G298
изучаемой реакции восстановления можно
рассчитать, пользуясь уравнением:
G298=Н298
— ТS298. (1.6)
-
Поскольку процессы
металлотермического восстановления
осуществляются в области весьма высоких
температур, при ориентировочном расчете
можно принять Т=2000К. -
Допустив независимость
тепловых эффектов от температуры,
теплопроизводительность шихты (q)
можно определить из уравнения: -
q
= — Н298/ΣМi, (1.7) - где
ΣМi
– сумма молекулярных (атомных) масс
реагирующих веществ, взятых в
стехиометрическом состоянии. -
В случае присутствия
в шихте нескольких окислов
теплопроизводительность смеси находится
на основании величины q
для отдельных окислов: -
q =
(q1m1+q2m2+…+qnmn)/(m1+m2+…mn), (1.8) - где
q1,q2,…qn
– теплопроизводительность реакции
восстановления определенного оксида,
кал/г; m1,m2,…mn
– сумма масс восстанавливаемого оксида
и восстановителя (алюминия), г. -
По значению q
оценивается тепловая сторона процесса. -
Расчет шихты для
получения определенного количества
сплава (металла) заданного состава
представляет собой решение задач на
базе стехиометрических уравнений и
соотношений.
Пример. Рассчитать шихту для получения 20г
ферромарганца, содержащего 30% Mn.
Железо восстанавливается из Fe2O3,
а марганец из MnO2.
В качестве восстановителя использовать
алюминий.
кол-во железа: mFe
= 20·70/100 = 14г,
кол-во марганца:
mMn
= 20·30/100 = 6г.
-
Расчет количества MnO2 (mMnO2) и Fe2O3 (mFe2O3), необходимых для получения 20г ферромарганца:
-
mMnO2
= mMn·М
MnO2
/АMn
= 6·87/54,93 = 9,5г -
mFe2O3
= mFe·М
Fe2O3
/2АFe
=
14·160/55,85 = 20г, -
где m
– масса оксида или элемента; М –
молекулярная масса; А – атомная масса.
-
Расчет количества восстановителя-алюминия, используя стехиометрические данные реакции восстановления.
-
Расчет количества
Al, необходимого для получения 14г Fe: -
2/3Fe2O3
+ 4/3Al = 2/3Al2O3
+ 4/3 Fe, -
(4/3АAl
)/ (4/3АFe)
= mAl
/ mFe, -
mAl
= (4/3·26,97·14) / (4/3·55,85) = 6,76г. -
Расчет кол-ва Al,
необходимого для получения 6г Mn: -
MnO2
+ 4/3Al = 2/3Al2O3
+ Mn, -
4/3·АAl
/ АMn
= mAl
/ mMn, -
mAl
= (4/3·26,97·6)/ 54,93 = 3,93г.
-
Следовательно, для получения 20г 30%-го сплава FeMn необходима следующая шихта:
mMnO2
= 9,5г; mFe2O3
= 20г;
mAl
= 6,76 + 3,93 = 10,69г.






