- Влияние водорода на свойства стали
- Взаимодействие металлов с водородом
- Гидриды лития помогают изучать свойства металлического водорода • Новости науки
- Эксперименты по «металлизации» водорода
- Чем интересен металлический водород?
- Обогащение веществ водородом — путь к его «металлизации»
- Большая Рнциклопедия Нефти Рё Газа
- Влияние водорода на свойства стали
- Водород в металлах | это… Что такое Водород в металлах?
- Водородооборот магния
- За экологию
В основной статье было допущено упущение и не рассмотрен вопрос о водородном охрупчивании металлов, на что мне указали различные специалисты. Каюсь и считаю своим долгом исправить и дополнить материал отдельной небольшой дополнительной заметкой.
Итак, на необъятных просторах интернетов, был найден древний фолиант, содержащий тайные знания погибшей цивилизации о воздействии водорода на металлы.
Вот он:

Весь труд довольно объёмен и желающие могут с ним ознакомиться полностью, по ссылке выше. Я же сделаю небольшие выдержки, того что показалось интересным с небольшими ми.

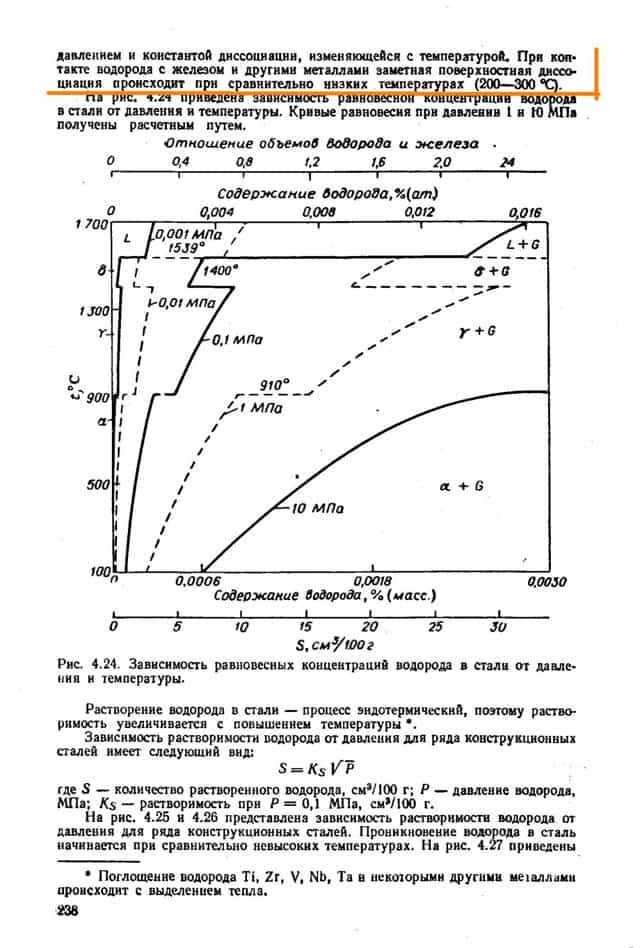
Активизация процессов водородного охрупчивания металлов, начинается при относительно небольших температурах, всего от 200 град.С. Я конечно понимаю, что газ в МГП находится под давлением и оттого слегка разогретым, но сильно сомневаюсь, что там есть близко 200 град.С. Но не суть, давайте дальше:

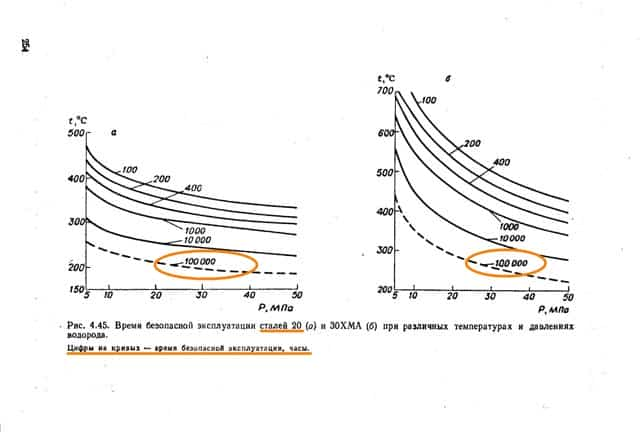
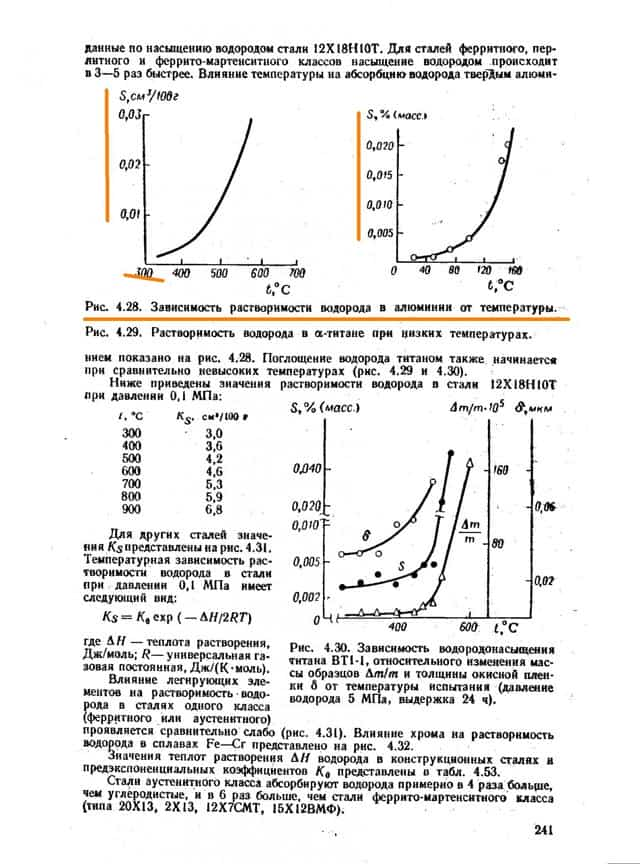
Охрупчивание начинается не сразу и вдруг, а имеется некий период безопасной эксплуатации. При температурах до 200 град.С индукционный период в металлах составляет скромные 100 тысяч часов. Тестировался суперсплав сталь 20.
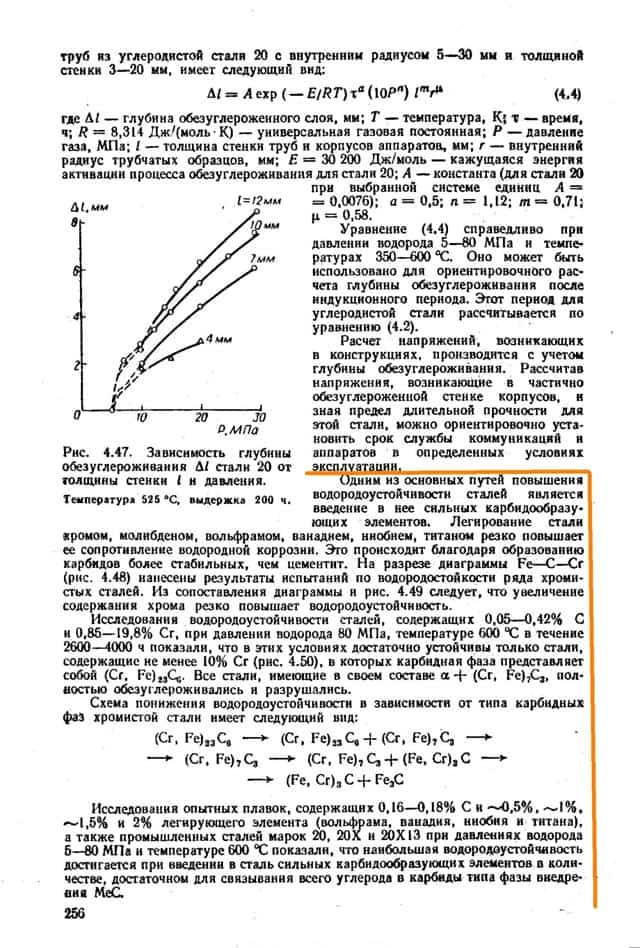
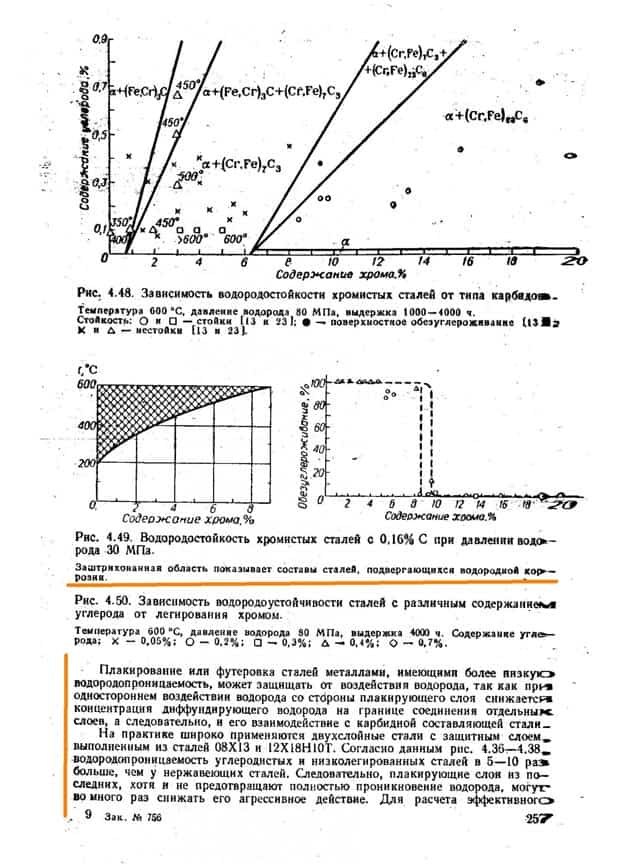
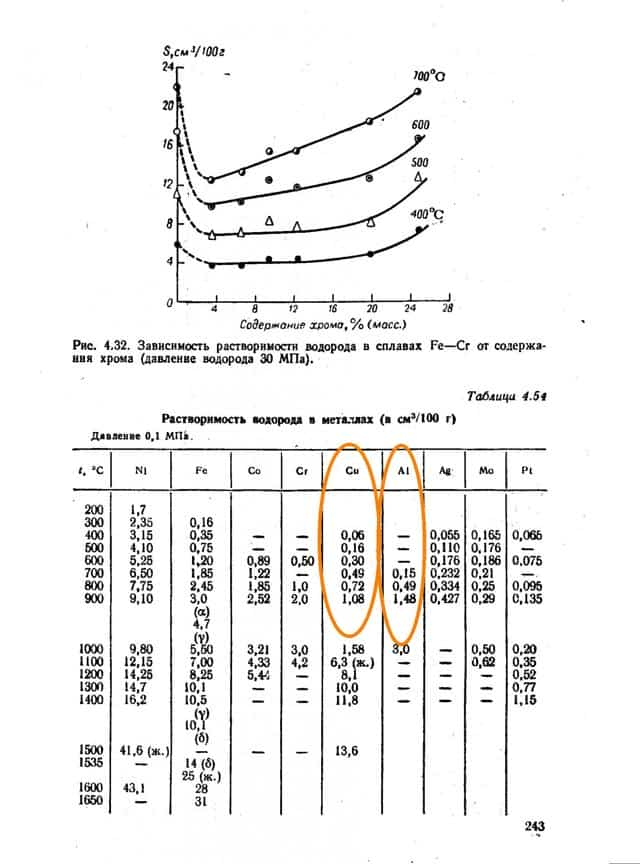
Имеются способы повысить стойкость металлов, в частности путём легирования. Легирование хромом наиболее эффективно и уже при 12% добавки сплав становится водородностойким. Обратите внимание на рис. 4.49 на незаштрихованную область. Даже меньшие чем 12% добавки хрома уже существенно повышают температуру процесса.
Также может применяться плакировка, вместо цельного сплава. Не рассмотрен процесс гальванопокрытия, например медью, но это 1978 год. Воды утекло с тех пор…
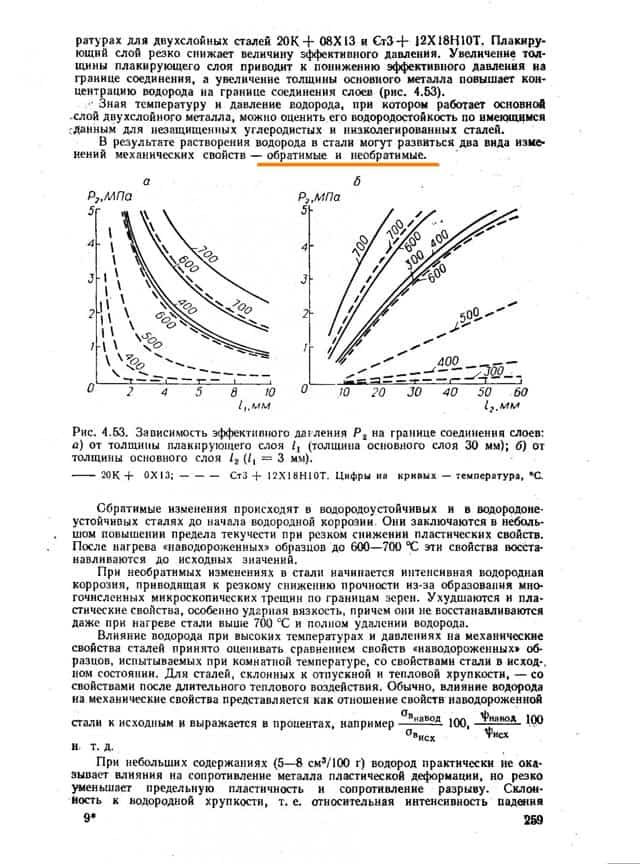
Процесс охрупчивания не является необратимым. При определённых условиях он может быть обращён вспять. «Повреждённая» деталь может быть восстановлена и возвращена в эксплуатацию.
- Последний слайд сообщает нам, что некий алюминиевый промышленник суетиться не просто так, а возможно что-то знает про технологии древних:
Зелёным выделен тезис о водородном охрупчивании меди. О процессе я писал в прошлый раз. Там вместо углерода в реакцию вступает кислород, отсюда и такие специфические требования именно к меди.
Содержание кислорода в 0,01% не является чем-то запредельным. Это ГОСТовский норматив по кислороду для сплавов М1 и чище.
Те же водопроводные трубы вполне себе делаются из сплава М1ф и полагаю могут быть использованы в качестве «последней водородной мили». (Внезапно даже для меня ).
Влияние водорода на свойства стали
- Водород может оказывать на металл двоякое влияние:
- — с одной стороны, он защищает его от насыщения кислородом и азотом, предупреждает окисление, связывая кислород, восстанавливает при известных условиях металл из оксидов;
- — с другой — растворяется в металле и становится причиной появления существенных дефектов в шве — пористости и трещин.
- Металлы по способности взаимодействовать с водородом делятся на две группы:
- 1) не образующие химических соединений с водородом: Fe, Ni, Al, Со, Си, Mo, Pt и др.;
- 2) образующие твердые растворы и химические соединения с водородом (гидриды) — Zr, Ti, V, Та, Th и др.
- Водород хорошо растворяется в стали, но
- — не образуют химических соединений с Fe,
- — образует химические соединения с легирующими элементами стали.
- Атомарный водород растворяется как в твердом, так и в жидком железе.
- Для сварных соединений нежелательно резкое изменение растворимости газов.
Растворимость водорода в железе с повышением температуры растет и изменяется скачкообразно в моменты полиморфных превращений.
При переходе железа из твердого состояния в жидкое наблюдается резкое возрастание растворимости водорода, достигающее максимальной величины при температуре ~ 2400 °С.
Таким образом, наиболее значительное насыщение металла водородом происходит в процессе переноса капель.
На стадии охлаждения при резком снижении растворимости Н в Fe происходит выделение избыточного водорода в виде пузырьков газа.
Степень насыщения жидкого металла водородом зависит от наличия в газовой среде элементов, способных связывать водород в химические соединения, нерастворимые в жидком металле,и тем самым снижающие парциальное давление его в газовой среде.
Так, образование в газовой среде соединений ОН и HF, нерастворимых в жидком металле, снижает насыщенность металла водородом. Количество водорода в газовой фазе дуги ограничено: атмосфере водорода мало, а основным источником водорода являются ржавчина, влага и химсоединения во флюсе.
Соединений ОН и HF уходят в атмосферу или в шлак, и не снижают прочности сварного шва.
Находясь в жидком металле, водород взаимодействует с кислородом по уравнениям:
Поэтому наличие в металле кислорода ограничивает концентрацию в нем водорода. На рис. 116 приведены данные о совместном растворении водорода и кислорода в жидком железе. Как видим, даже незначительная окисленность жидкого металла резко снижает содержание в нем водорода.
Насыщение водородом жидкого металла отрицательно сказывается на его свойствах. При достаточно быстром охлаждении металла ванны часть растворенного в ней водорода не успевает выделиться, что ведет к образованию газовых пузырей.
Оставшийся в металле атомарный водород превращается в молекулярный, что ведет к формированию газовой фазы в микротрещинах металла.
В следствие этого парциальное давление молекулярного водорода в зоне микротрещин возрастает, а в близь расположенных участках металла парциальное давление атомарного водорода снижается, что ведет к его притоку за счет диффузии.
Таким образом, происходит накопление водорода в микротрещинах, что является причиной возникновения холодных трещин.
Непрерывно образующийся молекулярный водород создает значительные давления, так как сам он не в состоянии диффундировать через металл и практически нерастворим в нем.
В связи с тем, что давление направлено во все стороны, в металле возникает объемное напряженное состояние, приводящее к снижению пластических свойств его, а иногда — и к хрупкому разрушению.
Следовательно, хотя водород и не образует с металлом шва соединений, отрицательно влияющих на прочность этого металла, он усиливает вредное влияние макро- и микронесплошностей, способствует резкому снижению пластических свойств металла и его хрупкому разрушению.
Взаимодействие металлов с водородом
Изучению взаимодействия водорода с металлами посвящено большое количество исследований как материаловедческого, так и фундаментального плана.
Это вызвано тем, что водород, проникающий в металл во время плавки, разливки и различных химических, электрохимических, газоразрядных и ядерных процессов, является одной из важнейших причин ухудшения эксплуатационных характеристик материала.
Снижение пластических свойств материалов (водородная хрупкость), раковины, пузыри, трещины и другие макроскопические несовершенства структуры способствуют быстрому разрушению изделий, контактирующих с водородом.
Основными проблемами конструкционных и функциональных материалов является механизм проникновения водорода в металл и изменение свойств под действием водорода.
Причиной низкотемпературного наводороживания является катодная поляризация поверхности стального оборудования в электролитических средах. Такая поляризация на практике может иметь место в результате двух принципиально отличающихся процессов: 1) саморастворения (коррозии, химического травления); 2) электрохимической обработки с наложением тока [1].
Наводороживание слагается из этапов адсорбции, абсорбции (растворение) и диффузии водорода. Следовательно, чтобы узнать характер неоднородности, появившейся в результате наводороживания нужно знать закон распределения водорода по объему конструктивного элемента и связь концентрации водорода со степенью изменения механических свойств.
Следуя Б.А.Колачеву, процесс диффузии водорода в металл можно описать следующим образом [2].
При адсорбции молекулы водорода в конечном итоге распадаются на атомы, которые затем диффундируют вглубь металла.
Плотность потока J, то есть количество вещества, диффундирующего в единицу времени через единицу поверхности, перпендикулярной потоку вещества, пропорциональна пространственному коэффициенту концентрации
где D – коэффициент диффузии, C — концентрация водорода.
Для одномерной задачи уравнение переходит в первый закон Фика
Если коэффициент D не зависит от концентрации, то из первого вытекает второй закон Фика в виде
В интегральной форме коэффициент диффузии:
- где — толщина стенки, t- время, — концентрации диффундирующего тела в поверхностных слоях.
- Кроме того, коэффициент диффузии для тонких мембран зависит от толщины сечения, это связано с тем, что при тонких сечениях не выполняется первый закон Фика, так как не достигается независимость концентрации от плотности поляризующего тока.
- Для нахождения закона распределения концентрации водорода и по объему конструктивного элемента в любой момент времени нужно решить уравнение диффузии с начальными и граничными условиями, соответствующими рассматриваемой задачи.
Большой интерес представляют работы Катлинского B.M. [2]. Он провел большую работу по анализу и статистической обработке опубликованных экспериментальных данных для коэффициента диффузии водорода в различных металлах. Причем автор при анализе исключал из рассмотрения резко отклоняющиеся данные и использовал метод наименьших квадратов для нахождения значений D и E в зависимости:
где D0 – предэкспоненциальный множитель, E – энергия активации при диффузии, R – газовая постоянная, T — абсолютная температура.
В таблице 1 приведены эффективные значения D и E.
Таблица 1. Параметры температурной зависимости коэффициента диффузии водорода D.
| Материал | Т, К | D, 10-3 см2/с | Е, кДж/моль |
| Ni | 400-1600 | ||
| 298-1837 | 1.03 0.12 | 11,32,09 | |
| — Fe | 324-1812 |
Гидриды лития помогают изучать свойства металлического водорода • Новости науки
В нормальных условиях водород — газообразный диэлектрик. Согласно теоретическим предсказаниям, сжатый под давлением в 4 млн атмосфер водород должен перейти в металлическое состояние. Большой интерес к проблеме металлического водорода связан прежде всего с вероятным существованием в нём комнатнотемпературной сверхпроводимости. Кроме того, некоторые ученые предполагают, что в определенном интервале температур и напряженностей внешнего магнитного поля водород-металл будет сверхтекучим сверхпроводником — жидкостью с нулевой вязкостью и нулевым сопротивлением. Однако до сих пор подобный переход диэлектрик–металл в водороде не наблюдался, поскольку необходимое для такой трансформации давление находится на пределе экспериментальных возможностей. Американо-российская группа ученых предлагает для изучения экзотических свойств металлического водорода использовать «обогащенные» водородом гидриды лития — LiHn (n = от 2 до 8). Компьютерное моделирование, проведенное исследователями, показало наступление металлической фазы в LiHn при давлении, в 4 раза меньшем, чем требуется для водорода, то есть уже в технологически реализуемых условиях.
В периодической системе химических элементов водород находится в одной группе с щелочными металлами, и казалось бы, должен, как и они, обладать хорошей электропроводностью. Однако в нормальном состоянии (при комнатной температуре и атмосферном давлении) водород — диэлектрик.
По-видимому, это логическое противоречие заставило Юджина Вигнера и Хилларда Хантингтона задаться вопросом, при каких условиях водород будет вести себя как металл. В 1935 году вышла их статья On the Possibility of a Metallic Modification of Hydrogen, в которой высказывалась гипотеза, что в водороде, сжатом до 25 ГПа (250 тыс. атмосфер, см.
таблицу), будет наблюдаться переход диэлектрик–металл, то есть водород станет металлическим. Подчеркнем, что термин «металлический водород» подразумевает не твердое агрегатное состояние, а характер проводимости — низкое электрическое сопротивление.
(Говоря об агрегатных состояниях водорода, на всякий случай напомним, что получить жидкий водород можно, охладив его до 20 К, а понижение температуры еще на 6 К переводит его в твердое состояние.)
Сравнительная таблица величин давлений
| Примеры | Давление (в ГПа) | Давление (в атмосферах) |
| Атмосферное давление на поверхности Земли | 0,0001 | 1 |
| Давление на дне Марианской впадины | 0,109 | 1090 |
| Давление в центре Земли | 330–360 | 3,3–3,6 млн |
| Давление в центре Юпитера | 3000–4500 | 30–45 млн |
Интерес к получению металлического водорода подогрела теоретическая работа советских физиков во главе с Юрием Коганом, появившаяся в начале 70-х годов прошлого века.
В ней доказывалось, что водород–металл — метастабильное вещество: будучи одни раз получен под высоким давлением, после снятия давления он не превратится обратно в диэлектрик, а останется металлом.
Правда, из статьи Юрия Когана и его коллег не было ясно, насколько продолжительным окажется существование металлического водорода.
Дальнейшие теоретические и экспериментальные исследования показали, что оценка Вигнера и Хантингтона оказалась сильно занижена. Согласно современным представлениям, водород должен «металлизироваться» при давлении 400 ГПа (4 млн атмосфер).
Достижимы ли сейчас такие давления? Есть два пути их получения — статическое сжатие с помощью алмазных наковален (подробности см. в обзоре: С. Блок, Г. Пьермарини. Алмазные наковальни открывают новые возможности в физике высоких давлений, PDF, 2,81 Мб // УФН, 1979. Том 127, вып.
4, 705) и импульсное, реализуемое в течение краткого периода с помощью взрывной волны. В первом случае ученые способны «выжать» максимум около 300 ГПа, что недотягивает до теоретических оценок по «металлизации» водорода. Импульсное сжатие производит значительно большее давление, достигающее 1500 ГПа, однако имеет существенные недостатки.
В этом процессе происходит сильный нагрев сжимаемого вещества, что позволяет исследовать объект лишь в его жидком состоянии.
Помимо этого, такие сверхвысокие давления образуются в течение очень ограниченного времени (порядка микросекунды и меньше), поэтому физики-экспериментаторы не всегда успевают зафиксировать в полной мере необходимые для них характеристики изучаемого материала. Разумеется, ученые всеми возможными способами пытаются уменьшить паразитный нагрев в процессе импульсного сжатия и избежать перехода вещества под давлением в жидкость.
Долгое время существенного прогресса в этом направлении не наблюдалось, однако совсем недавно, в 2009 году, сотрудники Ливерморской национальной лаборатории усовершенствовали импульсный способ, научившись получать давление более 1000 ГПа без значительного увеличения температуры — так что вещество остается в кристаллическом (твердом) состоянии. Благодаря этой технологии ученые изучили механические свойства алмаза, сжатого до 1400 ГПа (подробности эксперимента вместе с описанием методики достижения таких давлений без существенного температурного эффекта можно найти в статье Diamond at 800 GPa в журнале Physical Review Letters).
Эксперименты по «металлизации» водорода
Первые намеки на переход диэлектрик–металл в водороде появились в 1969 году.
Группа советских физиков-экспериментаторов, возглавляемых Леонидом Верещагиным из Института физики высоких давлений, при температуре 4,2 К и давлении около 100 ГПа (статический способ) наблюдала скачкообразное уменьшение электрического сопротивления водорода на 6 порядков (в миллион раз). Правда, исходя из этих данных, идентифицировать водород как металл ученые не решились, назвав свою статью Возможность перехода водорода в металлическом состоянии (PDF, 103 Кб).
Из работ, которые близки к нашему времени, стоит упомянуть исследования американских ученых из Ливерморской национальной лаборатории в середине 90-х годов прошлого века. Используя импульсное сжатие (температура составляла около 3000 К), они обнаружили уменьшение сопротивления жидкого водорода в 10 тыс.
раз при увеличении давления от 93 до 140 ГПа. Правда, говорить, что в этом эксперименте наблюдался переход водорода из диэлектрического состояния в металлическое, по-прежнему нельзя: дополнительное исследование внутренней структуры показало, что он так и не стал металлом.
Фактически, всего лишь имела место жидкость с типом проводимости, напоминающим металлическую.
Один из последних значимых экспериментов в этой области был осуществлен в 1998 году. Сжимая статическим образом твердый водород до 342 ГПа (3,42 млн атмосфер), группа ученых из США так и не увидела в нём признаков металлической проводимости. Заметим, что приложенное давление приблизительно было равно давлению в центре Земли (см. таблицу).
Итак, подведем промежуточный итог. Несмотря на локальные достижения, прямых свидетельств «металлизации» водорода нет до сих пор.
Чем интересен металлический водород?
Попытки получения металлического водорода важны не только для фундаментальной науки, но и связаны с потенциальными прикладными аспектами его использования. Особое внимание к металлическому водороду привлекла работа американского физика-теоретика Нэйла Ашкрофта, датируемая 1968 годом.
Отталкиваясь от уже созданной на тот момент теории сверхпроводимости БКШ (Бардина–Купера–Шриффера), он представил расчеты, согласно которым металлический водород оказывается высокотемпературным сверхпроводником.
Причем его критическая температура Tc (температура перехода из нормального состояния в сверхпроводящее) должна быть на уровне комнатной! С учетом предполагаемой метастабильности металлического водорода (см. выше) в нашем распоряжении может оказаться вожделенное вещество с комнатнотемпературной сверхпроводимостью.
Между прочим, последние теоретические работы в этой области лишь укрепляют гипотезу Ашкрофта (см. новость Металлический водород — сверхпроводник с наибольшей критической температурой?, «Элементы», 09.07.2008).
Но это еще не всё. Как оказалось, металлический водород может обладать и другими экзотическими физическими свойствами.
Егор Бабаев, Асле Судбё и тот же Нэйл Ашкрофт в статье A superconductor to superfluid phase transition in liquid metallic hydrogen (доступной также здесь), опубликованной в 2004 году в журнале Nature, обнаружили, что в металлическом водороде в присутствии внешнего магнитного поля возникает уникальный фазовый переход «сверхпроводник — сверхтекучая жидкость». Более того, в определенном интервале температур и напряженности магнитного поля водород представляет собой жидкостью с нулевой вязкостью и одновременно с нулевым сопротивлением — то есть является сверхтекучим сверхпроводником.
В общем, дело осталось за малым — добиться «металлизации» водорода.
Обогащение веществ водородом — путь к его «металлизации»
И вот здесь ученые изобрели обходной путь — для решения проблемы «металлизации» были задействованы соединения, содержащие водород в большом количестве. Первым, кто догадался о таком альтернативном подходе, снова был Нэйл Ашкрофт.
Он предложил использовать гидриды элементов из 4-й группы периодической системы Менделеева — кремния, олова, германия.
По мнению Ашкрофта, силан (SiH4), герман (GeH4) и гидрид олова (SnH4) должны становиться устойчивыми стабильными металлами при давлениях, в несколько раз меньших 400 ГПа, необходимых для получения металлического водорода.
Кроме этого, вышеупомянутые соединения, согласно некоторым расчетам, обязаны быть еще и высокотемпературными сверхпроводниками. Например, гидрид олова, как следует из этой работы, — стабильный металл в интервале давлений от 70 до 160 ГПа, имеющий критическую температуру перехода 80 К при 120 ГПа.
Что касается экспериментов, то не далее как в 2008 году ученые из Германии, Канады и России обнаружили у силана, сжатого приблизительно до 100 ГПа, сверхпроводимость с Tc = 17 К.
Конечно же, SiH4 оказался далеко не комнатным сверхпроводником, да и высокотемпературным его назвать сложно.
Тем не менее данный эксперимент подтвердил гипотезу Ашкрофта о возможности изучения металлического водорода и его высокотемпературной сверхпроводимости с помощью веществ, обогащенных водородом.
Среди исследований подобного рода выделяется свежая теоретическая работа американо-российской команды ученых A little bit of lithium does a lot for hydrogen, опубликованная в журнале Proceedings of the National Academy of Sciences. В числе авторов — всё тот же Нэйл Ашкрофт, а от России — Артём Оганов и Андрей Ляхов.
Авторы статьи, используя компьютерное моделирование, показали, что гидриды лития могут помочь решить проблему «металлизации» водорода. Читателя может смутить множественное число в словосочетании «гидриды лития», так как известно, что литий и водород одновалентны, а значит, и гидрид лития может быть только один — LiH.
На самом деле никаких противоречий нет. Численные расчеты, выполненные учеными, свидетельствуют о существовании еще семи гидридов лития с общей формулой LiHn (n = от 2 до  с металлическим характером их проводимости.
с металлическим характером их проводимости.
В нормальных условиях эти соединения «жить» не могут, однако сверхсильное сжатие делает литиевые гидриды метастабильными, а некоторые из них — даже стабильными веществами. Как утверждают исследователи, чтобы гидриды лития стали устойчивыми или почти устойчивыми металлами, к ним нужно применить давление приблизительно 100 ГПа.
Эта величина, во-первых, в 4 раза меньше, чем та, что требуется для чистого водорода, а во-вторых, что самое главное, находится в диапазоне давлений, спокойно получаемых статическим путем.
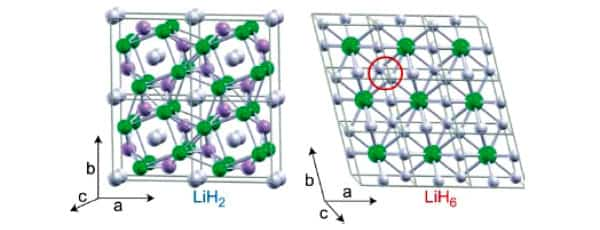
Особое внимание в статье авторы уделяют двум разновидностям гидридов — LiH2 и LiH6. Область их стабильности начинается от 130 и от 140 ГПа соответственно. Кристаллические структуры гидридов лития, находящихся под давлением 150 ГПа, изображены на рис. 1.
В обеих решетках видны «одинокие» атомы (отмечены белым цветом), образующие молекулы водорода. Сжатие этих «одиноких» атомов и порождает металлический водород. Грубо говоря, LiH2 и LiH6 представляют собой как бы сплав двух металлов.
Первый металл состоит из нераздельно связанных между собой атомов лития и водорода, а второй — из молекул H2.
Мы уже неоднократно упоминали о металлическом водороде в контексте высокотемпературной сверхпроводимости.
Возникает вопрос: будет ли сверхпроводящим семейство литиевых гидридов и если да, то какова критическая температура? Авторы статьи сосредоточили свое внимание на LiH6, поскольку это наиболее перспективный высокотемпературный сверхпроводник.
Они вычислили, что температура Дебая этого члена семейства при давлении 100 и 300 ГПа чрезвычайно велика — 4200 и 5165 К соответственно.
Каково значение температуры Дебая для сверхпроводимости? Чтобы это понять, совершим небольшой экскурс в теорию этого явления. На микроскопическом уровне причина сверхпроводимости — объединение всех электронов проводимости вещества в куперовские пары.
Притяжение между электронами возникает за счет взаимодействия между ними и кристаллической решеткой фононов (безмассовых частиц — квантов колебательного движения атомов кристаллической решетки) и носит название электрон-фононного.
«Силу» электрон-фононного притяжения определяют безразмерной величиной — константой электрон-фононного взаимодействия. Обычное кулоновское отталкивание между электронами никуда не делось — просто в сверхпроводнике оно слабее, чем электрон-фононное взаимодействие.
В теории сверхпроводимости кулоновское взаимодействие характеризуется специальной безразмерной константой, именуемой псевдопотенциал Мореля–Андерсона, или кулоновский потенциал.
Именно через псевдопотенциал Мореля–Андерсона — вместе с константой электрон-фононного взаимодействия и температурой Дебая — выражается формула Макмиллана для Tc сверхпроводника, у которого куперовские пары образуются за счет фононов. Чем выше температура Дебая, чем больше константа электрон-фононного взаимодействия и чем меньше потенциал кулоновского отталкивания, тем выше критическая температура вещества
Ученые в обсуждаемой работе говорят об очень сильном электрон-фононном взаимодействии. Наряду с очень высокой дебаевской температурой логично ожидать и высокую Tc. И хотя авторы статьи не приводят значение критической температуры, благодаря формуле Макмиллана можно эту температуру оценить.
Пусть константа электрон-фононного взаимодействия равна 2 (это действительно очень сильное притяжение), а псевдопотенциал Мореля–Андерсона равен типичному значению для металлов, то есть 0,13. Для LiH6, сжатого до 100 и 300 ГПа, получим Tc = 426 и 524 К.
Это более чем на 100 и 200 К выше, чем комнатная температура!
Конечно же, приведенные числа выглядят немного спекулятивно, так как, например, константа электрон-фононного взаимодействия и величина кулоновского потенциала взяты лишь приблизительно.
Однако впервые речь идет о веществах, содержащих водород, как о действительно высокотемпературных сверхпроводниках, чья критическая температура не уступает Tc чистого водорода.
К тому же данная статья также впервые предсказывает «металлизацию» соединений, сильно обогащенных водородом по сравнению с гидридами элементов из 4 группы периодической системы. И, что тоже немаловажно, давления, необходимые для этого, находятся в технологически достижимых пределах.
Источник: Eva Zurek, Roald Hoffmann, N. W. Ashcroft, Artem R. Oganov, Andriy O. Lyakhov. A little bit of lithium does a lot for hydrogen // PNAS. October 20, 2009. V. 106. P. 17640–17643.
Юрий Ерин
Большая Рнциклопедия Нефти Рё Газа
Cтраница 1
Насыщение металла азотом воздуха происходит путем образования нитридов металла и нитридов кислорода, которые растворяются в жидком металле. [1]
Насыщение металлов РІРѕРґРѕСЂРѕРґРѕРј зависит РЅРµ только РѕС‚ скорости диффузии или коэффициента диффузии, РЅРѕ Рё РѕС‚ способности Рє проникновению, зависящей РѕС‚ реакции РЅР° поверхности металла. Проникновение РІРѕРґРѕСЂРѕРґР° РІ металл возможно лишь после диссоциации Рќ2 — Рќ — f — H, которая протекает СЃРѕ значительной энергией активации ( 103 ккал / моль) Рё зависит РѕС‚ температуры Рё давления, Р° ниже 300 РЎ скорость этой реакции крайне мала. Атомарный РІРѕРґРѕСЂРѕРґ РІ дефектах кристаллической решетки металла, РІ порах, РЅР° границах фаз или зерен превращается РІ молекулы, РІ образующихся полостях создается необратимое накопление молекулярного РІРѕРґРѕСЂРѕРґР°, что РїСЂРёРІРѕРґРёС‚ Рє локально высокому давлению. [2]
Насыщение металла водородом повышает пористость наплавленного металла и способствует возникновению в нем значительных внутренних напряжений.
Водород проникает в наплавленный металл из влаги, которая всегда содержится в гигроскопичных электродных обмазках и флюсах, поэтому при употреблении их рекомендуется тщательно просушивать. [3]
Насыщение металла водородом повышает пористость наплавленного металла и способствует возникновению в нем значительных внутренних напряжений.
Водород проникает в наплавленный металл из влаги, которая всегда содержится в гигроскопичных электродных обм-азках и флюсах, поэтому при употреблении их рекомендуется тщательно просушивать. [4]
- Насыщение металла шва кислородом, азотом и водородом в процессе сварки резко снижает пластичность и предел длительной прочности сварных конструкций. [5]
- Насыщение металла сварного соединения водородом способствует образованию трещин, так как отрицательно влияет как на первый, так и на второй фактор. [6]
- Насыщение металла сварного шва кислородом больше, чем при пропан-бутановой и ацетилено-кислородной сварке из-за избыточного кислорода в пламени, который не успевает прореагировать в горящем пламени и частично растворяется в расплавленном металле сварочной ванны. [7]
Предотвратить насыщение металла шва газами невозможно.
Поэтому РІ состав голой легированной проволоки РІРІРѕРґСЏС‚ примеси, которые связывают кислород РІ РІРёРґРµ шлаковых включений, Р° азот — РІ РІРёРґРµ твердого раствора.
К таким примесям относятся титан и алюминий.
Для повышения пластических свойств металла РІ проволоку дополнительно вводятся редкоземельные элементы, повышающие пластичность Рё вязкость стали. Введение редкоземельных элементов повышает РІ 2 — 3 раза ударную вязкость литых конструкционных сталей. [8]
Степень насыщения металла углеродом определяется температурой и длительностью обработки.
Если продлить время обработки металла окисью углерода, то количество углерода, содержащегося в карбиде, увеличивается. При более высоких температурах для реакции требуется меньше времени.
После окончания реакции полученный продукт охлаждают в слабом токе окиси углерода; Продукт имеет серый цвет, на воздухе устойчив. [9]
- Степень насыщения металла углеродом определяется температурой п длительностью обработки. [10]
- �сточником насыщения металла шва водородом является гигроскопическая и кристаллизационная влага, находящаяся в электродных покрытиях и флюсах, влага ржавчины на сварочной проволоке и кромках деталей, влага атмосферного воздуха и свариваемых деталей. [11]
- РџСЂРё насыщении металлов Р±РѕСЂРѕРј применялся состав, содержащий 97 % очищенного аморфного 99 1 % — РЅРѕРіРѕ Р±РѕСЂР° Рё 3 % хлористого аммония РІ качестве активатора диффузии. [12]
РџСЂРё насыщении металлов Рё сплавов углеродом РЅР° РёС… поверхности РїСЂРё определенных условиях образуются химические соединения — металлоподобные карбиды, изменяющие свойства поверхности РІ требуемом направлении. Скорость образования Рё роста карбидных покрытий, Р° также РёС… фазовый состав Рё структура определяются диаграммой состояния металл-углерод, Р° также составом ( активностью) насыщающей среды, температурой Рё временем насыщения, составом Рё структурой насыщенного металла или сплава. [13]
- При насыщении металла азотом образуются нитриды легирующих компонентов, которые сообщают поверхности изделий большую твердость. [14]
- При насыщении металлов элементами газовым или жидким методом применяются галогенидные соли диффундирующего металла. [15]
- Страницы: 1 2 3 4
Влияние водорода на свойства стали
ИСТОЧНИКИ НАВОДОРОЖИВАНИЯ
1. НАВОДОРОЖИВАНИЕ ПРИ МЕТАЛЛУРГИЧЕСКИХ ПРОЦЕССАХ
Процесс выплавки стали всегда сопровождается наводороживанием металла. Водород попадает в металл из шихтовых материалов, печной атмосферы и различных добавок, вводимых в ванну.
Чугун и стальной лом содержат значительное количество водорода, однако его содержание в готовой жидкой стали определяется главным образом технологическими особенностями плавки и почти не зависит от содержания водорода в металлической шихте.
Кислый мартеновский процесс обеспечивает более низкое содержание водорода в готовой жидкой стали, чем основной. По данным литературы концентрация водорода в кислой мартеновской стали обычно находится в пределах 3—5 см3/100 г, а в основной 5—9. см3/100 г.
Это различие объясняется свойствами кислого мартеновского шлака, обладающего жидкотекучестью и газопроницаемостью, причем количество растворенного водорода в таком шлаке ниже, чем в шлаках основного мартеновского процесса, что значительно уменьшает переход водорода из шлака в металл. Кипение в кислых мартеновских печах происходит менее интенсивно, чем в основных, кислый шлак лучше смачивает металл, чем основной; благодаря этому во время кипения металл обнажается меньше, что также затрудняет поглощение водорода из атмосферы печи [83].
В основных электропечах условия для дегазации металла лучше. Однако полная смена шлака и загрузка шлакообразующих материалов на поверхность обнаженного металла во время плавки качественной стали приводит к усвоению влаги жидким металлом, в результате чего содержание водорода в стали повышается и обычно достигает такого же уровня, как у основной мартеновской стали (5—9 см3/100 г).
Во время выпуска плавки из печи содержание водорода в стали обычно понижается, так как смещается равновесие между концентрациями водорода в расплавленном металле и в окружающей среде.
Эффективный метод снижения концентрации водорода в стали — вакуумная обработка жидкой стали в ковше или при переливе из одного ковша в другой, либо в изложницу.
В вакууме выделение растворенных в стали водорода и азота происходит весьма интенсивно благодаря понижению их растворимости.
При вакуумировании струи металла и создании достаточного разрежения можно снизить концентрацию водорода в жидкой стали до 2 см3/100 г.
Количество водорода в стали резко снижается при ее затвердевании. Часть водорода при этом выделяется в виде пузырьков, создавая пористость. Чаще всего это наблюдается в слитках хромистой стали. В отливках пористость может иметь место независимо от состава стали.
- Влияние водорода, содержащегося в жидкой стали, на физические свойства твердой стали невелико.
- В слитках и в прокатанных заготовках перепад концентрации водорода между внутренними и поверхностными зонами заготовки зависит от среднего содержания водорода по всему сечению: большему среднему содержанию отвечает больший градиент концентрации в радиальном направлении.
- По мере переката блюмсов на меньшие профили содержание водорода значительно понижается и в большинстве случаев не превышает 3 см3/100 г, однако после первых перекатов градиент его концентрации увеличивается (сравнительно небольшие потери водорода при значительном уменьшении диаметра), а потом опять снижается в связи с десорбцией водорода.
- Неравномерное распределение водорода по сечению прокатных заготовок нельзя объяснять ни удалением части водорода из поверхностных зон заготовки, ни его перераспределением после кристаллизации слитка [83], ни диффузионными процессами,, протекающими в объеме твердого металла, так как разница температур по сечению слитка очень незначительна и даже длительной термической обработкой равномерное распределение его не достигается.
Сегрегация водорода, очевидно, происходит во время кристаллизации стального слитка из-за различной растворимости его в жидкой и твердой стали.
При этом жидкий металл обогащается водородом и поэтому объемы металла, застывающие последними (осевая и головная части слитка), содержат его больше.
Вместе с тем в процессе кристаллизации одновременно с диффузией водорода в осевую и головную части слитка некоторое количество водорода удаляется в атмосферу и среднее содержание водорода в блюмсах становится ниже его содержания, в жидкой стали во время разливки.
Таким образом содержание водорода в жидкой стали не может однозначно характеризовать среднее содержание водорода в прокатке или поковках, и тем более его содержание в центральных зонах этих изделий. Однако обычно, чем ниже концентрация водорода в жидкой стали, тем ниже его содержание в полученных из этой стали изделиях (поковках, прокате и т. д.).
Для возможно более полного удаления водорода из проката: и поковок применяют специальную термическую обработку — низкий отжиг стали.
Скорость выделения водорода из твердого металла определяется величиной коэффициента диффузии и растворимостью водорода в металле.
Обе эти величины понижаются с температурой, однако, поскольку в аустените растворимость водорода больше, а коэффициент диффузии меньше, чем в продуктах распада аустенита, оптимальной для отжига
Разработка надежного способа отбора проб металла для определения содержания водорода по сечению стальных изделий [83, 71] позволила изучить влияние термической обработки на удаление водорода и перераспределение его в блюмсах различного сечения.
Выявлено, что во время отжига блюмсов при 660—700° С содержание водорода в металле понижается. Количество выделившегося водорода зависит от размера сечения блюмсов и продолжительности отжига.
Начало процесса отжига характеризуется так называемым «инкубационным периодом» (20—30 час), во время которого удаляется только незначительное количество водорода (10—20% от начального содержания), причем характер его распределения по сечению заготовки остается прежним. Только более длительный отжиг (до 60 час.
) резко увеличивает количество удаленного водорода: таким образом может быть удалено до 40% от начального содержания водорода.
При дальнейшем увеличении длительности отжига скорость выделения водорода постепенно уменьшается, так как снижается градиент концентрации водорода по сечению блюмса и в связи с этим уменьшается скорость диффузии. В результате отжига среднее содержание водорода в стали понижается до 2 см3/100 г при довольно равномерном его распределении по сечению заготовки (колебание концентрации не превышает обычно 1 см3/100 г).
2. НАВОДОРОЖИВАНИЕ СТАЛИ В СРЕДАХ, СОДЕРЖАЩИХ ВОДОРОД, ПРИ ВЫСОКИХ ТЕМПЕРАТУРАХ И ДАВЛЕНИЯХ
Высокотемпературное наводороживание стали наблюдается не только в процессе ее выплавки и передела, но и при термической обработке, и даже в процессе эксплуатации стальных деталей, если металл долго находится при повышенных температурах в среде, содержащей водород, особенно если среда имеет повышенное давление.
Проникая в сталь в указанных условиях, водород приводит к снижению ее пластичности и длительной прочности и зачастую к хрупкому разрушению. Значение этой проблемы становится ясным, если вспомнить о необходимости применения стальной аппаратуры при синтезе аммиака, производстве искусственного жидкого топлива и др.
- Процесс наводороживания стали при высоких температурах и давлениях можно подразделить на три этапа: 1) поглощенной сегрегация водорода; 2) обезуглероживание; 3) растрескивание ή разбухание стали.
- Механизм поглощения водорода сталью по сравнению с поглощением водорода чистым железом усложняется наличием углерода стали, взаимодействующего с водородом при достаточно высокой температуре.
- Диссоциированный водород среды, адсорбируясь поверхностью стали, ионизируется и в виде протонов проникает в нагретую углеродистую сталь, диффундируя в глубь ее в основном через кристаллическую решетку феррита (аналогично абсорбции водорода чистым железом), и сегрегируется в коллекторах, расположенных преимущественно у границ зерен. Однако диффузия водорода через кристаллы цементита при повышенных температурах неизбежно ведет к реакции гидрирования цементита
- Fe3C + 4Н+ + 4е — 3Fe + СН4. (1)
- Таким образом первый этап наводороживания (адсорбция) сразу же переходит во второй (обезуглероживание).
- Молекулярный водород, сегрегировавшийся в микропустотах, тоже может принимать участие в реакции гидрирования, но с несколько большей затратой энергии:
- Fe3C + 2Н2 — 3Fe + СН4. (2)
- 3. НАВОДОРОЖИВАНИЕ ПРИ ТЕРМИЧЕСКОЙ ОБРАБОТКЕ
При некоторых условиях наводороживание при термической: обработке может привести к снижению прочности, не восстанавливаемому даже путем отпуска.
Такому наводороживаиию способствуют восстановительная атмосфера, присутствие влаги; (действующей как катализатор), наличие атомарного водорода, возникающего при закалке в воду, а также быстрое охлаждение, препятствующее десорбции водорода, проникшего уже в сталь.
4. НАВОДОРОЖИВАНИЕ ПРИ СВАРКЕ
Еще при освоении электродуговой сварки было замечено, что околошовная зона становится хрупкой и в ней появляются трещины; однако только сравнительно недавно (с 1940 г.) процесс сварки начали исследовать более глубоко. Теперь одной из причин появления околошовных трещин считают наводороживание.
- При дуговой сварке стали возникают условия для наводороживания металла наплавленного шва и основного металла, так как в атмосфере сварочной дуги находится водород, легко диффундирующий в сталь при высокой температуре процесса.
- Источником наводороживания при сварке, как показали эксперименты [275], является гигроскопическая и кристаллизационная влага, содержащаяся в электродных покрытиях и флюсах, а также влага ржавчины на кромках свариваемых поверхностей.
- Для электросварки характерны высокие скорости охлаждения наплавленного металла шва и околошовного материала в связи с наличием больших масс смежного, не нагретого в процессе сварки, металла.
- 5. НАВОДОРОЖИВАНИЕ ПРИ ЭЛЕКТРОЛИТИЧЕСКИХ ПРОЦЕССАХ
Электролитическое наводороживание стали может происходить при действии электролитов на погруженный в них металл как при катодной его поляризации от внешнего источника тока, так и без нее.
Технологическими процессами, в основе которых лежит действие растворов щелочей или кислот на металл, являются обезжиривание, декапирование, травление и гальванопокрытие.
Кроме того, электролитическое наводороживание происходит в производственных условиях при эксплуатации деталей в некоторых коррозионных средах, и особенно при катодной защите.
Обезжиривание обычно проводится ιβ щелочных ваннах часто при катодной поляризации стали от внешнего источника тока. в качестве электролита обычно применяют едкий натр, соду, поташ. Обезжиривание проводится при комнатных температурах или горячими растворами щелочей (70—80° С).
Декапирование — это кратковременное травление стали в слабых растворах серной и соляной кислот. Этот процесс применяют обычно перед гальванопокрытиями.
Травление применяют для изменения вида поверхности металла или для удаления окислов, а также перед пайкой и лужением. Травление проводится в основном в водных растворах серной или соляной кислот, иногда три поляризации стали от внешнего источника тока.
Эти виды технологической обработки металла вызывают выделение ионов водорода на катодных участках металла.
В случае катодной поляризации вся поверхность стали является катодной и подвергается наводороживапию; при отсутствии поляризации от внешнего источника тока, но при наличии водородной деполяризации наводороживание происходит через участки металла, имеющие более положительный электродный потенциал, т. е. через катодные участки поверхности, тогда как анодные участки металла подвергаются растворению.
Водород в металлах | это… Что такое Водород в металлах?
- ВОДОРОД — Н (лат. hydrogenium), самый легкий газообразный химический элемент член IA подгруппы периодической системы элементов, иногда его относят к VIIA подгруппе. В земной атмосфере водород в несвязанном состоянии существует только доли минуты, его… … Энциклопедия Кольера
- Водород — Н (лат. hydrogenium; a. hydrogen; н. Wasserstoff; ф. hydrogene; и. hidrogeno), хим. элемент периодич. системы элементов Mенделеева, к рый относят одновременно к I и VII группам, ат. н. 1, ат. м. 1,0079. Природный B. имеет стабильные… … Геологическая энциклопедия
- Водород — H2 газ без цвета, запаха и вкуса. Молярная масса 2,0157 кг/кмоль, температура плавления 13,95 К, температура кипения 71,07 кг/м3, низшая теплота сгорания 114460 кДж/кг, газовая постоянная 4,124 Дж/(кг*К), стехиометрический коэффициент 34,25 кг… … Энциклопедия техники
- Водород — 1 Водород → Гелий … Википедия
- водород — а; м. Химический элемент (H), лёгкий газ без цвета и запаха, образующий в соединении с кислородом воду. ◁ Водородный, ая, ое. В ые соединения. В ые бактерии. В ая бомба (бомба огромной разрушительной силы, взрывное действие которой основано на… … Энциклопедический словарь
- Водород — (лат. Hydrogenium) Н, химический элемент, первый по порядковому номеру в периодической системе Менделеева; атомная масса 1,00797. При обычных условиях В. газ; не имеет цвета, запаха и вкуса. Историческая справка. В трудах химиков … Большая советская энциклопедия
- водород — водород, H2 — газ без цвета, запаха и вкуса. Молярная масса 2,0157 кг/кмоль, температура плавления 13,95 K, температура кипения 71,07 кг/м3, низшая теплота сгорания 114 460 кДж/кг, газовая постоянная 4,124 Дж/(кг·K), стехиометрический… … Энциклопедия «Авиация»
- водород — водород, H2 — газ без цвета, запаха и вкуса. Молярная масса 2,0157 кг/кмоль, температура плавления 13,95 K, температура кипения 71,07 кг/м3, низшая теплота сгорания 114 460 кДж/кг, газовая постоянная 4,124 Дж/(кг·K), стехиометрический… … Энциклопедия «Авиация»
- Газы в металлах — Газы в металлах. Г. попадают в твердые и жидкие металлы при их выплавке и электролитическом получении, при взаимодействии металлических изделий с атмосферой. Например, при производстве стали из чугуна в мартеновских печах или в конверторах в… … Большая советская энциклопедия
- Металлический водород — Эта статья содержит незавершённый перевод с английского языка. Вы можете помочь проекту, переведя её до конца … Википедия
Водородооборот магния
Многие уверены, что в недалеком будущем мы будем ездить на электромобилях. Однако определенности в том, что будет служить источником энергии в этом автомобиле, пока нет. Да, сегодня в основном это литий-ионный аккумулятор.
Но есть и альтернатива — топливный элемент, работающий на водороде. Как считается, более экологичный вариант. Да и вообще, проект декарбонизации мировой экономики в своей основе имеет водород.
Предполагается, что именно он станет основным источником энергии.
Сегодня в водородные автомобили водород «загружается» в газообразном виде, в баллонах под давлением. И из-за этого проигрывает литий-ионным аккумуляторам, поскольку при том же объеме в баллонах можно сохранить меньше энергии. К тому же баллоны должны выдерживать высокое давление, что усложняет их производство.
Немецкие ученые из Института производственных технологий и передовых материалов им. Фраунгофера (IFAM, Дрезден, ФРГ) представили новый материал на основе магния, который может накапливать энергии в десять раз больше, чем литиевая батарея сопоставимых веса и размеров.
Он также хранит значительно больше энергии, чем в применяемых сегодня баллонах. Этот материал — специальная паста на основе гидрида магния, которая хранит водород при атмосферном давлении.
А его высвобождение и дальнейшее использования в топливном элементе не самая сложная техническая задача: гидрид магния взаимодействует с водой при обычной температуре. На выходе — гидроксид магния и водород.
Между тем российская компания «ХитЛаб» из Ульяновска уже год как поставляет исследователям из IFAM основные компоненты для «прорывного» вида топлива, в частности гидрид магния. Более того, у компании есть собственные подобные разработки, и она вполне могла бы наладить аналогичное производство в России при наличии средств на исследования и развитие.
За экологию
Поиск оптимальных решений для создания безопасного источника энергии идет непрерывно, и предложение использовать водород в виде пасты — одно из них. Новый метод может оказаться инновационным, несмотря на кажущуюся простоту.
По уверениям разработчиков Powerpaste, процесс получения водородной пасты технологически несложный и не очень затратный. Для ее производства сначала магний смешивают с водородом при температуре около 350 °C и давлении, в пять-шесть раз превышающем атмосферное, с образованием гидрида магния.
Сложный эфир и соль металла добавляются для завершения процесса и образования вязкой серой массы, которую можно загружать в картриджи.
Полная версия этого материала доступна только подписчикам
Читать материалы из печатного выпуска журнала в полном объеме могут только те, кто оформил платную подписку на ONLINE-версию журнала.
Подписка за 0₽ в первый бесплатный месяц даёт доступ только к материалам выпусков, выходящих в течение этого месяца. Если вам нужен полный доступ к архиву, подписывайтесь на любой онлайн доступ от 390 рублей.
Подписаться за 390 руб Все материалы номера за 120 руб
Я – подписчик






