- Как рассчитать степень окисления
- Алгоритм действий
- Как узнать степень окисления нескольких элементов
- Как определить высшую и низшую степень окисления
- Как найти степень окисления в органическом соединении
- Графический метод
- Валентность и степень окисления: в чем разница?
- Вопросы для самопроверки
- Степень окисления
- Полезные советы:
- 1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов
- Степень окисления
- Как рассчитать степень окисления элемента в соединении?
- Нахождение степеней окисления элементов в различных соединениях
- Пример 1
- Решение:
- Решение:
- Валентность
- Валентные возможности атома водорода
- Валентные возможности атома углерода
- Валентные возможности атома азота
- Валентные возможности фосфора
- Валентные возможности атома кислорода
- Валентные возможности атома серы
- Таблица степени окисления химических элементов
- Примеры решения задач
Для начала давайте вспомним, как проходят химические связи в молекуле вещества. Взаимодействуя между собой, атомы могут притягивать или отдавать электроны для образования общей электронной пары. Атом с более высокой электроотрицательностью (ЭО) притягивает электроны и приобретает отрицательный заряд, а атом с меньшей ЭО, напротив, отдает электроны и обретает положительный заряд.
Степень окисления — это условный заряд, который предположительно обретет атом после перемещения электронов. Он вычисляется из предположения, что все свободные электроны полностью перемещаются от одного атома к другому и все образованные связи — ионные.
Почему в определении степени окисления мы говорим об условном заряде? Потому что в реальности он может быть другим, а химические связи атома в соединении не обязательно будут ионными. Но мы предполагаем, что все именно так, чтобы немного упростить расчеты. Это помогает в составлении формул и классификаций.
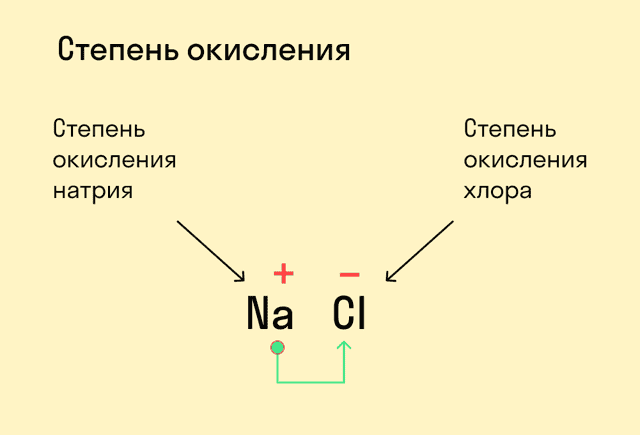
Запомните:
-
Численно степень окисления равна количеству электронов, которые перешли от одного атома к другому.
-
У атома с меньшей ЭО, который отдает электроны, — положительная степень окисления.
-
У атома с большей ЭО, который притягивает электроны, — отрицательная степень окисления.
-
Простые вещества, такие как Cl2, O2 и т. д., имеют степень окисления, равную 0, поскольку смещения электронов в данном случае не происходит.
Как рассчитать степень окисления
Как мы уже выяснили выше, определить степень окисления элемента (иначе говоря, окислительное число) помогает электроотрицательность. Значения ЭО легко узнать, пользуясь таблицей Менделеева или шкалой относительной электроотрицательности. Сравните, у какого химического элемента в соединении ЭО выше — этот элемент будет притягивать электроны и приобретет отрицательный заряд.
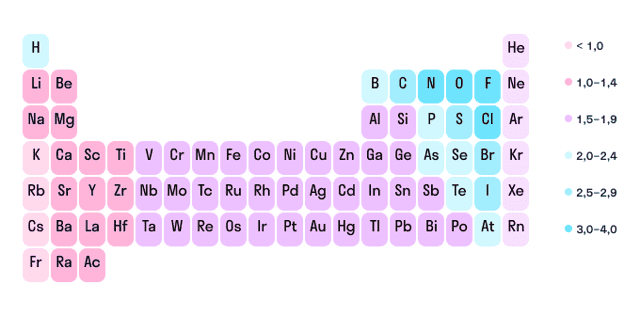
Шкала относительной электроотрицательности
В нейтральной молекуле все окислительные числа в сумме образуют ноль. В ионе их сумма равна заряду иона.
Это правило поможет составить уравнение и посчитать степень окисления любого химического элемента в соединении, если известны данные по остальным элементам. Еще больше облегчат расчеты следующие закономерности:
- у водорода в гидридах окислительное число −1, а во всех остальных веществах оно равно +1;
- у кислорода степень окисления в оксидах равна −2, в пероксидах −1, в соединениях с фтором +2;
- у неметаллов в соединениях с водородом и металлами окислительное число всегда отрицательное;
- у металлов степень окисления всегда положительная.
Также есть элементы, которые во всех соединениях отдают или принимают одинаковое количество электронов, поэтому их окислительное число — постоянная величина.

Алгоритм действий
Итак, мы знаем основные закономерности. Давайте разберемся, как находить степени окисления на примерах. Предлагаем следующий алгоритм действий.
-
Посмотрите, является ли вещество элементарным. Если да — значит, оно находится в химически несвязанном состоянии и окислительное число равно 0. Это правило подходит как для веществ, образованных из отдельных атомов, так и для тех, что включают многоатомные молекулы одного и того же элемента.
-
Пример
Степень окисления Cl2, S8 равна 0.
-
Если это соединение, определите, состоит ли оно из ионов. В многоатомном ионе сумма всех степеней окисления равна его заряду. Узнайте эту сумму из таблицы растворимости и составьте уравнение с известными окислительными числами.
-
Если соединение — нейтральная молекула, составьте уравнение, учитывая, что все окислительные числа в сумме равны 0.
Пример
Допустим, нужно определить заряд азота в ионе аммония.
Согласно таблице растворимости заряд иона аммония NH4+ равен +1. Это значит, что сумма степеней окисления в этом соединении тоже будет равна +1.
Также известно, что водород всюду, кроме гидридов, имеет заряд +1. В данном случае есть 4 атома водорода, т. е. +1 × 4.
Составим формулу: х + (+1) × 4 = +1. Значит х = −3.
Окислительное число азота в ионе аммония равно −3, т. е. N-3H4+1.
Пример
Допустим, нужно определить степень окисления серы в соединении Na2SO4.
Мы знаем, что у щелочного металла Na постоянное окислительное число +1. Кислород, согласно вышеизложенным правилам, в оксидах имеет заряд −2.
Составим уравнение: (+1) × 2 + х + (−2) × 4 = 0. Значит х = −6.
Степень окисления серы равна −6, т. е. Na2+1S-6O4-2.
Как узнать степень окисления нескольких элементов
А как быть, если неизвестны окислительные числа двух и более элементов в соединении? В математике уравнения с двумя неизвестными не всегда имеют решение. Но в химии есть выход: можно разделить химическую формулу на несколько частей, которые имеют постоянные заряды.
Пример
Как вычислить степень окисления в сложном веществе (NH4)2SO4? Посмотрим на него как на соединение двух ионов с известными зарядами: NH4+ и SO42-.
Поскольку мы знаем окислительные числа водорода и кислорода, найти заряды азота и серы в каждом ионе не составит труда.
В ионе NH4+ формула для определения заряда азота будет следующей: х + (+1) × 4 = 1. Понятно, что х = −3, т. е. степень окисления азота −3.
В ионе SO42- формула для серы х + (−2) × 4 = −2. Следовательно, х = 6, т. е. заряд серы равен +6.
Получаем следующие окислительные числа: (N-3H4+1)2S+6O4-2.
Как определить высшую и низшую степень окисления
Выделяют высшую (или максимально положительную) и низшую (максимально отрицательную) степени окисления. В диапазоне между ними располагаются окислительные числа, которые могут принадлежать данному химическому элементу в различных соединениях. Для четных групп характерны четные числа в диапазоне, а для нечетных групп — нечетные.
- Высшая степень окисления совпадает с номером группы элемента (для элементов в главной подгруппе) в короткой форме периодической системы.
- Низшая степень окисления равна числу, которое получится, если от номера группы элемента отнять 8.
- Исключения: фтор, железо, кобальт, родий, подгруппа никеля, кислород, благородные газы (помимо ксенона).
- Проиллюстрируем на примере, как найти высшую и низшую степень окисления.
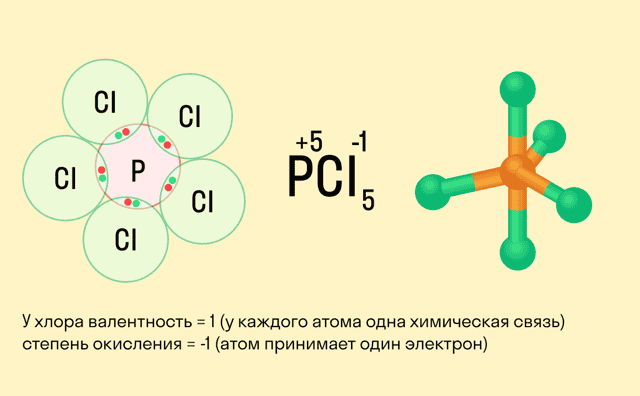
Хлор (Cl), согласно короткой периодической таблице, принадлежит к группе VII. Значит, его максимальное окислительное число будет +7. Такой условный заряд элемент приобретает в оксиде хлора Cl2O7 и хлорной кислоте HClO4. Минимальное число получаем следующим образом: 7 − 8 = −1 (характерно для хлороводорода HCl).
Картинка
По степени окисления можно понять, как поведет себя вещество в окислительно-восстановительных реакциях. Если в соединении главный действующий элемент имеет высшую степень окисления, оно является окислителем, а если он имеет низшую степень окисления — восстановителем.
Например, серная кислота является окислителем, поскольку у серы в данном случае заряд +6. А вот в сернистой кислоте у серы заряд всего +4, поэтому она может проявлять и окислительную способность, и восстановительную. В сероводороде заряд серы равен −2, и это минимальная степень окисления, а значит, данное вещество — восстановитель.
Как найти степень окисления в органическом соединении
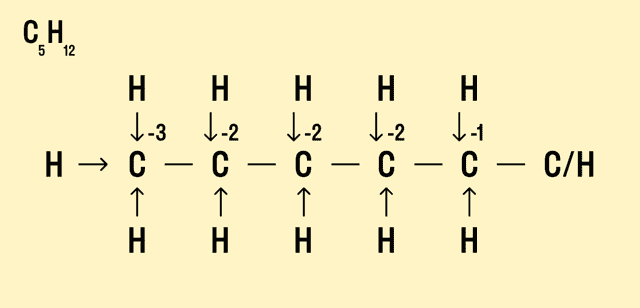
В органической химии определять окислительные числа элементов немного сложнее, поскольку все органические вещества включают углерод, известный большим количеством неполярных связей. Если у нас всего один атом углерода, можно использовать стандартный способ.
- Пример
- Рассчитайте степень окисления углерода в метаноле H3C−OH.
- Мы знаем, что водород Н имеет окислительное число +1, а у кислорода в данном случае оно равно −2. Составим уравнение:
- х + (+1) × 4 + (+2) × 1 = 0
- х + 4 − 2 = 0
- х = −2
Заряд углерода равен −2, т. е. C-2H4+1O-2.
Но что делать, если атомов углерода больше? Придется анализировать структурную формулу, чтобы понять, какие химические связи есть между элементами и сколько электронов они теряют/приобретают в результате. Такой вариант нахождения окислительного числа называют графическим.
Графический метод
-
Нарисуйте структурную формулу соединения.
-
Изобразите стрелками химические связи и смещение атомов (все связи между атомами углерода С−С считайте неполярными).
-
Посчитайте, сколько стрелок ведет к атому (это «−») и сколько от него (это «+»), а затем суммируйте «+» и «−», чтобы узнать степень окисления.
- валентность не имеет знака, в то время как у окислительного числа он есть («+» или «−»);
- валентность равна нулю только в том случае, если атом не имеет связей с другими частицами, а степень окисления может быть равна нулю и при наличии таких связей;
- вычисляя степень окисления, мы предполагаем, что в соединении ионные связи, хотя на самым деле это может быть не так, а валентность всегда имеет реальный смысл.
-
Почему степень окисления называют формальным зарядом, условным?
-
Что отражает численная величина степени окисления?
-
Чему равна сумма всех окислительных чисел в ионе?
-
Как определить низшую степень окисления?
-
Как найти две неизвестных степени окисления в одном веществе?
-
Как определять степени окисления в органических веществах?
Валентность и степень окисления: в чем разница?
Школьники, которые только начали изучать данные разделы химии, нередко путают степень окисления и валентность. Численно эти показатели могут совпадать (но далеко не всегда), а вот по смыслу они в корне различаются.
Валентность показывает, какое количество связей способен образовать один атом, а степень окисления — сколько электронов перемещается в результате этих связей.
Между этими двумя понятиями есть следующие отличия:
Поэтому отождествлять эти два понятия ни в коем случае не стоит. Более того, не нужно ориентироваться на валентность, пытаясь определить окислительное число.
Вопросы для самопроверки
Степень окисления
Темы кодификатора ЕГЭ: Электроотрицательность. Степень окисления и валентность химических элементов.
Когда атомы взаимодействуют и образуют химическую связь, электроны между ними в большинстве случаев распределяются неравномерно, поскольку свойства атомов различаются. Более электроотрицательный атом сильнее притягивает к себе электронную плотность.
Атом, который притянул к себе электронную плотность, приобретает частичный отрицательный заряд δ—, его «партнер» — частичный положительный заряд δ+. Если разность электроотрицательностей атомов, образующих связь, не превышает 1,7, мы называем связь ковалентной полярной.
Если разность электроотрицательностей, образующих химическую связь, превышает 1,7, то такую связь мы называем ионной.
Степень окисления – это вспомогательный условный заряд атома элемента в соединении, вычисленный из предположения, что все соединения состоят из ионов (все полярные связи – ионные).
Что значит «условный заряд»? Мы просто-напросто договариваемся, что немного упростим ситуацию: будем считать любые полярные связи полностью ионными, и будем считать, что электрон полностью уходит или приходит от одного атома к другому, даже если на самом деле это не так. А уходит условно электрон от менее электроотрицательного атома к более электроотрицательному.
Например, в связи H-Cl мы считаем, что водород условно «отдал» электрон, и его заряд стал +1, а хлор «принял» электрон, и его заряд стал -1. На самом деле таких полных зарядов на этих атомах нет.
Наверняка, у вас возник вопрос — зачем же придумывать то, чего нет? Это не коварный замысел химиков, все просто: такая модель очень удобна.
Представления о степени окисления элементов полезны при составлении классификации химических веществ, описании их свойств, составлении формул соединений и номенклатуры.
Особенно часто степени окисления используются при работе с окислительно-восстановительными реакциями.
- Степени окисления бывают высшие, низшие и промежуточные.
- Высшая степень окисления равна номеру группы со знаком «плюс».
- Низшая определяется, как номер группы минус 8.
- И промежуточная степень окисления — это почти любое целое число в интервале от низшей степени окисления до высшей.
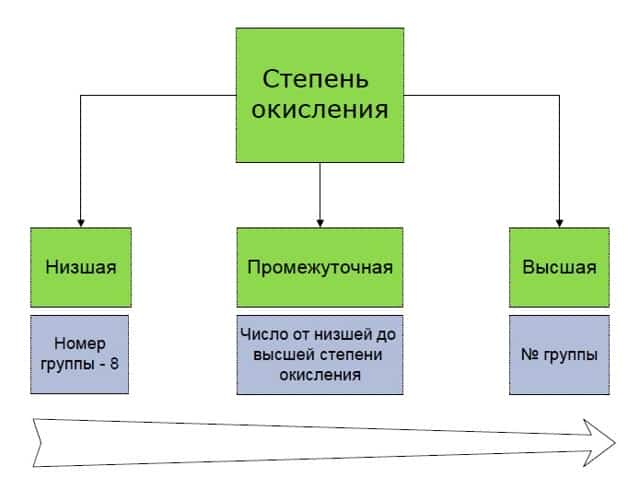
Например, для азота характерны: высшая степень окисления +5, низшая 5 — 8 = -3, а промежуточные степени окисления от -3 до +5. Например, в гидразине N2H4 степень окисления азота промежуточная, -2.
Чаще всего степень окисления атомов в сложных веществах обозначается сначала знаком, потом цифрой, например +1, +2, -2 и т.д. Когда речь идет о заряде иона (предположим, что ион реально существует в соединении), то сначала указывают цифру, потом знак. Например: Ca2+, CO3 2-.
Для нахождения степеней окисления используют следующие правила:
- Степень окисления атомов в простых веществах равна нулю;
- В нейтральных молекулах алгебраическая сумма степеней окисления равна нулю, для ионов эта сумма равна заряду иона;
- Степень окисления щелочных металлов (элементы I группы главной подгруппы) в соединениях равна +1, степень окисления щелочноземельных металлов (элементы II группы главной подгруппы) в соединениях равна +2; степень окисления алюминия в соединениях равна +3;
- Степень окисления водорода в соединениях с металлами (солеобразные гидриды — NaH, CaH2 и др.) равна -1; в соединениях с неметаллами (летучие водородные соединения) +1;
- Степень окисления кислорода равна -2. Исключение составляют пероксиды – соединения, содержащие группу –О-О-, где степень окисления кислорода равна -1, и некоторые другие соединения (супероксиды, озониды, фториды кислорода OF2 и др.);
- Степень окисления фтора во всех сложных веществах равна -1.
Выше перечислены ситуации, когда степень окисления мы считаем постоянной. У всех остальных химических элементов степень окисления — переменная, и зависит от порядка и типа атомов в соединении.
Примеры:
Задание: определите степени окисления элементов в молекуле дихромата калия: K2Cr2O7.
Решение: степень окисления калия равна +1, степень окисления хрома обозначим, как х, степень окисления кислорода -2. Сумма всех степеней окисления всех атомов в молекуле равна 0. Получаем уравнение: +1*2+2*х-2*7=0. Решаем его, получаем степень окисления хрома +6.
В бинарных соединениях более электроотрицательный элемент характеризуется отрицательной степенью окисления, менее электроотрицательный – положительной.
Обратите внимание, что понятие степени окисления – очень условно! Степень окисления не показывает реальный заряд атома и не имеет реального физического смысла. Это упрощенная модель, которая эффективно работает, когда нам необходимо, например, уравнять коэффициенты в уравнении химической реакции, или для алгоритмизации классификации веществ.
Степень окисления – это не валентность! Степень окисления и валентность во многих случаях не совпадают. Например, валентность водорода в простом веществе Н2 равна I, а степень окисления, согласно правилу 1, равна 0.
Это базовые правила, которые помогут Вам определить степень окисления атомов в соединениях в большинстве случаев.
В некоторых ситуациях вы можете столкнуться с трудностями при определении степени окисления атома. Рассмотрим некоторые из этих ситуаций, и разберем способы их разрешения:
- В двойных (солеобразных) оксидах степень у атома, как правило, две степени окисления. Например, в железной окалине Fe3O4 у железа две степени окисления: +2 и +3. Какую из них указывать? Обе. Для упрощения можно представить это соединение, как соль: Fe(FeO2)2. При этом кислотный остаток образует атом со степенью окисления +3. Либо двойной оксид можно представить так: FeO*Fe2O3.
- В пероксосоединениях степень окисления атомов кислорода, соединенных ковалентными неполярными связями, как правило, изменяется. Например, в пероксиде водорода Н2О2, и пероксидах щелочных металлов степень окисления кислорода -1, т.к. одна из связей – ковалентная неполярная (Н-О-О-Н). Другой пример – пероксомоносерная кислота (кислота Каро) H2SO5 (см. рис.) содержит в составе два атома кислорода со степенью окисления -1, остальные атомы со степенью окисления -2, поэтому более понятной будет такая запись: H2SO3(O2). Известны также пероксосоединения хрома – например, пероксид хрома (VI) CrO(O2)2 или CrO5, и многие другие.
- Еще один пример соединений с неоднозначной степенью окисления – супероксиды (NaO2) и солеобразные озониды KO3. В этом случае уместнее говорить о молекулярном ионе O2 с зарядом -1 и и O3 с зарядом -1. Строение таких частиц описывается некоторыми моделями, которые в российской учебной программе проходят на первых курсах химических ВУЗов: МО ЛКАО, метод наложения валентных схем и др.
- В органических соединениях понятие степени окисления не очень удобно использовать, т.к. между атомами углерода существует большое число ковалентных неполярных связей. Тем не менее, если нарисовать структурную формулу молекулы, то степень окисления каждого атома также можно определить по типу и количеству атомов, с которыми данный атом непосредственно связан. Например, у первичных атомов углерода в углеводородах степень окисления равна -3, у вторичных -2, у третичных атомов -1, у четвертичных — 0.
Потренируемся определять степень окисления атомов в органических соединениях. Для этого необходимо нарисовать полную структурную формулу атома, и выделить атом углерода с его ближайшим окружением — атомами, с которыми он непосредственно соединен.
Полезные советы:
- Для упрощения расчетов можно использовать таблицу растворимости – там указаны заряды наиболее распространенных ионов. На большинстве российских экзаменов по химии (ЕГЭ, ГИА, ДВИ) использование таблицы растворимости разрешено. Это готовая шпаргалка, которая во многих случаях позволяет значительно сэкономить время.
- При расчете степени окисления элементов в сложных веществах сначала указываем степени окисления элементов, которые мы точно знаем (элементы с постоянной степенью окисления), а степень окисления элементов с переменной степенью окисления обозначаем, как х. Сумма всех зарядов всех частиц равна нулю в молекуле или равна заряду иона в ионе. Из этих данных легко составить и решить уравнение.
Тренировочный тест по теме «Степени окисления и валентность» 10 вопросов, при каждом прохождении новые.
1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
- График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
- При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
- Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т.е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Как рассчитать степень окисления элемента в соединении?
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
| Щелочные металлы, т.е. все металлы IA группы — Li, Na, K, Rb, Cs, Fr | +1 |
| Все элементы II группы, кроме ртути: Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd | +2 |
| Алюминий Al | +3 |
| Фтор F | -1 |
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
| Кислород | VI | +2 (в OF2) |
| Фтор | VII | |
| Медь | I | +2 |
| Железо | VIII | +6 (например K2FeO4) |
- 6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
- низшая степень окисления неметалла = №группы − 8
- Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Нахождение степеней окисления элементов в различных соединениях
Пример 1
Определите степени окисления всех элементов в серной кислоте.
Решение:
- Запишем формулу серной кислоты:
- Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
- Степень окисления кислорода во всех сложных веществах равна -2 (кроме пероксидов и фторида кислорода OF2). Расставим известные степени окисления:
- Обозначим степень окисления серы как x:
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т.к. сумма степеней окисления всех атомов в молекуле равна нулю.
Схематически это можно изобразить следующим образом:
Т.е. мы получили следующее уравнение:
Решим его:
- Таким образом, степень окисления серы в серной кислоте равна +6.
- Пример 2
- Определите степень окисления всех элементов в дихромате аммония.
Решение:
Запишем формулу дихромата аммония:
Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:
Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Обратим внимание на то, что указанное вещество относится к классу солей и, соответственно, имеет ионное строение.
Тогда справедливо можно сказать, что в состав дихромата аммония входят катионы NH4+ (заряд данного катиона можно посмотреть в таблице растворимости).
Следовательно, так как в формульной единице дихромата аммония два положительных однозарядных катиона NH4+ , заряд дихромат-иона равен -2, поскольку вещество в целом электронейтрально. Т.е. вещество образовано катионами NH4+ и анионами Cr2O72-.
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x и y соответственно, мы можем записать:
Т.е. мы получаем два независимых уравнения:
- Решая которые, находим x и y:
- Таким образом, в дихромате аммония степени окисления азота -3, водорода +1, хрома +6, а кислорода -2.
- Как определять степени окисления элементов в органических веществах можно почитать здесь.
Валентность
Валентность — число химических связей, которые образует атом элемента в химическом соединении.
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
- Валентные возможности атома зависят от количества:
- 1) неспаренных электронов
- 2) неподеленных электронных пар на орбиталях валентных уровней
- 3) пустых электронных орбиталей валентного уровня
Валентные возможности атома водорода
Изобразим электронно-графическую формулу атома водорода:
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня.
Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е.
атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных ( ) орбиталей валентного уровня.
Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму.
Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
- Резюмируя информацию по валентным возможностям атома углерода:
- 1) Для углерода возможны валентности II, III, IV
- 2) Наиболее распространенная валентность углерода в соединениях IV
- 3) В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH3), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар.
Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор( ) предоставляет ее другому атому с вакантной ( ) орбиталью валентного уровня (акцептору). Т.е.
для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии.
Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей.
Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Пунктирной линией на иллюстрации изображена так называемая делокализованная π-связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O3, бензола C6H6 и т.д.
- em>Резюмируя информацию по валентным возможностям атома азота:
- 1) Для азота возможны валентности I, II, III и IV
- 2) Валентности V у азота не бывает!
3) В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления +5 (!).
4) В соединениях, в которых атом азота четырехвалентен, одна из ковалентных связей образована по донорно-акцепторному механизму (соли аммония NH4+, азотная кислота и д.р).
Валентные возможности фосфора
- Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:
- Как мы видим, строение внешнего слоя у атома фосфора в основном состоянии и атома азота одинаково, в связи с чем логично ожидать для атома фосфора так же, как и для атома азота, возможных валентностей, равных I, II, III и IV, что и наблюдается на практике.
- Однако в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне еще и d-подуровень с 5-ю вакантными орбиталями.
- В связи с этим он способен переходить в возбужденное состояние, распаривая электроны 3s-орбитали:
Таким образом, недоступная для азота валентность V для атома фосфора возможна. Так, например, валентность, равную пяти, атом фосфора имеет в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т.д.
Валентные возможности атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:
Мы видим на 2-м уровне два неспаренных электрона, в связи с чем для кислорода возможна валентность II. Следует отметить, что данная валентность атома кислорода наблюдается практически во всех соединениях.
Выше при рассмотрении валентных возможностей атома углерода мы обсудили образование молекулы угарного газа.
Связь в молекуле CO тройная, следовательно, кислород там трехвалентен (кислород — донор электронной пары).
Из-за того что атом кислорода не имеет на внешнем уровне d-подуровня, распаривание электронов s и p-орбиталей невозможно, из-за чего валентные возможности атома кислорода ограничены по сравнению с другими элементами его подгруппы, например, серой.
Таким образом, кислород практически всегда имеет валентность, равную II, однако в некоторых частицах он трехвалентен, в частности, в молекуле угарного газа C≡O. В случае, когда кислород имеет валентность III, одна из ковалентных связей образована по донорно-акцепторному механизму.
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:
У атома серы, как и у атома кислорода, в обычном состоянии два неспаренных электрона, поэтому мы можем сделать вывод о том, что для серы возможна валентность, равная двум. И действительно, валентность II сера имеет, например, в молекуле сероводорода H2S.
Как мы видим, у атома серы на внешнем уровне появляется d-подуровень с вакантными орбиталями. По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p-подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
В таком состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявления атомами серы валентности, равной IV. Действительно, валентность IV сера имеет в молекулах SO2, SF4, SOCl2 и т.д.
При распаривании второй неподеленной электронной пары, расположенной на 3s-подуровне, внешний энергетический уровень приобретает конфигурацию:
В таком состоянии уже становится возможным проявление валентности VI. Примером соединений с VI-валентной серой являются SO3, H2SO4, SO2Cl2 и т.д.
Аналогично можно рассмотреть валентные возможности остальных химических элементов.
Таблица степени окисления химических элементов
Она принимает как положительные, так и отрицательные значения. Чтобы указать степень окисления элемента в соединении нужно поставить сверху над его символом арабскую цифру с соответствующим знаком («+» или «-»).
Следует помнить, что степень окисления — величина, не имеющая физического смысла, так как не отражает реальный заряд атома. Однако это понятие весьма широко используется в химии.
Максимальную положительную и минимальную отрицательную степень окисления можно определить с помощью Периодической таблицы Д.И. Менделеева. Они равны номеру группы, в которой расположен элемент, и разнице между значением «высшей» степени окисления и числом 8, соответственно.
- Если рассматривать химические соединения более конкретно, то в веществах с неполярными связями степень окисления элементов равна нулю (N2, H2, Cl2).
- Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
- В простых ионных соединениях степень окисления входящих в них элементов равна электрическому заряду, поскольку при образовании этих соединений происходит практически полный переход электронов от одного атома к другому: Na+1I-1, Mg+2Cl-12, Al+3F-13, Zr+4Br-14.
При определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значениях их электроотрицательностей. Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Существуют элементы, для которых характерно только одно значение степени окисления (фтор, металлы IA и IIA групп и т.д.). Фтор, характеризующийся наибольшим значением электроотрицательности, в соединениях всегда имеет постоянную отрицательную степень окисления (-1).
Щелочные и щелочноземельные элементы, для которых свойственно относительно невысокое значение электроотрицательности, всегда имеют положительную степень окисления, равную соответственно (+1) и (+2).
Однако, имеются и такие химические элементы, для которых характерны несколько значений степени окисления (сера – (-2), 0, (+2), (+4), (+6) и др.).
Для того, чтобы легче было запомнить сколько и какие степени окисления характерны для конкретного химического элемента используют таблицы степеней окисления химических элементов, которые выглядят следующим образом:
| Порядковый номер | Русское / англ. название | Химический символ | Степень окисления |
| 1 | Водород / Hydrogen | H | (+1), (-1) |
| 2 | Гелий / Helium | He | 0 |
| 3 | Литий / Lithium | Li | (+1) |
| 4 | Бериллий / Beryllium | Be | (+2) |
| 5 | Бор / Boron | B | (-1), 0, (+1), (+2), (+3) |
| 6 | Углерод / Carbon | C | (-4), (-3), (-2), (-1), 0, (+2), (+4) |
| 7 | Азот / Nitrogen | N | (-3), (-2), (-1), 0, (+1), (+2), (+3), (+4), (+5) |
| 8 | Кислород / Oxygen | O | (-2), (-1), 0, (+1), (+2) |
| 9 | Фтор / Fluorine | F | (-1) |
| 10 | Неон / Neon | Ne | 0 |
| 11 | Натрий / Sodium | Na | (+1) |
| 12 | Магний / Magnesium | Mg | (+2) |
| 13 | Алюминий / Aluminum | Al | (+3) |
| 14 | Кремний / Silicon | Si | (-4), 0, (+2), (+4) |
| 15 | Фосфор / Phosphorus | P | (-3), 0, (+3), (+5) |
| 16 | Сера / Sulfur | S | (-2), 0, (+4), (+6) |
| 17 | Хлор / Chlorine | Cl | (-1), 0, (+1), (+3), (+5), (+7), редко (+2) и (+4) |
| 18 | Аргон / Argon | Ar | 0 |
| 19 | Калий / Potassium | K | (+1) |
| 20 | Кальций / Calcium | Ca | (+2) |
| 21 | Скандий / Scandium | Sc | (+3) |
| 22 | Титан / Titanium | Ti | (+2), (+3), (+4) |
| 23 | Ванадий / Vanadium | V | (+2), (+3), (+4), (+5) |
| 24 | Хром / Chromium | Cr | (+2), (+3), (+6) |
| 25 | Марганец / Manganese | Mn | (+2), (+3), (+4), (+6), (+7) |
| 26 | Железо / Iron | Fe | (+2), (+3), редко (+4) и (+6) |
| 27 | Кобальт / Cobalt | Co | (+2), (+3), редко (+4) |
| 28 | Никель / Nickel | Ni | (+2), редко (+1), (+3) и (+4) |
| 29 | Медь / Copper | Cu | +1, +2, редко (+3) |
| 30 | Цинк / Zinc | Zn | (+2) |
| 31 | Галлий / Gallium | Ga | (+3), редко (+2) |
| 32 | Германий / Germanium | Ge | (-4), (+2), (+4) |
| 33 | Мышьяк / Arsenic | As | (-3), (+3), (+5), редко (+2) |
| 34 | Селен / Selenium | Se | (-2), (+4), (+6), редко (+2) |
| 35 | Бром / Bromine | Br | (-1), (+1), (+5), редко (+3), (+4) |
| 36 | Криптон / Krypton | Kr | |
| 37 | Рубидий / Rubidium | Rb | (+1) |
| 38 | Стронций / Strontium | Sr | (+2) |
| 39 | Иттрий / Yttrium | Y | (+3) |
| 40 | Цирконий / Zirconium | Zr | (+4), редко (+2) и (+3) |
| 41 | Ниобий / Niobium | Nb | (+3), (+5), редко (+2) и (+4) |
| 42 | Молибден / Molybdenum | Mo | (+3), (+6), редко (+2), (+3) и (+5) |
| 43 | Технеций / Technetium | Tc | (+6) |
| 44 | Рутений / Ruthenium | Ru | (+3), (+4), (+8), редко (+2), (+6) и (+7) |
| 45 | Родий / Rhodium | Rh | (+4), редко (+2), (+3) и (+6) |
| 46 | Палладий / Palladium | Pd | (+2), (+4), редко (+6) |
| 47 | Серебро / Silver | Ag | (+1), редко (+2) и (+3) |
| 48 | Кадмий / Cadmium | Cd | (+2), редко (+1) |
| 49 | Индий / Indium | In | (+3), редко (+1) и (+2) |
| 50 | Олово / Tin | Sn | (+2), (+4) |
| 51 | Сурьма / Antimony | Sb | (-3), (+3), (+5), редко (+4) |
| 52 | Теллур / Tellurium | Te | (-2), (+4), (+6), редко (+2) |
| 53 | Иод / Iodine | I | (-1), (+1), (+5), (+7), редко (+3), (+4) |
| 54 | Ксенон / Xenon | Xe | |
| 55 | Цезий / Cesium | Cs | (+1) |
| 56 | Барий / Barium | BA | (+2) |
| 57 | Лантан / Lanthanum | La | (+3) |
| 58 | Церий / Cerium | Ce | (+3), (+4) |
| 59 | Празеодим / Praseodymium | Pr | (+3) |
| 60 | Неодим / Neodymium | Nd | (+3), (+4) |
| 61 | Прометий / Promethium | Pm | (+3) |
| 62 | Самарий / Samarium | Sm | (+3), редко (+2) |
| 63 | Европий / Europium | Eu | (+3), редко (+2) |
| 64 | Гадолиний / Gadolinium | Gd | (+3) |
| 65 | Тербий / Terbium | Tb | (+3), (+4) |
| 66 | Диспрозий / Dysprosium | Dy | (+3) |
| 67 | Гольмий / Holmium | Ho | (+3) |
| 68 | Эрбий / Erbium | Er | (+3) |
| 69 | Тулий / Thulium | Tm | (+3), редко (+2) |
| 70 | Иттербий / Ytterbium | Ib | (+3), редко (+2) |
| 71 | Лютеций / Lutetium | Lu | (+3) |
| 72 | Гафний / Hafnium | Hf | (+4) |
| 73 | Тантал / Tantalum | Ta | (+5), редко (+3), (+4) |
| 74 | Вольфрам / Tungsten | W | (+6), редко (+2), (+3), (+4) и (+5) |
| 75 | Рений / Rhenium | Re | (+2), (+4), (+6), (+7), редко (-1), (+1), (+3), (+5) |
| 76 | Осмий / Osmium | Os | (+3), (+4), (+6), (+8), редко (+2) |
| 77 | Иридий / Iridium | Ir | (+3), (+4), (+6), редко (+1) и (+2) |
| 78 | Платина / Platinum | Pt | (+2), (+4), (+6), редко (+1) и (+3) |
| 79 | Золото / Gold | Au | (+1), (+3), редко (+2) |
| 80 | Ртуть / Mercury | Hg | (+1), (+2) |
| 81 | Талий / Thallium | Tl | (+1), (+3), редко (+2) |
| 82 | Свинец / Lead | Pb | (+2), (+4) |
| 83 | Висмут / Bismuth | Bi | (+3), редко (+3), (+2), (+4) и (+5) |
| 84 | Полоний / Polonium | Po | (+2), (+4), редко (-2) и (+6) |
| 85 | Астат / Astatine | At | — |
| 86 | Радон / Radon | Ra | |
| 87 | Франций / Francium | Fr | — |
| 88 | Радий / Radium | Ra | (+2) |
| 89 | Актиний / Actinium | Ac | (+3) |
| 90 | Торий / Thorium | Th | (+4) |
| 91 | Проактиний / Protactinium | Pa | (+5) |
| 92 | Уран / Uranium | U | (+3), (+4), (+6), редко (+2) и (+5) |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |