- Ионы – это заряженные атомы и атомные группы. Понятие об ионных реакциях и заряде ионов :
- Номенклатура и классификация ионов
- Механизм образования ионов
- Ионы в физике и химии
- Ионные реакции в растворе
- Резюме
- Урок 6. Простые ионы – HIMI4KA
- Ионная химическая связь
- Положительные и отрицательные ионы
- Степень окисления веществ
- Валентность химических элементов
- Название ионов
- Электрический ток в металлах | 8 класс | Физика
- Содержание
- Строение металлов
- Ток в металлах
- Доказательные опыты
- Скорость распространения электрического поля и тока в металлах
- Скорость движения электронов в металлах
- Металлы
- Примеры ионов с положительным и отрицательным зарядом — Толковый Словарь — 2022
- Видео: Примеры ионов с положительным и отрицательным зарядом
- Примеры положительных ионов
- Примеры отрицательных ионов
- Многоатомные катионы и анионы
- Многоатомные катионы
- Многоатомные анионы
- Ионные соединения
- Ионы
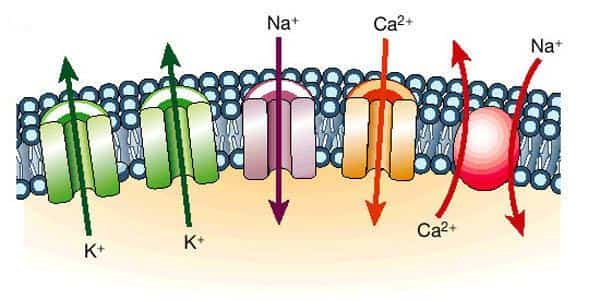
Электрический ток в металлах обуславливается упорядоченным движением свободных электронов (электронов проводимости). Положительно заряженные ионы не принимают участия в переносе заряда.
Электронную природу носителей тока в металлах объясняют таким образом:
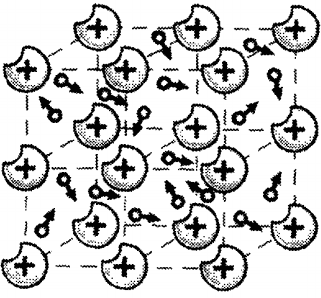
Кристаллическая решетка металла состоит из положительных ионов, которые расположены в узлах решетки, и электронов, которые свободно передвигаются между узлами. Эти электроны — являются валентными электронами атомов металла, которое оставили свои атомы.
Свободные электроны беспорядочно двигаются по кристаллу, «не помня» уже, какому атому они принадлежали. Их также называют электронным газом.
Естественно, при этом сумма положительных зарядов ионов решетки равняется суммарному отрицательному заряду свободных электронов, значит, металл остается незаряженным, или электронейтральным.
Не думайте, что под действием электрического тока все электроны в проводнике направляются в одном направлении. У них просто появляется преимущественное направление движения (вдоль поля), накладывающееся на хаотическое движение в отсутствие поля.
Причем средняя скорость движения электронов составляет несколько миллиметров в секунду. Однако скорость распространения самого электрического поля — окло 3 · 108 м/с. С такой же скоростью распространяется электрический ток.
Здесь можно провести аналогию электрического тока с течением воды в водопроводе, а распространение электрического поля — с распространением давления воды.
Вода в кране находится под давлением всего столба воды в водонапорной башне. Но из крана течет та вода, которая в нем была, а вода из башни дойдет до крана гораздо позднее, т. к.
движение воды происходит с гораздо меньшей скоростью, чем распространение давления.
Существование свободных электронов в металлах доказано опытнм путем Л. И. Мандельштама и Н. Д. Папалекси (качественно), Б. Стюартом и Р. Томсоном — с получением количественных результатов (1916 г.).
Схема опыта:
Катушка с большим числом витков тонкой проволоки приводилась в быстрое вращение вокруг своей оси. Концы катушки через специальные контакты замыкались на чувствительный гальванометр. После раскручивания катушки она резко тормозилась специальным приспособлением.
При этом гальванометр регистрировал кратковременный ток, направление которого указывало на отрицательный знак носителей заряда. В опыте были использованы инерционные свойства электронов: при резком торможении проводника они продолжали некоторое время двигаться (подобно пассажирам резко тормозящего вагона).
Из этих опытов было определено отношение заряда к массе носителя тока, которое совпало с соответствующим значением для электрона (1,8 · 1011 Кл/кг.)
Объяснить большинство свойств металлов, например, его электрических свойств (закон Ома), озволяет электронная теория металлов.
Классическая электронная теория металлов основывается на представлении об электронах проводимости как об электронном газе, подобном идеальному атомарному газу молекулярной физики.
В этой теории считается, что движение электронов подчиняется законам Ньютона, взаимодействием между собой электронов пренебрегают, а взаимодействие с положительными ионами решетки сводят только к соударениям.
- Что бы объяснить закон Ома основываясь на классической электронной теории металлов, нужно определить выражение для средней скорости v направленного упорядоченного движения электронов в электрическом поле с напряженностью Е и подставить в известную формулу для силы тока I:
- I = q0nvS,
- где q0 = e — заряд электрона, n — концентрация электронов, S — площадь поперечного сечения проводника.
Электроны в металле, участвуя в тепловом движении, все время сталкиваются с ионами решетки. Т.к. масса электрона гораздо меньше массы иона, значит, после следующего столкновения все направления скорости равновероятны.
Это значит, что начальная скорость после следующего столкновения может иметь любое направление и, значит, среднее значение вектора начальной скорости равняется нулю, и начальная скорость не влияет на среднюю скорость направленного движения электронов.
Это позволяет считать, что средняя скорость упорядоченного движения электронов v равняется произведению ускорения на среднее время τ движения электрона между двумя соударениями с ионами: v = а · τ. Применив второй закон Ньютона и выражение для напряженности электрического поля, получим:
где F — сила, действующая на электрон со стороны поля, U — напряжение на концах проводника длиной L.
Теперь, подставляя полученное уравнение в выражение I = q0nvS, имеем:
Как можно увидеть из полученного выражения, сила тока является пропорциональной напряжению, как это и следует из закона Ома. Это следствие того, что средняя скорость направленного движения электронов прямо пропорциональна напряженности электрического поля в металле.
Но классическая электронная теория не может объяснить большинство экспериментальных зависимостей, таких как, зависимость сопротивления от температуры. Это связано с тем, что движение электронов в металле подчиняется законам квантовой механики, а не классической механики Ньютона.
Ионы – это заряженные атомы и атомные группы. Понятие об ионных реакциях и заряде ионов :
Впервые термин «ион» был введен в 1834 году, в чем заслуга Майкла Фарадея. После изучения действия электрического тока на растворы солей, щелочей и кислот он пришел к выводу, что в них содержатся частицы, имеющие некий заряд.
Катионами Фарадей назвал ионы, которые в электрическом поле двигались к катоду, имеющему отрицательный заряд. Анионы — отрицательно заряженные неэлементарные ионные частицы, которые в электрическом поле движутся к плюсу — аноду.
Данная терминология применяется и сейчас, а частицы изучаются далее, что позволяет рассматривать химическую реакцию как результат электростатического взаимодействия.
Многие реакции протекают по этому принципу, что позволило понять их ход и подобрать катализаторы и ингибиторы для ускорения их протекания и для угнетения синтеза.
Также стало известно, что многие вещества, особенно в растворах, всегда находятся в виде ионов.
Номенклатура и классификация ионов
Ионы — это заряженные атомы или группа атомов, которая в ходе химической реакции потеряла или приобрела электроны. Они составляют внешние слои атома и могут теряться из-за низкой силы притяжения ядра.
Тогда результатом отсоединения электрона является положительный ион. Также если атом имеет сильный ядерный заряд и узкую электронную оболочку, ядро является акцептором дополнительных электронов.
В результате этого образуется отрицательная ионная частица.
Сами ионы — это не только атомы с избыточной или недостаточной электронной оболочкой. Это может быть и группа атомов. В природе чаще всего существуют именно групповые ионы, которые присутствуют в растворах, биологических жидкостях тел организмов и в морской воде.
Имеется огромное количество видов ионов, названия которых вполне традиционны. Катионы — это ионные частицы, заряженные положительно, а заряженные отрицательно ионы — это анионы. В зависимости от состава их называют по-разному. Например, катион натрия, катион цезия и другие.
Анионы называются по-другому, так как чаще всего состоят из многих атомов: сульфат-анион, ортофосфат-анион и другие.
Механизм образования ионов
Химические элементы в составе соединений редко являются электрически нейтральными. То есть они почти никогда не находятся в состоянии атомов.
В образовании ковалентной связи, которая считается самой распространенной, атомы также имеют некий заряд, а электронная плотность смещается вдоль связей внутри молекулы.
Однако заряд иона здесь не формируется, потому как энергия ковалентной связи меньше, нежели энергия ионизации. Потому, несмотря на различную электроотрицательность, одни атомы не могут полностью притянуть электроны внешнего слоя других.
В ионных реакциях, где разница электроотрицательности между атомами достаточно большая, один атом может забирать электроны внешнего слоя у другого атома. Тогда созданная связь сильно поляризуется и разрывается. Затраченная на это энергия, которая создает заряд иона, называется энергией ионизации. Для каждого атома она различная и указывается в стандартных таблицах.
Ионизация возможна только в том случае, когда атом или группа атомов способен либо отдавать электроны, либо акцептировать их. Чаще всего это наблюдается в растворе и кристаллах солей.
В кристаллической решетке также присутствуют почти неподвижные заряженные частицы, лишенные кинетической энергии.
А поскольку в кристалле нет возможности для передвижения, то реакция ионов протекают чаще всего в растворах.
Ионы в физике и химии
Физики и химики активно изучают ионы по нескольким причинам. Во-первых, эти частицы присутствуют во всех известных агрегатных состояниях вещества.
Во-вторых, энергию отрыва электронов от атома можно измерить, чтобы использовать это в практической деятельности. В-третьих, в кристаллах и растворах ионы ведут себя по-разному.
И, в-четвертых, ионы позволяют проводить электрический ток, а физико-химические свойства растворов меняются в зависимости от концентраций ионов.
Ионные реакции в растворе
Сами растворы и кристаллы следует рассмотреть детальнее. В кристаллах солей существуют отдельно расположенные положительные ионы, к примеру, катионы натрия и отрицательные, анионы хлора. Структура кристалла удивительна: за счет сил электростатического притяжения и отталкивания ионы ориентируются особым образом.
В случае с хлоридом натрия они образуют так называемую алмазную кристаллическую решетку. Здесь каждый натриевый катион окружен 6 хлоридными анионами. В свою очередь, каждый хлоридный анион окружает 6 анионов хлора. Из-за этого простая поваренная соль и в холодной и горячей воде растворяется почти с одинаковой скоростью.

В растворе тоже не существует цельной молекулы хлорида натрия. Каждый из ионов здесь окружается диполями воды и хаотично передвигается в ее толще.
Наличие зарядов и электростатических взаимодействий приводит к тому, что солевые растворы воды замерзают при температуре чуть меньше нуля, а кипят при температуре выше 100 градусов.
Более того, если в растворе присутствуют другие вещества, способные вступить в химическую связь, то реакция протекает не с участием молекул, а ионов. Это создало учение о стадийности химической реакции.
Те продукты, которые получаются в конце, не образуются сразу в ходе взаимодействия, а постепенно синтезируются из промежуточных продуктов.
Изучение ионов позволило понять, что реакция протекает как раз по принципам электростатических взаимодействий.
Их результатом является синтез ионов, которые электростатически взаимодействуют с другими ионами, создавая конечный равновесный продукт реакции.
Резюме
Такая частица, как ион, это электрически заряженный атом или группа атомов, которая получается в ходе потери или приобретения электронов. Самым простым ионом является водородный: если он теряет один электрон, то представляет собой лишь ядро с зарядом +1. Он обуславливает кислую среду растворов и сред, что важно для функционирования биологических систем и организмов.
Ионы могут иметь как положительные, так и отрицательные заряды. За счет этого в растворах каждая частица вступает в электростатическое взаимодействие с диполями воды, что также создает условия для жизни и передачи сигналов клетками. Более того, в ионные технологии развиваются дальше. К примеру, созданы ионные двигатели, которыми оснащалось уже 7 космических миссий NASA.
Урок 6. Простые ионы – HIMI4KA
Архив уроков › Основные законы химии
В уроке 6 «Простые ионы» из курса «Химия для чайников» познакомимся с простыми ионами и выясним, чему равен его заряд; также рассмотрим как образуется ионная химическая связь; научимся определять степень окисления и валентность элементов. Данный урок очень важный, и чтобы его лучше понять, обязательно просмотрите прошлые уроки, особое внимание уделяя уроку 1 «Схема строения атомов», а также уроку 3 «Схема образования молекул».
Ионная химическая связь
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.
Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).
Положительные и отрицательные ионы
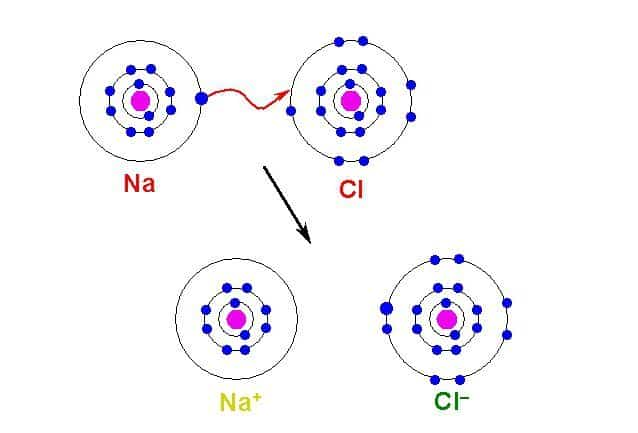
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
Поэтому при образовании молекулы NaCl каждый атом Na теряет один электрон (e—), образуя положительный ион натрия Na+, а каждый атом Cl, наоборот, приобретает этот потерянный электрон натрия, образуя отрицательный ион хлора Cl—. Это записывается в виде двух реакций:
- Na → Na+ + e— и ½Cl2 + e— → Cl—
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
На рисунке выше, изображена кристаллическая решетка NaCl, где каждый хлорид-ион Cl— окружен со всех сторон соседними положительными ионами натрия Na+; ионы натрия Na+ точно также окружены ближайшими хлорид-ионами Cl—. Подобное расположение ионов обладает высокой устойчивостью.
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:
Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:
Степень окисления веществ
Заряд простого, одноатомного иона, например Mg2+ или F2-, называется его степенью окисления. Степень окисления — это такое число электронов, которое необходимо прибавить (восстановить) к иону или отнять (окислить) у него, чтобы он превратился обратно в нейтральный атом.
- Реакция восстановления: Mg2+ + 2e— → Mg
- Реакция окисления: F2- → F + 2e—
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:
Пример 12. Окисляется или восстанавливается хлор при образовании хлорид-иона? Какова степень окисления этого иона? Решение: Хлор восстанавливается, поскольку к каждому атому хлора необходимо присоединить один электрон, чтобы образовался хлорид-ион. Хлорид-ион, Сl—, имеет степень окисления -1.
Пример 13. Окисляются или восстанавливаются металлы при образовании ими ионов? Какова степень окисления иона алюминия? Решение: При образовании ионов металлов последние окисляются, поскольку при этом происходит удаление электронов от атомов металла. Ион алюминия, Аl3+, имеет степень окисления +3.
Валентность химических элементов
Валентностью называют число химических связей, которые данный атом образует с другими атомами в молекуле. Однако, если говорить простыми словами, то под валентностью понимается все та же степень окисления, но в отличии от нее валентность не имеет знака и не равна нулю.
| Молекулярная формула | Валентность | Степень окисления |
| H2O | H(I), O(II) | H+1, O-2 |
| CS2 | C(IV), S(II) | C+4, S-2 |
| CH4 | C(IV), H(I) | C-4, H+1 |
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
- Fe2+ железо(II) или ион двухвалентного железа
- Fe3+ железо(III) или ион трехвалентного железа
- Сu+ медь(I) или ион одновалентной меди
- Cu2+ медь (II) или ион двухвалентной меди
- Sn2+ олово(II) или двухвалентного олова
- Sn4+ олово(IV) или ион четырехвалентного олова
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Решение: Уравнение реакции имеет следующий вид: Fe3+ + e— → Fe2+. Она представляет собой процесс восстановления, поскольку к исходному иону присоединяется электрон.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
Электрический ток в металлах | 8 класс | Физика
Содержание
Электрический ток представляет собой упорядоченное движение заряженных частиц. Этими частицами могут являться не только свободные электроны, но и ионы.
Металлы являются отличными проводниками. Какие частицы приходят в движение под действием электрического поля в них: электроны или ионы?
На данном уроке вы узнаете ответ на этот вопрос. Мы вспомним некоторые факты о строении металлов и рассмотрим процессы, которые будут происходить в этих веществах при протекании тока.
Строение металлов
Находясь в твердом агрегатном состоянии, металлы обладают кристаллической решеткой. Это упорядоченная структура: каждый атом находится в строго определенном месте.
https://www.youtube.com/watch?v=CAhjn2GbXG0u0026t=8s
Но какие частицы тогда будут обеспечивать протекание электрического тока? Дело в тем, что в узлах кристаллической решетки находятся положительные ионы (рисунок 1). В пространстве меду этими ионами беспрестанно двигаются свободные электроны.
Рисунок 1. Кристаллическая решетка металла
Вспомним немного о том, что же представляют собой такие частицы, как ионы. В обычных условиях атомы электрически нейтральны. Электроны несут отрицательный заряд, а протоны, находящиеся в ядре — положительный. Заряд этот по модулю одинаков. Таким образом, в электрически нейтральном атоме количество электронов будет равно количеству протонов в ядре.
Если атом теряет хоть один электрон, он теряет свою электронную стабильность. Теперь суммарный положительный заряд всех протонов в ядре по абсолютному значению больше отрицательного заряда электронов. Такой атом называют положительным ионом.
В таком строении кроется ответ на вопрос: “Почему в обычных условиях металл электрически нейтрален?”.
Отрицательный заряд всех свободных электронов по абсолютному значению равен положительному заряду всех ионов решетки.
Обратите внимание на тот факт, что не все электроны в металлах являются свободными. Часть из них остается связанными с ядрами атомов, а другая их часть — беспорядочно движется между этими атомами.
Эти электроны изначально находятся на самых удаленных от ядра орбитах. Они слабо связаны с ядром. Поэтому они могут довольно легко переходить от одного атома к другому, повторяя этот процесс множество раз. Именно это движение мы и называем беспорядочным движением свободных электронов.
{«questions»:[{«content»:»В металле[[choice-1]]»,»widgets»:{«choice-1»:{«type»:»choice»,»options»:[«часть электронов связана с ядрами, а часть является свободными»,»все электроны свободные»,»нет свободных электронов»],»answer»:[0]}}}]}
Ток в металлах
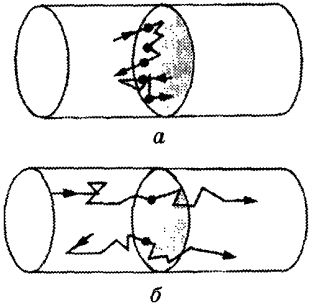
Создадим в металле электрическое поле с помощью любого источника тока. Положительные ионы останутся в узлах кристаллической решетки. В движение придут именно свободные электроны под действием электрических сил. Их движение станет направленным (рисунок 2).
Рисунок 2. Ток в металле
При этом сохранится и беспорядочность этого движения. Как это можно представить? Вообразите себе стайку мошкары, где каждое насекомое беспорядочно двигается. Если подует ветер, то эта стайка начнет перемещаться в одном направлении, при этом беспорядочное движение внутри этой стайки сохранится. На это и будет похоже движение электронов под действием электрических сил.
Теперь мы можем определить природу электрического тока в металлах и дать ему определение.
Электрический ток в металлах — это упорядоченное движение свободных электронов.
{«questions»:[{«content»:»Электрической ток в металлах представляет собой[[choice-5]]»,»widgets»:{«choice-5»:{«type»:»choice»,»options»:[«направленное движение электронов»,»направление движение положительных ионов»,»направленно движение отрицательных ионов»,»беспорядочное движение электронов»],»answer»:[0]}}}]}
Доказательные опыты
Сделанные нами выводы построены не просто на рассуждениях, но и множество раз доказаны эмпирически.
Российские ученые Леонид Исаакович Мандельштам (рисунок 3) и Николай Дмитриевич Папалекси (рисунок 4) провели ряд интересных опытов.
Эти опыты позже были подтверждены американскими физиками Бальфуром Стюартом и Робертом Толменом.
 Рисунок 3. Леонид Исаакович Мандельштам (1879 — 1944) — российский и советский физик, один из основателей научной школы радиофизики Рисунок 4. Николай Дмитриевич Папалекси (1880 — 1947) — российский и советский физик, основоположник радиоастрономии
Рисунок 3. Леонид Исаакович Мандельштам (1879 — 1944) — российский и советский физик, один из основателей научной школы радиофизики Рисунок 4. Николай Дмитриевич Папалекси (1880 — 1947) — российский и советский физик, основоположник радиоастрономии
Суть опытов заключалась в следующем. Уже известно, что в металле есть какие-то свободные заряды, и они обладают массой. Тогда они должны испытывать на себе инерцию.
Для проверки этого предположения металлический проводник нужно было привести в движение, а затем резко остановить. Для удобства использовали вращательно движение, а не поступательное.
Металлическую проволоку наматывали на деревянный каркас и раскручивали (рисунок 5). После резкой остановки с помощью гальванометра фиксировали возникновение тока.
Рисунок 5. Опыт Мандельштама и Папалекси
Было определено, что именно электроны вылетали из проводника. Установили это, определяя отношение заряда к массе его носителя. Эти данные для электрона у ученых уже имелись.
Скорость распространения электрического поля и тока в металлах
После создания электрического поля свободные электроны приходят в движение. Скорость их движения совсем небольшая. В среднем она составляет несколько миллиметров в секунду.
Но как тогда после щелчка выключателем лампа в комнате загорается мгновенно? Дело обстоит в следующем.
https://www.youtube.com/watch?v=CAhjn2GbXG0u0026t=56s
Именно само электрическое поле распространяется в проводнике с огромной скоростью. Она близка к скорости света в вакууме ($c = 300 space 000 frac{км}{с}$). Распространяется поле по всей длине проводника.
Соответственно, в движение приходят одновременно все электроны в проводнике. И те, что ближе к выключателю, и те, что ближе к электроприбору.
Например, пошлем электрический сигнал из Владивостока в Москву. Расстояние между этими городами составляет около 8000 км. В Москве сигнал будет зафиксирован уже через 0,03 с.
Это не означает, что электроны от Владивостока проделали весь этот путь за указанное время и прибыли в Москву.
Нет, это электрическое поле распространилось по проводам с невероятной скоростью и привело в движение самые ближние к приемнику в Москве электроны в движение, которое и было зафиксировано.
Поэтому, когда говорят о скорости распространения тока в проводнике, то имеется в виду скорость распространения электрического поля по всей длине проводника.
{«questions»:[{«content»:»Под действием электрического поля электроны в металлическом проводнике движутся со скоростью[[choice-10]]»,»widgets»:{«choice-10»:{«type»:»choice»,»options»:[«несколько миллиметров в секунду»,»несколько метров в секуду»,»света»,»большей, чем скорость света»],»explanations»:[«»,»»,»Со скоростью света распространяется по проводнику электрическое поле.»,»»],»answer»:[0]}}}]}
Скорость движения электронов в металлах
С какой скоростью все же двигаются сами электроны в металлах? Давайте ответим на этот вопрос и сравним полученную скорость со скоростью света, т.е. со скоростью распространения электрического поля по проводнику.
Скорость движения электронов при действии на них электрических сил называется дрейфовой скоростью.
Величина дрейфовой скорости электронов лежит в пределах $0.6 — 6 frac{мм}{с}$.
Сравним среднее значение этой скорости ($2.7 frac{мм}{с}$) со скоростью света. Для этого переведем значение, выраженное в $frac{мм}{с}$ в $frac{м}{с}$:$upsilon_e = 2.7 frac{мм}{с} = 2.7 cdot 10^{-3} frac{м}{с}$.
Сравним со скоростью света:$frac{c}{upsilon_e} = frac{3 cdot 10^8 frac{м}{с}}{2.7 cdot 10^{-3} frac{м}{с}} approx 1 cdot 10^{11} approx $ Сравним со скоростью света:
$frac{c}{upsilon_e} = frac{3 cdot 10^8 frac{м}{с}}{2.7 cdot 10^{-3} frac{м}{с}} approx 1 cdot 10^{11} approx 10^{11} $.
Получается, что скорость распространения электрического поля по проводнику (скорость света) больше в $10^{11}$ раз скорости движения электронов под действием этого же электрического поля.
{«questions»:[{«content»:»Дрейфовая скорость электронов — это скорость, с которой они двигаются[[choice-19]]»,»widgets»:{«choice-19»:{«type»:»choice»,»options»:[«под действием электрического поля»,»хаотично»,»при повышении температуры»,»при электризации тел»],»answer»:[0]}}}]}
Металлы
В периодах и группах периодической системы Д. И. Менделеева существуют закономерности в изменении металлических и неметаллических свойств элементов, можно достаточно определённо указать положение элементов-металлов и элементов-неметаллов в периодической системе.
Если провести диагональ от элемента бора B (порядковый номер 5) до элемента астата At (порядковый номер 85), то слева от этой диагонали в периодической системе все элементы являются металлами, а справа от неё элементы побочных подгрупп являются металлами, а элементы главных подгрупп – неметаллами.
Элементы расположенные вблизи диагонали (например, Al, Ti, Ge, Sb, Te, As, Nb), обладают двойственными свойствами: в некоторых своих соединениях ведут себя как металлы; в некоторых – проявляют свойства неметаллов.
Все s-элементы (кроме H и He), d-элементы (все элементы побочных подгрупп) и f-элементы (лантаноиды и актиноиды) являются металлами. Среди p-элементов есть и металлы, и неметаллы, число элементов-металлов увеличивается с увеличением номера периода.
Деление на металлы и неметаллы объясняется различием в строении атомов. Рассмотрим, например, строение атомов третьего периода:
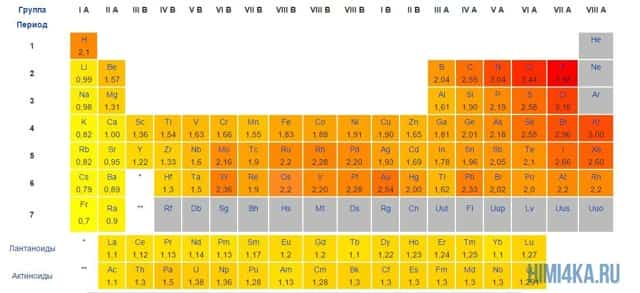
Элементы третьего периода: Na, Mg, Al, Si, P, S, Cl, Ar (аргон).
Радиус атома: 0.19; 0.16; 0.143; 0.134; 0.130; 0.104; 0.099.
Число электронов на внешнем слое: 1, 2, 3, 4, 5, 6, 7.
Электроотрицательность: 0.9; 1.2; 1.5; 1.8; 2.1; 2.5; 3.0.
- Любой гидроксид содержит гидроксидные группы – OH.
- Слева направо:
- а. Радиус атомов уменьшается;
- б. Заряд ядра увеличивается;
- в. Электроотрицательность увеличивается;
- г. Число электронов на внешнем слое увеличивается;
- д. Прочность связи внешних электронов с ядром увеличивается;
е. Способность атомов отдавать электроны уменьшается.
Поэтому:
Na, Mg, Al – металлы, а Si, P, S, Cl – неметаллы.
Атомы большинства металлов на внешнем электронном слое имеют от 1 до 3 электронов. Исключение: атомы германия Ge, олова Sn, свинца Pb на внешнем электронном слое имеют четыре электрона, атомы сурьмы Sb, висмута Bi – пять, атомы полония Po – шесть.
Атомы металла имеют меньший заряд ядра и больший радиус (размер) по сравнению с атомами неметаллов данного периода. Потому прочность связи внешних электронов с ядром в атомах металлов небольшая.
Атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы.
Простые вещества, которые образуют элементы-металлы, при обычных условиях являются твёрдыми веществами (кроме ртути). Кристаллическая решётка металлов образуется за счёт металлической связи.
Имеющиеся между узлами кристаллической решётки свободные электроны могут переносить теплоту и электрический ток, что является причиной главных физических свойств металлов – высокой электро- и теплопроводности.
Металлическая связь образуется во всех металлах. Это связь, которую осуществляют относительно свободные электроны с положительными ионами металлов в кристаллической решётке.
Атомы металла легко отдают валентные электроны и превращаются в положительные ионы.
Относительно свободные электроны перемещаются между положительными ионами металла и между ними возникает металлическая связь, то есть электроны как бы цементируют положительные ионы металла в кристаллической решётке.
Атомы металлов более или менее легко отдают электроны, то есть окисляются.
Энергия, которая необходима для отрыва электрона от атома и превращение его в положительно заряженный ион, называется энергией ионизации. Металлы характеризуются небольшими величинами энергий ионизации.
Атомы металлов не могут присоединять электроны. Поэтому металлы во всех химических реакциях являются восстановителями и в соединениях имеют только положительные степени окисления. Восстановительная активность различных металлов не одинакова.
В периодах слева направо восстановительная активность уменьшается; в главных подгруппах сверху вниз – увеличивается.
Восстановительная активность металлов в химических реакциях, которые протекают в водных растворах различных веществ, характеризуется положением металлов в электрохимическом ряду напряжений металлов.
- Металлы являются восстановителями и вступают в химические реакции с различными окислителями.
- 2. Альдегиды
- Альдегиды – органические вещества, содержащую функциональную группу (альдегидную группу).
Примеры ионов с положительным и отрицательным зарядом — Толковый Словарь — 2022
Видео: Примеры ионов с положительным и отрицательным зарядом
Видео: Положительный и отрицательный ион
Ион — это атом или группа атомов, в которых количество электронов не равно количеству протонов. Электроны имеют отрицательный заряд, а протоны — положительный. Когда атом получает электроны, это приводит к отрицательному заряду. Этот тип иона называется анионом. Когда атом теряет электроны, это приводит к положительному заряду. Положительно заряженный ион называется катионом. Давайте рассмотрим несколько примеров ионов обоих типов.
Примеры положительных ионов
Положительные ионы обычно являются металлами или действуют как металлы. Эти ионы содержатся во многих обычных материалах. Например, ртуть содержится в термометрах, а алюминий — это металл, который содержится в удивительном количестве вещей. Он даже входит в состав пищевой соды и некоторых других пищевых продуктов!
Положительный заряд (больше протонов по сравнению с электронами) катиона показан числом и знаком плюс после формулы. Если есть только знак плюса, это означает, что заряд равен плюсу 1. Вот некоторые примеры катионов или положительных ионов:
- Алюминий — Al 3+
- Барий — Ba 2+
- Висмут — Bi 3+
- Кадмий — Cd 2+
- Кальций — Ca 2+
- Цезий — Cs +
- Хром (III) — Cr 3+
- Кобальт — Co 2+
- Медь (I) — Cu +
- Медь (II) — Cu 2+
- Водород — H +
- Железо (II) — Fe 2+
- Железо (III) — Fe 3+
- Свинец (II) — Pb 2+
- Литий — Li +
- Магний — Mg 2+
- Ртуть (I) — Hg2 2+
- Ртуть (II) — Hg 2+
- Никель — Ni 2+
- Калий — K +
- Рубидий — Rb +
- Серебро — Ag +
- Натрий — Na +
- Стронций — Sr 2+
- Олово (II) — Sn 2+
- Цинк — Zn 2+
Примеры отрицательных ионов
Подобно тому, как атомы могут терять электроны, чтобы стать катионами, некоторые могут приобретать электроны и становиться отрицательно заряженными анионами. Опять же, возможно, вы знакомы с некоторыми из этих ионов. Иногда в коммунальные системы водоснабжения добавляют фторид. Ваш стоматолог также может назначить вам лечение фторидом.
Отрицательный заряд (меньше протонов, чем электронов) аниона показан числом и знаком минус после формулы. Если есть только знак минус, это означает, что заряд минус 1. Вот несколько примеров анионов:
- Бромид — Br —
- Хлорид — Cl —
- Фторид — F —
- Йодид — I —
- Нитрид — N 3-
- Оксид — O 2-
- Сульфид — S 2-
Многоатомные катионы и анионы
Если ион состоит из двух или более атомов, он называется многоатомным ионом. Как и их одноатомные аналоги, они тоже могут приобретать и терять электроны.
Многоатомные катионы
Ионы с несколькими атомами, которые теряют электроны и поэтому заряжены положительно, называются многоатомными катионами.
- Аммоний — NH4 +
- Гидроний — H3O +
Многоатомные анионы
Ионы с несколькими атомами, которые приобретают электроны и, следовательно, имеют отрицательный заряд, называются многоатомными анионами. В приведенном ниже списке обвинение заключено в круглые скобки для удобства чтения, но стандартная запись требует, чтобы платеж был записан в виде надстрочного индекса.
- Ацетат — CH3COO (-) или C2H3O (2-)
- Арсенат — AsO4 (3-)
- Бикарбонат или гидрокарбонат — HCO3 (-)
- Борат — BO3 (3-)
- Карбонат — CO3 (2-)
- Хлорат — ClO3 (-)
- Хлорит — ClO2 (-)
- Хромат — CrO4 (2-)
- Цианид CN (-)
- Дихромат — Cr2O7 (2-)
- Дигидрофосфат — H2PO4 (-) или H2O4P (-)
- Формиат — CHO2 (-) или HCOO (-) или CHOO (-)
- Сероводород или бисульфат — HSO4 (-)
- Сероводород или бисульфит — HSO3 (-)
- Фосфат водорода — HPO4 (2-)
- Гидроксид ОН (-)
- Гипохлорит — ClO (-)
- Нитрат — NO3 (-)
- Нитрит — NO2 (-)
- Оксалат — C2O4 (2-)
- Перхлорат — ClO4 (-)
- Перманганат — MnO4 (-)
- Перекись O2 (2-)
- Фосфат — PO4 (3-)
- Фосфит — PO3 (3-)
- Силикат — SiO3 (2-)
- Сульфат — SO4 (2-)
- Сульфит — SO3 (2-)
- Тиоцианат — SCN (-)
- Тиосульфат — S2O3 (2-)
Ионные соединения
Ионное соединение состоит из одного или нескольких анионов и одного или нескольких катионов.
Некоторые примеры ионных соединений включают:
- Сульфид алюминия — Al2S3
- Хлорид бериллия — BeCl2
- Иодид бора — BI3
- Нитрид кальция — Ca3N2
- Фосфид меди — Cu3P
- Иодид железа (II) — FeI2
- Оксид железа (III) — Fe2O3
- Сульфид свинца (II) — PbS
- Фосфид свинца (IV) — Pb3P4
- Литий фторид — LiF
- Хлорид магния — MgCl2
- Бромид калия — KBr
- Фторид натрия — NaF
- Нитрид натрия — Na3NПолностью заряженная реакция
Изучая химию, вы встретите множество примеров ионов, а также различные типы ионов и то, как они взаимодействуют и соотносятся друг с другом. Для получения дополнительной информации по теме обязательно изучите некоторые примеры химических связей и примеры химических свойств.Возможно, они станут катализатором позитивных изменений в вашем обучении!
Ионы
Ион — одноатомная или многоатомная электрически заряженная частица вещества, образующаяся в результате потери или присоединения атомом в составе молекулы одного или нескольких электронов.
Заряд иона кратен заряду электрона.
Понятие и термин «ион» ввел в 1834 году Майкл Фарадей, который, изучая действие электрического тока на водные растворы кислот, щелочей и солей, предположил, что электропроводность таких растворов обусловлена движением ионов.
Положительно заряженные ионы, движущиеся в растворе к отрицательному полюсу (катоду), Фарадей назвал катионами, а отрицательно заряженные, движущиеся к положительному полюсу (аноду) — анионами.
1) знаком и величиной их заряда;
2) строением ионов, т. е. расположением электронов и прочностью их связей, причем особенно важны внешние электроны;
3) их размерами, определяемыми радиусом орбиты внешнего электрона.
4) прочностью электронной оболочки (деформируемостью ионов).
В виде самостоятельных частиц ионы встречаются во всех агрегатных состояниях вещества: в газах (в частности, в атмосфере), в жидкостях (в расплавах и растворах), в кристаллах и в плазме (в частности, в межзвездном пространстве). Являясь химически активными частицами, ионы вступают в реакции с атомами, молекулами и между собой. В растворах ионы образуются в результате электролитической диссоциации и обусловливают свойства электролитов.
Число элементарных электрических зарядов у ионов в растворах почти всегда совпадает с валентностью данного атома или группы; газовые ионы могут иметь и другое число элементарных зарядов.
Под влиянием достаточно энергичных воздействий (высокая температура, излучение высокой частоты, электроны большой скорости) могут образоваться положительные ионы с различным числом электронов, вплоть до голых ядер. Положительные ионы обозначаются знаком + (плюс) или точкой (например, Mg***,Аl+++), отрицательные знаком — (минус) или знаком' (Сl-, Br').
Число знаков обозначает число избыточных элементарных зарядов. Чаще всего образуются ионы с устойчивыми внешними электронными оболочками, соответствующими оболочке благородных газов.
Ионы, из которых построены кристаллы, и ионы, встречающиеся в растворах и растворителях с высокими диэлектрическими постоянными, принадлежат большей частью к этому типу, например щелочные и щелочноземельные металлы, галоиды и т. д. Впрочем встречаются и т. н. переходные ионы, у которых внешние оболочки содержат от 9 до 17 электронов; эти ионы могут переходить сравнительно легко в ионы другого типа и значности (например Fe- — , Си» и т.д.).
Химические и физические свойства ионов резко отличаются от свойств нейтральных атомов, напоминая во многих отношениях свойства атомов других элементов, имеющих тоже число электронов и ту же внешнюю электронную оболочку (напр. К' напоминает Ar, F'—Ne). Простые ионы, как показывает волновая механика, имеют сферическую форму. Размеры ионы характеризуются величиной их радиусов, которые могут быть определены эмпирически по данным рентгеновского анализа кристаллов (Гольдшмидт) или вычислены теоретически методами волновой механики (Паулииг) или статистики (Ферми). Результаты, полученные обоими методами, дают вполне удовлетворительное совпадение. Целый ряд свойств кристаллов и растворов определяется радиусами ионов, из которых они состоят; у кристаллов этими свойствами являются энергия кристаллической решетки и в значительной степени ее тип; в растворах ионов поляризуют и притягивают молекулы растворителя, образуя оболочки переменного состава, эта поляризация и прочность связи между ионов и молекулами растворителя определяются почти исключительно радиусами и зарядами ионов. Насколько вообще сильно действие поля ионов на молекулы растворителя, показывают вычисления Цвикки, который нашел, что молекулы воды находятся вблизи ионов под давлением порядка 50.000 атм. Прочность(деформируемость) внешней электронной оболочки зависит от степени связанности внешних электронов и обусловливает главным образом оптические свойства ионов (цветность, рефракция). Впрочем цветность ионов связана также и с образованием ионов различных соединений с молекулами растворителя. Теоретические вычисления эффектов, связанных с деформацией электронных оболочек, более затруднительны и менее наделены, чем вычисления сил взаимодействия между ионами. Причины образования ионов в растворах точно неизвестны; наиболее правдоподобно мнение, что молекулы растворимых веществ разрываются на ионы молекулярным нолем растворителя; гетерополярные, т. е. построенные из ионов кристаллы дают повидимому при растворении сразу ионы. Значение молекулярного поля растворителя подтверждается как будто параллелизмом между величиной диэлектрической постоянной растворителя, являющейся приблизительным мерилом напряжения его молекулярного поля, и степенью диссоциации (правило Нернста-Томсона, экспериментально подтвержденное Вальденом). Однако ионизация происходит и в веществах с малыми диэлектрическими постоянными, но здесь растворяются преимущественно электролиты, дающие комплексные ионны. Комплексы образуются иногда из ионов растворяющегося вещества, иногда растворитель также принимает участие в их образовании. Для веществ с малыми диэлектрическими постоянными характерно также образование комплексных ионов при прибавлении не электролитов, например (С2Н5)0Вг3 дает при смешении с хлороформом проводящую
систему. Внешним признаком образования комплексных ионов служит т. н. аномальная электропроводность, при которой график, изображающий зависимость молярной электропроводности от разведения, дает максимум в области концентрированных растворов и минимум—при дальнейшем разведении.
Номенклатура
Согласно химической номенклатуре, название катиона, состоящего из одного атома совпадает с названием элемента, например, Na+ называется натрий-ионом, иногда добавляют в скобках заряд, например, название катиона Fe2+ — железо(II)-ион. Название состоит из одного атома аниона образуется из корня латинского названия элемента и суффикса «-ид/-ид», например, F — называется фторид-ионом.
Список использованной литературы
- БСЭ, 48 том, первое издание (1926—1947)






