- Сравнительная таблица
- Выводы
- Металлы 1 ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ И НЕМЕТАЛЛОВ
- Вопросы к параграфу 39 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман (решебник)
- 2. Чем по строению и свойствам кристаллические решётки металлов отличаются от ионных и атомных кристаллических решёток?
- 3. Каковы общие физические свойства металлов? Объясните эти свойства, основываясь на представлениях о металлической связи
- 4. Почему некоторые металлы пластичные (например, медь), а другие — хрупкие (например, сурьма)?
- 5. При «растворении» в соляной кислоте 12,9 г сплава, состоящего из меди и цинка, получили 2,24 л водорода (н. у.). Вычислите массовые доли (в процентах) цинка и меди в этом сплаве
- 6. Медно-алюминиевый сплав обработали 60 г соляной кислоты (массовая доля НСl — 10%). Вычислите массу и объём выделившегося газа (н. у.)
- Тестовые задания
- 1. Наиболее ярко металлические свойства проявляет простое вещество, атомы которого имеют строение электронной оболочки
- 1) 2е, 1е
- 2) 2е, 2е
- 3) 2е, Зе
- 4) 2е, 4е
- 2. Наиболее ярко металлические свойства проявляет простое вещество, атомы которого имеют строение электронной оболочки
- 1) 2е, 2е
- 2) 2е, 8е, 2е
- 3) 2е, 8е, 8е, 2е
- 4) 2е, 8е, 18е, 8е, 2е
- 3. Хорошо проводит электрический ток твёрдое вещество, имеющее кристаллическую решётку
- 1) молекулярную
- 2) атомную
- 3) металлическую
- 4) ионную
- Строение металлов
- Разница между металлами и неметаллами
- Сравнение
- Выводы TheDifference.ru
- Чем металлы отличаются от неметаллов
- Чем различаются строение атомов металлов и неметаллов?
- Какую особенность строения имеют Атомы металлических элементов в отличии от неметаллических?
- Как в периодической системе Менделеева располагаются элементы металлы?
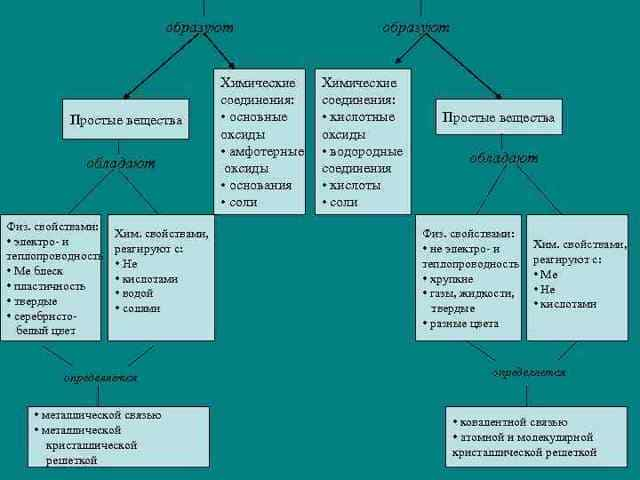
Химики делят все простые вещества на металлы и неметаллы. Они имеют большую разницу. При этом далеко не всем известно, чем конкретно отличаются металлы от неметаллов.
Разница касается структуры, физических характеристик и химических свойств. Многие вещества удается определить визуально. Однако этот метод сложно назвать достоверным.
Чтобы не допустить ошибку, стоит опираться на четкие признаки, характерные для рассматриваемых веществ.
Под этим термином понимают элементы, которые принимают электроны на внешний энергетический уровень. Они могут обладать различными агрегатными состояниями. Так, кислород и азот представляют собой газы, а бром – жидкость. Твердыми веществами являются углерод, бор, мышьяк.
В это понятие входят элементы, которые отдают электроны с внешнего энергетического уровня. Чаще всего они представлены в твердом агрегатном состоянии. Единственным исключением считается ртуть. При нормальных условиях она представляет собой жидкость.
Важным различием между рассматриваемыми элементами считается положение в таблице Менделеева. Чтобы определить разновидность вещества, стоит провести диагональную линию от бора до астата.
Элементы, которые находятся выше черты, считаются неметаллами, а ниже – металлами. При этом все химические вещества побочных подгрупп представляют собой только металлы. Таким образом, можно увидеть, что количество металлических элементов в таблице значительно больше.
В основной подгруппе первой группы присутствуют щелочные металлы. К ним относят литий, рубидий, натрий. Также туда входят калий, фраций, цезий, калий. Эти элементы получили такое название, поскольку при растворении в воде они формируют щелочи. При этом образуются растворимые гидроксиды.
Для щелочных металлов характерна электронная конфигурация внешнего энергетического уровня ns1. Это означает, что на наружной оболочке присутствует один валентный электрон. Отдавая его, вещества проявляют восстановительные характеристики.
В основную подгруппу второй группы входят щелочноземельные металлы. К ним относятся магний, радий, барий. Также в эту группу входят стронций, бериллий, кальций. Эти вещества отличаются серым окрасом. При комнатной температуре они имеют твердую консистенцию. На внешнем энергетическом уровне эта разновидность металлов отличается электронной конфигурацией ns2.

Вещества, которые входят в побочные подгруппы, считаются переходными металлами. В атомах этих элементов присутствуют валентные электроны, которые располагаются на d-орбиталях и f-орбиталях.
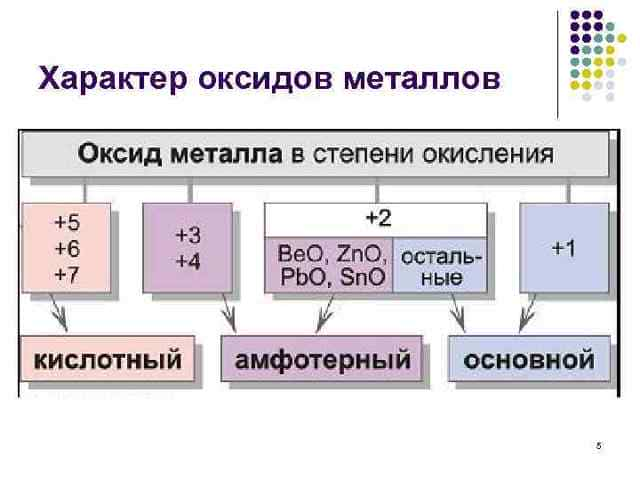
Для переходного подтипа характерны переменные уровни окисления. В низших степенях они проявляют основные характеристики, в промежуточных – амфотерные, а в высших – кислотные.
В верхнем правом углу периодической системы Менделеева находятся неметаллы. На внешнем энергетическом уровне атомы этих элементов содержат много электронов. Потому им выгоднее принимать дополнительные электроны, нежели отдавать свои собственные.
Во втором периоде находятся вещества от бора до неона, в третьем – от кремния до аргона. Четвертый период включает элементы от мышьяка до криптона. К пятому периоду относятся йод, ксенон и теллур, к шестому – радон и астат. Гелий и водород тоже считаются неметаллами.
Важным отличием рассматриваемых веществ считается строение их атомов. При этом стоит учитывать количество электронов на внешнем энергетическом уровне. У атомов металлов оно составляет от 1 до 3. Обычно для них характерен больший радиус. Атомы металлов беспрепятственно отдают наружные электроны, поскольку отличаются выраженными восстановительными характеристиками.
Неметаллы отличаются большим числом электронов на внешнем уровне. С этим связана их окислительная активность. Неметаллы притягивают электроны, которых им не хватает. Как следствие, энергетический уровень полностью заполняется. Наиболее выраженные окислительные свойства характерны для неметаллов второго и третьего периода шестой и седьмой групп.
Для полного энергетического уровня характерно 8 электронов. Наибольшей окислительной способностью отличаются галогены, которые имеют валентность I. Лидирующие позиции среди них занимает фтор, поскольку это вещество лишено свободных орбиталей.
Рассматриваемые вещества отличаются по структуре. На физические свойства элементов влияет порядок размещения элементарных частиц.
Если условно соединить их воображаемыми линиями, удастся получить структуру, которая называется кристаллической решеткой. В ней могут присутствовать разные элементы – молекулы или атомы.
Также в структуру входят ионы, которые представляют собой заряженные частицы.
У отдельных неметаллов образуется атомная кристаллическая решетка. Ее частицы соединяются ковалентными связями. Вещества с такой структурой бывают твердыми и нелетучими. К ним, в частности, относят кремний, графит, фосфор.
Для молекулярной кристаллической решетки характерна более слабая связь между элементарными частицами. Как правило, такие неметаллы представлены в виде газа или жидкости. Иногда это могут быть твердые легкоплавкие неметаллы.
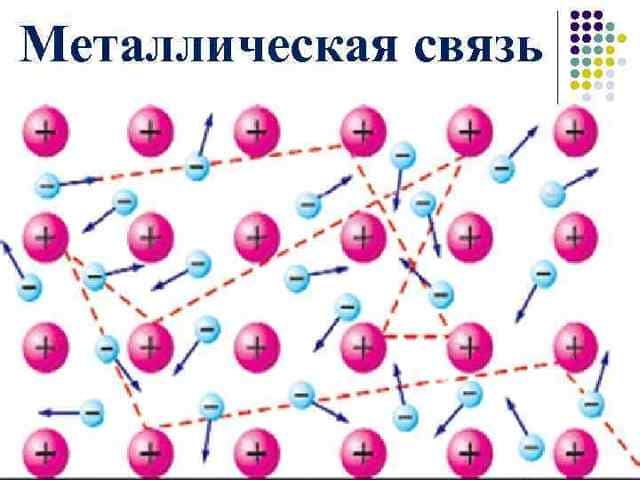
При этом часть атомов любых металлов теряет наружные электроны. Этот процесс сопровождается их превращением в катионы, которые представляют собой положительно заряженные частицы. Они опять соединяются с электронами и формируют нейтрально заряженные элементы. Таким образом, в металлической решетке одновременно присутствуют атомы, электроны и катионы.
Отличаются и физические свойства рассматриваемых веществ. Основной характеристикой считается агрегатное состояние. Традиционно все металлы представляют собой твердые вещества. Исключением является лишь ртуть, которая является тягучей серебристой жидкостью. Ее пары считаются токсичным веществом, которое провоцирует интоксикацию организма.
Еще одной отличительной особенностью таких веществ считается металлический блеск. Это обусловлено тем, что поверхность металла отражает свет. Также для этих веществ характерна тепло- и электропроводность. Эта особенность связана с наличием в металлических решетках свободных электронов. В электрическом поле они начинают направленное движение. Ток и тепло лучше всего проводит ртуть. При этом наименьшие показатели характерны для серебра.
Металлическая связь делает вещества ковкими и пластичными. По этим параметрам лидирующие показатели занимает золото. Из него удается раскатать пластину, толщина которой не превышает человеческий волос.
Чаще всего металлы и неметаллы обладают противоположными физическими свойствами. Так, для неметаллов характерны невысокие параметры электро- и теплопроводности. К тому же они отличаются отсутствием металлического блеска.
В обычных условиях неметаллы имеют жидкое или газообразное состояние. Твердые вещества всегда отличаются хрупкостью и легкоплавкостью. Это связано с молекулярным строением веществ. Кремний, алмаз и красный фосфор считаются нелетучими и тугоплавкими элементами, которые характеризуются немолекулярным строением.
Сравнительная таблица
Ключевые особенности веществ сведены в таблицу:
| Свойства | Металлы | Неметаллы |
| Агрегатное состояние при комнатной температуре | Твердое, кроме ртути | Твердое, жидкое, газообразное |
| Цвет | Серебристо-белый или серебристо-серый, кроме меди и золота | Разный – желтый, желто-зеленый, красно-бурый |
| Блеск | Металлический | Отсутствует |
| Ковкость | Хорошая | Отсутствует |
| Теплопроводность | Хорошая | Только углерод |
| Электропроводность | Хорошая | Только углерод и черный фосфор |
Выводы
Металлы и неметаллы имеют много отличий. Они затрагивают строение кристаллической решетки, физические характеристики и химические свойства.
Металлы 1 ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ И НЕМЕТАЛЛОВ



Твердые вещества, кроме ртути. (самый мягкий – калий, самый твердый – хром)
Температура плавления Легкоплавкие Hg, Ga, Cs, In, Bi тугоплавкие W, Mo, V, Cr
Пластичные Au, Ag, Cu, Sn, Pb, Zn, Fe уменьшается
Теплопроводность Hg, Cu, Ag, Al, Fe уменьшается Электропроводность Ag Mn уменьшается
Обладают металлическим блеском
плотность легкие (Li–самый легкий, K, Na, Mg) тяжелые (осмий – самый тяжелый, Ir, Pb)
Ртуть Цезий Вольфрам 22
Тантал Церий Литий 23
Золото Платина 24 Серебро
Уран 25
Бериллий Натрий Индий 26 Хром
Образцы металлов индий кобальт хром висмут вольфрам сурьма галий германий берилий
Металлы. l Алюминий Al
ОЛОВО Оказывается, и металлы «болеют» . «Оловянной чумой» прозвали фазовый переход одной из аллотропных модификаций олова, белого олова (β-Sn), в другую — серое олово (α-Sn), при котором компактный металл рассыпается в серый порошок.
Причина разрушения состоит в резком увеличении удельного объёма металла (плотность β-Sn больше, чем плотность α-Sn).
Переход облегчается при контакте олова с частицами α-Sn (они действуют подобно затравке, вызывающей образование кристаллов в пересыщенном растворе) и распространяется подобно «болезни» .
Наибольшую скорость распространения оловянная чума имеет при температуре – 33 °С; свинец и многие другие примеси её задерживают. В результате разрушения «чумой» паянных оловом сосудов с жидким топливом в 1912 г. погибла экспедиция Роберта Скотта к Южному полюсу. олово
ТАЛИЙ Талий — металл, белого цвета с голубоватым оттенком, похожим на свинец, но ещё более мягким.
Таллий был впервые обнаружен с помощью спектроскопа, в большинстве минералов этот рассеянный элемент присутствует в столь малых количествах, что случайно напасть на его след химическим путём практически невозможно. Таллий и его соединения ядовиты.
Недаром они попали в литературное произведение: в романе Агаты Кристи «Вилла ”Белый конь”» действует преступная группа, отравляющая людей соединениями таллия. Симптом отравления — выпадение волос. Другим последствием может оказаться тяжёлое нервное заболевание. талий
Металлы. l Вольфрам W
Активные металлы и металлы средней активности калий магний железо натрий цинк алюминий никель
Причины, приводящие к различию в физических свойств металлов Атомы металлов образуют разные типы кристаллических решеток
3. Ряд стандартных электродных потенциалов металлов. Распространение в природе.
Положение того или иного металла в ряду напряжений характеризует его способность к окислительновосстановительным взаимодействиям в водных растворах при стандартных условиях.
Чем ближе металл к началу ряда, тем более сильные восстановительные свойства проявляет металл как простое вещество. Чем дальше расположен металл в ряду напряжений, тем более сильными окислителями в водном растворе являются его ионы.
платина
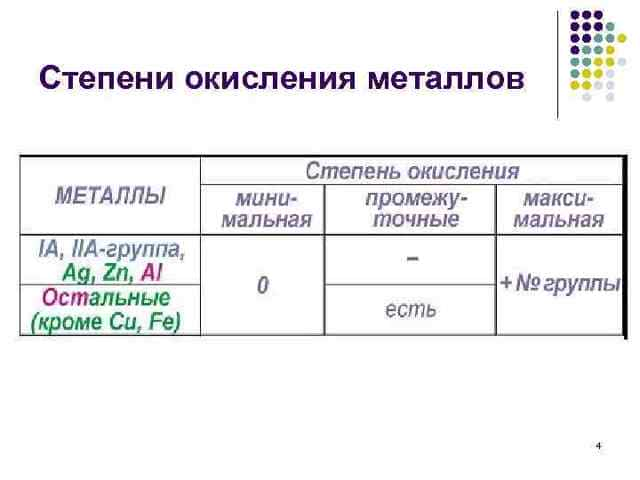
Химические свойства металлов Металлы в химических реакциях являются восстановителями, при этом они окисляются Mo – ne =Mn+ Al, Be, Mg, Ca, Li, Na, K, Rb, Cs Восстановительная способность возрастает
Металлы вытесняются из их соединений другими металлами Н. Н. Бекетов – создал «вытеснительный ряд» (прототип электрохимического ряда напряжения металлов) Li, K, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au.
Взаимодействуют с простыми веществами — С галогенами и кислородом 2 Na + Cl 2 = 2 Na Cl Mg + O 2 = 2 Mg O — C элементами пятой группы (труднее) 3 Ca + 2 P =Ca 3 P 2
Взаимодействие со сложными веществами — С кислотами Zn + H 2 SO 4 = Zn S O 4 + H 2 — C солями Zn + Pb(NO 3)2 = Zn(NO 3)2 + Pb — C водой (активные) 2 Na + 2 H 2 O =2 Na OH + H 2
Применение металлов Станко строение Металлур гическая промышленность медиц ина Сельское хозяйство Для получени я сплавов Домашнее хозяйство
Получение металлов Пирометаллургическим способомвосстановление углеродом, оксидом углерода (II), водородом при высокой температуре. Алюминотермическим способом Гидрометаллургическим способом – получение из руды более активным металлом или из растворов Электролизом – с помощью электрического тока из расплавов или растворов
Вопросы к параграфу 39 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман (решебник)

Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Издательство: Просвещение
Тип: Учебник
Металлы в периодической таблице химических элементов Д.И. Менделеева располагаются преимущественно в I, II, III группах.
Строение атомов металлов от строения атомов неметаллов отличается тем, что у атомов металлов на внешнем энергетическом уровне чаще всего располагается от одного до трёх элементов, атомы металлов обладают большим радиусом.
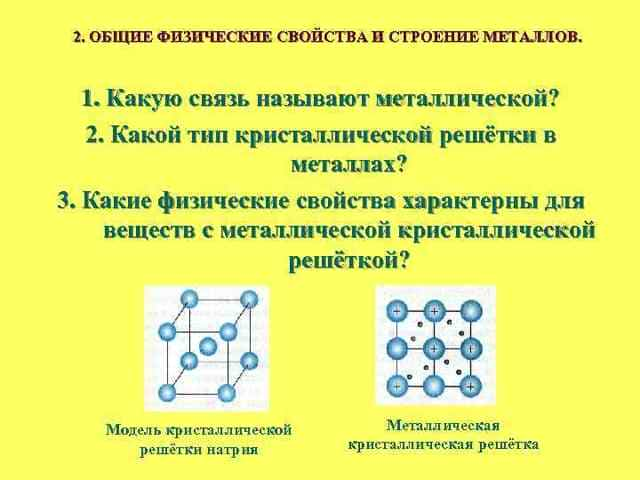
2. Чем по строению и свойствам кристаллические решётки металлов отличаются от ионных и атомных кристаллических решёток?
| Металлическая кристаллическая решётка | Ионная кристаллическая решётка | Атомная кристаллическая решётка |
| Сходства | В узлах решётки — катионы металлов. | в узлах решётки — нейтральные атомы. |
| Различия | Нет анионов, есть нейтральные атомы. | Есть катионы металлов и относительно свободные электроны. |
3. Каковы общие физические свойства металлов? Объясните эти свойства, основываясь на представлениях о металлической связи
Особое строение кристаллической решётки — наличие свободных электронов — объясняет физические свойства металлов, такие как пластичность (изменение формы при ударе), хорошая ковкость, металлический блеск, непрозрачность (свободные электроны взаимодействуют с падающими на металл квантами света), электропроводность (направленное движение свободных электронов от отрицательного к положительному полюсу под влиянием разности потенциалов), теплопроводность (высокая подвижность свободных электронов и колебание атомов, из-за чего температура по массе металла быстро выравнивается).
4. Почему некоторые металлы пластичные (например, медь), а другие — хрупкие (например, сурьма)?
При увеличении числа электронов на внешнем энергетическом уровне обеспечивается прочность отдельных слоёв ионов, препятствует их свободному скольжению, уменьшая пластичность. У меди на внешнем энергетическом уровне 1 электрон, у сурьмы — 5.
5. При «растворении» в соляной кислоте 12,9 г сплава, состоящего из меди и цинка, получили 2,24 л водорода (н. у.). Вычислите массовые доли (в процентах) цинка и меди в этом сплаве

6. Медно-алюминиевый сплав обработали 60 г соляной кислоты (массовая доля НСl — 10%). Вычислите массу и объём выделившегося газа (н. у.)

Тестовые задания
1. Наиболее ярко металлические свойства проявляет простое вещество, атомы которого имеют строение электронной оболочки
1) 2е, 1е
2) 2е, 2е
3) 2е, Зе
4) 2е, 4е
1) 2е, 1е
2. Наиболее ярко металлические свойства проявляет простое вещество, атомы которого имеют строение электронной оболочки
1) 2е, 2е
2) 2е, 8е, 2е
3) 2е, 8е, 8е, 2е
4) 2е, 8е, 18е, 8е, 2е
4) 2е, 8е, 18е, 8е, 2е
3. Хорошо проводит электрический ток твёрдое вещество, имеющее кристаллическую решётку
1) молекулярную
2) атомную
3) металлическую
4) ионную
3) металлическую
Вам также может понравиться
Строение металлов


Средняя оценка: 4.7
Всего получено оценок: 83.
Средняя оценка: 4.7
Всего получено оценок: 83.
Металлы – твёрдые элементы, сплавы которых широко применяются в промышленности, строительстве и повседневной жизни. Пластичность, твёрдость, тепло- и электропроводность, а также способность к плавке и ковке обусловлены строением металлов.
Электронное строение атома металла включает:
- положительно заряженное ядро;
- отрицательно заряженные электроны.
Ядро состоит из протонов и нейтронов. Количество протонов, заряд ядра и число электронов соответствуют порядковому номеру металла в периодической таблице.
Электроны в металлических атомах расположены намного дальше от ядра, чем электроны неметаллов. Этим объясняется лёгкость отделения валентных электронов, поэтому металлы всегда являются восстановителями в химических реакциях.
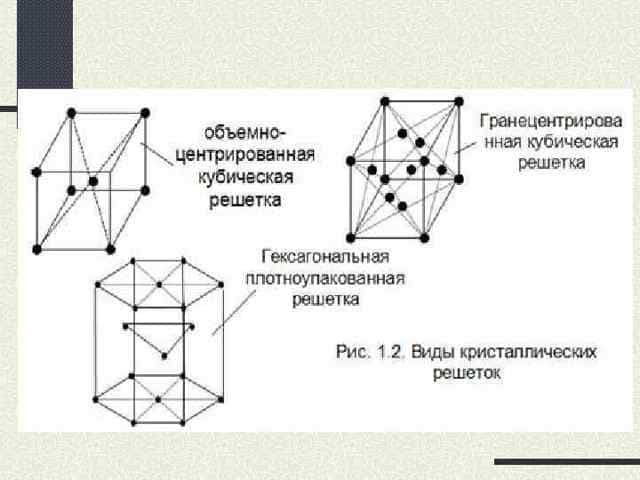
Атомы всех металлов, за исключением ртути, образуют кристаллические решётки. Кристаллическая решётка состоит из повторяющихся комплексов атомов – элементарных кристаллических ячеек, которые бывают трёх видов. Их отличия описаны в таблице строения металлов.
| Вид решётки | Характеристика | Примеры |
| Кубическая объёмно-центрированная (ОЦК) | Восемь ионов находятся по углам условного куба, один – в середине | Fe, Cr, Mo, W, V |
| Кубическая гранецентрированная | Ионы располагаются в углах куба и в центре каждой грани. Центр куба свободен | Cu, Ag, Ni, Pb, Al |
| Гексагональная плотноупакованная | Шестигранная призма. В углах и в центре между ними находятся ионы. Посередине призмы лежат ионы, образующие треугольник | Zn, Ti, Mg, Co, Zr |
Рис. 1. Виды решёток металлов.
Металлы отличаются от неметаллов характерными физическими свойствами:
- имеют металлический блеск;
- проводят электрический ток и тепло;
- не имеют запаха;
- обладают серебристо-серым цветом (исключение – медь и золото).
Благодаря пластичности и плавке металлы могут образовывать сплавы – смеси химических элементов. Большую часть сплавов составляют металлы, остальное – случайные примеси и специально вводимые вещества. Сплавы отличаются высокой прочностью, упругостью, хрупкостью. Широко применяются сплавы на основе железа (чёрные металлы) и алюминия (цветные металлы).
Высокую электропроводность обуславливают свободные электроны, перемещающиеся по кристаллической решётке под действием электрических полей. При нагревании электропроводность уменьшается.
Классификация металлов приведена в таблице.
| Признак | Вид | Пример |
| Температура кипения | Легкоплавкие (Т1000°С) | Au, Cu, Ni |
| Плотность | Лёгкие (ρ5 г/см3) | Os |
| Твёрдость | Мягкие – режутся ножом | Na, Rb, Cs |
| Твёрдые – используются для резки | Cr |
В химии по структуре орбиталей атома металла различают s-, p-, d-, f-металлы.
Металлы являются восстановителями и вступают в реакцию с неметаллами, образуя оксиды, гидроксиды, соли. Самыми активными являются щелочные и щелочноземельные металлы, расположенные в I и II группах таблицы Менделеева. Благородные металлы (Au, Ag, Pt) малоактивны и не взаимодействуют с кислородом и водой.
 Рис. 2. Шкала активности металлов.
Рис. 2. Шкала активности металлов.
Особенности химического взаимодействия металлов с другими элементами описаны в таблице.
| Взаимодействие | Продукты | Уравнение |
| С кислородом | Оксиды | 2Mg + O2 → 2MgO |
| С серой | Сульфиды | Zn + S → ZnS |
| С азотом | Нитриды | 6Li + N2 → 2Li3N |
| С фосфором | Фосфиды | 3Ca + 2P → Ca3P2 |
| С галогенами | Галогениды | 2Na + Cl2 → 2NaCl |
| С водой | Гидроксиды | 2Na + 2H2O → 2NaOH + H2 |
| С кислотами | Соли | 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 |
| С солями (замещают менее активные металлы) | Соль | 2Fe + Cu2SO4 → Fe2SO4 + 2Cu |
Золото растворяется в царской водке (смеси соляной и азотной кислот), серебро – в концентрированной азотной и горячей серной кислотах.
 Рис. 3. Золото.
Рис. 3. Золото.
Рассмотрели особенности строения атомов металлов, физические и химические свойства. Металлы состоят из элементарных кристаллических ячеек, отличающихся конфигурацией.
Элементы обладают металлическим блеском, электропроводностью, пластичностью, твёрдостью. Металлы – восстановители. Наиболее активные находятся в I и II группах таблицы Менделеева.
Металлы реагируют с кислородом, водой, кислотами, галогенами и неметаллами.
Чтобы попасть сюда — пройдите тест.
Средняя оценка: 4.7
Всего получено оценок: 83.
А какая ваша оценка?
Гость завершил
Тест «Алые паруса»с результатом 6/12
Гость завершил
Тест «Тарас Бульба»с результатом 11/16
Гость завершил
Тест «Евгений Онегин»с результатом 13/16
Гость завершил
Тест «Кавказский пленник»с результатом 9/11
Гость завершил
Тест «Мертвые души»с результатом 10/19
Гость завершил
Тест «Толстый и тонкий»с результатом 3/8
Гость завершил
Тест «Евгений Онегин»с результатом 14/16
Гость завершил
Тест «Левша»с результатом 12/12
Не подошло? Напиши в х, чего не хватает!
Разница между металлами и неметаллами
Химики разделили все простые вещества на металлы и неметаллы. Они сильно различаются по строению, физическим и химическим свойствам. Многие из них легко отличить визуально, например медь – металл, а бром – неметалл. Однако чтобы не допустить ошибку при классификации элементов, лучше опираться на знание четких признаков, свойственных металлам и неметаллам.
- Содержание статьи
Элементы, отдающие электроны с внешнего энергетического уровня, называют металлами. Металлы – это, как правило, твердые вещества (особняком стоит ртуть, которая при нормальных условиях является жидкостью).
Элементы, принимающие электроны на внешний энергетический уровень, являются неметаллами. Они находятся в различных агрегатных состояниях. Кислород и азот – это газы, бром – жидкость, а к твердым веществам относятся, например, мышьяк, углерод и бор.
Сравнение
Все металлы наделены металлическим блеском, они превосходные проводники электрического тока и тепла. Большинство из них пластичны, при физическом воздействии металлы легко меняют форму. Неметаллы, наоборот, плохие проводники тепла и электрического тока.
Строение металлов и неметаллов – главная отличительная характеристика. Неметаллы – обладатели большего числа неспаренных электронов, размещающихся на внешних уровнях. Металлы имеют металлическую кристаллическую решетку. А неметаллам присущи молекулярные (к примеру, кислороду, хлору и сере) и атомарные (углероду, образующему алмаз) кристаллические решетки.
У металлов маленькая электроотрицательность, а значит и окислительно-восстановительный потенциал невелик. Они, как правило, принимают электроны и окисляются, проявляя восстановительные свойства.
Неметаллы, наделенные большой электроотрицательностью и значительным окислительно-восстановительным потенциалом, могут выступать как в качестве окислителей, так и в качестве восстановителей (такое возможно в присутствии наиболее мощного окислителя).
У металлов есть весьма интересное свойство – амфотерность. Амфотерным металлам присущи свойства и металлов, и неметаллов. Например, цинк, находясь в состоянии высшей степени окисления, ведет себя как неметалл.
Выводы TheDifference.ru
- В физических свойствах.
- В строении атомов.
- В кристаллических решетках.
- В химических свойствах.
- В способности проявлять окислительно-восстановительные свойства.
- В амфотерности металлов.
Чем металлы отличаются от неметаллов
Всем известно, что металлы легко отличить от неметаллов характерным ярким серебристым или золотистым цветом, блеском их поверхности. Металлы пластичны, их куют, прокатывают, штампуют. Кроме того, металлы хорошо проводят тепло и электрический ток.
Это так называемые физические свойства металлов. Есть у них и химические свойства. Окислы металлов обладают щелочными свойствами, и при соединении с водой они образуют щелочные растворы.
Окислы неметаллов имеют кислотные свойства и, соединяясь с водой, образуют кислоты.
Все это было хорошо известно еще более 200 лет тому назад во времена Ломоносова, Лавуазье. А вот причины такого различия свойств металлов и неметаллов были найдены значительно позже, после того как было открыто электронное строение атомов. Напомним, что электрон был открыт лишь в 1895 году.
Электронное строение металлов. Каждому элементу Д. И. Менделеев еще в 1869 году приписал определенный атомный номер и поместил его в периодическую систему с этим номером, ничего еще не зная об электронах. Позже выяснилось, что номер элемента точно совпадает с числом электронов, вращающихся по нескольким орбитам.
По наиболее близкой к ядру орбите вращаются обычно два электрона. По второй орбите, более удаленной от ядра, могут вращаться восемь электронов. Третья, еще более удаленная от ядра орбита, может вместить до 18 электронов.
Если номер орбиты обозначить буквой n, а число электронов, которые она вмещает, через N, то количество электронов, несущихся на каждой орбите, можно выразить главным квантовым числом: N=2n2.
Возьмем, например, такой металл как алюминий. Его атомный номер 13 в таблице Менделеева. Это значит, что вокруг его ядра вращаются по разным орбитам 13 электронов. По первой орбите (n= 1) число электронов N окажется равным двум (N = 2). По второй орбите (n = 2) число электронов будет равно 8 (N = 2·22 = 8).
По третьей орбите будут вращаться все остальные электроны и их окажется 13—(2 + 8)= 3. Это в то время, как третья орбита могла бы вместить 18 электронов. Выходит, что третья, наружная орбита у алюминия недоукомплектована. Три электрона, вращающихся по ней, наиболее удалены от ядра и поэтому наименее прочно связаны с ним.
Они могут легко оторваться от своего ядра и перейти к соседнему атому.
Неукомплектованные орбиты. Выяснилось, что у всех металлов наружные электронные орбиты оказались недоукомплектованными. По ним вращаются, как правило, один, два, три и в редких случаях — четыре электрона. В то же время у неметаллов наружные электронные орбиты, наоборот, полностью или почти полностью укомплектованы.
Переходом наружных электронов от одних атомов к другим и было объяснено явление электрического тока. Числом электронов на наружной орбите было объяснено свойство валентности металлов.
Электронное строение атомов дало ключ к объяснению таких явлений, как ферромагнетизм, полиморфизм, потенциал ионизации.
Все эти вопросы получили отражение в разработанной советскими физиками теории металлического состояния.
Чем различаются строение атомов металлов и неметаллов?
1. Чем отличается строение атомов металлов от строения атомов неметаллов и как это отражается на химических свойствах металлов? Атомы металлов обладают большими радиусами и содержат на внешних оболочках от одного до трех электронов.
Элементы—неметаллы в таблице Менделеева Характерной особенностью неметаллов является большее по сравнению с металлами число электронов на внешнем энергетическом уровне их атомов и высокие значения электроотрицательности.
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
Какую особенность строения имеют Атомы металлических элементов в отличии от неметаллических?
Металлы — химические элементы, атомы которых легко отдают электроны внешнего электронного слоя, превращаясь в положительные ионы. Атомы большинства металлов содержат на внешнем уровне содержится электрона. Металлы характеризуются низкими значениями электроотрицательности.
Атомы металлов характеризуются небольшим числом электронов на внешнем энергетическом уровне (один-три электрона) и большим радиусом атома. Строение атомов металлов определяет их положение в периодической системе химических элементов Д. И. Менделеева.
В периодической системе Менделеева металлы расположены ниже диагонали бор-астат. Т. е. это представители I-III групп (главных подгрупп, начиная со второго периода) и все представители побочных подгрупп.
Как в периодической системе Менделеева располагаются элементы металлы?
Металлы содержатся во всех группах периодической системы. Они в основном расположены в левой нижней части системы, условная граница между элементами—металлами и элементами-неметаллами в главных подгруппах проходит по диагонали B (бор) — Si (кремний) – As (мышьяк) — Te (теллур) – At (астат).
Металлы можно ковать, прокатывать в листы, вытягивать в проволоку. Неметаллы не имеют общих физических свойств и не похожи на металлы. У них отсутствует металлический блеск. У большинства неметаллов низкие электропроводность и теплопроводность.
В отличие от металлов неметаллы обладают низкой электропроводностью, разнообразной окраской, отсутствием металлического блеска и разнообразием агрегатных состояний при нормальных условиях.
Простых веществ—неметаллов больше, чем химических элементов—неметаллов. Это обусловлено явлением аллотропии. Аллотропией называют способность атомов одного и того же химического элемента образовывать несколько простых веществ – аллотропных модификаций.
НЕМЕТАЛЛЫ — химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов. К неметаллам обычно относят 22 элемента: газы водород, азот, кислород, фтор, хлор и благородные газы; жидкость бром; твердые тела бор,… …
Физические свойства неметаллов. Они могут иметь молекулярное и немолекулярное строение. Благодаря различиям в строении, простые вещества неметаллы существуют в трех агрегатных состояниях: Молекулярные: Летучие, газообразные, бесцветные кислород, водород.
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы. Химические элементы металлы, образующие простые вещества с металлическими свойствами, располагаются в периодической таблице слева ниже диагонали «водород — бор — кремний — мышьяк — теллур — астат — № 118».
Атомы металлов характеризуются небольшим числом электронов на внешнем энергетическом уровне (один-три электрона) и большим радиусом атома. Строение атомов металлов определяет их положение в периодической системе химических элементов Д. И. Менделеева.
В твердом состоянии любой металл обладает кристаллическим строением. Для этого вида строения характерна упорядоченность расположения ионов (атомов). Элементарные ячейки периодически повторяются в пространстве, образуя кристаллическую решетку.
Атомы металлов характеризуются небольшим числом электронов на внешнем энергетическом уровне (один-три электрона) и большим радиусом атома. Строение атомов металлов определяет их положение в периодической системе химических элементов Д. И. Менделеева.
Общие физические свойства металлов
- Пластичность — способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
- Металлический блеск и непрозрачность. …
- Электропроводность . …
- Теплопроводность. …
- Твердость. …
- Плотность. …
- Температуры плавления и кипения.
29 июн. 2013 г.






