- Электронное строение азота
- Строение молекулы азота
- Физические свойства азота
- Химические свойства азота
- Важнейшие соединения азота
- Аммиак
- Азотная кислота
- Оксиды азота
- Вопросы для самопроверки
- Ответы
- 2.3.3. Химические свойства азота и фосфора
- Взаимодействие азота с металлами
- Взаимодействие азота с неметаллами
- Взаимодействие азота со сложными веществами
- Химические свойства фосфора
- Взаимодействие фосфора с неметаллами
- Взаимодействие фосфора с металлами
- Взаимодействие фосфора со сложными веществами
- V группа главная подгруппа периодической таблицы Менделеева (азот, фосфор)
- Общая характеристика элементов 5 группы главной подгруппы
- Нахождение в природе азота и фосфора
- Аллотропные модификации фосфора
- Азот
- Способы получения азота
- Химические свойства азота
- Фосфор
- Способы получения фосфора
- Химические свойства фосфора
- С чем реагирует азот? — экобаланс
- Положение азота в периодической системе химических элементов
- Электронное строение азота
- Физические свойства азота и нахождение в природе
- Строение молекулы азота
- Природные соединения азота
- Получение азота
- Химические свойства азота
- Азот в составе аммиака
- Азот в составе соли аммония
- Оксид азота II – NO
- Оксид азота III – N2O3
- Оксид азота IV – NO2
- Окислительные свойства азота
- Восстановительные свойства азота
Азот (N2) — первый представитель V группы главной подгруппы и 2 периода периодической системы химических элементов Д. И. Менделеева.
Если рассматривать местоположение азота в длиннопериодной таблице Менделеева, то там он занимает лидирующее место в 15 группе.
Для представителей этой группы было предложено название пниктогены (от греческого корня πνῑ́γω — удушливый, плохо пахнущий). Явно это относится к водородным соединениям представителей данной группы.
Электронное строение азота
Рассмотрим строение атома и электронную конфигурацию азота, а затем сделаем некоторые заключения.
Атомный или порядковый номер азота равен 7, что соответствует количеству электронов и протонов в ядре. Молярная масса равна 14,00728 г/моль, а количество нейтронов в атоме этого изотопа равно семи.
Теперь перейдем к электронному строению. В основном состоянии электронная формула азота: 1s2 2s2 2p3, в сокращенном виде — [He]2s2 2p3. На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.
Исходя из такой конфигурации, азот может образовывать только 3 связи по обменному механизму и еще одну по донорно-акцепторному механизму. Это связано с тем, что на втором подуровне у азота больше нет вакантных орбиталей, куда могли бы распариться электроны с 2s-подуровня. Отсюда вытекает максимальная валентность азота IV.
Для азота характерен весь спектр возможных степеней окисления от −3 до +5.
Давайте рассмотрим шкалу, где отражены соединения азота в различных веществах.

Строение молекулы азота
Азот — двухатомная молекула, атомы которой связаны между собой прочной тройной связью. Длина связи — 0,110 нм.
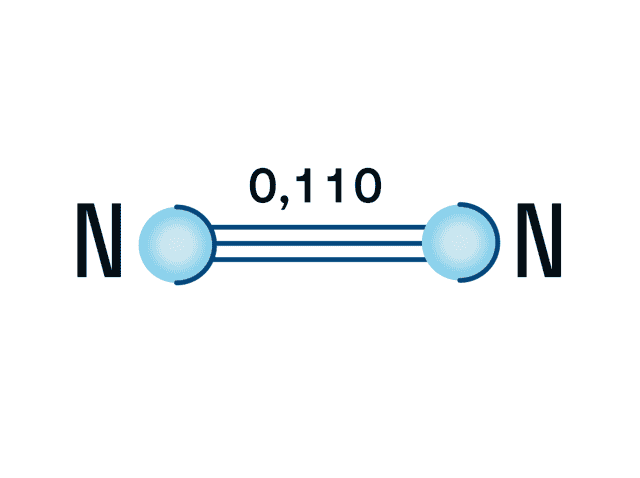
Почему именно тройная связь и из чего она состоит?
Напомним, что у каждого атома в молекуле азота 3 неспаренных электрона, которые и образуют впоследствии тройную связь, которая, в свою очередь, состоит из одной сигма-связи и двух пи-связей.
Физические свойства азота
Азот как простое вещество — бесцветный газ, который не имеет запаха и плохо растворяется в воде. По своей молярной массе азот легче, чем воздух.
Благодаря наличию тройной неполярной связи и относительно маленьким радиусам атомов азот имеет низкие температуры кипения и плавления: tпл = −210 °С и tкип = −196 °С. Аллотропных модификаций азот не имеет. Несмотря на то, что основное состояние азота — газообразное, он бывает еще и жидким.
Например, 1 литр жидкого азота при нагревании до 20 °С превращается в 700 литров газообразного азота. Более подробную информацию можно узнать в нашем видео:
Химические свойства азота
Азот химически малоактивен из-за наличия все той же тройной связи. Она же обуславливает малую термическую устойчивость соединений азота при нагревании. В химических реакциях азот может проявлять себя и как окислитель, и как восстановитель благодаря широкому спектру возможных степеней окисления.
Как восстановитель азот реагирует:
- с фтором
N2 + F2 = 2NF3 - с кислородом
N2 + O2 = 2NO
Эти реакции проходят при температуре выше 1000 градусов Цельсия либо в электрическом заряде.
Как окислитель азот реагирует:
- с металлами
N2 + 6Li = 2Li3N
азот реагирует при обычных условиях только с литием, а с щелочноземельными металлами — только при нагревании; - с водородом
N2 +3H2 = 2NH3реакция протекает обратимо в присутствии металлического железа в качестве катализатора.
Рассмотрим способы получения азота. В промышленности его получают фракционной перегонкой жидкого воздуха, а вот в лаборатории азот получают иначе. Вот лишь некоторые способы:
- реакция взаимодействия хлорида аммония и нитрита натрия
NaNO2 + NH4Cl = N2 + NaCl + 2H2O - разложение некоторых солей аммония (на примере нитрита аммония)
NH4NO2 = N2 + 2H2O
Азот — основной компонент любого белка в организме человека. Давайте рассмотрим способы получения исходных компонентов для синтеза собственных белков.
Важнейшие соединения азота
Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:
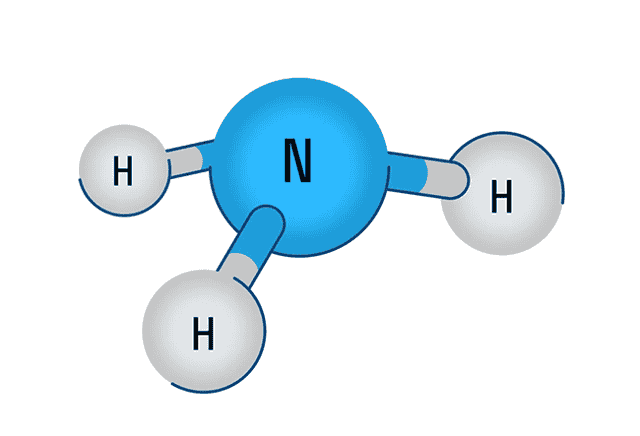
Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания.
В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды.
Вас когда-нибудь приводили в чувства после потери сознания ваткой, смоченной чем-то гадко пахнущим? Поздравляю, это было ваше первое знакомство с раствором аммиака в воде.
Поговорим теперь о химических свойствах этого газа.
В отличие от самого азота, аммиак является крайне реакционноспособным соединением. Так как азот находится в аммиаке в своей низшей степени окисления (−3), то аммиак проявляет только восстановительные свойства.
Например, аммиак реагирует с кислородом (при нагревании):
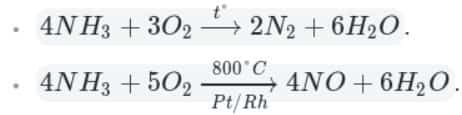
Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
- 6NH3 + 8KClO3 + 6NaOH = 6NaNO3 + 8KCl + 12H2O
- 10NH3 + 6KMnO4 + 9H2SO4 = 5N2 + 6MnSO4 + 3K2SO4 + 24H2O
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
- NH3 + HCl = NH4Cl
- NH3 + H2SO4 = NH4HSO4
А теперь рассмотрим получение аммиака. Различают два типа способов: промышленный и лабораторный.
-
Промышленный способ — синтез из простых веществ:
-
Лабораторный способ:
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.
Азотная кислота
Азотная кислота — одна из важнейших неорганических кислот. Это летучая бесцветная жидкость с резким запахом, которая способна смешиваться с водой в любых пропорциях.
Получают ее в промышленности в несколько этапов. Рассмотрим подробнее каждый из них:
-
Окисление аммиака кислородом воздуха на платиновом катализаторе
4NH3 + 5O2 = 4NO + 6H2O -
Окисление оксида азота (II)
2NO + O2 = 2NO2 -
Поглощение образующегося оксида азота (IV) водой в избытке воздуха
4NO2 + O2 + 2H2O = 4HNO3
Для азотной кислоты характерны особые химические свойства исходя из ее концентрации.
Например, с металлами данная кислота никогда не будет реагировать с выделением газообразного водорода. Рассмотрим таблицу с примерами металлов с различными концентрациями азотной кислоты:
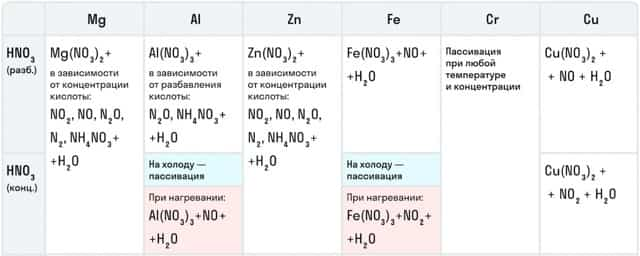
Также азотная кислота как сильный окислитель способна окислять некоторые неметаллы до их кислот. Давайте рассмотрим примеры:
Азотная кислота в соотношении 1:3 с соляной кислотой образуют смесь под названием царская водка. Это желтовато-оранжевая дымящаяся жидкость, которая получила свое название от алхимиков благодаря способности растворять «царские» металлы — золото и платину.
Оксиды азота
В отличие от других химических элементов, азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислотным. В таблице показали, какой оксид какой кислоте соответствует:
Оксид азота (I) N2O. Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде.
У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад.
При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.
Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень неустойчивое и существует только при низких температурах. В твердом и жидком состоянии оксид азота (III) окрашен в ярко-синий цвет. При температуре выше 0 градусов разлагается до оксида азота (II) и оксида азота (IV).
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO2 в смеси. Эти оксиды хорошо растворимы в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Вопросы для самопроверки
-
Какую связь образуют между собой атомы азота?
-
Одинарную.
-
Двойную.
-
Тройную.
-
-
Выберите высшую и низшую степени окисления азота:
-
−3 и +5,
-
−5 и +3,
-
0 и +4,
-
−3 и +3.
-
-
Максимальная валентность азота равна:
-
В каком качестве выступает аммиак в окислительно-восстановительных реакциях?
-
Только окислитель.
-
Только восстановитель.
-
И окислитель, и восстановитель.
-
Не участвует в реакциях с изменением степеней окисления.
-
-
Выберите формулу веселящего газа:
Ответы
2.3.3. Химические свойства азота и фосфора
Химический элемент азот образует только одно простое вещество. Данное вещество является газообразным и образовано двухатомными молекулами, т.е. имеет формулу N2.
Не смотря то, что химический элемент азот имеет высокую электроотрицательность, молекулярный азот N2 является крайне инертным веществом. Обусловлен данный факт тем, что в молекуле азота имеет место крайне прочная тройная связь (N≡N).
По этой причине практически все реакции с азотом протекают только при повышенных температурах.
Взаимодействие азота с металлами
Единственное вещество, которое реагирует с азотом в обычных условиях – литий:
Интересным является тот факт, что с остальными активными металлами, т.е. щелочными и щелочноземельными, азот реагирует только при нагревании:
Взаимодействие азота с металлами средней и низкой активности (кроме Pt и Au) также возможно, однако требует несравнимо более высоких температур.
Нитриды активных металлов легко гидролизуются водой:
А также растворами кислот, например:
Взаимодействие азота с неметаллами
Азот реагирует с водородом при нагревании в присутствии катализаторов. Реакция является обратимой, поэтому для повышения выхода аммиака в промышленности процесс ведут при высоком давлении:
Как восстановитель азот реагирует со фтором и кислородом. Со фтором реакция идет при действии электрического разряда:
С кислородом реакция идет под действием электрического разряда или при температуре более 2000 оС и является обратимой:
Из неметаллов азот не реагирует с галогенами и серой.
Взаимодействие азота со сложными веществами
В рамках школьного курса ЕГЭ можно считать, что азот не реагирует ни с какими сложными веществами кроме гидридов активных металлов:
Химические свойства фосфора
Существует несколько аллотропных модификаций фосфора., в частности белый фосфор, красный фосфор и черный фосфор.
Белый фосфор образован четырехатомными молекулами P4, не является устойчивой модификацией фосфора. Ядовит. При комнатной температуре мягкий и подобно воску легко режется ножом. На воздухе медленно окисляется, и из-за особенностей механизма такого окисления светится в темноте (явление хемилюминесценции). Даже при слабом нагревании возможно самопроизвольное воспламенение белого фосфора.
Из всех аллотропных модификаций белый фосфор наиболее активен.
Красный фосфор состоит из длинных молекул переменного состава Pn. В некоторых источниках указывается то, что он имеет атомное строение, но корректнее все-таки считать его строение молекулярным.
Вследствие особенностей строения является менее активным веществом по сравнению с белым фосфором, в частности в отличие от белого фосфора на воздухе окисляется значительно медленнее и для его воспламенения требуется поджиг.
Черный фосфор состоит из непрерывных цепей Pn и имеет слоистую структуру схожую со структурой графита, из-за чего и внешне похож на него. Данная аллотропная модификация имеет атомное строение.
Самый устойчивый из всех аллотропных модификаций фосфора, наиболее химически пассивен.
По этой причине, рассмотренные ниже химические свойства фосфора следует относить прежде всего к белому и красному фосфору.
Взаимодействие фосфора с неметаллами
Реакционная способность фосфора является более высокой, чем у азота. Так, фосфор способен гореть после поджига при обычных условиях, образуя кислотный оксид Р2O5:
- а при недостатке кислорода оксид фосфора (III):
- Реакция с галогенами также протекает интенсивно. Так, при хлорировании и бромировании фосфора в зависимости от пропорций реагентов образуются тригалогениды или пентагалогениды фосфора:
- Ввиду существенно более слабых окислительных свойства йода по сравнению с остальными галогенами, возможно окисление фосфора йодом только до степени окисления +3:
- В отличие от азота фосфор с водородом не реагирует.
Взаимодействие фосфора с металлами
Фосфор реагирует при нагревании с активными металлами и металлами средней активности образуя фосфиды:
- Фосфиды активных металлов подобно нитридам гидролизуются водой:
- А также водными растворами кислот-неокислителей:
Взаимодействие фосфора со сложными веществами
Фосфор окисляется кислотами окислителями, в частности, концентрированными азотной и серной кислотами:
Следует знать, что белый фосфор реагирует с водными растворами щелочей. Однако, ввиду специфичности умение записывать уравнения таких взаимодействий на ЕГЭ по химии пока еще не требовалось.
- Тем не менее, тем, кто претендует на 100 баллов, для собственного спокойствия, можно запомнить следующие особенности взаимодействия фосфора с растворами щелочей на холоду и при нагревании.
- На холоду взаимодействие белого фосфора с растворами щелочей протекает медленно. Реакция сопровождается образованием газа с запахом тухлой рыбы — фосфина и соединения с редкой степенью окисления фосфора +1:
- При взаимодействии белого фосфора с концентрированным раствором щелочи при кипячении выделяется водород и образуется фосфит:
V группа главная подгруппа периодической таблицы Менделеева (азот, фосфор)
К элементам главной подгруппы V группы периодической таблицы Менделеева относятся:
- Азот N
- Фосфор P
- Мышьяк As
- Сурьма Sb
- Висмут Bi
Общая характеристика элементов 5 группы главной подгруппы
От N к Bi (сверху вниз в периодической таблице)
Увеличивается
- атомного радиуса,
- металлических, основных, восстановительных свойств,
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
- Электронные конфигурации у данных элементов схожи, все они содержат 5
электронов на внешнем слое ns2np3: - N – 2s2 2p3;
- P – 3s23p3;
- As – 4s2 4p3;
- Sb – 5s2 5p3;
- Bi – 6s2 6p3
- Db – 7s27p3
- Электронное строение азота и фосфора
Нахождение в природе азота и фосфора
Азот – это основной компонент воздуха (79% по
массе). В земной коре азот встречается в основном в виде нитратов. Входит в
состав белков, аминокислот и нуклеиновых кислот в живых организмах.
Фосфор встречается только в виде соединений. В
основном это апатиты (например, Ca3(PO4)2),
фосфориты и др.). Фосфор входит в состав важнейших биологических соединений — фосфолипидов.
Аллотропные модификации фосфора
Азот
Способы получения азота
Лабораторный способ
- Разложение азидов щелочных металлов:
2NaN3 → 2Na + 3N2
- Разложение некоторых солей аммония:
NH4NO2 → N2 + 2H2O
(NH4)2Cr2O7 → N2 + 4H2O + Cr2O3
- Окисление аммиака и солей аммония:
- 4NH3 + 3O2 → 2N2 + 6H2O
- 8NH3 + 3Br2 → 2N2 + 6NH4Br
- NH4Cl + NaNO2 → N2 + NaCl + 2H2O
- Восстановление оксида меди (II) аммиаком при температуре ~700°C:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
- Пропускание воздуха над раскаленной медью. При этом медь поглощает кислород, а азот с примесями остается:
2Cu + O2 = 2CuO
Промышленный способ
- Т.к.
азот в свободном состоянии присутствует в воздухе, то в промышленности его и
получают путем разделения воздушной смеси (ректификация жидкого воздуха).
Кроме
этого, широко применяются азотные установки и станции, для адсорбционного и
мембранного разделения
Химические свойства азота
- Молекула азота химически устойчива, вследствие чего азот химически инертен.
- Но при определенных условиях он
реагирует с металлами, тяжелее с неметаллами. - В реакциях с металлами он выступает в
качестве восстановителя, а в реакциях с неметаллами – в качестве окислителя.
Со сложными веществами азот практически не взаимодействует,
т.к.
его реакционная способность очень мала.
- Реакция
возможна только с активными веществами и в жестких условиях. - Взаимодействие азота с простыми веществами
- С кислородом
- С кислородом взаимодействует только при
температуре электрических искровых разрядов (2000оС, в природе – во
время грозы): - N2 + O2 ⇄ 2NO – Q
- Процесс сопровождается поглощением теплоты (эндотермическая реакция)
- С галогенами (F, Cl, Br, I)
- Взаимодействует только со фтором, с образованием фторида азота:
- N2 + 3F2 = 2NF3
- С водородом
- Взаимодействует с водородом с образованием аммиака. Реакция обратима, поэтому для смещения равновесия в сторону продуктов реакции реакцию проводят в присутствии катализатора, при высоком давлении и высокой температуре:
- N2 + ЗН2 ⇄ 2NH3
- При этом
происходит выделение теплоты (экзотермическая реакция) - С серой
- Не
взаимодействует - С фосфором
- Не взаимодействует
- С углеродом
- Реакция протекает при высокой
температуре (2000оС или действие электрического
разряда) с образованием дициана: - 2С + N2 → N≡C–C≡N
- В присутствии соды реакция протекает с образованием цианид натрия:
- 2N2 + 5C + 2Na2CО3 = 4NaCN + 3CО2↑
- С кремнием
- Взаимодействие
с кремнием с образованием нитрида кремния - 2N2 + 3Si = Si3N4
- С металлами
- Реагирует с щелочными и щелочноземельными металлами с образованием нитридов
- N2 + 6Li = 2Li3N
- N2 + 6Cs = 2Cs3N
- N2 + 3Mg = Mg3N2
- Взаимодействие возможно как с чистым азотом, так и при горении металлов на
воздухе - Взаимодействие азота со сложными веществами
- С водой
- Не
взаимодействует - С кислотами
- Не
взаимодействует - Сводными растворами щелочей
- Не
взаимодействует - С солями
- Не
взаимодействует - С оксидами
- Не
взаимодействует - С гидридами активных металлов
- Реагирует с образованием нитридов:
- N2 + 3LiH → Li3N + NH3
Фосфор
Способы получения фосфора
- Основной способ получения белого фосфора состоит в вакуум-термическом восстановлении природных минералов, содержащих Ca3(PO4)2.:
Ca3(PO4)2 + 3SiO2 + 5C → 3CaSiO3 + 5CO + 2P
Таким
способом получается фосфор
в газообразном состоянии
- Кроме фосфатов используют и другие
неорганические соединения фосфора, например:
4HPO3 + 10C → P4 + 2H2O + 10 CO
- Красный
и черный фосфор получают из белого фосфора, при температуре
около 400ºС, давлении около 12000 Мпа в
присутствии катализатора Hg
Химические свойства фосфора
Фосфор вступает в реакции как с металлами, так и неметаллами. В реакциях с элементами, расположенными ниже и левее в Периодической системе фосфор выступает в качестве окислителя, с элементами, расположенными выше и правее – в качестве восстановителя.
- При недостатке окислителя образуются соединения
фосфора (III), при избытке — соединения фосфора (V) - Взаимодействие фосфора с простыми веществами
- С кислородом
- Взаимодействие с кислородом воздуха приводит
к образованию оксидов –
ангидридов соответствующих кислот: - 4P + 3O2 → 2P2O3
- 4P + 5O2 → 2P2O5
- С галогенами (F, Cl, Br, I)
- Взаимодействует с галогенами с
образованием галогенидов с общей формулой PHal3 – при недостатке галогена и
PHal5 – при избытке галогена: - 2P + 3Cl2 → 2PCl3
- 2P + 5Cl2 → 2PCl5
- С водородом
- Непосредственно не
взаимодействует - С серой
- При взаимодействии с серой образуются сульфиды:
- 2P + 3S → P2S3
- 2P + 5S → P2S5
- Сазотом
- Не взаимодействует
- С углеродом
- Не
взаимодействует - С кремнием
- С кремнием азот реагирует в очень жестких условиях, с образованием нитридов:
- 3Si + 2N2→ Si3N4
- С металлами
- В реакциях с
активными металлами фосфор выступает в качестве окислителя, образуя фосфиды
металлов: - 2Р + ЗСа =
Са3Р2 - Р + 3Na = Na3P
- Взаимодействие фосфора со сложными веществами
- С водой
- Красный фосфор реагирует с водой при температуре 700-900ºС и в
присутствии катализатора (Cu, Pt, Ti, Zr): - 2P + 8H2O = 2H3PO4 + 5H2
- С кислотами
- Взаимодействует с кислотами – окислителями:
- Р + 5HNО3(конц.) = Н3РО4 + 5NО2 + Н2О
- ЗР + 5HNО3(разб.) + 2Н2О = ЗН3РО4 + 5NO
- 2Р + 5H2SО4(конц.)= 2Н3РО4 + 5SО2 + 2Н2О
- Сводными растворами щелочей
- С щелочными растворами вступает в реакции диспропорционирования, с образованием фосфина:
- 4Р + ЗКОН + 3Н2О = РH3↑ + ЗКН2PО2
- 8Р + ЗВа(ОН)2+ 6Н2О = 2PH3↑ +ЗВа(Н2PО2)2
- С солями
- Не
взаимодействует - С оксидами
- Взаимодействует
с сильными окислителями: - 8Р+ 10NО2 = 4P2О5 + 5N2
С чем реагирует азот? — экобаланс
8 ноября 2021
Азот относится к жизненно важным элементам, так как входит в состав молекул белков и нуклеиновых кислот.
Положение азота в периодической системе химических элементов
Азот расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение азота
Электронная конфигурация азота в основном состоянии:
Атом азота содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии.
Следовательно, атом азота может образовать 3 связи по обменному механизму и 1 связь по донорно-акцепторному механизму. Таким образом, максимальная валентность азота в соединениях равна IV.
Также характерная валентность азота в соединениях — III.
Степени окисления атома азота – от -3 до +5. Характерные степени окисления азота -3, 0, +1, +2, +3, +4, +5.
В природе азот встречается в виде простого вещества (входит в состав воздуха, объемная доля азота в воздухе равна 78 %) и в составе минералов, в основном селитр.
Химический элемент азот входит в состав белков и аминокислот, поэтому он содержится в растениях, организмах человека и животных. Для повышения урожая азот вносят в почву в виде азотных удобрений. Азот также входит в состав многих лекарств, синтетических волокон и взрывчатых веществ.
Физические свойства азота и нахождение в природе
Азот в природе существует в виде простого вещества газа N2. Нет цвета, запаха и вкуса. Молекула N2 неполярная, следовательно, в воде азот практически нерастворим.
Азот – это основной компонент воздуха (79% по массе). В земной коре азот встречается в основном в виде нитратов. Входит в состав белков, аминокислот и нуклеиновых кислот в живых организмах.
Строение молекулы азота
Связь между атомами в молекуле азота – тройная, т.к. у каждого атома в молекуле по 3 неспаренных электрона. Одна σ-связь (сигма-связь) и две — π-связи.
Структурная формула молекулы азота:
Структурно-графическая формула молекулы азота: N≡N.
Природные соединения азота
В природе азот встречается в виде следующих соединений:
- Воздух – во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 – индийская селитра, калиевая селитра
- NaNO3 – чилийская селитра, натриевая селитра
- NH4NO3 – аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако, следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.
Получение азота
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения из сжиженного воздуха получают азот.
- Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.
- В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
- NH4NO2 → (t) N2 + H2O
- Также азот можно получить путем восстановления азотной кислоты активными металлами.
- HNO3(разб.) + Zn → Zn(NO3)2 + N2 + H2O
Химические свойства азота
Азот восхищает – он принимает все возможные для себя степени окисления от -3 до +5.
Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.
- Реакция азота с металлами.
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
- N2 + Li → Li3N (нитрид лития)
- N2 + Mg → (t) Mg3N2
- N2 + Al → (t) AlN
- Реакция азота с неметаллами.
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
N2 + H2 ⇄ (t, p) NH3
Азот в составе аммиака
Амиак – то бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях, называется нашатырным спиртом.
- В промышленности аммиак получают прямым взаимодействием азота и водорода.
- N2 + H2 ⇄ (t, p) NH3
- В лабораторных условиях сильными щелочами действуют на соли аммония.
- NH4Cl + NaOH → NH3 + NaCl + H2O
- Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
Образует нестойкое соединение – гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
NH3 + H2O ⇄ NH4OH
- Основные свойства аммиака.
- Как основание аммиак способен реагировать с кислотами с образованием солей.
- NH3 + HCl → NH4Cl (хлорид аммония)
- NH3 + HNO3 → NH4NO3 (нитрат аммония)
- Восстановительные свойства аммиака.
Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные восстановительные свойства. Его используют для восстановления металлов из их оксидов.
NH3 + FeO → N2↑ + Fe + H2O
NH3 + CuO → N2↑ + Cu + H2O
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается выделением NO.
NH3 + O2 → (t) N2 + H2O
NH3 + O2 → (t, кат) NO + H2O
Азот в составе соли аммония
- Получение соли аммония состоит в следующей химической реакции с азотом:
- NH3 + H2SO4 → NH4HSO4 (гидросульфат аммония, избыток кислоты)
- 3NH3 + H3PO4 → (NH4)3PO4
- Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода – реакция идет.
- Реакции соли аммония с кислотами.
NH4Cl + H2SO4 → (NH4)2SO4 + HCl↑
- Реакции соли аммония с щелочами.
В реакциях с щелочами образуется гидроксид аммония – NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
NH4Cl + KOH → KCl + NH3 + H2O
- Реакции соли аммония с солями.
(NH4)2SO4 + BaCl2 = BaSO4↓ + NH4Cl
- Реакция гидролиза соли аммония.
- В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
- NH4+ + H2O ⇄ NH4OH + H+
- NH4OH ⇄ NH3 + H2O
- Реакции разложения соли аммония.
- NH4Cl → (t) NH3↑ + HCl↑
- (NH4)2CO3 → (t) NH3↑ + H2O + CO2↑
- NH4NO2 → (t) N2↑ + H2O
- NH4NO3 → (t) N2O↑ + H2O
- (NH4)3PO4 → (t) NH3↑ + H3PO4
Закись азота, веселящий газ – N2O – обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.
- Получают N2O разложением нитрата аммония при нагревании:
- NH4NO3 → N2O + H2O
- Оксид азота I разлагается на азот и кислород:
- N2O → (t) N2 + O2
Оксид азота II – NO
Окись азота – NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
- В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
- NH3 + O2 → (t, кат) NO + H2O
- В лабораторных условиях – в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
- Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
- На воздухе быстро окисляется с образованием бурого газа – оксида азота IV – NO2.
- NO + O2 → NO2
Оксид азота III – N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.
- Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой (две реакции, в которых образуется смесь оксидов азота), затем охлаждением полученной смеси газов до температуры – 36 °C.
- As2O3 + HNO3 + H2O → H3AsO4 + NO↑
- As2O3 + HNO3 + H2O → H3AsO4 + NO2↑
- При охлаждении газов образуется оксид азота III.
- NO + NO2 → N2O3
Является кислотным оксидом. соответствует азотистой кислоте – HNO2, соли которой называются нитриты (NO2–). Реагирует с водой, основаниями.
H2O + N2O3 → HNO2
NaOH + N2O3 → NaNO2 + H2O
Оксид азота IV – NO2
Бурый газ, имеет острый запах. Ядовит.
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при разложении нитратов.
- Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2O
- Cu(NO3)2 → (t) CuO + NO2 + O2
- Pb(NO3)2 → (t) PbO + NO2 + O2
- Проявляет высокую химическую активность, кислотный оксид.
- Окислительные свойства оксида азота.
- Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
- NO2 + C → CO2 + N2
- NO2 + P → P2O5 + N2
- Окисляет SO2 в SO3 – на этой реакции основана одна из стадий получения серной кислоты.
- SO2 + NO2 → SO3 + NO
- Реакции оксида азота с водой и щелочами.
Оксид азота IV соответствует сразу двум кислотам – азотистой HNO2 и азотной HNO3. Реакции с водой и щелочами протекают по одной схеме.
- NO2 + H2O → HNO3 + HNO2
- NO2 + LiOH → LiNO3 + LiNO2 + H2O
- Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
- NO2 + H2O + O2 → HNO3
Окислительные свойства азота
Химические реакции азота могут вступать в следующие окислительные свойства.
- Азот вступает в химические взаимодействия с металлами. В нормальных условиях он реагирует только с литием, с другими металлами при повышенных температурах. Соединения металлов с азотом называются нитридами.6Li + N2 → 2Li3N
2Fe + N2 → 2FeN - Азот реагирует с водородом при определенных условиях. Остановимся более подробно на этих условиях.
Давайте пропустим смесь водорода и азота через стеклянную трубку. Теперь положите в трубочку порошок железа и снова пропустите через трубочку смесь водорода и азота. При комнатной температуре мы опять не замечаем образования аммиака. Нагрейте трубку.
В присутствии железного порошка теперь образуется аммиак. Это видно по запаху и по изменению цвета фенолфталеина (он становится малиновым) в поглощающей колбе, прикрепленной к выходному отверстию трубки.
Железо в этой реакции не расходуется, оно служит катализатором.
- Таким образом, необходимыми условиями для реакции соединения азота с водородом являются: катализатор и нагревание.
- N2 + 3H2 ⟷2NH3 + Q
- Данная реакция относится к равновесным химическим процессам: на примере этой реакции легче всего понять смысл скорости химической реакции и смещения химического равновесия.
Восстановительные свойства азота
При высоких температурах азот вступает в восстановительную реакцию с кислородом. Пропустим через воздух электрические искры. Появляется желтое «пламя» и образуется газ с резким запахом. При температуре искры азот соединяется с кислородом, с образованием окиси азота (II).
N2 + O2 → 2NO
Азот не взаимодействует с галогенами и серой, но галогениды и сульфиды могут быть получены побочным способом. С водой, кислотами и щелочами азот так же не взаимодействует.
Источники:
- https://studarium.ru/article/168
- https://chemege.ru/nitrogen
- https://interneturok.ru/lesson/chemistry/9-klass/himiya-nemetallov/svoystva-elementa-i-prostogo-veschestva-azota
- https://www.yaklass.ru/p/himija/89-klass/khimiia-nemetallov-157456/azot-i-ego-soedineniia-161796/re-c79e2cf3-4588-479f-88f0-348ec0688712
- https://bingoschool.ru/manual/ximicheskie-svojstva-azota






