- Коррозия металла — причины возникновения и методы защиты
- Что такое коррозия металлов
- Химическая коррозия
- Электрохимическая коррозия
- Другие причины коррозии металла
- Меры защиты металлов от коррозии
- Антикоррозийная защита неметаллическими покрытиями
- Защита железа от коррозии покрытиями из других металлов
- Повышение коррозийной стойкости путем добавления в стальные сплавы легирующих добавок
- Меры противодействия электрохимической коррозии
- Защита от блуждающих токов
- Влияние параметров поверхностного слоя детали на коррозионную стойкость
- Химическая коррозия
- Газовая коррозия
- Химическая коррозия в жидкостях-неэлектролитах
Журнал «Новости теплоснабжения», № 1, (17), январь, 2002, С.34 – 39, www.ntsn.ru
К.т.н. В.Б. Косачев, А.П. Гулидов, НПК «Вектор», г. Москва
В статье приведены сведения о коррозии металлов, которые могут быть полезны для широкого круга инженерно-технических работников, связанных по роду деятельности с осуществлением практических мер по защите от коррозии оборудования теплоснабжающих организаций.
Коррозия и ее социальное значение
Любой коррозионный процесс приводит к изменениям в свойствах конструкционных материалов. Результатом процесса является «коррозионный эффект», ухудшающий функциональные характеристики металла оборудования, среды и технических систем, расценивающийся как «эффект повреждения» или «коррозионная порча».
Очевидно, что экономические потери, связанные с коррозией металлов, определяются не столько стоимостью прокорродировавшего металла, сколько стоимостью ремонтных работ, убытками за счет временного прекращения функционирования инженерных систем, затратами на предотвращение аварий, в некоторых случаях абсолютно недопустимых с точки зрения экологической безопасности. Оценки затрат, связанных с коррозией (по данным зарубежных источников) приводят к выводу, что общие годовые расходы на борьбу с последствиями коррозии составляют 1,5-2% валового национального продукта. Часть этих затрат неизбежна; было бы нереально полностью исключить все коррозионные разрушения. Тем не менее, можно значительно сократить коррозионные потери за счет лучшего использования на практике накопленных знаний о коррозионных процессах и методов защиты от коррозии, которыми антикоррозионные службы располагают на данный момент.
Процессы коррозии
Понятие «коррозия металлов» включает большую группу химических процессов, приводящих к разрушению металла.
Эти процессы резко отличаются друг от друга по внешним проявлениям, по условиям и средам в которых они протекают, а также по свойствам реагирующих металлов и образующихся продуктов реакции. Однако для их объединения имеются все основания, т.к.
несмотря на резкие отличия, все эти процессы имеют не только общий результат – разрушение металла, но и единую химическую сущность – окисление металла.
Причина коррозии – термодинамическая неустойчивость металлов, вследствие чего большинство из них встречаются в природе в окисленном состоянии (оксиды, сульфиды, силикаты, алюминаты, сульфаты и т.д.).
Таким образом, коррозию можно определить как самопроизвольный процесс, протекающий при взаимодействии металла с окружающей средой, сопровождающийся уменьшением свободной энергии Гиббса и разрушением металла. Коррозия протекает на границе раздела двух фаз «металл – окружающая среда», т. е.
является гетерогенным многостадийным процессом и состоит как минимум из трех основных многократно повторяющихся стадий:
- 1 подвода реагирующих веществ (в том числе коррозионного агента) к поверхности раздела фаз;
- 2 собственно реакции взаимодействия металла с коррозионной средой, итогом которой является переход некоторого количества металла в окисленную форму с образованием продуктов коррозии, а коррозионного агента в восстановленную форму;
- 3 отвод продуктов коррозии из реакционной зоны.
- Механизмы процессов коррозии
- По механизму протекания процесса окисления металла различают химическую и электрохимическую коррозию.
Химическая коррозия. К этому виду коррозии относятся такие процессы окисления металла и восстановления коррозионного агента, при которых передача электронов металла осуществляется непосредственно атомам или ионам окислителя (коррозионного агента), которым наиболее часто является кислород воздуха.
- 2Ме + О2 —>2МеО (1)
- В практике теплоснабжения наиболее распространенным и практически важным видом химической коррозии является газовая коррозия – коррозия металлов в сухих газах (воздух, продукты сгорания топлива) при высоких температурах. Основными факторами, влияющими на скорость газовой коррозии, являются:
- 3 природа металла (сплава);
- 4 состав газовой среды;
- 5 механические свойства образующихся продуктов коррозии (оксидных пленок);
- 6 температура.
Так, для железа, основного компонента углеродистых сталей, применяемых для изготовления экранов топочного пространства и конвективной части водогрейных котлов, зависимость скорости газовой коррозии от температуры близко к экспоненциальной, рис. 1.
Температура оказывает влияние на состав образующихся на стали оксидных пленок и законы их роста, табл. 1. От состава оксидных пленок зависят их механические и, соответственно, защитные свойства, поскольку плотная сплошная оксидная пленка может защитить металл от дальнейшего окисления.
Парциальное давление кислорода также оказывает влияние на скорость газовой коррозии.
При окислении ряда металлов при постоянной и достаточно высокой температуре с повышением парциального давления кислорода (Ро2) скорость окисления сначала резко увеличивается, а затем, при достижении некоторого критического значения (Р о2) – резко уменьшается и в широком диапазоне давлений остается достаточно низкой, рисунок 2. Большое влияние на скорость окисления металлов оказывает режим нагрева. Колебания температуры (переменный нагрев и охлаждение) даже в небольших интервалах вызывают разрушение оксидных пленок вследствие возникновения больших внутренних напряжений, в результате чего скорость окисления металла резко увеличивается.
Для защиты от газовой коррозии применяют жаростойкое легирование сталей, создают защитные (восстановительные) атмосферы, используют термодиффузионные (на основе алюминия, кремния и хрома) и напыляемые (на основе оксидов алюминия, магния, циркония) защитные покрытия.
Электрохимическая коррозия. Этот вид коррозии наиболее распространен и включает те случаи, когда процессы окисления металла и восстановления окислительного компонента протекают раздельно в среде жидкого электролита, т.е. в среде, проводящей электрический ток.
Такими средами могут являться: природная вода, водные растворы солей, кислот, щелочей, а также воздух, почва и теплоизоляционные конструкции, содержащие электролит (влагу) в определенном количестве.
Таким образом, процесс электрохимической коррозии представляет собой совокупность двух сопряженно протекающих реакций:
анодной (окисление) Ме → Ме z+ + ze- (2),
и катодной (восстановление) D + ze- → (Dze- ) (3),
где D – деполяризатор (окислитель), присоединяющий к себе электроны металла. В качестве деполяризатора могут выступать: кислород, растворенный в электролите, ионы водорода (Н+) и некоторых металлов. Общая схема электрохимического коррозионного процесса металла приведена на рисунке 3, а частный случай ржавления железа описывается реакцией:
- 2Fe + 2H2O + O2 → 2Fe2+ + 4 OH- (4).
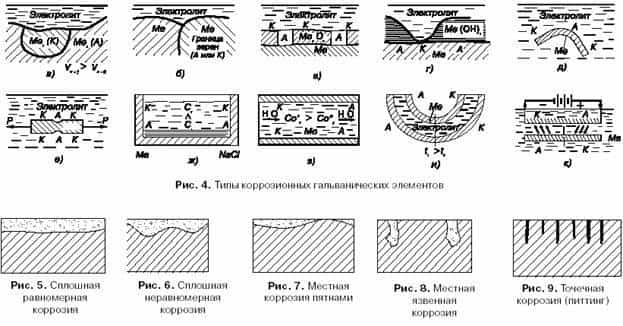
- Возникновение гальванических элементов «катод – анод» на углеродистых сталях (основного конструкционного материала трубопроводов) при их контакте с электролитами происходит в основном из-за дифференциации поверхности сталей на участки с различными электродными потенциалами (теория локальных коррозионных элементов). Причины дифференциации могут быть различны:
- 7 неоднородность структуры металла (в углеродистых сталях присутствуют фазы – феррит и цементит, структурные составляющие – перлит, цементит и феррит, имеющие различные электродные потенциалы);
- 8 наличие на поверхности сталей оксидных пленок, загрязнений, неметаллических включений и т.п;
- 9 неравномерное распределение окислителя на границе «металл-электролит», например, различные влажность и аэрация на различных участках поверхности металла;
- 10 неравномерность распределения температуры;
- 11 контакт разнородных металлов.
Сводные данные по Н.Д. Томашову о гальванических коррозионных парах (табл. 2), образование которых возможно на действующих трубопроводах тепловых сетей в присутствии влаги или ее следов, позволяют утверждать, что все случаи ржавления трубопроводов и металлоконструкций тепловых сетей происходят в результате электрохимической коррозии.
Основные виды электрохимической коррозии
и характер коррозионных повреждений металла
В зависимости от условий протекания процесса электрохимической коррозии (вида коррозионной среды) различают атмосферную, почвенную, микробиологическую и жидкостную (кислотную, щелочную, солевую, морскую и пресноводную) коррозию.
В зависимости от условий эксплуатации любой из вышеприведенных видов коррозии может протекать при наложении таких эксплуатационных факторов как трение, кавитация, напряжения в металле, воздействие внешних источников постоянного и переменного тока.
В таблице 3 представлены возможные виды электрохимической коррозии трубопроводов и емкостного оборудования теплоснабжающих предприятий, а также неблагоприятные эксплуатационные факторы, способствующие возрастанию скорости коррозионных процессов. На рисунках 5-9 приведены наиболее характерные коррозионные повреждения конструкционных углеродистых сталей, вызываемые различными видами электрохимической коррозии.
Методы защиты от электрохимической коррозии
Защита от электрохимической коррозии представляет комплекс мероприятий, направленных на предотвращение и ингибирование коррозионных процессов, сохранение и поддержание работоспособности оборудования и сооружений в требуемый период эксплуатации.
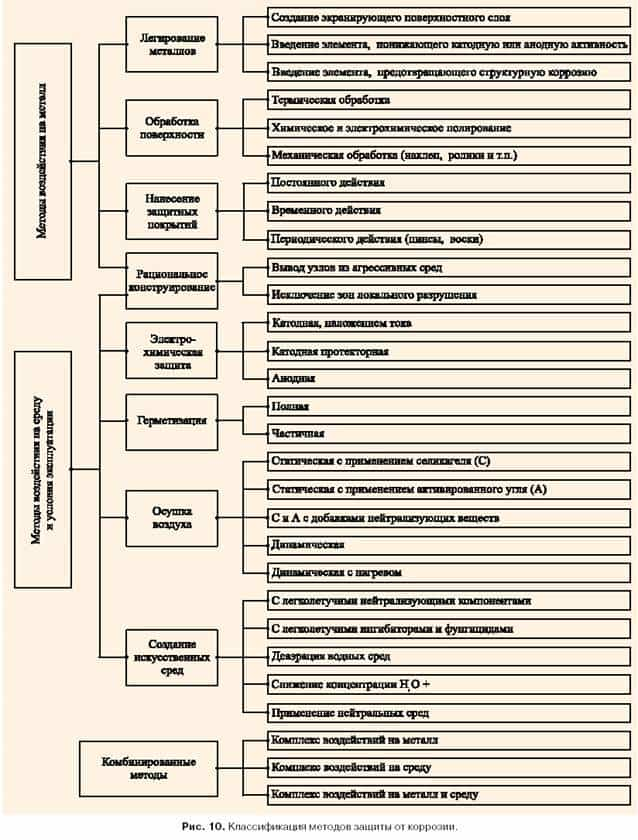
Методы защиты металлоконструкций от коррозии основаны на целенаправленном воздействии, приводящем к полному или частичному снижению активности факторов, способствующих развитию коррозионных процессов. Методы защиты от коррозии можно условно разделить на методы воздействия на металл и методы воздействия на среду, а также комбинированные методы. Классификация методов представлена на рисунке 10.
Среди методов воздействия на металл, в практике защиты оборудования и трубопроводов теплоснабжающих организаций наибольшее распространение получили защитные и изолирующие покрытия постоянного действия (полимерные, стеклоэмалевые, металлические цинковые и алюминиевые). Воздействие на коррозионную среду (вода) применяется при защите от внутренней коррозии емкостного оборудования и трубопроводов путем ее ингибирования и деаэрации.
В значительной степени снизить скорость коррозионных процессов на трубопроводах можно, применяя электрохимическую защиту. При данном виде защиты электрохимический потенциал трубопровода смещают в необходимую (защитную) область потенциалов (поляризация конструкции) путем его подключения к внешнему источнику тока – станции катодной защиты или протектору.
Следует отметить, что вариант защиты для конкретного объекта должен выбираться исходя из анализа условий его эксплуатации. При этом должны учитываться требования к показателям, характеризующим необходимое качество работы объекта, технологические особенности применения выбранного метода (методов) защиты и достигаемый при этом экономический эффект.
Усложнение условий эксплуатации оборудования и, в первую очередь, теплопроводов, появление специфических загрязнений воздуха и воды требует постоянного совершенствования методов защиты от коррозии.
Основываясь на анализе обобщенной информации о коррозионных повреждениях различного оборудования теплоснабжающих предприятий, можно заключить, что основными направлениями при совершенствовании методов защиты от коррозии в теплоснабжении являются: внедрение антикоррозионных и гидроизоляционных покрытий для наружных поверхностей трубопроводов с улучшенными потребительскими свойствами; применение для горячего водоснабжения труб со стеклоэмалевыми и полимерными внутренними покрытиями; применение комбинированных вариантов защиты с совместным использованием установок электрохимической защиты и защитных покрытий.
Таблица 1
| Температура, оС | Состав оксидной пленки | Закон роста оксидной пленки |
| До 400оС | Fe2O3 | Логарифмический |
| 400 – 575оС | Fe3O4, Fe2O3 | Степенной, n > 2 |
| 575 – 730оС | FeO, Fe3O4, Fe2O3 | Степенной, n > 2 |
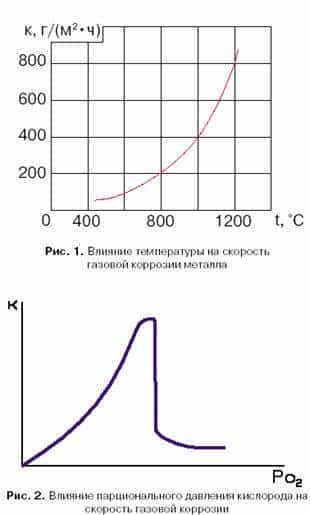
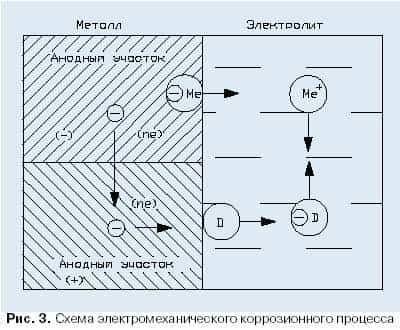
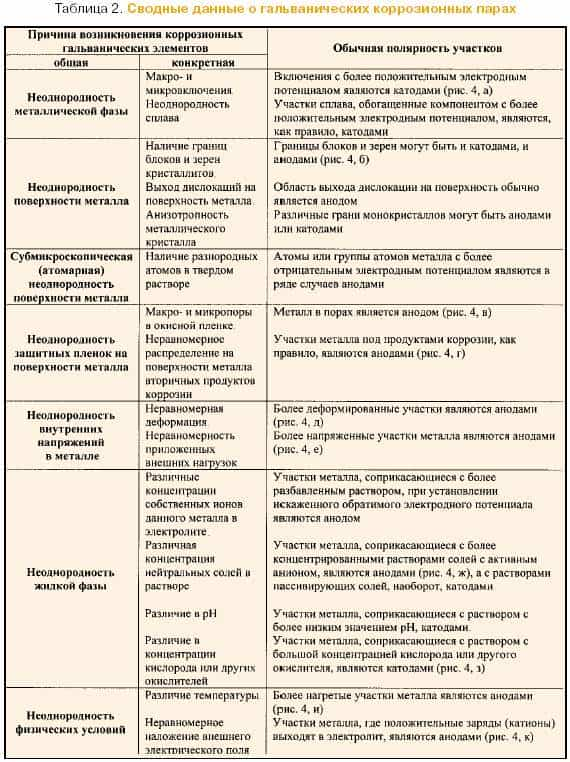
Таблица 3.
| № пп | Вид электрохимической коррозии | Способ прокладки трубопровода (вид оборудования) |
Дополнительные коррозионные факторы |
| 1. | Атмосферная коррозия | Наружные поверхности трубопроводов наземной и канальной прокладки (при уровне подтопления и заиливания канала, не достигающим изоляционных конструкций). Поверхности различных металлоконструкций и оборудования, не контактирующие с водой и грунтом. | Внутренние напряжения в металле трубопровода и металлоконструкций, ударно-механическое воздействие капели с перекрытий. Характерные коррозионные повреждения: равномерная коррозия, в местах капели возможна коррозия пятнами. |
| 2. | Подземная коррозия |
Наружные поверхности трубопроводов бесканальной прокладки (при нарушении целостности изоляции), канальной прокладки (периодическое подтопление и заиливание канала, сопровождающееся увлажнением тепловой изоляции). | Внутренние напряжения в металле, коррозия внешним постоянным и переменным током, воздействие капели. Характерные коррозионные повреждения: неравномерная коррозия, коррозия пятнами, при воздействии блуждающих токов возможны сквозные поражения стенки трубопровода. |
| 3. | Подводная коррозия | Наружные поверхности трубопроводов канальной прокладки. (Постоянное подтопление канала при отсутствии тепловой изоляции на трубопроводе). Внутренние поверхности трубопроводов и оборудования химводоподготовки (деаэраторы, фильтры и т.п.) | Внутренние напряжения в металле, коррозия внешним постоянным и переменным током. При неполном погружении трубопровода возможна коррозия по ватерлинии.
|
Коррозия металла — причины возникновения и методы защиты
Словосочетания «коррозия металла» заключает в себе намного больше, чем название популярной рок-группы.
Коррозия безвозвратно разрушает металл, превращая его в труху: из всего, произведенного в мире железа, 10% полностью разрушится в этот же год.
Ситуация с российским металлом выглядит примерно так — весь металл, выплавленный за год в каждой шестой доменной печи нашей страны, становится ржавой трухой еще до конца года.

Выражение «обходится в копеечку» в отношении коррозии металла более чем верно — ежегодный ущерб, приносимый коррозией, составляет не менее 4% годового дохода любой развитой страны, а в России сумма ущерба исчисляется десятизначной цифрой. Так что же вызывает коррозийные процессы металлов и как с ними бороться?
Что такое коррозия металлов
Разрушение металлов в результате электрохимического (растворение во влагосодержащей воздушной или водной среде — электролите) или химического (образование соединений металлов с химическими агентами высокой агрессии) взаимодействия с внешней средой. Коррозийный процесс в металлах может развиться лишь в некоторых участках поверхности (местная коррозия), охватить всю поверхность (равномерная коррозия), или же разрушать металл по границам зерен (межкристаллитная коррозия).
Металл под воздействием кислорода и воды становится рыхлым светло-коричневым порошком, больше известным как ржавчина (Fе2O3·H2О).
Химическая коррозия
Этот процесс происходит в средах, не являющихся проводниками электрического тока (сухие газы, органические жидкости — нефтепродукты, спирты и др.), причем интенсивность коррозии возрастает с повышением температуры — в результате на поверхности металлов образуется оксидная пленка.
Химической коррозии подвержены абсолютно все металлы — и черные, и цветные. Активные цветные металлы (например — алюминий) под воздействием коррозии покрываются оксидной пленкой, препятствующей глубокому окислению и защищающей металл.
А такой мало активный металл, как медь, под воздействием влаги воздуха приобретает зеленоватый налет — патину.
Причем оксидная пленка защищает металл от коррозии не во всех случаях — только если кристаллохимическая структура образовавшейся пленки сообразна строению металла, в противном случае — пленка ничем не поможет.

Сплавы подвержены другому типу коррозии: некоторые элементы сплавов не окисляются, а восстанавливаются (например, в сочетании высокой температуры и давления в сталях происходит восстановление водородом карбидов), при этом сплавы полностью утрачивают необходимые характеристики.
Электрохимическая коррозия
Процесс электрохимической коррозии не нуждается в обязательном погружении металла в электролит — достаточно тонкой электролитической пленки на его поверхности (часто электролитические растворы пропитывают среду, окружающую металл (бетон, почву и т.д.)).
Наиболее распространенной причиной электрохимической коррозии является повсеместное применение бытовой и технической солей (хлориды натрия и калия) для устранения льда и снега на дорогах в зимний период — особенно страдают автомашины и подземные коммуникации (по статистике, ежегодные потери в США от использования солей в зимний период составляют 2,5 млрд. долларов).
Происходит следующее: металлы (сплавы) утрачивают часть атомов (они переходят в электролитический раствор в виде ионов), электроны, замещающие утраченные атомы, заряжают металл отрицательным зарядом, в то время как электролит имеет положительный заряд.
Образуется гальваническая пара: металл разрушается, постепенно все его частицы становятся частью раствора. Электрохимическую коррозию могут вызывать блуждающие токи, возникающие при утечке из электрической цепи части тока в водные растворы или в почву и оттуда — в конструкции из металла.
В тех местах, где блуждающие токи выходят из металлоконструкций обратно в воду или в почву, происходит разрушение металлов. Особенно часто блуждающие токи возникают в местах движения наземного электротранспорта (например, трамваев и ж/д локомотивов на электрической тяге).
Всего за год блуждающие токи силой в 1А способны растворить железа — 9,1 кг, цинка — 10,7 кг, свинца — 33,4 кг.
Другие причины коррозии металла
Развитию коррозийных процессов способствуют радиация, продукты жизнедеятельности микроорганизмов и бактерий. Коррозия, вызываемая морскими микроорганизмами, наносит ущерб днищам морских судов, а коррозийные процессы, вызванные бактериями, даже имеют собственное название — биокоррозия.

Совокупность воздействия механических напряжений и внешней среды многократно ускоряет коррозию металлов — снижается их термоустойчивость, повреждаются поверхностные оксидные пленки, а в тех местах, где появляются неоднородности и трещины, активируется электрохимическая коррозия.
Меры защиты металлов от коррозии
Неизбежными последствиями технического прогресса является загрязнение нашей среды обитания — процесс, ускоряющий коррозию металлов, поскольку внешняя окружающая среда проявляет к ним все большую агрессию. Каких-либо способов полностью исключить коррозийное разрушение металлов не существует, все, что можно сделать, это максимально замедлить этот процесс.
Для минимизации разрушения металлов можно сделать следующее: снизить агрессию среды, окружающей металлическое изделие; повысить устойчивость металла к коррозии; исключить взаимодействие между металлом и веществами из внешней среды, проявляющими агрессию.
Человечеством за тысячи лет испробованы многие способы защиты металлических изделий от химической коррозии, некоторые из них применяются по сей день: покрытие жиром или маслом, другими металлами, коррозирующими в меньшей степени (самый древний метод, которому уже более 2 тыс. лет — лужение (покрытие оловом)).
Антикоррозийная защита неметаллическими покрытиями
Неметаллические покрытия — краски (алкидные, масляные и эмали), лаки (синтетические, битумные и дегтевые) и полимеры образуют защитную пленку на поверхности металлов, исключающую (при своей целостности) контакт с внешней средой и влагой.
Применение красок и лаков выгодно тем, что наносить эти защитные покрытия можно непосредственно на монтажной и строительной площадке.
Методы нанесения лакокрасочных материалов просты и поддаются механизации, восстановить поврежденные покрытия можно «на месте» — во время эксплуатации, эти материалы имеют сравнительно низкую стоимость и их расход на единицу площади невелик.
Однако их эффективность зависит от соблюдения нескольких условий: соответствие климатическим условиям, в которых будет эксплуатироваться металлическая конструкция; необходимость применения исключительно качественных лакокрасочных материалов; неукоснительное следование технологии нанесения на металлические поверхности. Лакокрасочные материалы лучше всего наносить несколькими слоями — их количество обеспечит лучшую защиту от атмосферного воздействия на металлическую поверхность.

В роли защитных покрытий от коррозии могут выступать полимеры — эпоксидные смолы и полистирол, поливинилхлорид и полиэтилен. В строительных работах закладные детали из железобетона покрываются обмазками из смеси цемента и перхлорвинила, цемента и полистирола.
Защита железа от коррозии покрытиями из других металлов
Существует два типа металлических покрытий-ингибиторов — протекторные (покрытия цинком, алюминием и кадмием) и коррозионностойкие (покрытия серебром, медью, никелем, хромом и свинцом).
Ингибиторы наносятся химическим способом: первая группа металлов имеет большую электроотрицательность по отношению к железу, вторая — большую электроположительность.
Наибольшее распространение в нашем обиходе получили металлические покрытия железа оловом (белая жесть, из нее производят консервные банки) и цинком (оцинкованное железо — кровельное покрытие), получаемые путем протягивания листового железа через расплав одного из этих металлов.
Часто цинкованию подвергаются чугунная и стальная арматура, а также водопроводные трубы — эта операция существенно повышает их стойкость к коррозии, но только в холодной воде (при проводе горячей воды оцинкованные трубы изнашиваются быстрее неоцинкованных).
Несмотря на эффективность цинкования, оно не дает идеальной защиты — цинковое покрытие часто содержит трещины, для устранения которых требуется предварительное никелерование металлических поверхностей (покрытие никелем).
Цинковые покрытия не позволяют наносить на них лакокрасочные материалы — нет устойчивого покрытия.
Лучшее решение для антикоррозийной защиты — алюминиевое покрытие. Этот металл имеет меньший удельный вес, а значит — меньше расходуется, алюминированные поверхности можно окрашивать и слой лакокрасочного покрытия будет устойчив.
Кроме того, алюминиевое покрытие по сравнению с оцинкованным покрытием обладает большей стойкостью в агрессивных средах.
Алюминирование слабо распространено из-за сложности нанесения этого покрытия на металлический лист — алюминий в расплавленном состоянии проявляет высокую агрессию к другим металлам (по этой причине расплав алюминия нельзя содержать в стальной ванне).
Возможно, эта проблема будет полностью решена в самое ближайшее время — оригинальный способ выполнения алюминирования найден российскими учеными. Суть разработки заключается в том, чтобы не погружать стальной лист в расплав алюминия, а поднять жидкий алюминий к стальному листу.
Повышение коррозийной стойкости путем добавления в стальные сплавы легирующих добавок
Введение в стальной сплав хрома, титана, марганца, никеля и меди позволяет получить легированную сталь с высокими антикоррозийными свойствами. Особенную стойкость стальному сплаву придает большая доля хрома, благодаря которому на поверхности конструкций образуется оксидная пленка большой плотности.
Введение в состав низколегированных и углеродистых сталей меди (от 0,2% до 0,5%) позволяет повысить их коррозийную устойчивость в 1,5-2 раза.
Легирующие добавки вводятся в состав стали с соблюдением правила Таммана: высокая коррозийная устойчивость достигается, когда на восемь атомов железа приходится один атом легирующего металла.
Меры противодействия электрохимической коррозии
Для ее снижения необходимо понизить коррозийную активность среды посредством введения неметаллических ингибиторов и уменьшить количество компонентов, способных начать электрохимическую реакцию. Таким способом будет понижение кислотности почв и водных растворов, контактирующих с металлами.
Для снижения коррозии железа (его сплавов), а также латуни, меди, свинца и цинка из водных растворов необходимо удалить диоксид углерода и кислород. В электроэнергетической отрасли проводится удаление из воды хлоридов, способных повлиять на локальную коррозию.
С помощью известкования почвы можно снизить ее кислотность.
Защита от блуждающих токов
Снизить электрокоррозию подземных коммуникаций и заглубленных металлоконструкций возможно при соблюдении нескольких правил:
- участок конструкции, служащий источником блуждающего тока, необходимо соединить металлическим проводником с рельсом трамвайной дороги;
- трассы теплосетей должны размещаться на максимальном удалении от рельсовых дорог, по которым передвигается электротранспорт, свести к минимуму число их пересечений;
- применение электроизоляционных трубных опор для повышения переходного сопротивления между грунтом и трубопроводами;
- на вводах к объектам (потенциальным источникам блуждающих токов) необходима установка изолирующих фланцев;
- на фланцевой арматуре и сальниковых компенсаторах устанавливать токопроводящие продольные перемычки — для наращивания продольной электропроводимости на защищаемом отрезке трубопроводов;
- чтобы выровнять потенциалы трубопроводов, расположенных параллельно, необходимо установить поперечные электроперемычки на смежных участках.
Защита металлических объектов, снабженных изоляцией, а также стальных конструкций небольшого размера выполняется с помощью протектора, выполняющего функцию анода.
Материалом для протектора служит один из активных металлов (цинк, магний, алюминий и их сплавы) — он принимает на себя большую часть электрохимической коррозии, разрушаясь и сохраняя главную конструкцию.
Один анод из магния, к примеру, обеспечивает защиту 8 км трубопровода.
© Абдюжанов Рустам, специально для рмнт.ру
18.03.10
Влияние параметров поверхностного слоя детали на коррозионную стойкость
Коррозия – результат химического или электрохимического взаимодействия металла поверхностного слоя деталей с агрессивной средой. Коррозионной стойкостью называется способность материала сопротивляться коррозионным разрушениям при действии агрессивной среды.
Коррозия не только портит внешний вид поверхностей изделий, но и снижает механические свойства металлов (рис. 27).
Причиной возникновения коррозии является термодинамическая неустойчивость металлов, возникающая в процессе сильного механического или термического воздействия на деталь, например в процессе обработки.
Все металлы и сплавы в условиях эксплуатации стремятся перейти в более устойчивое окисленное (ионное) состояние. Физико-химическая сущность процесса коррозии заключается в самопроизвольном переходе металла из неустойчивого в устойчивое состояние.

Рис. 27. Вид коррозионных повреждений кузова автомобиля
Интенсивность и характер коррозионного процесса всегда обусловлены рядом факторов, которые делятся на внешние и внутренние. К внешним факторам относятся химический состав среды, в которой эксплуатируется деталь, температура в рабочей зоне и скорость движения среды.
- Эксплуатация автомобильного транспорта происходит в условиях высоких скоростей при наличии агрессивной среды, перепада температур и действия больших механических нагрузок, которые способствуют развитию коррозионных процессов.
- К внутренним факторам относятся: химический состав металлов и параметры поверхностей деталей, такие как шероховатость, структура, твердость и остаточные напряжения, которые обусловлены способами обработки.
- Коррозионная стойкость деталей в зависимости от вида коррозии оценивается либо уменьшением веса металла с единицы площади либо уменьшением линейных размеров за единицу времени.
Коррозия происходит под действием химически агрессивных сред: воздуха, воды, органических и неорганических кислот и др. Различают два основных вида коррозии – химическую и электрохимическую. В свою очередь, в зависимости от условий эксплуатации и состава внешней среды химическая коррозия может быть атмосферной и газовой.
При атмосферной коррозии, которая происходит при нормальном давлении и температуре ниже 80ºС, поверхности деталей покрываются слоем окислов, образующихся в результате химического взаимодействия металла с компонентами окружающей среды (преимущественно с кислородом). Окисный слой в большинстве случаев не обладает необходимыми защитными свойствами, т. е.
не изолирует поверхность от агрессивной среды.
Важнейшими конструкционными материалами для изготовления большинства деталей машин по-прежнему являются углеродистые и низколегированные стали. Эти стали имеют большое сродство к кислороду и поэтому подвержены интенсивному коррозионному разрушению.
Шероховатость поверхности также является существенным фактором, определяющим интенсивность коррозии. С увеличением высоты микронеровностей возрастает площадь контакта поверхности детали с окружающей агрессивной средой и, как следствие, возрастает скорость коррозионных разрушений.
Кроме того, ускорению коррозионных процессов способствуют малые радиусы закругления впадин микропрофиля, являющиеся энергоёмкими местами (концентраторами напряжений), в которых в первую очередь зарождаются очаги коррозии. На полированной поверхности таких энергоёмких мест мало, поэтому она в меньшей степени подвержена коррозии.
Наоборот, после пескоструйной, дробеструйной, химической или механической обработки поверхности деталей имеют большую склонность к коррозии.
Наклеп оказывает неоднозначное влияние на коррозионную стойкость. Известно, что в результате деформационного упрочнения коррозионная стойкость резко снижается. Например, поврежденный при соударении в дорожно-транспортном происшествии участок кузова автомобиля подвергается интенсивной коррозии.
Происходит это из-за того, что после холодной пластической деформации мягкая сталь может поглощать на порядок больше кислорода, чем отожжённая сталь.
Однако также имеет место повышение коррозионной стойкости при обкатывании деталей, которое происходит вследствие создания наклепанного поверхностного слоя материала с более положительным электродным потенциалом по сравнению с основным металлом.
Этому способствует и высокая термодинамическая устойчивость материала наклепанного слоя, возникающая вследствие образования мелкоблочной и высокодисперсной структуры. Очевидно, что такое противоречивое влияние наклёпа на коррозионную стойкость можно объяснить, во-первых, материалом детали, а во-вторых, методом повышения поверхностной твёрдости.
Так, при упрочнении поверхностного слоя обкатыванием происходит завальцовывание поверхностных микродефектов, которые являются путями проникновения агрессивных сред внутрь металла. Кроме того, упрочнение методами поверхностного пластического деформирования увеличивает диффузию кислорода воздуха в металле поверхностного слоя, образуя в нём твёрдые химические соединения FeO, Fe2O3, FeO4, которые обладают защитными свойствами.
Газовая коррозия является частным случаем химической коррозии и происходит в результате воздействия газов и паров на поверхность металла при высокой температуре (особенно при температуре выше 300°С). В качестве агрессивных компонентов газовой среды могут выступать химические соединения серы, хлора, азота и, конечно же, кислорода.
Скорость коррозии возрастает с увеличением содержания в газовой среде агрессивных примесей (например, углекислого газа, двуокиси серы и др.). Образующиеся продукты коррозии создают на поверхности деталей пленку, которая на какое-то время защищает металл от воздействия агрессивной среды и снижает интенсивность коррозионных процессов.
Защитные свойства пленок зависят от их сплошности, толщины и прочности сцепления с металлом. Большей защитной способностью обладают тонкие пленки, вследствие их меньшей хрупкости.
С повышением параметров процесса газовой коррозии, таких как температура, давление и скорость движения газовой среды, защитные свойства пленок в большинстве случаев снижаются.
Значительное влияние на скорость коррозии углеродистых и низколегированных сталей оказывает соотношение окиси углерода СО и углекислого газа СО2 в выхлопных газах.
С увеличением содержания СО скорость коррозии снижается, а при концентрации 14…18% коррозия может прекратиться совсем.
Примером газовой коррозии являются разрушения на фасках тарелок выпускных клапанов, выпускного тракта автомобильного двигателя и в глушителе, которые происходят под воздействием отработавших газов.
Процесс электрохимической коррозии может происходить только при наличии макрои микрогальванических элементов. На поверхности металлических изделий, находящихся в атмосфере, образуется тонкая пленка воды, так называемый конденсат.
Толщина такой пленки может быть различной в зависимости от температуры и влажности окружающей среды. Газы, присутствующие в воздухе, растворяются в этой пленке, создавая электропроводную среду (электролит). Электролит – это водный раствор солей, щелочей, кислот.
Так естественным образом формируются условия для электрохимической коррозии.
Известно, что у каждого металла при попадании в электролит возникает электродный потенциал. А при контакте двух разных металлов в жидкой электропроводной среде за счёт возникновения разности электродных потенциалов возникает гальваническая пара и металл с более отрицательным электродным потенциалом (анод) начинает растворяться.
Достаточно часто на металлической поверхности возникают короткозамкнутые микрогальванические элементы, образованные различными структурными составляющими сплава, из которого изготовлена деталь.
Анодом и катодом также могут служить граница и сердцевина зерна, чистый металл и его окислы, деформированные и недеформированные участки металла, имеющие разные электродные потенциалы.
При наличии электролита на катодных участках идет восстановление окислителей, а на анодных участках – растворение металла.
В начальной стадии коррозия имеет точечный характер, затем распространяется на всю поверхность изделия. Наряду с образованием многочисленных гальванических микропар имеет место образование макропар между сопряженными деталями из разных металлов. В условиях электрохимической коррозии прежде всего разрушаются выступы неровностей на поверхности металла, который является анодом.
Необходимо отметить важный факт: скорость разрушения материала при электрохимической коррозии значительно выше, чем при химической.
Коррозионные повреждения кузова автомобиля можно рассматривать как совместный результат действия химической и электрохимической коррозии. При этом коррозионные повреждения проявляются:
- в нарушении товарного вида автомобиля, происходящем в результате действия подслойной коррозии и выражающемся во вспучивании и шелушении лакокрасочного покрытия;
- в изменении геометрии кузова и деформации дверных проемов, возникающих вследствие локальных разрушений в усилителях, лонжеронах, местах соединений деталей пола, порогах, крыльях и др.;
- в уменьшении прочности креплений узлов и агрегатов автомобиля;
- в ухудшении общего физического состояния металлических деталей.
Наиболее сильные коррозионные повреждения кузова происходят при эксплуатации автомобиля в зимнее время года. Этому во многом способствует обработка дорожного покрытия солью, песком и различными противогололедными реагентами, попадающими на элементы кузова и вызывающими электрохимическую коррозию.
Большую роль в развитии коррозионных процессов играет изменение температуры элементов кузова в течение суток, особенно если автомобиль днем эксплуатируется в условиях отрицательных температур окружающей среды, а ночью находится в тёплом гараже при положительных температурах.
Во-первых, повышение температуры электролита, образовавшегося из соляных составов, ускоряет протекание коррозионных процессов. Во-вторых, снег и лед, попавшие на кузов на улице, тают, и образовавшаяся вода затекает в узкие зазоры, щели и трещины лакокрасочного покрытия.
Когда же автомобиль выезжает на морозную улицу, вода в щелях и трещинах замерзает и в силу расклинивающего действия раздвигает их, вскрывая лакокрасочное покрытие кузова.
Для сплавов на основе железа распространенным и опасным видом локальной коррозии является щелевая коррозия, которая возникает при разности pH-среды в различных щелях, узких зазорах, под всевозможными прокладками и наростами. Этому виду коррозии достаточно сильно подвержены участки металла, контактирующие с неметаллическими материалами, такими как древесина, стекло, пластик, бетон, ткани и др.
Структура в многофазных сплавах, фазы которых являются электрохимически гетерогенными (неоднородными), является одной из причин межкристаллитной коррозии. Она обусловлена не только химическим составом, но и неправильной термической обработкой.
Например, нарушение режима термообработки коррозионностойких сталей приводит к обогащению границ зёрен (кристаллитов) химическими элементами, из которых состоит сталь. Границы зёрен становятся электрохимически отличными от зёрен металла, что приводит к образованию микрогальванической пары и, как следствие, к их разрушению.
Далее коррозия распространяется по межкристаллитным границам в сердцевину детали. В результате происходит разрушение металла на большой глубине без явных коррозионных повреждений на поверхности изделия.
Структурная неоднородность и высокая напряженность металла сварных швов являются причиной ножевой коррозии. В местах сварки ножевая коррозия протекает с высокой скоростью и сопровождается большими повреждениями.
Считается, что остаточные напряжения любого знака как один из главных факторов термодинамической неустойчивости металлов снижают сопротивление коррозии.
Однако также известен факт повышения сопротивления коррозионной усталости (при одновременном действии переменных напряжений и коррозионной среды) обкатанных образцов.
Повышение обусловлено действием остаточных напряжений сжатия, замедляющих процессы коррозионного растрескивания.
Наоборот, остаточные напряжения растяжения способствуют коррозионному растрескиванию (коррозионной статической усталости) в коррозионно-агрессивных средах. Такое достаточно сильное влияние остаточных напряжений на коррозионную усталость можно объяснить тем, что усталостный фактор является превалирующим в процессе разрушения по отношению к коррозионному фактору.
Существует множество способов защиты изделий от коррозии, учитывающих не только особенности самого металла, но и условия его эксплуатации. Поэтому нет какой-либо единой системы выбора и применения мер защиты от коррозии.
Наиболеераспространённымиимаксимальноэффективнымиявляются методы нанесения защитных покрытий – металлических, гальванических, химических, лакокрасочных, эмалевых и др. Роль покрытий как средств защиты от коррозии сводится большей частью к изоляции металла от агрессивной среды.
В этой связи к ним предъявляются определенные требования.
Они не должны иметь пор, должны быть газои водонепроницаемыми, химически стойкими, механически прочными, обладать высокой прочностью сцепления с основным металлом и, следовательно, не должны отслаиваться в процессе эксплуатации.
Одним из эффективных методов повышения коррозионной стойкости является электрохимическая защита. Суть ее заключается
в подключении защищаемой поверхности к катоду постороннего источника постоянного тока с целью создания на ней отрицательного потенциала (катодная защита) или в присоединении металлов с более отрицательным электродным потенциалом (протекторов), благодаря чему анодные участки защищаемой поверхности становятся катодными (протекторная защита).
Для электрохимической защиты применяют анодные покрытия (цинк, кадмий), получаемые электрохимическим способом, которые также имеют более отрицательный электродный потенциал, чем основной металл (железо). Электрохимическая защита кабелей, трубопроводов, свай и др. получила широкое распространение в нефтяной, химической, судостроительной и других отраслях промышленности.
Необходимо отметить, что многие проблемы, связанные с электрохимической коррозией, могут быть решены на стадии проектирования конструкции изделия. Так, при конструировании кузова следует исключить условия длительного контакта элементов кузова с водой.
Для этого в нижних точках полостей, куда может попадать вода, должны быть предусмотрены дренажные отверстия. Такими отверстиями снабжены двери автомобиля, площадки кронштейнов для установки аккумуляторных батарей, отсеки для хранения запасного колеса и др.
Отверстия должны иметь размеры, достаточные для вытекания воды и удаления мусора при условии возможного их засорения.
Внешняя форма кузова должна обеспечивать быстрое стекание воды даже при сильном дожде. Обводы щелей при закрытом капоте и крышке багажника должны иметь желобки, по которым вода может свободно стекать с кузова, не попадая в моторный отсек и багажник при стоянке автомобиля.
Поскольку площадка для стоянки автомобиля не всегда строго горизонтальная, желательно, чтобы конструкция желобков обеспечивала полное стекание воды при наклоне автомобиля в любую сторону по крайней мере на угол 2…3°.
Конструкция отверстий для вентиляции кузова (за счет жалюзи, специальных отбортовок или других устройств) должна исключать попадание дождевой воды во внутренние полости кузова как при стоянке автомобиля, так и при его движении.
При конструировании кузова его элементы необходимо выполнять из однородных металлов, что позволит устранить образование макрогальванических пар и протекание электрохимических процессов.
Химическая коррозия
Химическая коррозия — это вид коррозионного разрушения металла, связанный с взаимодействием металла и коррозионной среды, при котором одновременно окисляется металл и происходит восстановление коррозионной среды. Химическая коррозия не связана с образованием, а также воздействием электрического тока.
- Движущей силой (первопричиной) химической коррозии является термодинамическая неустойчивость металлов. Они могут самопроизвольно переходить в более устойчивое состояние в результате процесса:
- Металл + Окислительный компонент среды = Продукт реакции
- При этом термодинамический потенциал системы уменьшается.
По знаку изменения термодинамического потенциала можно определить возможность самопроизвольного протекания химической коррозии. Критерием обычно служит изобарно-изотермический потенциал G. При самопроизвольном протекании химического процесса наблюдается убыль изобарно-изотермического потенциала. Поэтому, если:
- Δ GТ < 0, то процесс химической коррозии возможен;
- Δ GТ > 0, то процесс химической коррозии невозможен;
- Δ GТ = 0, то система находится в равновесии.
- К химической коррозии относятся:
- — газовая коррозия — коррозионное разрушение под воздействием газов при высоких температурах;
- — коррозия в жидкостях-неэлектролитах.
Газовая коррозия
Газовая коррозия — наиболее распространенный вид химической коррозии. При высоких температурах поверхность металла под воздействием газов разрушается. Это явление наблюдается в основном в металлургии (оборудование для горячей прокатки, ковки, штамповки, детали двигателей внутреннего сгорания и др.)
- Самый распространенный случай химической коррозии – взаимодействие металла с кислородом. Процесс протекает по реакции:
- Ме + 1/2О2 — МеО
- Направление этой реакции (окисления) определяется парциальным давлением кислорода в смеси газов (pО2) и давлением диссоциации паров оксида при определенной температуре (рМеО).
- Эта химическая реакция может протекать тремя путями:
- 1) pО2 = рМеО, реакция равновесная;
- 2) pО2 > рМеО, реакция сдвинута в сторону образования оксида;
- 3) pО2 < рМеО, оксид диссоциирует на чистый металл и оксид, реакция протекает в обратном направлении.
- Зная парциальное давление кислорода газовой смеси и давление диссоциации оксида можно определить интервал температур, при которых термодинамически возможно протекание данной реакции.
- Скорость протекания газовой коррозии определяется несколькими факторами: температуры окружающей среды, природы металла или состава сплава, характера газовой среды, времени контакта с газовой средой, от свойств продуктов коррозии.
- Процесс химической коррозии во многом зависит от характера и свойств образовавшейся на поверхности оксидной пленки.
- Процесс появления на поверхности оксидной пленки можно условно разделить на две стадии:
- — на поверхности металла, которая непосредственно контактирует с атмосферой, адсорбируются молекулы кислорода;
- — металл взаимодействует с газом с образованием химического соединения.
На первой стадии между поверхностными атомами и кислородом возникает ионная связь: атом кислорода забирает у металла два электрона. При этом возникает очень сильная связь, намного сильнее, чем связь кислорода с металлом в окисле.
Возможно это явление наблюдается из-за действия на кислород поля, создаваемого атомами металла.
После полного насыщения поверхности окислителем, что происходит почти мгновенно, при низких температурах за счет ванн-дер-вальсовых сил может наблюдаться и физическая адсорбция молекул окислителя.
В результате образуется очень тонкая мономолекулярная защитная пленка, которая со временем утолщается, затрудняя подход кислорода.
На второй стадии, из-за химического взаимодействия, окислительный компонент среды отнимает у металла валентные электроны и с ним же реагирует, образуя продукт коррозии.
Если образовавшаяся оксидная пленка будет обладать хорошими защитными свойствами — она будет тормозить дальнейшее развитие процесса химической коррозии. Кроме того, оксидная пленка очень сильно влияет на жаростойкость металла.
- Существует три вида пленок, которые могут образоваться:
- — тонкие (невидимые невооруженным глазом);
- — средние (дают цвета побежалости);
- — толстые (хорошо видны).
- Чтобы оксидная пленка была защитной, она должна отвечать некоторым требованиям: не иметь пор, быть сплошной, хорошо сцепляться с поверхностью, быть химически инертной по отношении к окружающей ее среде, иметь высокую твердость, быть износостойкой.
- Если пленка рыхлая и пористая, кроме того имеет еще плохое сцепление с поверхностью — она не будет обладать защитными свойствами.
- Существует условие сплошности, которое формулируется так: молекулярный объем оксидной пленки должен быть больше атомного объема металла.
- Сплошность — способность окисла покрывать сплошным слоем всю поверхность металла.
- Если это условие соблюдается, то пленка сплошная и, соответственно, защитная.
Но есть металлы, для которых условие сплошности не является показателем. К ним относятся все щелочные, щелочно-земельные (кроме бериллия), даже магний, который важен в техническом плане.
Для определения толщины образовавшейся на поверхности оксидной пленки, изучения ее защитных свойств применяют множество методов. Защитную способность пленки могут определять во время ее формирования, по скорости окисления металла и характеру изменения скорости во времени.
Если окисел уже сформировался, целесообразно исследовать толщину и защитные его свойства, нанося на поверхность какой-нибудь подходящий для этого случая реагент (например раствор Cu(NO3)2, который применяется для железа).
По времени проникновения реагента к поверхности можно определить толщину пленки.
Даже уже образовавшаяся сплошная пленка не прекращает своего взаимодействия с металлом и окислительной средой.
Влияние внешних и внутренних факторов на скорость протекания химической коррозии.
На скорость химической коррозии очень сильное влияние оказывает температура. При ее повышении процессы окисления идут намного быстрее. При этом уменьшение термодинамической возможности протекания реакции не имеет никакого значения.
Особенно сильно влияет переменный нагрев и охлаждение. В защитной пленке вследствие появления термических напряжений образуются трещины. Сквозь трещины окислительный компонент среды имеет непосредственный доступ к поверхности. Формируется новая оксидная пленка, а старая — постепенно отслаивается.
Большую роль в процессе коррозии играет состав газовой среды. Но это индивидуально для каждого металла и изменяется с колебаниям температур.
Например, медь очень быстро корродирует в атмосфере кислорода, но устойчива в среде, содержащей SO2.
Никель же наоборот, интенсивно корродирует при контакте с атмосферой SO2, но устойчив в средах O2, CO2 и H2O. Хром относительно устойчив во всех четырех средах.
Если давление диссоциации окисла выше давления окисляющего компонента — окисление металла прекращается, он становится термодинамически устойчивым.
Скорость окисления зависит от состава сплава. Возьмем, к примеру, железо. Добавки серы, марганца, фосфора и никеля не влияют на его окисление. Кремний, хром, алюминий — замедляют процесс.
А бериллий, кобальт, титан и медь очень сильно тормозят окисление. При высоких температурах интенсифицировать процесс могут вольфрам, молибден, а также ванадий.
Это объясняется летучестью или легкоплавкостью их окислов.
Наблюдая за скоростью окисления железа при различных температурах, отметим что с увеличением температуры самое медленное окисление наблюдается при аустенитной структуре. Она является наиболее жаростойкой, по сравнению с другими.
На скорость протекания химической коррозии влияет и характер обработки поверхности. Если поверхность гладкая, то она окисляется немного медленнее, чем бугристая поверхность с дефектами.
Химическая коррозия в жидкостях-неэлектролитах
Жидкости-неэлектролиты — это жидкие среды, которые не являются проводниками электричества. К ним относятся: органические (бензол, фенол, хлороформ, спирты, керосин, нефть, бензин); неорганического происхождения (жидкий бром, расплавленная сера и т.д.).
Чистые неэлектролиты не реагируют с металлами, но с добавлением даже незначительного количества примесей процесс взаимодействия резко ускоряется. Например, если нефть будет содержать серу или серосодержащие соединения (сероводород, меркаптаны) процесс химической коррозии ускоряется.
Если вдобавок увеличится температура, в жидкости окажется растворенный кислород — химическая коррозия усилится.
- Присутствие в жидкостях-неэлектролитах влаги обеспечивает интенсивное протекание коррозии уже по электрохимическому механизму.
- Химическая коррозия в жидкостях-неэлектролитах подразделяется на несколько стадий:
- — подход окислителя к поверхности металла;
- — хемосорбция реагента на поверхности;
- — реакция окислителя с металлом (образование оксидной пленки);
- — десорбция оксидов с металлом (может отсутствовать);
- — диффузия оксидов в неэлектролит (может отсутствовать).
- Для защиты конструкций от химической коррозии в жидкостях-неэлектролитах на ее поверхность наносят покрытия, устойчивые в данной среде.






