- Щелочноземельные металлы
- Выводы
- Щелочноземельные металлы
- Щелочноземельные металлы:
- Строение атомов щелочноземельных металлов:
- Физические свойства щелочноземельных металлов:
- Химические свойства щелочноземельных металлов:
- Химические свойства щелочных и щелочноземельных металлов
- Применение и биологическая роль щелочноземельных металлов и их соединений
- Оксиды и пероксиды металлов IIA группы
- Получение
- Свойства
- Гидроксиды
- Получение
- Свойства
- § 13. Свойства s-элементов (щелочных и щелочноземельных металлов) и их соединений
- Химические свойства металлов
- Соединения s-металлов
Самоучитель по химии › Неорганическая химия
Содержание
- Щелочные металлы
- Щелочноземельные металлы
- Выводы
Щелочные металлы — это элементы главной подгруппы I группы Периодической системы химических элементов Менделеева (ПСМ) (кроме водорода).
Задание 9.1. Назовите все щелочные металлы. Составьте схемы строения атомов натрия и калия. Укажите распределение их валентных электронов.
На внешнем уровне у атомов таких металлов находится по 1 электрону, но расстояние до ядра, а значит, и притяжение к нему, у этих электронов различно.
Вопрос. У какого элемента (натрия или калия) внешние электроны дальше от ядра?
Чем дальше электроны от ядра, тем слабее они притягиваются к нему, тем легче данный атом отдаёт электроны.
А это означает, что металлические свойства выражены тем ярче, чем дальше валентные электроны от ядра (при прочих равных условиях).
Поэтому сверху вниз в каждой главной подгруппе увеличивается число энергетических уровней в атомах, растёт металлическая активность элементов, т. е. способность их атомов отдавать электроны.
Вопрос. Какой металл более активный: натрий или калий?
Таким образом, активность щелочных металлов возрастает
Но поскольку на внешнем уровне любого щелочного металла находится один электрон, в любой химической реакции щелочные металлы могут отдать только один электрон. Значит, они имеют постоянную валентность I и образуют оксиды состава
Этот оксид растворяется в воде, реагирует с нею:
Полученное основание — щёлочь.
Вопрос. Что такое щёлочь? (См. урок 2.3.)
В подгруппе сверху вниз увеличивается и сила оснований, т. е. способность диссоциировать в водных растворах на ионы. Самой сильной щёлочью является CsOH.
Растворы щелочей мылкие на ощупь, разъедают кожу и ткани (щёлочи — едкие!), изменяют окраску индикаторов. Поскольку все металлы главной подгруппы I группы образуют щёлочи, — их называют «щелочные металлы».
Рассмотрим свойства щелочных металлов на примере натрия. При этом будем придерживаться схемы, изложенной начале второй части.
Строение атома Nа изображается схемой:
Имея один валентный электрон (…3s1), натрий является активным металлом с постоянной валентностью I:
Простое вещество «натрий» — очень лёгкий (легче воды) серебристо-белый металл, который легко режется ножом. Натрий активно реагирует с кислородом, водородом, неметаллами, водой:
Вопрос. Почему атом серы присоединил 2 электрона?
Задание 9.2. Составьте уравнения реакций натрия с хлором Cl2, азотом N2 и водой (при затруднениях см. пояснения в уроке 7).
Даже небольшие кусочки натрия (величиной с горошину) при попадании в воду вызывают оглушительный взрыв — это взрывается водород (см. урок 12). Тот же эффект будет, если натрий опустить в раствор кислоты или соли. Кроме того, здесь возможны более сложные побочные процессы. Поэтому составлять уравнения реакций для щелочных металлов в качестве примеров процессов
- металл + раствор кислоты →
- металл + раствор соли →
не рекомендуется.
Натрий образует основный оксид Nа2O, который реагирует с водой, с кислотами и кислотными оксидами (см. урок 2.1), например:
Задание 9.3. Составьте уравнения реакций оксида натрия с водой и с серной кислотой.
Гидроксид натрия NaOH (едкий натр, каустическая сода) проявляет все свойства щелочей: реагирует с кислотными оксидами, кислотами, растворами солей (см. урок 2.3), например:
Все соединения натрия окрашивают пламя в жёлтый цвет. Это качественная реакция на соединения натрия.
Задание 9.4. Составьте уравнения реакций гидроксида натрия с хлоридом железа III, фосфорной кислотой, оксидом серы IV. (При затруднениях см. урок 2.3.)
Задание 9.5. Опишите по разобранной схеме свойства калия и его соединений.
Многие соединения натрия нашли применение в быту и промышленности. Так, каустическая сода NаОН применяется для получения мыла, в производстве алюминия, искусственных волокон и др. Кальцинированная сода Na2CO3 также применяется при получении мыла, а также при варке стекла, стирке белья и др.
Но в пищу эти «соды» не употребляются! При приготовлении пищи используют питьевую соду NaHCO3 и поваренную соль NaCl. Питьевая сода используется при лечении простуды, её кладут в печенье, пирожки. Без соли NaCl почти любая еда покажется невкусной, без неё невозможно законсервировать мясо, овощи, грибы.
Эти вещества применяются и в технических целях.
Щелочноземельные металлы
Металлы главной подгруппы II группы в отличие от щелочных металлов имеют довольно разные свойства.
Вопросы
- Сколько электронов на внешнем уровне атомов этих металлов?
- Какой металл более активен: натрий или магний? Почему?
Эти металлы имеют на внешнем уровне по 2 электрона, следовательно, они менее активны, чем их «соседи» — щелочные металлы, так как на отрыв двух электронов нужно затратить больше энергии, чем на отрыв одного электрона.
Вопрос. Как изменяется активность металлов в подгруппе сверху вниз? Почему?
В этой подгруппе, как и у щелочных металлов, сверху вниз увеличивается сила оснований, т. е. способность диссоциировать в водных растворах на ионы. Кроме того, увеличивается заряд иона, а значит, усиливается притяжение группы ОН в гидроксиде металла: ионы Na+ и OH– притягиваются слабее, чем Са2+ и ОН–.
- Поэтому первые два элемента этой подгруппы не образуют щелочей:
- Кальций уже образует сильное основание — щёлочь, а стронцию и барию соответствуют ещё более сильные основания.
- Запомните: Ca, Sr, Ba — щелочноземельные* металлы, так как их оксиды проявляют щелочные свойства.
* «Земли» — устаревшее название оксидов металлов, так как эти оксиды входят в состав земли (почвы).
Несмотря на эти различия, перечисленные элементы имеют много сходного в свойствах.
Вопрос. Какую валентность проявляют эти химические элементы в соединениях?
- Главное сходство химических элементов главной подгруппы II группы заключается в том, что они проявляют в соединениях постоянную валентность II, так как на внешнем уровне имеют по два электрона, а на предвнешнем уровне нет незавершённых подуровней.
- Рассмотрим свойства химических элементов главной подгруппы II группы на примере кальция. Строение атома кальция изображается схемой:
- Имея два валентных электрона: …4s2, кальций является активным металлом, поскольку оба электрона расположены на внешнем уровне. Его постоянная валентность равна двум:
- Простое вещество «кальций» — довольно прочный, серебристо-белый умеренно твёрдый металл. Активно реагирует с кислородом, водородом, неметаллами, водой, растворами кислот:
- Рассмотрим как происходит взаимодействие кальция с азотом:
Вопрос. Почему атом азота присоединяет три электрона?
Задание 9.6. Составьте уравнения реакций кальция с кислородом, хлором (Cl2), серой, водой, соляной кислотой.
- Оксид кальция CaO (негашёная известь) очень активно реагирует с водой с выделением такого большого количества теплоты, что вода закипает:
- Этот процесс называется «гашением извести», а систему называют «кипелкой».
Вопрос. С какими ещё веществами может реагировать оксид кальция?
Как основный оксид CaO реагирует с кислотными оксидами и с кислотами:
- CaO + SO2 → СаSO3
- CaO + НNO3 → … (закончить уравнение этой реакции).
Гидроксид кальция Са(ОН)2 (гашёная известь) проявляет все свойства щелочей.
Вопрос. С какими веществами могут реагировать щелочи? (При затруднении см. урок 2.3.)
Задание 9.7. Составить уравнения реакций:
- Са(ОН)2 + СO2 →
- Са(ОН)2 + H3PO4 →
- Са(ОН)2 + Na2CO3 →
Прозрачный раствор гидроксида кальция в воде называется известковой водой. Она мутнеет при пропускании через неё углекислого газа:
Этот эффект реакции считают качественным признаком того, что в данном растворе присутствуют ионы кальция. Убедиться в этом поможет также реакция с пламенем: все соединения кальция окрашивают пламя в кирпично-красный цвет.
Задание 9.8. Опишите по предложенной схеме свойства магния и его соединений.
Многие соединения кальция играют заметную роль в нашей жизни. Достаточно сказать, что фосфат кальция, карбонат кальция составляют основу костей, зубов. Без ионов кальция не может свертываться кровь. Без соединений кальция невозможно построить дом, так как известь (гашёная и негашёная) обеспечивает скрепление строительных блоков друг с другом:
Образование в результате этих реакций прочных нерастворимых карбонатов и силикатов кальция надёжно скрепляет стены. Аналогичные реакции происходят при схватывании цемента.
Оксид кальция в больших количествах получают обжигом известняка:
Карбонат кальция СаСО3 составляет основу мела, мрамора, известняка. Из него состоят целые горы и пласты земной коры. Под действием воды и углекислого газа из воздуха карбонат кальция переходит в водорастворимое состояние — гидрокарбонат кальция:
Аналогичные процессы происходят и с карбонатами магния. В результате этих и других процессов в природной воде появляются ионы кальция и магния.
Вода, содержащая ионы кальция и магния, называется ЖЁСТКОЙ.
Этот термин возник из-за того, что некоторые овощи и плоды под действием такой воды становятся жёсткими: ионы кальция и магния вступают в реакцию с органическими компонентами плодов и овощей.
Чаще всего жёсткая вода приносит неприятности: долго развариваются продукты, плохо моет мыло (см. урок 24.4), на стенках котлов и труб появляется слой накипи, что может привести к авариям:
- Накипь, конечно, можно растворить при помощи соляной кислоты:
Задание 9.10. Можно ли растворить накипь при помощи серной, азотной, фосфорной кислот? Ответ подтвердите ионно-молекулярными уравнениями реакций.
Но лучше всего в случаях, когда жёсткость воды повышена, а это нежелательно, умягчать воду. Для этого ионы кальция и магния нужно перевести в нерастворимое состояние.
Вопрос. Умягчается ли вода при кипячении?
Частично вода умягчается при кипячении, так как при этом растворимые гидрокарбонаты переходят в нерастворимые карбонаты. Но некоторые соли кальция и магния (сульфаты, хлориды) при нагревании не изменяются. В этом случае в воду добавляют вещества, образующие с ионами кальция и магния осадки.
Задание 9.11. Какие из солей: кальцинированная сода, фосфат натрия, поваренная соль — устраняют жёсткость воды? Ответ подтвердить ионными уравнениями реакций, считая, что в состав воды входит сульфат кальция.
- Чаще всего для умягчения воды используют кальцинированную соду Na2CO3:
Кальцинированная сода входит в состав стиральных порошков, которые также содержат и фосфаты. Эти вещества «автоматически» смягчают воду при стирке.
Выводы
Щелочные металлы — это простые вещества, которые образованы элементами главной подгруппы первой группы. Это очень активные металлы, которые образуют с водой сильные растворимые основания — щёлочи.
Щелочноземельные металлы — это простые вещества, которые образованы некоторыми элементами главной подгруппы второй группы Ca, Sr, Ba. Это очень активные металлы, которые образуют с водой щёлочи. Ионы кальция и магния делают воду жёсткой.
Щелочноземельные металлы
- К щелочноземельным металлам относятся бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba, радий Ra.
- Щелочноземельные металлы
- Строение атомов щелочноземельных металлов
- Физические свойства щелочноземельных металлов
- Химические свойства щелочноземельных металлов
Щелочноземельные металлы:
Щелочноземельные металлы – это элементы 2-й группы периодической таблицы химических элементов Д.И. Менделеева (по устаревшей классификации – элементы главной подгруппы II группы):
- – бериллий Be,
- – магний Mg,
- – кальций Ca,
- – стронций Sr,
- – барий Ba,
- – радий Ra.
Строение атомов щелочноземельных металлов:
Особенность строения атомов щелочноземельных металлов заключается в том, что они содержат два электрона на внешнем энергетическом уровне: их электронная конфигурация ns2. Поэтому щелочноземельные металлы проявляют валентность II и степень окисления +2.
Щелочноземельные металлы относятся к элементам s-семейства.
Так, электронная конфигурация атома бериллия 1s2 2s2. Атом бериллия состоит из положительно заряженного ядра (+4), вокруг которого по двум оболочкам движутся 4 электрона. При этом 2 электрона находятся на внутреннем уровне, а 2 электрона – на внешнем.
Поскольку бериллий расположен во втором периоде, оболочек всего две. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внешняя оболочка также представлена s-орбиталью. На внешнем энергетическом уровне атома бериллия – на 2s-орбитали находятся два спаренных электрона.
В свою очередь ядро атома бериллия состоит из 4 протонов и 5 нейтронов.
Радиус атома бериллия составляет 112 пм. Потенциал ионизации атома бериллия равен 9,32 эВ (898,8 кДж/моль). Электроотрицательность атома бериллия равна 1,57 (шкала Полинга).
Электронная конфигурация атома магния 1s2 2s2 2p6 3s2. Атом магния состоит из положительно заряженного ядра (+12), вокруг которого по трем атомным оболочкам движутся 12 электронов. При этом 10 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем.
Поскольку магний расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома магния – на 3s-орбитали находится два спаренных электрона.
В свою очередь ядро атома магния состоит из 12 протонов и 12 нейтронов.
Радиус атома магния составляет 160 пм. Потенциал ионизации атома магния равен 7,64 эВ (737,3 кДж/моль). Электроотрицательность атома магния равна 1,31 (шкала Полинга).
Электронная конфигурация атома кальция 1s2 2s2 2p6 3s2 3p6 4s2. Атом кальция состоит из положительно заряженного ядра (+19), вокруг которого по четырем оболочкам движутся 20 электронов. При этом 18 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем.
Поскольку кальций расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая и третья – внутренние оболочки представлена s- и р-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома кальция – на 4s-орбитали находится два спаренных электрона.
В свою очередь ядро атома кальция состоит из 20 протонов и 20 нейтронов.
Радиус атома кальция составляет 197 пм. Потенциал ионизации атома кальция равен 6,11 эВ (589,4 кДж/моль). Электроотрицательность атома кальция равна 1,00 (шкала Полинга).
Электронная конфигурация атома стронция 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2. Атом стронция состоит из положительно заряженного ядра (+38), вокруг которого по пяти оболочкам движутся 38 электронов. При этом 36 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку стронций расположен в пятом периоде, оболочек всего пять.
Первая – внутренняя оболочка представлена s-орбиталью. Вторая и четвертая – внутренние оболочки представлены s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Пятая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома стронция на 5s-орбитали находятся два спаренных электрона.
В свою очередь ядро атома стронция состоит из 38 протонов и 50 нейтронов.
Радиус атома стронция составляет 215 пм. Потенциал ионизации атома стронция равен 5,69 эВ (549,0 кДж/моль). Электроотрицательность атома стронция равна 0,95 (шкала Полинга).
Электронная конфигурация атома бария 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2. Атом бария состоит из положительно заряженного ядра (+56), вокруг которого по шести атомным оболочкам движутся 56 электронов.
При этом 54 электрона находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку барий расположен в шестом периоде, оболочек всего шесть. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями.
Третья и пятая – внутренние оболочки представлена s-, р- и d-орбиталями. Четвертая – внутренняя оболочка представлена s-, р-, d- и f-орбиталями. Шестая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома бария – на 6s-орбитали находится два спаренных электрона.
Поэтому барий проявляет валентность II и степень окисления +2. В свою очередь ядро атома бария состоит из 56 протонов и 81 нейтрон.
Радиус атома бария составляет 222 пм. Потенциал ионизации атома бария равен 5,21 эВ (502,5 кДж/моль). Электроотрицательность атома бария равна 0,89 (шкала Полинга).
С увеличением порядкового номера у щелочноземельных металлов увеличиваются радиус атома, способность отдавать валентные электроны и восстановительная активность, уменьшается электроотрицательность и энергия ионизации.
Физические свойства щелочноземельных металлов:
Все щёлочноземельные металлы серые или серебристо-белые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение – стронций).
- Общими физическими свойствами щелочноземельных металлов являются: их металлический блеск, ковкость, пластичность, высокая тепло- и электропроводность.
- Вместе с тем указанные металлы имеют разные значения температуры плавления, кипения, плотности и другие физические свойства.
- При этом с увеличением порядкового номера у щелочноземельных металлов каких-либо закономерностей в изменении физических свойств не проявляется.
Химические свойства щелочноземельных металлов:
Все щелочноземельные металлы обладают высокой химической активностью. Они проявляют высокую химическую активность при взаимодействии с водой, кислородом, галогенами, водородом, оксидами, кислотами, солями и другими соединениями. Поэтому ввиду своей высокой химической активности все щелочноземельные металлы в свободном состоянии в природе не встречаются.
В соединениях щелочноземельные металлы проявляют единственную степень окисления +2 (очень редко +1) и валентность II. Они являются сильными восстановителями.
С увеличением порядкового номера у щелочноземельных металлов усиливаются металлические свойства и ослабевают неметаллические свойства, увеличивается восстановительная способность, возрастает химическая активность.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
Химические свойства щелочных и щелочноземельных металлов


Средняя оценка: 4.3
Всего получено оценок: 377.
Средняя оценка: 4.3
Всего получено оценок: 377.
Химические свойства щелочных и щелочноземельных металлов схожи. На внешнем энергетическом уровне щелочных металлов находится один электрон, щелочноземельных – два. При реакциях металлы легко расстаются с валентными электронами, проявляя свойства сильного восстановителя.
В I группу периодической таблицы входят щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
Рис. 1. Щелочные металлы.
Они отличаются мягкостью (можно разрезать ножом), низкими температурами плавления и кипения. Это наиболее активные металлы.
Химические свойства щелочных металлов представлены в таблице.
| Реакция | Особенности | Уравнение |
| С кислородом | Быстро окисляются на воздухе. Литий образует оксид при температуре выше 200°C. Натрий образует смесь – 80 % пероксида (R2O2) и 20 % оксида. Остальные металлы образуют надпероксиды (RO2) |
|
| С азотом | Реагирует только литий при комнатной температуре | 6Li + N2 → 2Li3N |
| С галогенами | Реакция проходит бурно | 2Na + Cl2→ 2NaCl |
| С неметаллами | При нагревании. Образуют сульфиды, гидриды, фосфиды, силициды. С углеродом реагируют только литий и натрий, образуя карбиды |
|
| С водой | Спокойно реагирует только литий. Натрий горит жёлтым пламенем. Калий реагирует со вспышкой. Цезий и рубидий взрываются | 2Na + 2H2O → 2NaOH + H2↑ |
| С кислотами | С соляной, фосфорной, разбавленной серной кислотами реагируют с взрывом. При реакции с концентрированной серной кислотой выделяется сероводород, с концентрированной азотной кислотой образует оксид азота (I), с разбавленной азотной кислотой – азот |
|
| С аммиаком | Образуют амины | 2Li + 2NH3 → 2LiNH2 + H2↑ |
Могут реагировать с органическими кислотами и спиртами.
Во II группе таблицы Менделеева находятся щелочноземельные металлы:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
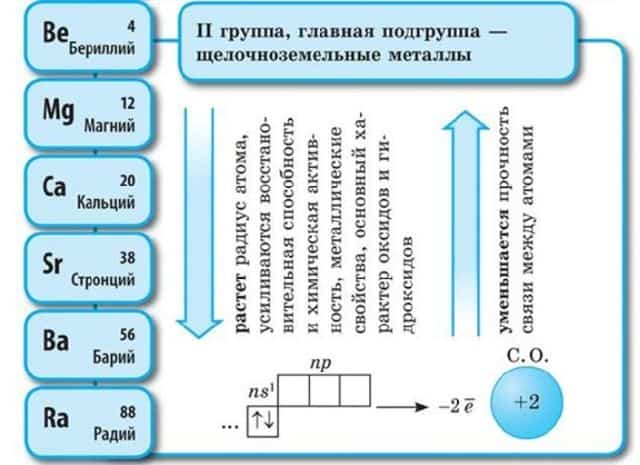 Рис. 2. Щелочноземельные металлы.
Рис. 2. Щелочноземельные металлы.
В отличие от щелочных металлов они более твёрдые. Ножом можно разрезать только стронций. Наиболее плотный металл – радий (5,5 г/см3).
Бериллий взаимодействует с кислородом только при нагревании до 900°С. С водородом и водой не реагирует при любых условиях. Магний окисляется при температуре 650°С и взаимодействует с водородом под высоким давлением.
В таблице отражены основные химические свойства щелочноземельных металлов.
| Реакция | Особенности | Уравнение |
| С кислородом | Образуют оксидные плёнки. При нагревании до 500°С самовоспламеняются | 2Mg + O2 → 2MgO |
| С водородом | При высокой температуре образуют гидриды | Sr + H2 → SrH2 |
| С галогенами и неметаллами | Реагируют при нагревании |
|
| С водой | При комнатной температуре | Mg + 2H2O → Mg(OH)2 + H2 |
| С кислотами | Реагируют все металлы с образованием солей | 4Ca + 10HNO3 (конц.) → 4Ca(NO3)2 + N2O + 5H2O |
| Со щелочами | Реагирует только бериллий | Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2 |
| Замещение | Замещают менее активные металлы в оксидах. Исключение – бериллий | 2Mg + ZrO2 → Zr + 2MgO |
Ионы щелочных и щелочноземельных металлов в солях легко обнаружить по изменению цвета пламени. Соли натрия горят жёлтым пламенем, калия – фиолетовым, рубидия – красным, кальция – кирпично-красным, бария – жёлто-зелёным. Соли этих металлов используют для создания фейерверков.
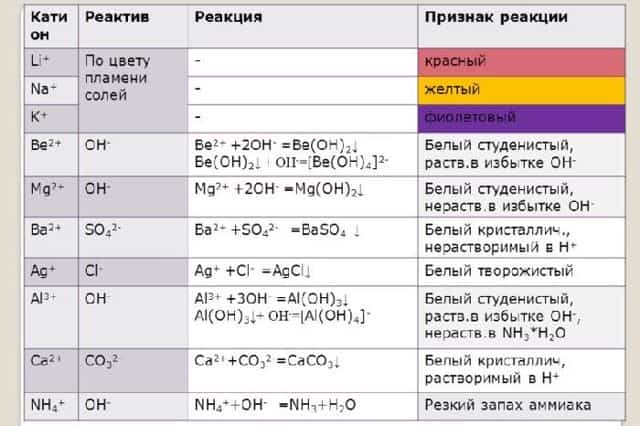 Рис. 3. Качественная реакция.
Рис. 3. Качественная реакция.
Щелочные и щелочноземельные металлы – активные элементы периодической таблицы, вступающие в реакции с простыми и сложными веществами.
Щелочные металлы более мягкие, бурно реагируют с водой и галогенами, легко окисляются на воздухе, образуя оксиды, пероксиды, надпероксиды, взаимодействуют с кислотами и аммиаком. При нагревании вступают в реакцию с неметаллами.
Щелочноземельные металлы реагируют с неметаллами, кислотами, водой. Бериллий не взаимодействует с водородом и водой, но реагирует со щелочами и с кислородом при высокой температуре.
Чтобы попасть сюда — пройдите тест.
Средняя оценка: 4.3
Всего получено оценок: 377.
А какая ваша оценка?
Гость завершил
Тест «Шинель»с результатом 12/12
Гость завершил
Тест «Тихое утро»с результатом 9/10
Гость завершил
Тест «Коняга»с результатом 10/10
Не подошло? Напиши в х, чего не хватает!
Применение и биологическая роль щелочноземельных металлов и их соединений
Щелочноземельные металлы: общая характеристика, строение; свойства и получение
Щелочноземельными металлами называют 4 химических элемента IIA группы Периодической системы Д. И. Менделеева, начиная с кальция:
- кальций Ca, стронций Sr, барий Ba, радий Ra.
- Электронное строение атомов
- На внешнем энергетическом уровне атомы металлов IIA группы имеют два электрона.
- Поэтому для всех щелочноземельных металлов характерна степень окисления +2.
- Этим объясняется сходство их свойств.
- Для металлов IIA группы (сверху вниз) характерно:
- увеличение радиуса атомов;
- уменьшение электроотрицательности;
- усиление восстановительных, металлических свойств.
- Нахождение в природе
- Из щелочноземельных металлов кальций наиболее широко распространён в природе, а радиоактивный радий — менее всего.
- Все щелочноземельные металлы обладают высокой химической активностью, поэтому встречаются в природе только в виде соединений.
- Основными источниками кальция являются его карбонаты CaCO3 (мел, мрамор, известняк).
В свободном виде простые вещества представляют собой типичные металлы от серого до серебристого цвета.
Физические свойства простых веществ
В твёрдом агрегатном состоянии атомы связаны металлической связью. Это обусловливает общие физические свойства простых веществ металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
- Тем не менее, металлы IIA группы имеют разные значения температуры плавления, плотности и других физических свойств.
- Химические свойства
- Щелочноземельные металлы обладают высокой химической активностью, реагируют с кислородом, водородом, другими неметаллами, оксидами, кислотами, солями.
- Они являются сильными восстановителями.
- Щелочноземельные металлы активно реагируют с:
- водой, образуя соответствующие гидроксиды и выделяя водород:
- Ba+2H2O=Ba(OH)2+H2↑⏐;
- кислотами, легко растворяясь в их растворах с образованием соответствующих солей:
- Ba+2HCl=BaCl2+H2↑;
- с неметаллами, образуя оксиды или соответствующие соли (гидриды, галогениды, сульфиды и др.):
- 2Ca+O2=2CaO,
- Ca+H2=CaH2,
- Bа+Cl2=BаCl2,
- Bа+S=BаS.
- Получение
Щелочноземельные металлы получают в основном электролизом расплавов галогенидов. Чаще используются хлориды металлов.
- При этом на катоде восстанавливаются катионы, а на аноде окисляются анионы.
- Суммарное уравнение реакции электролиза расплава хлорида кальция:
- CaCl2=Ca+Cl2↑.
- Оксиды и гидроксиды щелочноземельных металлов
- Оксиды
- Щелочноземельные металлы образуют оксиды общей формулы ЭО:
- CaO, SrO, BaO, RaO.
- Все оксиды обладают выраженными основными свойствами.
- В ряду от оксида кальция к оксиду бария основные свойства усиливаются.
- Оксиды щелочно-земельных металлов реагируют с:
- водой:
- CaO+H2O=Ca(OH)2.
- Обрати внимание!
Реакция взаимодействия оксида кальция с водой протекает с выделением большого количества теплоты. Её называют реакцией гашения извести, так как оксид кальция входит в состав негашёной извести, а гидроксид кальция — гашёной извести.
- кислотными оксидами:
- CaO+CO2=CaCO3.
- кислотами:
- BaO+2HCl=BaCl2+H2O.
- Гидроксиды
- Щелочноземельные металлы при их взаимодействии (или их оксидов) с водой образуют основные гидроксиды (основания).
- Сила оснований увеличивается в группе сверху вниз.
- Гидроксиды щелочноземельных металлов являются сильными основаниями, растворимыми в воде— щелочами.
- Гидроксиды щелочноземельных металлов проявляют все характерные свойства оснований, взаимодействуя с кислотными (и амфотерными) оксидами, кислотами (и амфотерными гидроксидами), солями.
- При нагревании гидроксиды разлагаются на соответствующий оксид и воду:
- Ca(OH)2−→−tCaO+H2O.
Гидроксид кальция является сильным основанием, но малорастворим в воде. Его насыщенный раствор называется известковой водой.
- На воздухе раствор постепенно мутнеет, так как поглощает углекислый газ, из которого образуется карбонат кальция:
- Ca(OH)2+CO2=CaCO3⏐↓+H2O.
- Эта реакция используется как качественная реакция для обнаружения углекислого газа.
- Соли щелочноземельных металлов
- Получение солей
- Соли щелочноземельных металлов можно получить при взаимодействии оксидов или гидроксидов металлов с соответствующими кислотами:
- CaO+2HCl=CaCl2+H2O,
- Ba(OH)2+2HCl=BaCl2+H2O.
- Соли бескислородных кислот образуются при непосредственном взаимодействии простых веществ:
- Ca+S=CaS,
- 2Ba+I2=2BaI2.
- Важнейшие соли кальция: его карбонаты и сульфаты.
- Карбонат кальция CaCO3 (мел, мрамор, известняк),
- гидрокарбонат кальция Ca(HCO3)2,
- сульфат кальция CaSO4 и его кристаллогидраты:
- CaSO4⋅2H2O (гипс), CaSO4⋅,5H2O (алебастр).
- Химические свойства
- Соли щелочноземельных металлов реагируют с кислотами, солями.
- При нагревании разлагаются:
- CaCO3−→−tCaO+CO2.
- Качественный анализ
- Обрати внимание!
- Соединения кальция окрашивают пламя в кирпично-красный цвет.
- Ионы бария можно обнаружить в растворе с помощью раствора серной кислоты или её солей. При этом образуется нерастворимый сульфата бария, который выпадает в осадок:
Качественная реакция на ионы бария:
- Применение и биологическая роль щелочноземельных металлов и их соединений
- Кальций
- Металлический кальций используется в производстве стали, чугуна, для их очистки от кислорода, серы и фосфора, для получения сплавов.
Благодаря химической активности металлический кальций также находит применение в восстановлении некоторых тугоплавких металлов (титан, цирконий и др.) из их оксидов.
Оксиды и пероксиды металлов IIA группы
Атомы металлов IIA группы в соединениях двухвалентны. Поэтому общая формула оксидов — MeO и пероксидов — MeO2 (ВеО2 — не получен).
Получение
- Оксиды получают при нагревании:
- 2Me + O2 = 2 MeO,Me(OH)2 MeO + H2O (Me = Be, Mg)MeCO3 MeO + CO2- (Me = Be, Mg, Ca, Sr)2Me(NO3)2 2MeO + 4NO2- + O2-
- Пероксиды получают по реакции нейтрализации Н2О2:
- Me(OH)2 + H2O2 = MeO2 + 2H2O (кроме BaO2),2BaO + O2 2BaO2.
Свойства
- Оксиды металлов IIA группы являются основными оксидами, а ВеО проявляет амфотерные свойства.
Оксиды реагируют с водой:
- МеO + H2O = Ме(OH)2 (кроме ВеО),
- легко растворяются в кислотах:
- MeO + 2HCl = MeCl2 + H2O,
- а ВеО взаимодействует и со щелочами:
- BeO + 2NaOH Na2BeO2 + H2O,BeO + 2NaOH + H2O = Na2[Be(OH)4],BeO + Na2CO3 = Na2BeO2 + CO2-.
- Пероксиды подвергаются сильному гидролизу:
- MeO2 + 2H2O = Me(OH)2 + H2O2,BaO2 + H2SO4 = BaSO4Ї + H2O2 (в лаборатории),
- легко разлагаются кислотами, даже очень слабыми:
- MeO2 + H2CO3 = MeCO3 + H2O2.
- Пероксиды являются сильными окислителями:
- MeO2 + 2NaI + 2H2O ® Me(OH)2 + 2NaOH + I2Ї,
- но могут и сами окисляться.
- Они реагируют с кислотными оксидами и кислотами:
- MeO + SO3 = MeSO4,MeO + 2HNO3 = Me(NO3)2 + H2O.
Гидроксиды
Гидроксиды имеют общую формулу Ме(ОН)2.
Получение
- Их получают взаимодействием оксидов Ca, Sr, Ba (Ме) с водой:
- MeO + H2O = Me(OH)2.
- Be(OH)2 и Mg(OH)2 получают с помощью обменных реакций:
- BeГ2 + 2NaOH = 2NaГ + Be(OH)2Ї.
Свойства
- Гидроксиды щелочноземельных металлов в воде полностью диссоциируют на ионы.
Они энергично взаимодействуют с кислотными и амфотерными оксидами и гидроксидами, с многоосновными кислотами могут давать кислые соли:
- Cl2 + Ca(OH)2 = Ca(ClO)Cl + H2O(хлорная известь),
- Me(OH)2 + 2HCl = MeCl2 + 2H2O,
2NH4Cl + Me(OH)2 = MeCl2 + 2NH3- + 2H2O,CuCl2 + Me(OH)2 = Cu(OH)2Ї + MeCl2,Ca(HCO3)2 + Ca(OH)2 = 2CaCO3Ї + 2H2O,Ca(OH)2 + CO2 = CaCO3¨ + H2O,Ba(OH)2 + H2SO4 = BaSO4¨ + 2 H2O.
Все содинения бериллия и растворимые соли бария весьма токсичны.
Известняк и известь применяют в сельском хозяйстве для известкования почв с целью понижения ее кислотности и улучшения структуры. Гипс (CaSO4·2H2O) при нагревании превращается в алебастр (CaSO4·0.5H2O). Они широко используются в строительном деле:.
- CaSO4·0,5H2O + 1,5H2O = CaSO4·2H2O.
- Катионы кальция и магния обуславливают жесткость воды. При кипячении воды бикарбонаты разлагаются:
- Ca(HCO3)2 CaCO3Ї + H2O + CO2-
и образуется накипь, что приводит к взрыву паровых катлов. Для борьбы с карбонатной жесткостью воду подвергают предварительному кипячению либо обрабатывают гашеной известью. Некарбонатная жесткость воды устраняется с помощью соды.
Ca2+ + CO32- = CaCO3Ї , Mg2+ + CO32- = MgCO3Ї.
Наиболее эффективным способом борьбы с жесткостью воды является применение ионнообменных смол. Важнейший строительный материал — цемент — это силикат и алюмосиликат кальция.
§ 13. Свойства s-элементов (щелочных и щелочноземельных металлов) и их соединений
Макеты страниц
s-элементами называются элементы главных подгрупп I и II групп Периодической системы, а также гелий. Все они, кроме водорода и гелия, являются металлами. Металлы I группы называются щелочными, поскольку все они реагируют с водой, образуя щелочи. Металлы II группы, за исключением бериллия, принято называть щелочноземельными.
Возникновение этого термина связано со старинным названием оксидов этих металлов — щелочные земли. Франций, завершающий I группу, и радий, завершающий II группу, являются радиоактивными элементами. Единственный природный изотоп имеет малый период полураспада мин, поэтому о его химических свойствах известно не так уж много.
Все -металлы имеют во внешней оболочке атомов по одному или два электрона. Эти металлы могут легко отдавать свои -электроны, образуя ионы с устойчивыми электронными конфигурациями благородных газов.
Все s-металлы при обычных условиях находятся в твердом состоянии, ни один из них не образует аллотропных модификаций. Металлы I группы очень мягкие и имеют небольшую плотность по сравнению с другими металлами.
Литий, натрий и калий легче воды и плавают на ее поверхности, реагируя с ней. Металлы II группы тверже, чем металлы I группы.
Они имеют сравнительно более высокую плотность, хотя она гораздо меньше, чем у переходных металлов.
Химические свойства металлов
- Все s-металлы горят в атмосфере воздуха, образуя оксиды одного или нескольких типов — нормальные оксиды состава (I группа) и (II группа), пероксиды состава (I группа) и (II группа), супероксиды состава (I группа) и (II группа).
- Например, только литий сгорает на воздухе с образованием оксида
- а натрий образует смесь пероксида и супероксида
- Оксиды натрия и калия могут быть получены только при соблюдении особых условий, например при нагревании смеси пероксида с избытком металла в отсутствие кислорода:
- Все -металлы I и II групп соединяются с водородом при нагревании, образуя гидриды, например:
- Также все s-металлы при нагревании реагируют с галогенами, серой, азотом, фосфором и углеродом, образуя при этом галогениды
- Все s-металлы I и II групп восстанавливают холодную воду до гидроксидов и водорода:
Их реакционная способность возрастает сверху вниз по группе. Так, литий реагирует с водой относительно медленно, тогда как калий реагирует с водой со взрывом, самопроизвольно загорается и горит фиолетовым пламенем на поверхности воды.
- Активность металлов I и II групп по отношению к кислотам тоже возрастает сверху вниз по группе
- Все щелочные металлы реагируют с кислотами со взрывом, поэтому в лабораториях такие реакции, как правило, не проводят.
Соединения s-металлов
Выше было указано, что -металлы образуют оксиды трех типов, которые обладают типичными основными свойствами. За исключением оксидов бериллия и магния, оксиды, пероксиды и супероксиды остальных элементов легко реагируют с водой, образуя сильно щелочные растворы, например:
Гидроксиды КОН и NaOH — важнейшие химические соединения щелочных металлов. В промышленности их получают электролизом растворов хлоридов.
- При реакции щелочей с кислотами образуются соли:
- Реакции такого типа называются реакциями нейтрализации.
- Гидриды, нитриды, фосфиды и карбиды -металлов реагируют с водой (см. § 9—12), например:
- а также с кислотами:
Потенциалы (энергии) ионизации щелочных и щелочноземельных металлов очень малы, поэтому при внесении металла или его соединения в пламя горелки элемент легко ионизуется, окрашивая пламя в цвет, соответствующий его спектральной линии возбуждения. Желтый цвет пламени характерен для соединений натрия, фиолетовый — для соединений калия, кирпичнокрасный — для соединений кальция.
Рекомендуемая литература: [Кузьменко, 1977, гл. 17], [Третьяков, § 61—66], [Фримантл, т. 2, гл. 13], [Хомченко, 1993, гл. 13].






