- СТРУКТУРА
- СВОЙСТВА
- Запасы и добыча
- ПРОИСХОЖДЕНИЕ
- ПРИМЕНЕНИЕ
- КЛАССИФИКАЦИЯ
- Физические свойства
- Оптические свойства
- Кристаллографические свойства
- Марганец – полезные свойства и особенности металла
- Что представляет собой
- История открытия
- Нахождение в природе
- Месторождения, добыча и цены
- Технология производства
- Физико-химические характеристики
- Где используется
- Другие отрасли
- Значение для человека
- Питание
- Жизненные процессы
- Симптомы избытка/дефицита
- Предостережение
- Марганец — мечта сталелитейщиков
- История открытия
- Свойства
- Месторождения
- Переработка марганцевых руд
- Сплавы
- Плюсы и минусы
- Использование
- Стоимость
- Марганец | это… Что такое Марганец?
- История открытия
- Распространённость в природе
- Минералы марганца
- Получение
- Физические свойства
- Химические свойства
- Применение в промышленности
- Определение методами химического анализа
- Биологическая роль и содержание в живых организмах
- Токсичность
- См. также
- Примечания
 Марганец — металл серебристо-белого цвета. Наряду с железом и его сплавами относится к чёрным металлам. Известны пять аллотропных модификаций марганца — четыре с кубической и одна с тетрагональной кристаллической решёткой. Марганец содержится в организмах всех растений и животных, хотя его содержание обычно очень мало, порядка тысячных долей процента, он оказывает значительное влияние на жизнедеятельность, то есть является микроэлементом.
Марганец — металл серебристо-белого цвета. Наряду с железом и его сплавами относится к чёрным металлам. Известны пять аллотропных модификаций марганца — четыре с кубической и одна с тетрагональной кристаллической решёткой. Марганец содержится в организмах всех растений и животных, хотя его содержание обычно очень мало, порядка тысячных долей процента, он оказывает значительное влияние на жизнедеятельность, то есть является микроэлементом.
СТРУКТУРА
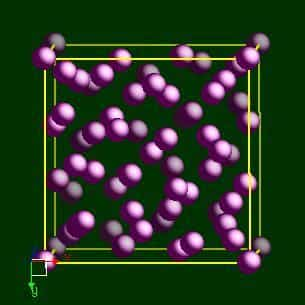 Марганец имеет 4 полиморфные модификации: α-Мn (кубическая объемноцентрированная решетка с 58 атомами в элементарной ячейке), β-Мn (кубическая объемноцентрированная с 20 атомами в ячейке), γ-Мn (тетрагональная с 4 атомами в ячейке) и δ-Mn (кубическая объемноцентрированная). Температура превращений: α=β 705 °С; β=γ 1090 °С и γ=δ 1133 °С; α-модификация хрупка; γ (и отчасти β) пластична, что имеет важное значение при создании сплавов.
Марганец имеет 4 полиморфные модификации: α-Мn (кубическая объемноцентрированная решетка с 58 атомами в элементарной ячейке), β-Мn (кубическая объемноцентрированная с 20 атомами в ячейке), γ-Мn (тетрагональная с 4 атомами в ячейке) и δ-Mn (кубическая объемноцентрированная). Температура превращений: α=β 705 °С; β=γ 1090 °С и γ=δ 1133 °С; α-модификация хрупка; γ (и отчасти β) пластична, что имеет важное значение при создании сплавов.
СВОЙСТВА

Растворяется в воде, полностью поглощает водород, не вступая в реакцию с ним. В процессе нагревания сгорает в кислороде. Активно реагирует с хлором и серой. При взаимодействии с кислотными окислителями образует соли марганца.
Плотность — 7200 кг/м3, t плавления — 1247°С, t кипения — 2150 °С. Удельная теплоемкость — 0,478 кДж. Обладает электрической проводимостью. Контактируя с хлором, бромом и йодом образует дигалогениды.
При высоких температурах вступает во взаимодействие с азотом, фосфором, кремнием и бором. Медленно взаимодействует с холодной водой. В процессе нагревания реакционная способность элемента возрастает. На выходе образуется Mn(OH)2 и водород.
Запасы и добыча
 Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной коры). Весовое количество марганца увеличивается от кислых (600 г/т) к основным породам (2,2 кг/т). Сопутствует железу во многих его рудах, однако встречаются и самостоятельные месторождения марганца. В чиатурском месторождении (район Кутаиси) сосредоточено до 40 % марганцевых руд. Марганец, рассеянный в горных породах, вымывается водой и уносится в Мировой океан. При этом его содержание в морской воде незначительно (10−7—10−6%), а в глубоких местах океана его концентрация возрастает до 0,3 %.
Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной коры). Весовое количество марганца увеличивается от кислых (600 г/т) к основным породам (2,2 кг/т). Сопутствует железу во многих его рудах, однако встречаются и самостоятельные месторождения марганца. В чиатурском месторождении (район Кутаиси) сосредоточено до 40 % марганцевых руд. Марганец, рассеянный в горных породах, вымывается водой и уносится в Мировой океан. При этом его содержание в морской воде незначительно (10−7—10−6%), а в глубоких местах океана его концентрация возрастает до 0,3 %.
Промышленное получение марганца начинается с добычи и обогащения руд. Если используют карбонатную руду марганца, то ее предварительно подвергают обжигу. В некоторых случаях руду далее подвергают сернокислотному выщелачиванию. Затем обычно марганец в полученном концентрате восстанавливают с помощью кокса (карботермическое восстановление).
ПРОИСХОЖДЕНИЕ
 Вследствие окисления растворённым в воде кислородом с образованием нерастворимого в воде оксида марганца, который в гидратированной форме (MnO2·xH2O) и опускается в нижние слои океана, формируя так называемые железо-марганцевые конкреции на дне, в которых количество марганца может достигать 45 % (также в них имеются примеси меди, никеля, кобальта). Такие конкреции могут стать в будущем источником марганца для промышленности.
Вследствие окисления растворённым в воде кислородом с образованием нерастворимого в воде оксида марганца, который в гидратированной форме (MnO2·xH2O) и опускается в нижние слои океана, формируя так называемые железо-марганцевые конкреции на дне, в которых количество марганца может достигать 45 % (также в них имеются примеси меди, никеля, кобальта). Такие конкреции могут стать в будущем источником марганца для промышленности.
В России является остродефицитным сырьём, известны месторождения: «Усинское» в Кемеровской области, «Полуночное» в Свердловской, «Порожинское» в Красноярском крае, «Южно-Хинганское» в Еврейской автономной области, «Рогачёво-Тайнинская» площадь и «Северо-Тайнинское» поле на Новой Земле.
ПРИМЕНЕНИЕ

Химический элемент выполняет множество функций, в том числе рафинирует и раскисляет сталь. Широко используется технология цинк марганец. Растворимость Zn в магнии составляет 2 %, а прочность стали, в этом случае, возрастает до 40 %.
В доменной шахте марганец удаляет серный налет из чугуна. В технике применяются тройные сплавы манганины, куда входит марганец медь и никель. Материал характеризуется большим электро-сопротивлением на которое влияет не температура, а сила давления.
Используется для изготовления манометров. Настоящей ценностью для промышленности является сплав медь — марганец. Содержание марганца здесь 70 %, меди 30%. Его применяют для снижения вредных производственных шумов. В изготовлении взрыв-пакетов для праздничных мероприятий используют смесь, куда входят такие элементы, как магний марганец. Магний широко используется в самолетостроении.
Некоторые виды солей марганца, такие как KMnO4 нашли свое применение в медицинской отрасли. Перманганат калия относится к солям марганцовой кислоты. Имеет вид темно-фиолетовых кристаллов. Растворяется в водной среде, окрашивая её в фиолетовый цвет. Является сильным окислителем. Антисептик, обладает противомикробными свойствами.
Марганец в воде легко окисляется, образуя плохо растворимый оксид марганца коричневого цвета. При соприкосновении с белком ткани формирует соединения с выраженными вяжущими качествами. В высоких концентрациях раствор марганца обладает раздражающим и прижигающим действием.
Калий марганец используют для лечения некоторых заболеваний и для оказания первой помощи, а пузырек с кристаллами марганцовки находится в каждой аптечки.
Марганец полезен для человеческого здоровья. Участвует в формировании и развитии клеток центрально-нервной системы. Способствует усвоению витамина В1, меди и железа. Регулирует содержание сахара в крови. Задействуется в строительстве костной ткани.
Участвует в образовании жирных кислот. Улучшает рефлекторные способности, память, убирает нервное напряжение, раздражительность.
Абсорбируясь в стенках кишечника марганец, витамины В, Е, фосфор, кальций усиливают этот процесс, влияет на организм и обменные процессы в целом.
Марганец (англ. Manganese) – Mn
КЛАССИФИКАЦИЯ
Физические свойства
Оптические свойства
Кристаллографические свойства
Марганец – полезные свойства и особенности металла
Необычные свойства этого металла объяснены самим Плинием Старшим. Марганец ценят металлурги и собиратели коллекций минералов.

Что представляет собой
Марганец – это элемент периодической системы Д.Менделеева №25.
Международное обозначение – Mn (Manganum).
Представляет собой металл цвета темного серебра. Плотный, твердый (превосходит железо), тяжелый. Относится к чёрным металлам.
Его свойства определяются запутанной структурой.
История открытия
Древние греки знали черную магнезию (минерал пиролюзит), ею осветляли стекломассу.
Классифицировалась как разновидность магнитного железняка, однако магнитом не притягивалась. Светило античной науки Плиний Старший (вероятно, адепт чисто «мужских отношений») считал это нормальным: магнит «равнодушен» к дамским чарам магнезии.

История открытия металла (1774 год) связана со шведскими химиками Карлом Шееле и Юханом Ганом:
- Шееле обнаружил в железной руде неизвестный металл.
- Послал образец на экспертизу Гану.
- Ган, получив образец (пиролюзит), смешал его с углем, затем нагрел. И получил металлический марганец.
- С начала XIX века в науке элемент фигурирует как «манганум».
По-русски в формулах элемент Mn озвучивается как «марганец».
Название восходит к немецкому Manganerz – марганцевая руда.
Нахождение в природе
Встречается как самостоятельный элемент, чаще – как компонент железных руд:
- Это распространенный в природе элемент – входит в топ-15. Среди металлов – второй после железа.
- Россыпи обнаружены в большинстве пород. Самые «богатые» минералы: пиролюзит, браунит, марганцовый шпат (62-69% марганца).
- В морской, океанской воде его мало. Перспективны придонные марганцево-железистые отложения (до 45% марганца).
Наличию марганца в составе обязаны розовым цветом минералы родохрозит и пурпурит. Их используют декораторы, ювелиры. За ними охотятся собиратели минералогических коллекций.
Месторождения, добыча и цены
- 40% марганцевых руд планеты сосредоточено в Грузии (Чиатурское месторождение).
- В России крупных залежей единицы: в Кемеровской, Еврейской автономной, Свердловской областях, Красноярском крае, на Новой Земле.
 Марганец металлический мн95
Марганец металлический мн95
Добыча сырья традиционна: карьер либо шахта.
На мировых биржах цены доступны: тонна металла марки Мн95 идет по $2100.
Технология производства
Способы получения стандартны для большинства черных металлов, однако конечным продуктом производства часто бывает ферромарганец. Он требуется сталеварам, поскольку при плавке удаляет из стали кислород.
Промышленное получение марганца как металла базируется на трех методах:
- Алюминотермический. Восстанавливается оксид металла. Как восстановитель также используется кремний.
- Восстановление железосодержащих руд. При помощи кокса получают ферромарганец с содержанием марганца 78%.
- Электролиз. Получают наиболее чистый продукт.
Также возможно обогащение карбонатной марганцевой руды. Ее обжигают либо выщелачивают, воздействуя серной кислотой.
Физико-химические характеристики
Химические свойства дают основания классифицировать марганец как переходный металл – он проявляет восстановительные и окислительные возможности:
- При нагревании образует соединения с простыми веществами, кислотами, основаниями.
- Образует сплавы почти со всеми металлами.

Наряду с этими достоинствами у марганца есть недостатки:
- Хрупкость, обусловленная структурой вещества. Она позволяет отличить марганец от других металлов.
- Высокая температура кипения.
- Низкая электропроводность.
Данные свойства затрудняют работу с металлом и его применение.
| Марганец / Manganum (Mn), 25 |
| 54,938045 (5) а. е. м. (г/моль) |
| [Ar] 3d5 4s2 |
| 127 пм |
| 117 пм |
| (+7e) 46 (+2e) 80 пм |
| 1,55 (шкала Полинга) |
| −1,180 В |
| 7, 6, 5, 4, 3, 2, 1, 0 |
| 716,8 (7,43) кДж/моль (эВ) |
| 7,21 г/см³ |
| 1 517 K |
| 2 235 K |
| 13,4 кДж/моль |
| 221 кДж/моль |
| 26,3 Дж/(K·моль) |
| 7,35 см³/моль |
| кубическая |
| 8,890 Å |
| 400 K |
| (300 K) 6,87 Вт/(м·К) |
| 7439-96-5 |
Особенность вещества – четыре структурные модификации. Каждая устойчива в определенном температурном промежутке. Эту характеристику учитывают при изготовлении сплавов с марганцем.
В обычных условиях металл малоактивен: этому способствует плотный оксидный слой, образующийся на воздухе.
Где используется
Хрупкость исключает применение марганца в чистом виде. Востребованы марганцевые сплавы и соединения.

- Главный потребитель сырья (90%) – металлургия.
- Здесь металл используется как легирующий компонент сталей:
- 1% элемента превращает сталь в нержавеющую, делает алюминиевые сплавы коррозиестойкими.
- 12,8%-13,1% Mn в разы повышают прочность, твердость стали. Она становится неуязвимой к ударам, износу.
- Сплав из 13% Mn (плюс медь и никель) наделен высоким электрическим сопротивлением, «равнодушным» к колебаниям температуры.
- 20% необходимы, чтобы чугун стал «зеркальным».
Востребованы сплавы элемента с железом, углеродом, кремнием.
На их основе создается продукция для разных отраслей хозяйства – от брони, землеройной и дробильной техники до оборудования для пищепрома.
Для получения тонны стали расходуется 7,5 кг марганца.
Другие отрасли
Соединения марганца востребованы разными сегментами рынка:
- Электротехника (реостаты).
- Химическая отрасль (промышленный и тонкий органический синтез).
- Выработка текстиля, стекла.
- Производство минеральных удобрений.
- Тара для хранения пищевых продуктов.
Сплавы металла с медью – материал деталей судов, контактирующих с соленой (океанской либо морской) водой.
Значение для человека
Марганец изначально присутствует в биологических организмах. Его содержание измеряется тысячными долями процента, но без этого микроэлемента жизнедеятельность невозможна.
В растительном сегменте металл – «участник» процесса фотосинтеза.
Питание
Марганцем богаты:
- Бобовые – горох, чечевица, фасоль.
- Крупы – пшеничная, овсяная, рисовая, гречневая.
- Злаки – пшеница, рожь.
- Грибы – белые, лисички, подосиновики.
- Орехи – грецкие, арахис, миндаль, фундук, фисташки.
- Зелень – укроп, шпинат, салат, свекольная ботва.
- Ягоды – черная смородина, малина, черника, брусника.
Микроэлементом насыщены говяжья печень, абрикосы, чеснок.
Жизненные процессы
Металл участвует в работе систем организма:
- Понижает в крови уровень сахара, предотвращая диабет.
- Синтезирует «хороший» холестерин, тормозит образование «плохого».
- Нормализует работу поджелудочной железы, нервной системы, головного мозга.
- Регулирует липидный обмен, препятствуя ожирению печени.
- Содействует росту костей, тканей организма.
Это активатор ферментов, без которых усложнено усвоение организмом полезных веществ.
Симптомы избытка/дефицита
Дефицит марганца ведет к анемичности, хрупкости костей, задержке роста, атрофии яичников и яичек. Это может проявиться у людей, чей рацион питания перенасыщен углеводами.
Об избытке металла сигнализируют плохой аппетит, сонливость, боли в мышцах. Опасное последствие – деформация костей (марганцевый рахит).
Взрослому человеку ежесуточно требуется 4,5-9,5 мг марганца.
Предостережение
Отравиться, объевшись пищей, богатой марганцем, невозможно.
Он токсичен только при постоянном вдыхании воздуха, загрязненного данным веществом:
- Такие условия характерны для предприятий металлургии.
- Симптомы отравления металлом отражаются на психике: повышенная раздражительность, моторика.
- Профессиональное заболевание работников горячих цехов таких предприятий – «марганцевое безумие» (проявляется как галлюцинации).
Распознать хроническое отравление веществом можно лишь за несколько лет.
Для интоксикации человеку достаточно 38-41 мг марганца в день.
Проверить совместимость мужчины и женщины по Знаку Зодиака
Марганец — мечта сталелитейщиков
Главная › Металлы
02.09.2020
Самая распространенная марганцевая руда (пиролюзит, или браунштейн) применялась с давних времен. Она отлично удаляла зеленоватый оттенок из расплава стекла. Оттенок придавался примесями железа, обычно содержащимися в песке.
История открытия
История открытия тянется со времен Античности. Плиний упоминал о «черной магнезии» (пиролюзите), но считал ее разновидностью магнитного железняка. То, что черная магнезия не притягивается магнитом, ученый объяснял просто. Античные ученые наделяли женскими и мужскими свойствами не только людей.
 Электролитический марганец
Электролитический марганец
Считается, что новый элемент обнаружил Шееле, работая с браунштейном (пиролюзитом). Новый металл называли браунштейном. Современное название металл марганец носит с XIX века.
Свойства
Химический элемент с №25 относится к металлам и называется марганец (Manganum, манганум). Его относят к чёрным металлам.
Химические свойства марганца:
- На воздухе поверхность покрывается слоем оксида, который ее пассивирует.
- Со щелочами практически не реагирует.
- При нагреве взаимодействует с кислотами-окислителями, образуя соли.
- В виде мелкого порошка проявляет пирофорность.
- Степени окисления: 0, +2, +3, +4, +6, +7; это сильный окислитель.
- Марганец образует многочисленные соли и бинарные соединения.
| Марганец / Manganum (Mn), 25 |
| 54,938045 (5)[1] а. е. м. (г/моль) |
| [Ar] 3d5 4s2 |
| 127 пм |
| 117 пм |
| (+7e) 46 (+2e) 80 пм |
| 1,55 (шкала Полинга) |
| −1,180 В |
| 7, 6, 5, 4, 3, 2, 1, 0 |
| 716,8 (7,43) кДж/моль (эВ) |
| 7,21 г/см³ |
| 1 517 K |
| 2 235 K |
| 13,4 кДж/моль |
| 221 кДж/моль |
| 26,3[2] Дж/(K·моль) |
| 7,35 см³/моль |
| кубическая |
| 8,890 Å |
| 400 K |
| (300 K) 6,87[3] Вт/(м·К) |
| 7439-96-5 |
Рекомендуем: МОЛИБДЕН — универсальный металл
Месторождения
Основные марганцевые руды:
- пиролюзит;
- манганит;
- браунит;
- гаусманит;
- псиломелан.
Крупнейший бассейн марганцевых руд в мире находится на юге Украины.
В его составе Никопольское и Большетокмакское месторождения.
Переработка марганцевых руд
Производство зависит от потребности разных сфер промышленности.
Способы получения металла:
- восстановлением пиролюзита кремнием, углеродом (редко — алюминием);
- электролизом раствора MnSO4; получаемый продукт осаждается на катоде;
- чистый металлический марганец получают электролитическим способом;
- в промышленных масштабах марганец часто получают в реакции восстановления углем из смеси марганцевых и железных руд.
Сплавы
Стальным сплавам добавка марганца придает вязкость, твердость, тягучесть.
 Марганец металлический Мн95
Марганец металлический Мн95
Ценный сплав под названием сталь Гадфильда обладает превосходными свойствами:
- большое сопротивление на износ;
- твердость;
- вязкость;
- высокий срок службы.
| Сплав | Содержание марганца (в %%) |
| Ферро-марганец | 50-82 |
| Силико-марганец | 55-75 |
| Фосфор-марганец | 65 |
| Силико-шпигель | 18-30 |
| Купро-марганец | 25-30 |
| Зеркальный чугун (шпигель) | 8-35 |
Марганцевистая бронза имеет большое сопротивление на разрыв.
Плюсы и минусы
Рассмотрим характеристики сплавов марганца.
| Достоинства | Недостатки |
| Химическая активность металла дает возможность получать множество соединений с различными свойствами | Высокая твердость в сочетании с хрупкостью ограничивает применение металла |
| Марганец образует сплавы практически со всеми металлами | Низкая электропроводность не позволяет использовать элемент в электротехнике |
| В сталелитейной промышленности сплавы с углеродом и кремнием незаменимы | Высокая температура кипения затрудняет работу с металлом |
| Соединения железа и марганца в любом соотношении образуют твердые растворы | Недостатки металла — следствие особенностей его структуры |
Трудно переоценить значение металла, как лигатуры.
Использование
Основная часть продукции, содержащей manganum, идет на нужды сталелитейной промышленности. Она потребляет ферромарганец для производства сталей и чугуна.
Рекомендуем: БАРИЙ — от китайского синего до рентгеноскопии
Применение марганца обосновано в промышленностях:
- стекольной;
- фармацевтической;
- стекольной;
- электротехнической;
- лакокрасочной.
- Mn(OH₂) применяют в текстильной промышленности, как коричневую краску.
- В производстве олифы соединения металла применяют, как сиккатив.
- Большое количество марганца идет в электротехническую промышленность, для производства сухих батарей.
Стоимость
Цена килограмма металла 3700 рублей (на 02.09.2020).
Марганец — мечта сталелитейщиков Ссылка на основную публикацию 
Марганец | это… Что такое Марганец?
| 25 | Марганец |
| 3d54s2 |
Ма́рганец — элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 25. Обозначается символом Mn (лат.
Manganum, ма́нганум, в составе формул по-русски читается как марганец, например, KMnO4 — калий марганец о четыре; но нередко читают и как манган). Простое вещество марганец (CAS-номер: 7439-96-5) — металл серебристо-белого цвета.
Известны пять аллотропных модификаций марганца — четыре с кубической и одна с тетрагональной кристаллической решёткой[1].
История открытия
Один из основных минералов марганца — пиролюзит — был известен в древности как чёрная магнезия и использовался при варке стекла для его осветления.
Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом черной магнезии, к которому магнит «равнодушен». В 1774 г. шведский химик К. Шееле показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю.
Гану, который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале XIX века для него было принято название «манганум» (от немецкого Manganerz — марганцевая руда).
Распространённость в природе
Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной коры). Весовое количество марганца увеличивается от кислых (600 г/т) к основным породам (2,2 кг/т).
Сопутствует железу во многих его рудах, однако встречаются и самостоятельные месторождения марганца. В чиатурском месторождении (район Кутаиси) сосредоточено до 40 % марганцевых руд. Марганец, рассеянный в горных породах вымывается водой и уносится в Мировой океан.
При этом его содержание в морской воде незначительно (10−7—10−6%), а в глубоких местах океана его концентрация возрастает до 0,3 % вследствие окисления растворённым в воде кислородом с образованием нерастворимого в воде оксида марганца, который в гидратированной форме (MnO2·xH2O) и опускается в нижние слои океана, формируя так называемые железо-марганцевые конкреции на дне, в которых количество марганца может достигать 45 % (также в них имеются примеси меди, никеля, кобальта). Такие конкреции могут стать в будущем источником марганца для промышленности.
В России является остродефицитным сырьём, известны месторождения: «Усинское» в Кемеровской области, «Полуночное» в Свердловской, «Порожинское» в Красноярском крае, «Южно-Хинганское» в Еврейской автономной области, «Рогачёво-Тайнинская» площадь и «Северо-Тайнинское» поле на Новой Земле.
Минералы марганца
- пиролюзит MnO2·xH2O, самый распространённый минерал (содержит 63,2 % марганца);
- манганит (бурая марганцевая руда) MnO(OH) (62,5 % марганца);
- браунит 3Mn2O3·MnSiO3 (69,5 % марганца);
- гаусманит (MnIIMn2III)O4
- родохрозит (марганцевый шпат, малиновый шпат) MnCO3 (47,8 % марганца);
- псиломелан mMnO • MnO2 • nH2O (45-60 % марганца);
- пурпурит (Mn3+[PO4]), 36,65 % марганца.
Получение
- Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита:
- Восстановлением железосодержащих оксидных руд марганца коксом. Этим способом в металлургии обычно получают ферромарганец (≅80 % Mn).
- Чистый металлический марганец получают электролизом
Физические свойства
Некоторые свойства приведены в таблице. Другие свойства марганца:
- Работа выхода электрона: 4,1 эВ
- Коэффициент линейного температурного расширения: 0,000022 см/см/°C (при 0 °C)
- Электропроводность: 0,00695·106 Ом−1·см−1
- Теплопроводность: 0,0782 Вт/см·K
- Энтальпия атомизации: 280,3 кДж/моль при 25 °C
- Энтальпия плавления: 14,64 кДж/моль
- Энтальпия испарения: 219,7 кДж/моль
- Твёрдость
- по шкале Бринелля: Мн/м²
- по шкале Мооса: 4[2]
- Давление паров: 121 Па при 1244 °C
- Молярный объём: 7,35 см³/моль
Химические свойства
| Mn2+ | Mn | H+ | −1,186 |
| Mn3+ | Mn2+ | H+ | +1,51 |
| MnO2 | Mn3+ | H+ | +0,95 |
| MnO2 | Mn2+ | H+ | +1,23 |
| MnO2 | Mn(OH)2 | OH− | −0,05 |
| MnO42− | MnO2 | H+ | +2,26 |
| MnO42− | MnO2 | OH− | +0,62 |
| MnO4− | MnO42− | OH− | +0,56 |
| MnO4− | H2MnO4 | H+ | +1,22 |
| MnO4− | MnO2 | H+ | +1,69 |
| MnO4− | MnO2 | OH− | +0,60 |
| MnO4− | Mn2+ | H+ | +1,51 |
Диаграмма Пурбе для марганца
Характерные степени окисления марганца: +2, +3, +4, +6, +7 (+1, +5 мало характерны).
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде (Mn + O2 → MnO2). Марганец при нагревании разлагает воду, вытесняя водород (Mn + 2H2O →(t) Mn(OH)2 + H2↑), образующийся гидроксид марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды.
C соляной и серной кислотами реагирует по уравнению:
С концентрированной серной кислотой реакция идёт по уравнению:
С разбавленой азотной кислотой реакция идёт по уравнению:
В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn2O3, MnO2, MnO3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn2O7.
Mn2O7 в обычных условиях жидкое маслянистое вещество тёмно-зелёного цвета, очень неустойчивое; в смеси с концентрированной серной кислотой воспламеняет органические вещества. При 90 °C Mn2O7 разлагается со взрывом. Наиболее устойчивы оксиды Mn2O3 и MnO2, а также комбинированный оксид Mn3O4 (2MnO·MnO2, или соль Mn2MnO4).
При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция:
Раствор окрашивается в малиновый цвет из-за появления аниона MnO4−, и из него выпадает коричневый осадок оксида-гидроксида марганца (IV).
Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители.
Например, перманганат калия в зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления.
В кислой среде — до соединений марганца (II), в нейтральной — до соединений марганца (IV), в сильно щелочной — до соединений марганца (VI).
При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия):
Под действием сильных окислителей ион Mn2+ переходит в ион MnO4−:
Эта реакция используется для качественного определения Mn2+ (см. в разделе «Определение методами химического анализа»).
При подщелачивании растворов солей Mn (II) из них выпадает осадок гидроксида марганца (II), быстро буреющий на воздухе в результате окисления. Подробное описание реакции см. в разделе «Определение методами химического анализа».
Соли MnCl3, Mn2(SO4)3 неустойчивы. Гидроксиды Mn(OH)2 и Mn(OH)3 имеют основной характер, MnO(OH)2 — амфотерный. Хлорид марганца (IV) MnCl4 очень неустойчив, разлагается при нагревании, чем пользуются для получения хлора:
Применение в промышленности
Марганец в виде ферромарганца применяется для «раскисления» стали при её плавке, то есть для удаления из неё кислорода. Кроме того, он связывает серу, что также улучшает свойства сталей.
Введение до 12-13 % Mn в сталь (так называемая Сталь Гадфильда), иногда в сочетании с другими легирующими металлами, сильно упрочняет сталь, делает её твердой и сопротивляющейся износу и ударам (эта сталь резко упрочняется и становится тверже при ударах).
Такая сталь используется для изготовления шаровых мельниц, землеройных и камнедробильных машин, броневых элементов и т. д. В «зеркальный чугун» вводится до 20 % Mn.
Сплав 83 % Cu, 13 % Mn и 4 % Ni (манганин) обладает высоким электросопротивлением, мало изменяющимся с изменением температуры. Поэтому его применяют для изготовления реостатов и пр.
- Марганец вводят в бронзы и латуни.
- Значительное количество диоксида марганца потребляется при производстве марганцево-цинковых гальванических элементов, MnO2 используется в таких элементах в качестве окислителя-деполяризатора.
- Соединения марганца также широко используются как в тонком органическом синтезе (MnO2 и KMnO4 в качестве окислителей), так и промышленном органическом синтезе (компоненты катализаторов окисления углеводородов, например, в производстве терефталевой кислоты окислением p-ксилола, окисление парафинов в высшие жирные кислоты).
- Цены на металлический марганец в слитках чистотой 95 % в 2006 году составили в среднем 2,5 долл/кг.
Арсенид марганца обладает гигантским магнитокалорическим эффектом, усиливающимся под давлением. Теллурид марганца перспективный термоэлектрический материал(термо-э.д.с 500 мкВ/К).
Определение методами химического анализа
- Марганец принадлежит к пятой аналитической группе катионов.
- Специфические реакции, используемые в аналитической химии для обнаружения катионов Mn2+ следующие:
- 1. Едкие щёлочи с солями марганца (II) дают белый осадок гидроксида марганца (II):
Осадок на воздухе меняет цвет на бурый из-за окисления кислородом воздуха.
Выполнение реакции. К двум каплям раствора соли марганца добавляют две капли раствора щёлочи. Наблюдают изменение цвета осадка.
2. Пероксид водорода в присутствии щёлочи окисляет соли марганца (II) до тёмно-бурого соединения марганца (IV):
Выполнение реакции. К двум каплям раствора соли марганца добавляют четыре капли раствора щёлочи и две капли раствора H2O2.
3. Диоксид свинца PbO2 в присутствии концентрированной азотной кислоты при нагревании окисляет Mn2+ до MnO4− с образованием марганцевой кислоты малинового цвета:
Эта реакция дает отрицательный результат в присутствии восстановителей, например хлороводородной кислоты и её солей, так как они взаимодействуют с диоксидом свинца, а также с образовавшейся марганцевой кислотой.
При больших количествах марганца эта реакция не удаётся, так как избыток ионов Mn2+ восстанавливает образующуюся марганцевую кислоту HMnO4 до MnO(OH)2, и вместо малиновой окраски появляется бурый осадок.
Вместо диоксида свинца для окисления Mn2+ в MnO4− могут быть использованы другие окислители, например персульфат аммония (NH4)2S2O8 в присутствии катализатора — ионов Ag+ или висмутата натрия NaBiO3:
Выполнение реакции. В пробирку вносят стеклянным шпателем немного PbO2, а затем 5 капель концентрированной азотной кислоты HNO3 и нагревают смесь на кипящей водяной бане.
В нагретую смесь добавляют 1 каплю раствора сульфата марганца (II) MnSO4 и снова нагревают 10—15 мин, встряхивая время от времени содержимое пробирки.
Дают избытку диоксида свинца осесть и наблюдают малиновую окраску образовавшейся марганцевой кислоты.
При окислении висмутатом натрия реакцию проводят следующим образом. В пробирку помещают 1—2 капли раствора сульфата марганца (II) и 4 капли 6 н. HNO3, добавляют несколько крупинок висмутата натрия и встряхивают. Наблюдают появление малиновой окраски раствора.
4. Сульфид аммония (NH4)2S осаждает из раствора солей марганца сульфид марганца (II), окрашенный в телесный цвет:
Осадок легко растворяется в разбавленных минеральных кислотах и даже в уксусной кислоте.
Выполнение реакции. В пробирку помещают 2 капли раствора соли марганца (II) и добавляют 2 капли раствора сульфида аммония.
Биологическая роль и содержание в живых организмах
Марганец содержится в организмах всех растений и животных, хотя его содержание обычно очень мало, порядка тысячных долей процента, он оказывает значительное влияние на жизнедеятельность, то есть является микроэлементом.
Марганец оказывает влияние на рост, образование крови и функции половых желёз. Особо богаты марганцем листья свёклы — до 0,03 %, а также большие его количества содержатся в организмах рыжих муравьёв — до 0,05 %.
Некоторые бактерии содержат до нескольких процентов марганца.
Избыточное накопление марганца в организме сказывается, в первую очередь, на функционировании центральной нервной системы. Это проявляется в утомляемости, сонливости, ухудшении функций памяти. Марганец является политропным ядом, поражающим также легкие, сердечно-сосудистую и гепатобиллиарную системы, вызывает аллергический и мутагенный эффект[источник не указан 372 дня].
Токсичность
Основная статья: Отравление марганцем
Токсическая доза для человека составляет 40 мг марганца в день. Летальная доза для человека не определена.
При пероральном поступлении марганец относится к наименее ядовитым микроэлементам. Главными признаками отравления марганцем у животных являются угнетение роста, понижение аппетита, нарушение метаболизма железа и изменение функции мозга.
Сообщений о случаях отравления марганцем у людей, вызванных приемом пищи с высоким содержанием марганца, нет. В основном отравление людей наблюдается в случаях хронической ингаляции больших количеств марганца на производстве.
Оно проявляется в виде тяжелых нарушений психики, включая гиперраздражительность, гипермоторику и галлюцинации — «марганцевое безумие». В дальнейшем развиваются изменения в экстрапирамидной системе, подобные болезни Паркинсона.
Чтобы развилась клиническая картина хронического отравления марганцем обычно требуется несколько лет. Она характеризуется достаточно медленным нарастанием патологических изменений в организме, вызываемый повышенным содержанием марганца в окружающей среде (в частности, распространение эндемического зоба, не связанного с дефицитом йода).
См. также
Примечания
- ↑ 1 2 Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1990. — Т. 2. — С. 647. — 671 с. — 100 000 экз. В.В. Еремин и др. Химия. 10 класс. Профильный уровень. — Москва: Дрофа, 2008. — С. 166. — 463 с. — 7000 экз. — ISBN 978-5-358-01584-5
- ↑ Поваренных А. С. Твердость минералов. — АН УССР, 1963. — С. 197-208. — 304 с.






