- Cu+2SO4 + KI-1 → Cu+1I-1 + I2 + K2SO4
- 2Fe+3Cl3 + 3Na2S-2 → 2Fe+2S + S0+6 NaCl
- 2Al3+ + 6Cl- + 6K+ + 3CO32- + 3H2O → 2Al(OH)3 + + 3CO2↑ +6K+ + 6Cl- 2Al3+ + 3CO32- + 3H2O → 2Al(OH)3 + + 3CO2↑
- Урок 11: Протекание реакций в растворе
- Особенности протекания реакций в растворе
- Кислоты и их свойства
- Основания и их свойства
- Соли и их свойства
- 2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка)
- Взаимодействие средних солей с гидроксидами металлов
- Реакции средних солей с кислотами
- Реакции средних солей с другими средними солями
- Реакции термического разложения солей
- Разложение карбонатов
- Разложение нитратов
- Разложение солей аммония
- Разложение хлората калия
- Химические свойства кислых солей
- Отношение кислых солей к щелочам и кислотам
- Более подробно, с разбором алгоритмов составления уравнений, взаимодействие кислых солей (в частности, гидрокарбонатов, дигидрофосфатов и гидрофосфатов) со щелочами рассмотрено в данной публикации.
- Термическое разложение кислых солей
- Химические свойства основных солей
- Химические свойства комплексных солей (на примере соединений алюминия и цинка)
- Соли в свете представления об электролитической диссоциации. Химические свойства солей: взаимодействие с металлами, кислотами, щелочами и солями
- Соли угольной кислоты: карбонаты натрия, калия, кальция, их практическое значение. Распознавание карбонатов
- Соли. Химические свойства солей. Взаимодействие с кислотами, щелочами, металлами. Реакции обмена..
| Химическая формула | Тип соли | Название соли | Тривиальное название |
| K2CO3 | Средняя | Карбонат калия | Поташ |
| NaHСO3 | Кислая | Гидрокарбонат натрия | Питьевая сода, пищевая сода |
| (CuOH)2CO3 | Основная | Гидроксокарбонат меди(II) | малахит |
| KAl(SO4)2 | Двойная | Сульфат алюминия-калия | Сернокислый алюминийкалий |
| CaOCl2 (Ca(ClO)Cl) | Смешанная | хлорид-гипохлорит кальция | Хлорная известь |
| Na[Al(OH)4] | Комплексная соль | Тетрагидроксоалюминат натрия | |
| Na2SO4*10H2O | Кристаллогидрат |
|
Глауберова соль (мирабилит) |
Задание 5.
| ФОРМУЛА СОЛИ | ГРУППА СОЛЕЙ | НАЗВАНИЕ ВЕЩЕСТВА | ФОРМУЛА ВЕЩЕСТВА |
| A) K2HPO4 | 1) основные | А) хлорная известь | FeS2 |
| Б) Cr(OH)2NO3 | 2) кислые | Б) бертолетова соль | FeSO4*7H2O |
| В) Na2[Zn(OH)4] | 3) средние | В) железный купорос | KClO3 |
| 4) комплексные | CaOCl2 |
Химические свойства
солей
| Растворимая соль взаимодействуют с щелочью, если в результате реакции выпадает осадок или выделяется газ. NH4OH→ NH3↑ + H2O |
|
| Кислоты реагируют с растворами солей, если в результате реакции выпадает осадок или выделяется газ. H2S↑; H2CO3→ H2O+ CO2 ↑; H2SO3→ H2O+ SO2↑ |
| 2HCl + CaCO3 = CaCl2 + H2O + CO2 ↑ H2SO4 + BaCl2 = BaSO4 + 2HCl |
| Соли взаимодействуют с металлами: каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. |
|
| Соли взаимодействуют с другими солями |
Химические свойства
солей
| Растворимая соль взаимодействуют с щелочью, если в результате реакции выпадает осадок или выделяется газ. NH4OH→ NH3↑ + H2O |
|
| Кислоты реагируют с растворами солей, если в результате реакции выпадает осадок или выделяется газ. H2S↑; H2CO3→ H2O+ CO2 ↑; H2SO3→ H2O+ SO2↑ |
| 2HCl + CaCO3 = CaCl2 + H2O + CO2 ↑ H2SO4 + BaCl2 = BaSO4 + 2HCl |
| Соли взаимодействуют с металлами: каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. |
|
| Соли взаимодействуют с другими солями |
Химические свойства
солей
| Растворимая соль взаимодействуют с щелочью, если в результате реакции выпадает осадок или выделяется газ. NH4OH→ NH3↑ + H2O |
|
| Кислоты реагируют с растворами солей, если в результате реакции выпадает осадок или выделяется газ. H2S↑; H2CO3→ H2O+ CO2 ↑; H2SO3→ H2O+ SO2↑ |
| 2HCl + CaCO3 = CaCl2 + H2O + CO2 ↑ H2SO4 + BaCl2 = BaSO4 + 2HCl |
| Соли взаимодействуют с металлами: каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. |
|
| Соли взаимодействуют с другими солями |
1.
По таблице растворимости проверяем соли на растворимость (между
собой могут реагировать только растворимые соли).
2.
Проверяем на возможность протекания
окислительно-восстановительной реакции: особенно, если в состав солей входят ионы железа (II), меди (I), сульфид-ионы, галогениды
(восстановители) и ионы железа (III),
меди (II) (окислители).
Пример 1. Медь растворили в концентрированной
серной кислоте.
- К
полученной соли добавили раствор иодида калия. - CuSO4 +
KI→ - Cu+2SO4 + KI-1 →
Cu+2SO4 + KI-1 → Cu+1I-1 + I2 + K2SO4
2Cu+2SO4
+ 4KI-1 → 2Cu+1I + I2 + 2K2SO4
2. Проверяем
на возможность протекания окислительно-восстановительной реакции: особенно,
если в состав солей входят ионы железа (II), меди
(I), сульфид-ионы, галогениды (восстановители) и ионы железа (III), меди (II)
(окислители). Пример 2. Газ, выделившийся при взаимодействии
хлороводородной кислоты с перманганатом калия, реагирует с
железом. Продукт реакции растворили в воде и добавили к нему сульфид натрия.
- ? Fe + Cl2 → FeCl2 Fe0 + Cl20 → Fe+2Cl2 => Fe+2Cl2+ Cl2→
FeCl3 - ? Fe + Cl2 →
FeCl3 2Fe +3 Cl2 → 2FeCl3 - FeCl3 + Na2S →
- Fe+3Cl3 + Na2S-2 → Fe+2S + S0+ NaCl
2Fe+3Cl3 + 3Na2S-2 → 2Fe+2S + S0+6 NaCl
3.Если реакция не окислительно-восстановительная, то
анализируем состав солей: если одна соль образована сильным основанием и слабой
кислотой, а другая соль образована слабым основанием и сильной кислотой, то
протекает совместный (полный) гидролиз (в левую часть реакции добавляем воду).
- FeCl3 + K2CO3
→ - FeCl3 + K2CO3
+ H2O → - FeCl3
+ K2CO3 + H2O → Fe(OH)3 + CO2↑+ KCl - 2FeCl3 + 3K2CO3
+ 3H2O → 2Fe(OH)3 + CO2↑+ 6KCl
| Сильные основания | Слабые основания |
| LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Ba(OH)2, Sr(OH)2 | Нерастворимые основания, NH3*H2O (NH4OH) |
| Сильные кислоты | Слабые кислоты |
|
|
2 2 3,
3 4
3.Если реакция не окислительно-восстановительная, то
анализируем состав солей: если одна соль образована сильным основанием и слабой
кислотой, а другая соль образована слабым основанием и сильной кислотой, то
протекает совместный (полный) гидролиз (в левую часть реакции добавляем воду).
Совместный (полный)
гидролиз.
(в заданиях ЕГЭ часто встречается фраза, указывающая на полный гидролиз: «выпал
осадок и выделился газ»)
! 2CuSO4
+ 2Na2CO3 + H2O = (CuOH)2CO3
+ CO2 + 2Na2SO4
| Сильные основания | Слабые основания |
| LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Ba(OH)2, Sr(OH)2 | Нерастворимые основания, NH3*H2O (NH4OH) |
| Сильные кислоты | Слабые кислоты |
|
|
2 2 3, 3 4

ГИА -11
Задание 31.
Для выполнения заданий 30 и 31 используйте следующий перечень веществ: сульфат
алюминия, дихромат аммония, гидроксид натрия, соляная кислота, карбонат калия,
оксид серебра. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми
возможна реакция ионного обмена, приводящая к выделению газа и образованию
осадка. Запишите молекулярное, полное и сокращённое ионное уравнения
реакции с участием выбранных веществ.
2AlCl3 +
3K2CO3 + 3H2O → 2Al(OH)3 + + 3CO2↑
+6KCl
2Al3+ + 6Cl- + 6K+
+ 3CO32- + 3H2O → 2Al(OH)3 +
+ 3CO2↑ +6K+ + 6Cl- 2Al3+ + 3CO32-
+ 3H2O → 2Al(OH)3 + + 3CO2↑
ГИА -11
Оксид марганца (4) прореагировал
при нагревании с концентрированной соляной кислотой. Выделившийся газ
пропустили через горячий раствор гидроксида калия. Полученный раствор разделили
на две части.
К одной части раствора добавили раствор нитрата серебра, в
результате чего выпал белый осадок. К другой части раствора прилили раствор
йодида натрия, образовался тёмно-бурый осадок.
Составьте уравнения четырёх
описанных реакций.
Порошок
железа растворили в разбавленной серной кислоте. В раствор добавили
концентрированную перекись водорода, в результате раствор приобрёл желтоватую
окраску. К образовавшемуся раствору прилили раствор сульфида калия, в
результате выпал осадок. На полученный осадок подействовали разбавленным
раствором соляной кислоты, при этом часть осадка растворилась. Нерастворившаяся
часть осадка имела жёлтый цвет. Составьте уравнения четырёх описанных реакций
Урок 11: Протекание реакций в растворе
- План урока:
- Особенности протекания реакций в растворе
- Кислоты и их свойства
- Основания и их свойства
- Соли и их свойства
Особенности протекания реакций в растворе
Химические реакции, в отличие от физических, характеризуются образованием новых веществ. Судить об их получении, мы можем, наблюдая изменение окраски, либо выделение газа или осадка.
Вспомним, что происходит с веществом, когда оно попадает в воду. Оно распадается на ионы. Тем не менее, этот процесс характерен не для всех веществ, а только для сильных электролитов, к которым относятся растворимые соли и кислоты, а также щёлочи.
Также необходимо вспомнить, какие реакции относятся к типу обмена.
Судить произошла реакция или нет, мы можем, если будет выполняться хотя бы одно из условий.
Условия протекания реакций между ионами сложных веществ.
Рассмотрим подробно каждое условие и составим алгоритм написания уравнений.
Выпадение осадка является подтверждением того, мы визуально видим, что реакция произошла. Составим уравнение между щёлочью – гидроксидом калия и солью – сульфатом меди (II). Запишем молекулярное уравнение.
Выполняя данный опыт, Вы могли бы наблюдать образование осадка голубого цвета.
Чтобы понять, какое вещество выпало в осадок, воспользуемся таблицей растворимости, а также составим полное ионно-молекулярное уравнение, которое отображает все частицы, находящиеся в растворе, с учётом коэффициентов.
Таким образом, KOH, K2SO4 и CuSO4 – это сильные электролиты, которые запишем в ионном виде. Cu(OH)2 – нерастворимое вещество, будет в молекулярном виде со стрелкой ↓. Также обращаем внимание, что перед щёлочью КОН находится коэффициент 2. Значит, образуется по два моля ионов К+ и ОН−.
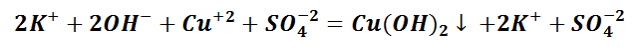
При написании уравнений реакций, не забываем о законе сохранения вещества. Поэтому количество атомов, а также ионов, до реакции и после должны быть равны.
Следует отметить, что в полном ионно-молекулярном уравнении, слева и справа, имеются одинаковые частицы, их можно сократить.
Эти ионы при взаимодействии не образуют вещества, поэтому находятся в растворе в свободном виде как K+и SO4−2.
Сокращённая реакция ионного обмена отображает суть химического процесса, а именно, между какими частицами происходит реакция.
Следственно, Cu(OH)2 будет осадком в растворе состоящем из ионов SO42−и К+.
Вторым из условий является выделение газа. Эту реакцию Вы наблюдаете, когда гасите соду кислотой, не важно, какой уксусной, лимонной, яблочной, или же при добавлении к ней кефира, результат будет один и тот же, образование пузырьков углекислого газа. Для примера возьмём взаимодействие соды и соляной кислоты. Составим молекулярное уравнение.
Возникает закономерный вопрос, в уравнении отсутствует газ, однако раствор «шипит». Чтобы разобраться в этой проблеме, следует вспомнить, что угольная кислота относится к слабым электролитам и происходит выделение углекислого газа, а также образование молекулы воды. Поэтому полное молекулярно-ионное уравнение приобретает вид.
- После сокращение одинаковых частиц левой и правой части, получаем сокращённое ионное уравнение.
- Именно по причине наличия ионов водорода, сода «шипит» во всех кислотах.
И к третьему условию относится образование слабого электролита, зачастую это молекула воды, однако могут получаться и другие вещества. Ярким примером является реакция нейтрализации.
Почему этот тип реакции носит такое название? Рассмотрим на примере взаимодействия оснований КОН и Cu(OH)2 с раствором соляной кислоты.
В каждом случае происходит образование воды. В случае нерастворимых оснований, реакция идёт с образованием растворимой соли.
Уравнение реакции нейтрализации показывает, как два противоположных по свойствам класса неорганических соединений, отдавая по своей частице (Н+ и ОН-), образуют нейтральное вещество Н2О.
Кислоты и их свойства
Если посмотреть на состав этого класса соединений, то абсолютно во всех содержаться ионы водорода.
Следует заметить, что уравнение диссоциации кислот похожи, но отличие будет по кислотному остатку.Рассмотрим на примерах следующих многоосновных кислот –сернойН2SО4 и фосфорной Н3РО4.Характерной особенностью диссоциации многоосновных кислот – это ступенчатая диссоциация. Это означает, что ионы водорода будут отрываться не сразу все (2 или 3), а по одному.
- Следствием этого является способность многоосновных кислот образовывать кислые соли.
- Рассмотрим химические свойства кислот, за которые отвечают ионы Н+.
Каким образом можно доказать, что неизвестное вещество относится к кислотам. Для этих целей создали индикаторы, которые как настоящие сыщики, ищут ионы Н+ или ОН- (в основаниях). Найдя их, они моментально меняют свою окраску. Кислая среда обусловлена наличием Н+.
- В реакциях обмена на их место могут стать только ионы металла, поэтому кислоты реагируют со следующими веществами.
- Следственно, при реакции кислот с основными оксидами образуется соль и вода.
- Атомы металла входят в состав оснований, в результате реакции нейтрализации, аналогично, как и основными оксидами, продуктом реакции является соль (может быть и кислая, и средняя) и вода.
- Исходя из этого, кислая соль образуется, если «не хватает» атомов металла, чтобы обменять их на атомы водорода.
- Взаимодействие кислот с солями возможно только в случае, когда соль образована слабой или летучей кислотой, а также в продукте будет газ или осадок.
- Источник
Особенно хочется отметить взаимодействие металлов с кислотами, поскольку это будет реакция замещения со сменой степени окисления. Не все металлы способны реагировать с кислотами, а только те, что стоят в ряду напряжения до водорода и способны его вытеснить.
Действие концентрированных серной и азотной кислот на металлы отличается от их растворов, при этом происходит образование не водорода, а воды и других продуктов. Детально со свойствами азотной кислоты Вы познакомитесь чуть позже, однако сейчас необходимо запомнить, что при реакции с раствором этой кислоты водород не выделяется.
Основания и их свойства
Данный класс веществ характеризуется наличием функциональной группы, которая отвечает за химические свойства, а именно группы ОН-. По растворимости основания делятся на щёлочи (растворимые) и нерастворимые основания. Соответственно они будут отличаться по химическим свойствам. Щелочная среда образуется, если есть свободные ОН-, которые образуются при диссоциации щелочей.
- Для щелочей, подобно многоосновным кислотам, характерна ступенчатая диссоциация.
Тем не менее, будет происходить не только взаимодействие щелочей с кислотами, но и нерастворимых оснований. Объяснением этому служит, то, что кислоты практически все растворимы, за исключением силикатной H2SiO3, которая реагирует только со щелочами. Продуктом будет соль (в зависимости от соотношения реагентов средняя, основная или кислая) и вода.
- Кислотные оксиды со щелочами образуют соль и воду.
- Для нерастворимых оснований эта реакция не характерна, поскольку именно гидроксильная группа реагирует с оксидами.
Амфотерные основания реагируют также с щелочами. Результатом данного взаимодействия будет соль, зачастую комплексная, и вода.
Взаимодействие солей с щелочами приводит к образованию соли либо основания. Также не забываем об условии, что в продукте должен быть либо газ, либо осадок.
Отличительной способностью обладают нерастворимые, а также амфотерные основания. Они при нагревании распадаются на оксиды.
Соли и их свойства
Этот класс веществ состоит из частичек кислоты – кислотного остатка и основания – катионов металла (либо иона аммония NH4+). Диссоциация солей всегда идёт в одну стадию.
Если посмотреть на состав соли, то смело можно предположить, что их растворы будут нейтральными. Поскольку нет ионов, которые отвечают за реакцию среды. Однако на деле совсем не так.
Лакмус в водном растворе солей может иметь как красную, так и синюю окраску, а также не изменять её. Объяснением этого явления служит их взаимодействие с водой, которое имеет название гидролиз солей.
Возьмём, к примеру, три пробирки, в которых содержатся растворы NaCl, ZnCl2 и Na2CO3. И в каждую добавим лакмус. Результаты эксперимента отображены на рисунке.
- Запишем суть реакции соли с водой (молекулу Н2О распишем как НОН), с помощью ионно-молекулярных уравнений.
Сокращённое уравнение хорошо иллюстрирует, почему происходит изменение окраски индикатора. Теперь давайте разберёмся, какие соли подвергаются гидролизу.
- Именно наличием ионов Н+ в растворе соли ZnCl2, а также группы ОН- в солевом растворе карбоната натрия, объясняется изменение окраски индикатора.
- Источник
Рассмотрим взаимодействие металлов с солями. Чтобы понять принцип их взаимодействия, вспомним ряд активностей металлов.
Данный вид взаимодействия Вы можете наблюдать, выполнив дома опыт (не забываем о разрешении родителей). Вам понадобится раствор медного купороса и скрепка, либо гвоздь.
На поверхности гвоздя выделилась медь в чистом виде. Это окислительно-восстановительная реакция.
Более сильный металл, вытесняет слабый с раствора его соли. Если промоделировать обратную реакцию, а именно положить медную проволоку в раствор соли железа, то не будет никакого взаимодействия. «Силы» у меди не хватит, потеснить железо.
- Взаимодействие солей между собой возможно только, если реагенты растворимы, а в продукте будет осадок.
- Свойства солей, кислот и оснований, рассмотренных выше, можно объединить в схематическом виде.
- Источник
2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка)
Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли. Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
Для того чтобы средняя соль реагировала с гидроксидом металла, должны одновременно (!) выполняться два требования:
- в предполагаемых продуктах должен быть обнаружен осадок или газ;
- исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
- 1) PbS + KOH
- 2) FeCl3 + NaOH
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:
В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок.
Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида.
Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Реакции средних солей с кислотами
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
- Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакции средних солей с другими средними солями
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- исходные соли растворимы;
- в предполагаемых продуктах есть осадок или газ.
- Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
- В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:
- Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
- Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4+ и анионы NO2— , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Реакции термического разложения солей
Разложение карбонатов
- Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:
- а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:
- Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:
- Также следует отметить специфику разложения нитрата аммония и нитрата железа (II):
Реакция разложения нитрата железа (II) снова стала встречаться в ЕГЭ по химии. В заданиях фигурирует формулировка о его разложении в токе воздуха, однако, что в токе воздуха, что без него, уравнение будет одинаковым. Писать оксид FeO при разложении нитрата железа (II) будет ошибкой.
Разложение солей аммония
- Термическое разложение солей аммония чаще всего сопровождается образованием аммиака:
- В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):
Разложение хлората калия
- Реакция разложения хлората калия может протекать по-разному. В присутствии катализатора (как правило MnO2), реакция приводит к образованию хлорида калия и кислорода:
- Без катализатора, реакция будет протекать по типу диспропорционирования:
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
- Кислые соли реагируют с щелочами. При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
- Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
- так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
- Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:
- Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Более подробно, с разбором алгоритмов составления уравнений, взаимодействие кислых солей (в частности, гидрокарбонатов, дигидрофосфатов и гидрофосфатов) со щелочами рассмотрено в данной публикации.
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
- Основные соли всегда реагируют со всеми сильными кислотами. При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:
- Также для основных солей характерны реакции разложения при нагревании, например:
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
- В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
- Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
- Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
- Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
- При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
- Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
- В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
- В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
- При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
Соли в свете представления об электролитической диссоциации. Химические свойства солей: взаимодействие с металлами, кислотами, щелочами и солями
-
Соли
– вещества, диссоциирующие в растворах
с образованием положительно заряженных
ионов, отличных от ионов водорода,
и отрицательно заряженных ионов, отличных
от гидроксид-ионов: -
NaCl
= Na+
+
Cl
— -
Соли,
состоящие из металла (или иона аммония)
и кислотного остатка, относятся к
средним. -
Соли
могут содержать водород – тогда их
относят к кислым
солям, например, гидрокарбонат натрия
– питьевая сода* NaHCO3. -
Оснóвные
соли содержат гидроксогруппу, как
оснóвный карбонат меди (II) – минерал
малахит (CuOH)2CO3. -
Двойные
соли образованы двумя металлами и одной
кислотой, как сульфат калия-алюминия
(квасцы) KAl(SO4)2 -
Смешанные
соли образованы одним металлом и двумя
кислотами. -
Химические
свойства:
-
Соли взаимодействуют с металлами – более активные металлы, расположенные левее в электрохимическом ряду напряжений**, вытесняют из солей менее активные металлы. Например, железо вытесняет медь из раствора хлорида меди (II):
Fe + CuCl2 = FeCl2 + Cu↓ -
Соли, образованные более слабой или летучей кислотой, взаимодействуют с более сильными кислотами. Так, многие кислоты вытесняют угольную из растворов карбонатов:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑ -
Соли реагируют со щелочами, если образуется осадок нерастворимого гидроксида:
CuCl2 + 2NaOH = 2NaCl + Cu(OH)2↓
или выделяется газ:
NH4Cl + NaOH = NaCl + H2O + NH3↑ (при нагревании) -
Соли взаимодействуют друг с другом в случае образования осадка:
NaCl + AgNO3 = NaNO3 + AgCl↓
*
Хотя гидрокарбонат натрия по
составу
относится к кислым солям, его водные
растворы обладают щелочной реакцией и
используются для нейтрализации кислоты,
попавшей на кожу. Это результат
гидролиза – взаимодействия соли с
водой.
**Для
вытеснения металлов из растворов солей
нельзя использовать такие активные
металлы как Na, K и другие, вступающие в
реакцию с водой.
Соли угольной кислоты: карбонаты натрия, калия, кальция, их практическое значение. Распознавание карбонатов
-
Соли
угольной кислоты – твердые кристаллические
вещества. -
Карбонат
натрия
Na2CO3
– сода – важнейший продукт химической
промышленности. - Применяется:
-
Для снижения жесткости воды, так как соли кальция и магния, присутствие которых обуславливает жесткость воды, взаимодействуют с карбонатом натрия с образованием осадка:
CaCl2 + Na2CO3 = 2NaCl + CaCO3↓ (1) -
В качестве моющего средства, так как раствор соды обладает щелочной реакцией вследствие гидролиза (взаимодействия с водой):
CO32 — + HOH = HCO3- + OH – (2) -
В производстве стекла, мыла. В нефтяной, целлюлозно-бумажной промышленности.
-
Соду
в промышленности получают прокаливанием
гидрокарбоната натрия – питьевой соды: -
2NaHCO3
= Na2CO3
+ H2O
+
CO2↑
(3) -
Питьевая
сода применяется:
-
для выпечки в качестве разрыхлителя, лучше с добавлением лимонной кислоты:
NaHCO3 + H+ = Na+ + H2O + CO2↑ -
2%-ный раствор – для нейтрализации кислоты, попавшей на кожу (та же реакция)
-
Питьевая сода тоже гидролизуется и обладает щелочной реакцией раствора, поэтому применяется для мытья посуды, чистки сантехники и т.п.
-
В составе наполнителя в пенных огнетушителях.
Химику
полезно знать, что из-за образования
большого количества газа сода не
используется при попадании кислоты в
пищеварительный тракт. В этом случае
применяется оксид магния.
Карбонат
калия
K2CO3
– потáш.
Белый порошок, расплывающийся во влажном
воздухе и хорошо растворимый в воде.
Применяется
для получения жидкого мыла, тугоплавкого
и хрустального стекла.
Карбонат
кальция
широко встречается в природе в виде
мела, известняка, мрамора (минерал
кальцит).
Нерастворим в воде, гидрокарбонат
кальция малорастворим.
Применение:
-
В строительстве. Известняк – для кладки стен и, в виде щебня, для бетонных работ, строительства дорог. Мел – в виде порошка как наполнитель в шпаклевках, замазках, мастúках. Мрамор – для облицовки зданий и станций метрополитена.
-
Óбжигом известняка в промышленности получают жжёную известь и углекислый газ:
CaCO3 = CaO + CO2↑ (4) -
Для известкования кислых почв. Известняк нейтрализует почвенные кислоты, при этом выделяется углекислый газ, повышая рыхлость почвы:
CaCO3 + 2H+ = Ca2+ + H2O +CO2↑
-
Для
распознавания
карбонатов приливают раствор соляной
кислоты, происходит бурное выделение
газа: -
CaCO3
+ 2HCl = CaCl2
+ H2O
+CO2↑
(5) -
Хотя
в формулировке вопроса билета нет
химических свойств, в старых «билетниках»
они перечисляются и преподаватель может
задать такой вопрос. В этом случае
назовите:
-
Реакции обмена с солями (уравнение 1)
-
Гидролиз (уравнение 2)
-
Взаимопревращения карбонатов и гидрокарбонатов (уравнение 3 – реакция обратимая)
-
Разложение при нагревании, кроме солей щелочных металлов (уравнение 4)
-
Взаимодействие с кислотами (уравнение 5)
Соли. Химические свойства солей. Взаимодействие с кислотами, щелочами, металлами. Реакции обмена..
Соли. Химические свойства солей. Взаимодействие с кислотами, щелочами, металлами. Реакции обмена между солями. Практическое значение солей (хлорида натрия, карбонатов натрия, калия и кальция).
ПЛАН ОТВЕТА:
- Определение
- Химические свойства:
- a) Взаимодействие с кислотами,
- b) Взаимодействие со щелочами,
- c) Взаимодействие с металлами,
- d) Взаимодействие с солями.
- a) Хлорида натрия,
- b) Карбоната натрия,
- c) Карбоната калия,
- d) Карбоната кальция.
- Соли – это электролиты, которые в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков.
- NaCl ® Na+ + Cl- K2SO4 ® 2K+ + SO42- Mg(NO3)2 ® Mg2+ + 2NO3-
- Общие химические свойства солей характеризуются их взаимодействием с кислотами, щелочами, металлами и солями.
- Соли взаимодействуют с кислотами, если образуется:
- a) летучая кислота: CaCO3 + 2HCl = CaCl2 + H2O + CO2, CaCO3 + 2H+ = Ca2+ + H2O + CO2;
- b) нерастворимая кислота: Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3?, SiO32- + 2H+ = H2SiO3;
- c) соль, нерастворимая в воде и образующейся кислоте:
AgNO3 + HCl = AgCl? + HNO3, Ag+ + Cl- = AgCl.
- Растворимые соли взаимодействуют со щелочами, если одно из образующихся веществ выпадает в осадок: CuSO4 + 2NaOH = Cu(OH)2? + Na2SO4 Cu2+ + 2OH- = Cu(OH)2,
Na2SO4 + Ba(OH)2 = BaSO4? + 2NaOH SO42- + Ba2+ = BaSO4
- Более активные металлы вытесняют менее активные металлы из растворов их солей, за исключением металлов, реагирующих с водой: CuSO4 + Zn = ZnSO4 + Cu
Cu + ZnSO4 = —————
!!! При взаимодействии растворов солей со щелочными металлами образуется новая соль, нерастворимое основание и водород, т.к. в реакции участвует вода из раствора:
Na + CuSO4 + H2О = …………………..
- 2Na + 2H2O = 2NaOH + H2
- 2NaOH + CuSO4 = Cu(OH)2? + Na2SO4
- ————————————————-
- 2Na + CuSO4 + 2H2O = H2 + Cu(OH)2? + Na2SO4
- Растворы солей реагируют между собой, если происходит связывание ионов.
- Если связывания ионов не происходит, то говорят, что реакция идёт не до конца:
- CuSO4 + BaCl2 = CuCl2 + BaSO4 SO42- + Ba2+ = BaSO4?
- есть связывание ионов, реакция идёт до конца.
- K2SO4 + 2NaCl = Na2SO4 + 2KCl
- 2K+ + SO42- + 2Na+ + 2Cl- = 2Na+ + SO42- + 2K+ + 2Cl-
- нет связывания ионов, реакция идёт не до конца.
Многие соли имеют большое практическое значение. Например, хлорид натрия NaCl или поваренная соль, каменная соль, пищевая соль – ценнейшее химическое сырьё. Его используют при получении соды, хлороводорода.
При электролизе водного раствора хлорида натрия получают гидроксид натрия, хлор и, попутно, водород, а при электролизе расплава хлорида натрия получают металлический натрий и хлор. Хлорид натрия применяют при первичной обработке кож, при подготовке тканей к крашению, как консервант в пищевой промышленности, как вкусовую добавку в пищу.
В дорожном хозяйстве для предотвращения обледенения асфальта. Всего хлорид натрия используют более чем в 1500 производствах различных веществ и материалов.
Карбонат натрия Na2CO3 или кальцинированная сода, сода, стиральная сода. Его применяют при производстве стекла, мыла и моющих средств, при варке целлюлозы, как нейтрализующее вещество при обработке кислых растворов.
Карбонат калия, K2CO3 поташ применяют при варке оптического стекла, жидкого мыла, минеральных красок, получении многих соединений калия.
Карбонат кальция CaCO3 – распространённое в природе вещество: минерал кальцит, горная порода известняк и его разновидности – мел, мрамор, туф.
Применяется для производства негашёной извести, цемента, стекла, минеральных удобрений, как наполнитель при изготовлении «мелованной» бумаги и резины, строительный камень (щебень) и компонент бетона и шифера, в виде осаждённого порошка – для изготовления школьных мелков, зубных порошков и паст, в побелке помещений.






