- Характеристика амфотерных металлов
- Характеристики элементов-металлов
- Физические свойства
- Способы получения
- Химические свойства
- Оксиды алюминия и цинка
- Гидроксиды алюминия и цинка
- Важнейшие химические свойства солей
- Фактчек
- Проверь себя
- Гидриды — свойства, формулы и применение водородных соединений
- Типы и классификация
- Соединения с ионным типом связи
- Когда связь ковалентна
- § 44. Общие химические свойства металлов
- Ряд активности металлов
- Соединения металлов IА группы
- Пероксиды Ме202
- Супероксиды (надпероксиды) Me+[O2-]
- Озониды Me+[O3-]
- Гидроксиды щелочных металлов
- Важнейшие соли натрия и калия
- Гдз химия 11 класc габриелян о.с. остроумов и.г. сладков с.а. §4 ионная химическая связь и ионные кристаллические решётки ответы
- Особенности строения атомов амфотерных металлов;
- Физические и химические свойства;
- И нашим, и вашим: обсудим амфотерность цинка и алюминия.
Кто-то любит соленое, кто-то любит сладкое, а кто-то — и то, и другое. То же самое происходит и с амфотерными металлами.
Характеристика амфотерных металлов
Под амфотерностью понимают способность соединений проявлять одновременно и кислотные, и основные свойства в зависимости от условий и природы реагентов, участвующих в реакции.
Список амфотерных металлов включает в себя множество наименований. Из них мы рассмотрим цинк и алюминий.
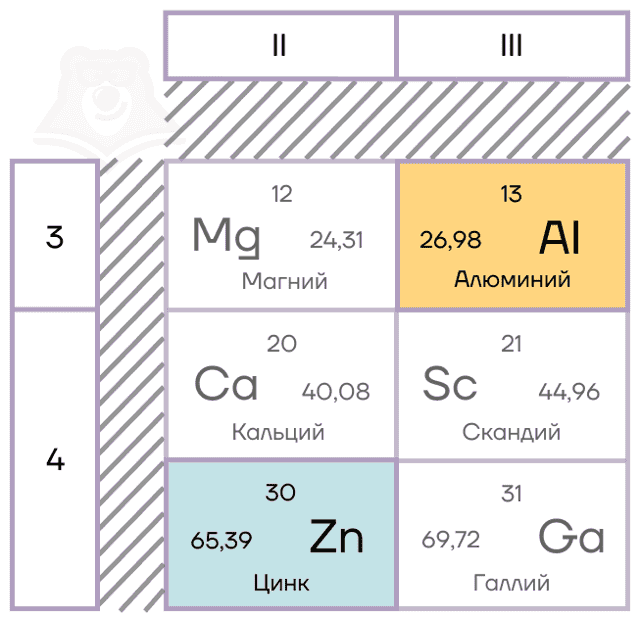
Характеристики элементов-металлов
Алюминий — элемент IIIA группы третьего периода. Его электронная конфигурация [Ne]3s23p1.
В возбужденном состоянии электронная пара на 3s-орбитали распаривается. В результате образуются три неспаренных электрона, которые способны образовывать химические связи. Поэтому у алюминия постоянная степень окисления +3.
Цинк — расположен во IIВ группе в четвертом периоде. Цинк относится к d-элементам, при этом атом цинка имеет полностью заполненные 3d– и 4s– электронные подуровни.
Его электронная конфигурация в основном состоянии [Ar]3d104s2. В соединениях цинк проявляет постоянную степень окисления +2.
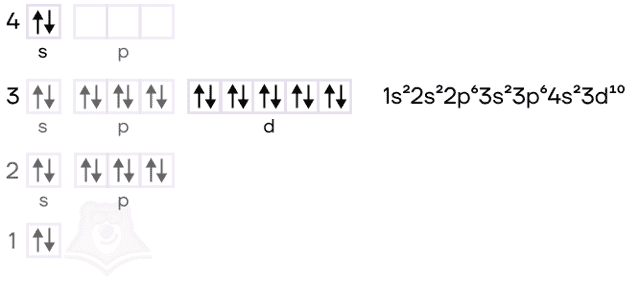
Физические свойства

Алюминий — лёгкий серебристо-белый металл, покрывающийся на воздухе оксидной плёнкой из-за взаимодействия с кислородом (на фото расположен слева). Из алюминия часто делают тысячи вещей, которые окружают нас в быту: от фольги на баночке йогурта до стильного корпуса смартфона.
Цинк — голубовато-белый металл (на фото расположен справа).
Способы получения

Химические свойства
По химическим свойствам они являются типичными восстановителями, а значит, способны реагировать с окислителями. Как и другие металлы, они будут взаимодействовать со своими противоположностями — неметаллами. Также они будут вступать в реакции вытеснения с водой, кислотами-неокислителями, щелочами и солями менее активных металлов.
Как типичные металлы, алюминий и цинк способны вступать в реакции с неметаллами и образовывать различные бинарные соединения.
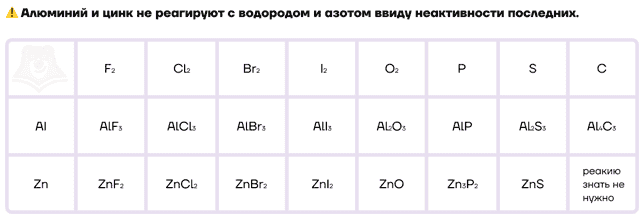
Ввиду низких значений электроотрицательности алюминий и цинк, как и другие металлы, являются отличными восстановителями. Настолько сильными, что они даже способны восстанавливать некоторые металлы и неметаллы из их оксидов. Этот процесс называется металлотермией.
| Активные металлы (стоящие до алюминия в ряду активности) не получают путём восстановления из оксидов. |
Алюминий является очень активным металлом, который, помимо этого, ещё и является одним из наиболее распространённых в земной коре.
Его очень часто используют в металлургии для получения других металлов из их оксидов. Этот процесс называется алюмотермией.
Так как алюминий и цинк — металлы, стоящие в ряду активности левее водорода, то они способны вытеснять водород из воды.

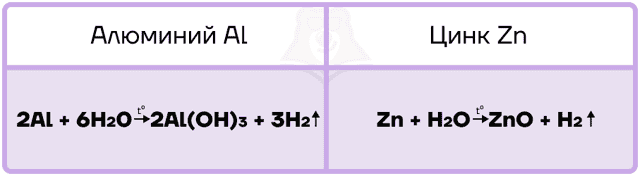
Алюминий, подобно другим активным металлам, при взаимодействии с водой образует гидроксид и водород.
Цинк является уже менее активным металлом, поэтому нуждается в создании более жёстких условий для реакции с водой. Он взаимодействует только с перегретым водяным паром и в таких жёстких условиях вытесняет из воды ОБА атома водорода, превращаясь в оксид.
Алюминий и цинк также способны вытеснять водород не только из воды, но и из кислот-неокислителей.
С кислотами-окислителями протекают более сложные ОВР, при этом помним, что в холодных концентрированных растворах кислот-окислителей алюминий пассивируется из-за наличия оксидной плёнки на его поверхности.
Амфотерные металлы реагируют со щелочами, причем продукты зависят от определенных условий:
Как и другие металлы, алюминий и цинк способны вытеснять менее активные металлы из их солей.
Оксиды алюминия и цинка
Оксиды алюминия и цинка по физическим свойствам представляют собой бесцветные порошки, нерастворимые в воде.
По химическим свойствам это типичные амфотерные оксиды, которые способны вступать в основно-кислотные взаимодействия как с основным, так и с кислотным. Как и другие оксиды, они могут вступать в ОВР с сильными восстановителями с восстановлением из них металла.
Оксидам алюминия и цинка соответствуют нерастворимые гидроксиды Al(OH)3 и Zn(OH)2, поэтому и сами оксиды с водой не взаимодействуют.
- Амфотерные свойства оксидов
Как типичные амфотерные оксиды, оксиды алюминия и цинка будут реагировать как с веществами, проявляющими основные свойства (основаниями, основными оксидами), так и с веществами, проявляющими кислотные свойства (кислотами, кислотными оксидами):
- ОВР с сильными восстановителями
Как и другие оксиды, оксид цинка может вступать в ОВР с сильными восстановителями (C, CO, H2, Al, Mg, Ca и т. д.) с восстановлением из них металла.
Гидроксиды алюминия и цинка
По физическим свойствам гидроксиды алюминия и цинка представляют собой белые порошкообразные вещества, нерастворимые в воде. Все их химические свойства обусловлены тем, что они являются амфотерными гидроксидами: они способны вступать в реакции как с основным, так и с кислотным.
Помимо этого, как и для других нерастворимых гидроксидов, для гидроксидов алюминия и цинка характерны реакции термического разложения.
- Гидроксиды алюминия и цинка как амфотерные гидроксиды
- Термическое разложение гидроксидов
Подобно другим нерастворимым гидроксидам, нерастворимые Al(OH)3 и Zn(OH)2 способны разлагаться при нагревании на соответствующий оксид и воду.
Важнейшие химические свойства солей
- Реакции с растворами щелочей
Соли алюминия и цинка реагируют с растворами щелочей.
- Разрушение комплексных солей и их аналогов кислотами
Если сильная кислота находится в недостатке, её хватает только для самого сильного металла (щелочного или щелочно-земельного). В результате образуется соль и амфотерный гидроксид, возможно также образование воды.
Если сильная кислота находится в избытке, её хватает на оба металла: образуются две соли и вода.
Со слабыми кислотами (угольной CO2(р-р), сернистой SO2(р-р), сероводородной H2S) ситуация немного сложнее:
- Если слабая кислота находится в недостатке, её также хватает только для самого сильного металла (щелочного или щелочно-земельного).
— Если слабая кислота находится в избытке, в продуктах образуется кислая соль (из-за избытка кислотного) и амфотерный гидроксид.Со слабой кислотой он не взаимодействует, так как сам слабый.
При нагревании комплексной соли будет происходить выпаривание из неё воды. В анионе там, где нет воды (например, в расплаве), образуются средние соли с амфотерными металлами.
Самые “страшные” реакции с участием комплексных солей — их реакции с солями. Чтобы их написать, можно для себя представить комплексную соль как совокупность щёлочи и амфотерного гидроксида.
Фактчек
- Алюминий и цинк относятся к амфотерным металлам, то есть таким, которые могут реагировать и с кислотами, и со щелочами в зависимости от природы реагирующих веществ.
- Алюминий относится к p-элементам, его постоянная степень окисления +3; цинк относится к d-элементам, его постоянная степень окисления +2.
- Алюминий и цинк реагируют с рядом веществ: неметаллами, водой, кислотами, щелочами, солями.
- Оксиды и гидроксиды алюминия и цинка также обладают амфотерными свойствами ,что определяет их химическое поведение в различных реакциях.
- Алюминий и цинк способны образовывать особый тип солей, называемый комплексными.
Проверь себя
Задание 1.Какими свойствами обладают алюминий, цинк и их оксиды и гидроксиды?
- Основными свойствами;
- Кислотными свойствами;
- Амфотерными свойствами;
- Нейтральными свойствами.
Задание 2.Цинк реагирует с водой с образованием:
- Оксида цинка и водорода;
- Гидроксид цинка и водорода;
- Цинката и водорода;
- Гидрида цинка и кислорода.
Задание 3.Что можно наблюдать при приливании раствора гидроксида натрия к раствору хлорида алюминия?
- Выделение газа;
- Выпадение осадка;
- Видимых изменений не наблюдается;
- Выпадение осадка, а затем его растворение.
Задание 4.Что образуется в реакции оксида цинка и сернистого газа?
- Сульфат цинка;
- Сульфит цинка;
- Сульфид цинка и кислород;
- Реакция не идет.
Задание 5.Какая соль образуется при взаимодействии тетрагидроксоалюмината натрия и избытка сероводорода?
- Средняя соль;
- Комплексная соль;
- Кислая соль;
- Основная соль.
ОТВЕТЫ: 1. — 3; 2. — 1; 3. — 4; 4. — 4; 5. — 3
Гидриды — свойства, формулы и применение водородных соединений
Время на чтение: 21 минута 
Типы и классификация
Вещества, созданные водородом с металлами и неметаллами многобразны. В зависимости от характера полученного соединения, выделяют:
- Простые гидриды — бинарные, в них только 2 элемента, они встречаются чаще всего.
- Со многими переходными металлами (элементы р-подгруппы) водород образует ко́мплексные соединения. Ко́мплексные гидриды металлов (к примеру, боро- или алюмогидриды) вместо атома водорода, имеют алюмогруппу (AlH4) или борогруппу (BH4). Из них натрийборогидрид Na (BH4) и литийалюмогидрид Li (AlH4), будучи сильными восстановителями, нашли применение в лабораторной практике. Кроме этого, Na (BH4) используют для отбеливания бумаги.
- И также есть гидриды интерметаллидов (пример: TiAl или Ti3Al, алюминид титана), в кристаллических решётках которых водород просто растворяется, аккумулируется.
У разных химических элементов строение атомов и молекул отличается. Соответственно, связи в образованных гидридах тоже неодинаковы. Классификация по виду связи определяет полученные вещества, как:
- металлоподобные;
- ионные (солеобразные);
- ковалентные.
Бинарные соединения самые распространённые, есть у всех элементов. Исключения здесь металлы платиновой группы (платиноиды), Au, Ag, Hg, Ti, Cd, In, а также благородные газы. Между этими веществами нет чётко выраженных границ, деление по характеру связи для них немного условно.
К металлическим принадлежат соединения водорода с переходными металлами и редкоземельными элементами. Это, скорее, раствор неметалла в металле, с внедрением атомов в кристаллическую решётку. Характерно для них следующее:

- В основном такие гидриды являются бертоллидами, состав их зависит от способа получения, непостоянен, законам постоянных и кратных отношений не подчиняется.
- В формулах для них указывают предельное содержание водорода.
- В отличие от прочих, они сохраняют исходную металлическую решётку.
- Их вид и физические свойства соответствуют металлам, с которыми они образованы.
- Имеют характе́рный металлический блеск, взаимодействуют с H2O (в жидком или газообразном состоянии), кислородом, при нормальных условиях, но медленно.
- Как и металлы, обладают значительной теплопроводностью и проводимостью.
- При нагревании распадаются на водород и исходный металл.
Образуются в процессе адсорбции водорода на металлической поверхности, диссоциации H2 и диффузного проникновения атомов в металлическую решётку. Поглощение обратимо, но химические связи весьма крепкие.
От металлоподобных, через гидриды меди (CuH, водородистая медь), цинка, ZnH2, водородистый цинк и им подобных, осуществляется переход к полимерам.
Это химические вещества со сложной структурой, в которой присутствуют цепи и полиэдры. Твёрдые, устойчивые, с кристаллическим строением (полимерные гидриды лёгких металлов стабильнее всего), данные соединения распадаются при нагреве на составляющие элементы.
От них, через гидриды бора и галлия — к водородным соединениям с неметаллами. В них водород имеет степень окисления +1.
Соединения с ионным типом связи
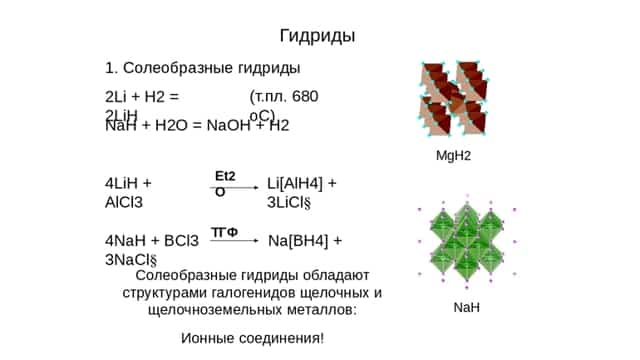
Их образует водород с металлами 1А и 2А групп, кроме Mg, а также с Al. Они отчасти показывают свойства соответствующих галогенидов, откуда и появилось второе наименование — солеобразные.
Это химические соединения, такие как гидрид натрия (NaH), кальция (CaH2), лития, с формулой LiH, другие. Для них характерно:
- Получают при высокой температуре и под давлением.
- В этих соединениях, проявляющих, как правило, щелочные свойства, у водорода степень окисления -1. С металлами 1А и 2А групп, такими, как Na, Li, Be, K, Rb, Sr он выступает окислителем, подобно галогенам. Например, гидрид натрия, с химической формулой NaH — в этом соединении ион водорода имеет отрицательный заряд.
- Это кристаллические вещества белого цвета, с ионной решёткой, структура подобна строению соответствующего галогенида.
- При нормальных условиях устойчивы.
- Распад на металл и водород при нагреве, минуя этап плавления (исключением является LiH, его температура плавления 688 градусов Цельсия).
- В расплаве — хорошие проводники, при этом на аноде будет выделяться H2.
- Вспыхивают при растирании на воздухе.
- Все являются сильными восстановителями. Применяются для получения чистых металлов из солей и оксидов, для удаления окалины, коррозии.
- Реагируют с оксидом углерода, формируют соли муравьиной кислоты (формиаты).
- Как и соли, могут участвовать в обменных реакциях, гидролизе.
Солеобразными бывают не только бинарные (простые) соединения водорода. Дигидриды, образуемые добавлением групп бора (BH4) или алюминия (AlH4) к металлу, также имеют ионный тип связи.
Окислительная активность водорода небольшая по сравнению с галогенами. Дополнительный электрон он отдаёт с трудом, при нагреве (реакция проходит с поглощением тепла). Это и обусловливает различие между свойствами ионных гидридов и галогенидов.
По химической природе такие соединения ведут себя как основные. Ионные гидриды обладают высокой химической активностью. Они бурно реагируют с кислородом и H2O в парообразном состоянии.
Но выраженный ионный характер — свойство, проявляемое соединениями кальция, натрия, щелочных и щёлочноземельных элементов. На них проще всего и нагляднее можно показать химию взаимодействий этих веществ:
- С водой: 2NaH + H2O = 2NaOH + H2O.
- С кислородом: NaH + O2 = NaO + H2O.
- Реакция разложения: CaH2 = Ca + H2.
- С оксидами углерода: NaH + CO2 = NaCOOH.
- Кремния: 4NaH + 3SiO2 = 2Na2SiO3 + Si + 2H2.
- Металлов: 4NaH + Fe3O4 = 4NaOH + 3Fe.
- Восстановление: 2NaH + 2SO2 = Na2SO4 + H2S.
- С аммиаком: NaH + NH3 = NaNH2 + H2.
- С кислотами: 2NaH + H2SO4 = Na2SO4 + 2H2.
- Со спиртами: KH + HO-R = KOR + H2.
По свойствам и природе связи промежуточное положение между ионными и ковалентными занимает гидрид магния, с формулой MgH2.
Соли и оксиды калия, кальция, меди и других щелочных и щёлочноземельных металлов образуют с гидридом кислорода (водой) ещё один вид соединений — дигидраты. Это соли серной кислоты (сульфаты), галогениды, оксиды плюс 2 присоединённых молекулы H2O. Формула алебастра — Ca5O4 плюс 2H2O, гипс — CaSO4 плюс 2H2O, в природе они не редкость.
Гидросульфид натрия, NaHS, образует не только дигидрат, NaHS плюс 2H2O, но и тригидрат, с присоединением 3H2O.
Когда связь ковалентна
Это соединения, в которых степень окисления водорода +1, как правило, газы, летучие жидкости. Их водород даёт с неметаллами, а также с германием, алюминием, бериллием, оловом, мышьяком, сурьмой — элементами 4, 5, 6 и 7 групп периодической системы. И также ковалентную связь имеют соединения водорода и бора.
Это могут быть вещества простые, бинарные, такие как метан (CH4), силан (формула SiH4). Сложные тоже имеются, с длинными цепями, многоатомные молекулы — они образуются водородом с кремнием, бором, германием.
Многие из них неустойчивы, так гидрид олова (SnH4) распадается уже при комнатной температуре, а гидрид свинца недолго существует и при отрицательных температурах. Самый простой гидрид бора не существует в природных условиях вообще.
Отличительные свойства:

- Все сильные восстановители, степень окисления водорода +1.
- Проявляют кислотные, а также амфотерные свойства.
- Агрегатное состояние — газ или летучая жидкость, исключения тут гидрид кислорода (вода), азота, фтороводород (плавиковая кислота), те, в которых молекулы полярны и возникает водородная связь. Последние существуют, как нелетучая жидкость или в твёрдом состоянии.
- Электронодефицитные виды, получаемые с элементами главной подгруппы 3 группы, например, гидрид алюминия AlH3 или бериллия, химическая формула BeH2, очень активны и образуют многоатомные, длинные полимерные цепи, с больши́м весом. Такие полимеры — твёрдые вещества.
- При нагреве легко и практически необратимо, разлагаются на элемент и водород H2. Требуется температура от 100 до 300 градусов по Цельсию (для гидрида серы H2S — порядка 400 градусов).
- Чаще всего они имеют высокую токсичность.
- Характерна высокая химическая активность, реакционная способность.
- Получить можно непосредственным взаимодействием элементов, разложением металлических соединений водой, кислотой, восстановлением галогенидов гидридами бора, алюминия, щелочных металлов.
- Высшие гидриды германия, кремния, с общей химической формулой EnH2n+2 — это полимеры, их стабильность тем ниже, чем больше атомный вес и количество атомов элемента.
- Принадлежащие к s-подгруппе хорошо растворяются в воде и проявляют кислотные свойства. Прочие — в незначительной мере, свойства у них основные. Все хорошо растворимы в неполярных органических растворителях.
- При взаимодействии с водой (H2O), выделяется чистый водород (H2) и оксид, с общей химической формулой EO2.
Тяжёлые элементы дают соединения с небольшой устойчивостью.
За счёт водородных связей и способности к донорно-акцепторному взаимодействию, вода (H2O), плавиковая кислота (HF), аммиака (NH3), а частично HCl и H2S, хорошие растворители.
Химические вещества, образованные двумя или более металлов, такие как FeTi, Ca2Ru, Mg2Ni — это интерметаллические соединения. Они хорошо поглощают водород и соединяясь с ним дают гидриды-интерметаллиды.
Содержат атомы железа, магния, меди, кальция, титана, алюминия, редкоземельные элементы. Их легко получить даже с H2 нехимическим (для технических нужд, до 2% примесей). Применяют для хранения водорода и аккумуляторных батарей.
У гидридов много областей применения. Особенно широко используют NaH. С его помощью удаляют термическую окалину с металлов, производят добавки, повышающие октановое число бензина, катализаторы полимеризации. Он необходим при производстве красителей, моющих средств, в качестве мощного восстановителя применяется в металлургии.
В органической химии комплексные водородные соединения применяют уже более 50 лет, для получения особо чистых химических элементов. В химии алкалоидов также широко используют комплексные гидриды металлов. Без них не обходится производство металлокерамики, дегазаторов, многих фармакологических средств.
Азот с водородом образует аммиак, кислород — воду, сера даёт сероводород, в природе постоянно идёт синтез подобных веществ. С миром химии человек пересекается постоянно. Поэтому знания о наиболее распространёных веществах принесут пользу каждому.
§ 44. Общие химические свойства металлов
Общие химические свойства металлов
По химическим свойствам металлы являются восстановителями, так как легко отдают свои электроны атомам неметаллов, превращаясь в положительно заряженные ионы — катионы.
Способность атомов металлов отдавать, а их катионов — присоединять электроны может служить мерой их химической активности.
Так, алюминий на воздухе очень быстро покрывается оксидной плёнкой, а с золотом заметных изменений не происходит. Цинк активно взаимодействует с соляной кислотой, а серебро — нет.
Поэтому алюминий и цинк можно отнести к активным металлам, а золото и серебро — к неактивным.
Ряд активности металлов
Химическую активность разных металлов легко сопоставить, анализируя их поведение в водных растворах солей и кислот.
Например, если в раствор сульфата меди(II) опустить цинковую пластинку или железный гвоздь, то практически сразу же на их поверхности появляется красноватый налёт меди.
Это свидетельствует о том, что цинк и железо вытесняют медь из раствора. Эти процессы можно представить следующими уравнениями:
- Zn + CuSО4 = ZnSО4 + Сu↓,
- Zn0 + Сu2+ = Zn2+ + Cu0;
- Fe + CuSО4 = FeSО4 + Сu↓,
- Fe0 + Cu2+ = Fe2+ + Сu0.
В этих реакциях цинк и железо отдают свои электроны ионам меди, то есть они окисляются. Ионы меди принимают электроны, поэтому медь восстанавливается.
Если поступить наоборот и в раствор сульфата цинка поместить медную пластинку, то на ней не произойдёт осаждения цинка. В чём тут причина?
Экспериментальным путём, изучая способность одних металлов вытеснять другие из водных растворов их солей, русский учёный Н. Н. Бекетов расположил металлы в ряд. В нём металлы, находящиеся левее, способны восстанавливать последующие из растворов их солей. Поскольку эта способность металлов связана с их восстановительной активностью, то этот ряд получил название ряда активности металлов.
Ряд активности металлов
Li K Ba Sr Cа Na Mg Al Mn Zn Cr Fe Ni Sn Pb (H2) Cu Hg Ag Pd Pt Au
Чем левее в этом ряду расположен металл, тем большими восстановительными свойствами в водном растворе он обладает, то есть легче отдаёт свои электроны окислителю и переходит в виде катиона в раствор; тем труднее катион этого металла восстанавливается. Цинк и железо легче отдают свои электроны, чем медь, и поэтому восстанавливают Cu2+ из раствора.
- По положению цинка в ряду активности можно прогнозировать, что этот металл способен восстановить из раствора ионы олова, меди и серебра:
- Zn0 + Sn2+ = Zn2+ + Sn0;
- Zn0 + Сu2+ = Zn2+ + Cu0;
- Zn0 + 2Ag+ = Zn2+ + 2Ag0.
- В то же время медь будет восстанавливать только ионы серебра, но не восстановит ионы олова:
- Cu0 + 2Ag+ = Cu2+ + 2Ag0.
Это означает, что цинк обладает большей восстановительной способностью. Он легче отдаёт электроны, чем олово, медь и серебро. Поэтому цинк считается более активным металлом, чем эти металлы. В свою очередь, медь — более активный металл, чем серебро.
Ряд активности металлов позволяет не только прогнозировать поведение металлов в реакциях с растворами солей, но и сравнивать их отношение к воде, растворам кислот, а также к неметаллам и ряду других веществ.
Так, слева от водорода расположены металлы, которые вытесняют водород из воды и кислот (то есть восстанавливают ионы водорода Н+). Металлы, расположенные справа от водорода, такой восстановительной активности в реакциях с растворами кислот не проявляют. Например, цинк реагирует с соляной кислотой, вытесняя водород:
- Zn + 2НСl = ZnCl2 + Н2↑,
- Zn0 + 2Н+ = Zn2+ + ,
- а серебро водород не вытесняет.
Взаимодействие металлов с простыми и сложными веществами
К общим химическим свойствам металлов относят их реакции с неметаллами, водой, кислотами, солями. Для некоторых металлов также характерны реакции с растворами щелочей. Часть металлов вступает в реакции с органическими веществами.
Многие перечисленные взаимодействия вам известны из предыдущих глав пособия. Кроме того, вы изучали химические свойства металлов в 9-м классе. Поэтому на данном этапе обучения мы систематизируем известные вам свойства, составив таблицу 31.
Таблица 31. Общие химические свойства металлов
| Реагенты и уравнения реакций | Особенности взаимодействия с металлами |
| Неметаллы | Образуют бинарные соединения: оксиды, гидриды, нитриды, галогениды. Реакции протекают как при обычных условиях, так и при нагревании |
|
Вода |
|
|
Щелочные металлы реагируют с кислотами-окислителями HNO3(конц), H2SO4(конц) со взрывом. Pb пассивируется в разбавленных HCl, H2SO4. Напомним, что при взаимодействии металлов с кислотами-окислителями HNO3(конц) и H2SO4(конц) водород не выделяется, а образуются продукты восстановления азота и серы |
|
В водных растворах металлы s-элементов, обладая сильными восстановительными свойствами, вытесняют из воды водород, а не ионы менее активных металлов из солей. Остальные металлы реагируют в соответствии с положением в ряду активности |
| Растворы щелочей | В такие реакции вступают цинк, алюминий, бериллий |
Отметим, что с водой при нормальных условиях взаимодействуют все металлы s-элементов, кроме бериллия и магния. Магний реагирует с водой при нагревании. Алюминий взаимодействует с водой при комнатной температуре, но только после удаления с его поверхности плёнки оксида алюминия.
При этом образуются гидроксиды металлов. Остальные металлы от марганца до водорода в ряду активности взаимодействуют с парами воды при нагревании, образуя, как правило, оксиды металлов. Металлы, находящиеся в ряду напряжений после водорода, не взаимодействуют с водой ни при каких условиях.
Активные металлы (Na, K) вступают в реакции с карбоновыми кислотами, спиртами, фенолами.
Положение металла в ряду активности металлов позволяет прогнозировать его поведение в окислительно-восстановительных реакциях, протекающих в водных растворах.
Атомы металлов во всех химических превращениях являются восстановителями.
Металлы в химических превращениях являются восстановителями и легко отдают свои электроны, превращаясь в положительно заряженные ионы — катионы.
Активность металлов в окислительно-восстановительных реакциях, протекающих в водных растворах, определяется по их положению в ряду активности: чем левее в этом ряду расположен металл, тем большими восстановительными свойствами он обладает и тем труднее катионы этого металла восстанавливаются.
Более активные металлы восстанавливают менее активные металлы из растворов их солей. Металлы, стоящие в ряду напряжений левее водорода, вытесняют его из разбавленных кислот (кроме азотной). Металлы s-элементов, за исключением бериллия и магния, вытесняют водород из воды при обычной температуре.
- Назовите характерные для металлов физические свойства.
- Перечислите p-элементы, которые относятся к элементам-металлам.
- Расставьте коэффициенты в уравнении реакции методом электронного баланса: Cu + HNO3(разб) → Cu(NO3)2 + NO↑ + H2O.
- Составьте уравнения возможных химических реакций с учётом, что медь окисляется до степени окисления +2:
- а) Ag + НСl →; б) Сu + Hg(NО3)2 → ;
- в) Mg + H2SО4(pазб) →; г) Ni + NaCl → ;
- д) Zn + АgNО3 → ; е) Au + H2O → .
- Составьте уравнения реакций взаимодействия цинка с неметаллами (O2, P), кислотами (разбавленными HCl, H2SO4), с растворами щелочей (NaOH, KOH), с солями (AgNO3, Pb(NO3)2).
- Цинк массой 1,3 г растворили в концентрированном растворе гидроксида натрия. Рассчитайте объём выделившегося газа.
- Составьте уравнения реакций, которые могут протекать на поверхности активного металла, например лития, на воздухе.
- Укажите, как изменится масса цинковой пластинки (увеличится, уменьшится, не изменится) при погружении её на небольшое время в раствор: 1) серной кислоты; 2) гидроксида натрия; 3) сульфата магния; 4) сульфата меди(II); 5) нитрата серебра(I).
- Определите объём водорода, который выделится при взаимодействии 260 г цинка с раствором серной кислоты объёмом 250 см3. Массовая доля H2SO4 равна 15 %, плотность — 1,1 г/см3.
- Железную пластинку массой 90 г погрузили в раствор медного купороса. Через некоторое время её вынули, промыли, высушили и взвесили. Масса стала равна 92,4 г. Определите массу прореагировавшего железа и массу меди, осевшей на пластинке.
*Самоконтроль
1. В порядке увеличения восстановительной активности металлы расположены в ряду:
- а) Mg, Ca, Na;
- б) Cu, Ag, Hg;
- в) Cа, K, Cs;
- г) Zn, Al, Pb.
2. Реагируют с растворами щелочей:
- а) Zn;
- б) Ca;
- в) Al;
- г) Be.
3. Реагируя с парами воды, образуют оксиды:
- а) Li;
- б) Ag;
- в) Fe;
- г) Zn.
4. Масса цинковой пластинки увеличится при погружении её в раствор:
- а) Hg(NO3)2;
- б) Cu(NO3)2;
- в) AgNO3;
- г) HNO3.
5. На растворение 13 г цинка требуется раствор, содержащий гидроксид натрия массой (г):
- а) 40;
- б) 20;
- в) 16;
- г) 4.
Соединения металлов IА группы
- — Бинарные соединения с кислородом;
- — Гидроксиды щелочных металлов;
- — Важнейшие соли натрия и калия.
Твердые вещества, х.р. в воде (за исключением Li2O, который растворяется медленно). Оксиды Li20 и Na20 бесцветны, К2O -желтовато-белый, Rb2O — светло-желтый, Cs2O — оранжевый.
- Наиболее устойчивый оксид Li2O образуется при горении Li на воздухе. Для получения других оксидов проводят медленное окисление металлов в условиях недостатка O2 или осуществляют восстановление пероксидов одноименными металлами:
- 4Na + O2= 2Na2O
- Na2O2 + 2Na → 2Na2O
- Являются типичными основными оксидами -взаимодействуют с Н2O, кислотными оксидами, кислотами.
- На воздухе оксиды «расплываются»; легко поглощают СO2, превращаясь при этом в карбонаты:
- Ме2O+ СO2 = Ме2СO3
Оксиды щел. Me не проявляют ни окислительных, ни восстановительных свойств.
Пероксиды Ме202
- Твердые вещества, растворимые в воде, имеют окраску отсветло-желтой у Na2O2 до темно-коричневой у Rb2O2.
- Практически наиболее важный пероксид натрия образуется при горении металла на воздухе:
- 2 Na + O2= Na2O2
- Пероксиды К, Rb, Cs получают действием 02 на растворы щел. Me в жидком NH3
Пероксидыщел. Me можно считать солями пероксида водорода Н2O2. В водномрастворе они гидролизуются как соли слабой кислоты:
- Na2O2 + Н2O → NaOH + NaHO2
- Сильные кислоты вытесняют из пероксидов щел. Me пероксид водорода:
- Na2O2 + H2SO4 = Na2SO4 + Н2O2
Пероксиды щел. Me являются сильными окислителями. Реакции со многими веществами (порошкообразный Al , уголь, эфир, хлопок и др.) происходят настолько энергично, что сопровождаются взрывом.
- Пероксид натрия поглощает СO2 с выделением кислорода:
- 2Na2O2 + 2СO2 = 2Na2CO3 + O2
- Это свойство используется в дыхательных аппаратах для водолазов и пожарных, а также для обновления воздуха а закрытых помещениях, а частности, на подводных лодках.
Супероксиды (надпероксиды) Me+[O2-]
Характерны для калия, рубидия, цезия. Образуются при горении этих металлов навоздухе. Уже при нулевой температуре разлагаются, выделяя свободный кислород:
- 2КO2+ 2Н2O = 2КОН + Н2O2 + O2
- Приболее высокой температуре разложение происходит без образования H2O2.
- Супероксиды являются очень сильными окислителями, подобно пероксидам.
Озониды Me+[O3-]
Известны для К, Rb , Cs . Очень неустойчивые соединения,имеют оранжево-красную окраску. При взаимодействии с водой выделяют наибольшее количество кислорода:
- 2RbO3 +Н2O = 2RbOH + 2,5O2
- Общим свойством всех бинарных соединений щелочных металлов с кислородом является их способность поглощать СO2. Пероксиды, супероксиды и озониды могут связывать также монооксид углерода СО:
- Na2O2 + СО = Na2CO3
- 2КO2 + СО = К2СO3+ O2
- 2RbO3 +СО = Rb2CO3 + 2O2
Гидроксиды щелочных металлов
МеОН — общая формула гидроксидов s'-металлов, называемых щелочами.
Щелочи — твердые, непрозрачные бесцветные вещества, довольно легкоплавкие. Плавятся без разложения в интервале температур -300-50°С. Только гидроксид лития при плавлении частично разлагается:
2LiOH = Li2O + Н2O
Твердые гидроксиды и их концентрированные растворы сильно гигроскопичны, они жадно поглощают влагу и используются для осушения газов, не обладающих кислотными свойствами. Вследствие гигроскопичности твердые щелочи быстро расплываются навоздухе.
Гидроксиды щелочных металлов очень хорошо растворяются в воде (за исключением малорастворимого LiOH ), а также в спирте.
Щелочи — очень агрессивные, едкие вещества. Они вызывают тяжелые ожоги кожи и слизистых оболочек, разъедают ткань, бумагу, кожу и др. вещества.
Щелочи — одни из самых реакционноспособных веществ, используются во многих реакциях неорганического и органического синтеза, а также в технологических процессах. Они находят широкое применение в щелочных аккумуляторах.
Важнейшие соли натрия и калия
NaCI — поваренная, или каменная соль. Пищевой продукт, консервирующее средство, сырье для получения соды Na2C03, хлора, NaOH . Изотонический р-р NaCI (0,9%) используется в медицине (физиологический раствор).
NaBr — бромид натрия. Применяется как седативное средство в медицине.
- Na2CO3 — кальцинированная сода. Водные растворы имеют сильнощелочную реакцию вследствие гидролиза:
- Na2CO3 + Н2O = NaHCO3 + NaOH.
- Получают аммиачно-хлоридным способом (метод Сольвэ):
- NaCl + NH 3 + СO2 + Н2O = NaHCO3 + NH4Cl
- 2NaHCO3= Na2CO3 + CO2 + H2O
Применяется для производства стекла, при получении мыла и др.моющих средств.
- NaHCO3 — питьевая, или пищевая, сода. Водные р-ры имеют слабощелочную среду в результате гидролиза:
- NaHCO3 + Н2O = Н2СO3+ NaOH;
- поэтому используются как лекарственное средство для понижения кислотности желудочного сока.
NaNO3 — натриевая, или чилийская, селитра. Применяется как удобрение; в качестве окислителя входит в состав взрывчатых смесей, ракетных топлив, пиротехнических средств.
Na2SO4 • 10H2O — мирабилит, или глауберова соль. Применяетсяв медицине как слабительное средство.
Na2B4O7 • 10H2O — бура (декагидрат тетрабората натрия). Применяют наружно как антисептическое средство для полосканий,спринцеваний и т.д.
KCl — в природе минерал сильвин (сильвинит — NaCl • KCl). Используется как удобрение, применяется при производстве КОН, КСlO3, КСlO4, KNO3 и др.
К2СO3- поташ. В значительных количествах содержится в растительной золе.
KNO3 — калийная селитра. Применяют как удобрение, для изготовления черного пороха (окислитель), в производстве спичек, для консервирования мясных продуктов.
КМnO4 (перманганат калия), К2Сr2О7 (дихромат калия, хромпик), КСlO3 (хлорат калия, бертолетова соль). Сильнейшие окислители, широко используются в неорганическом и органическом синтезе.
K4[Fe(CN)6] — желтая кровяная соль. Используется как реагент для обнаружения ионов Fe3+.
K3[Fe(CN)6] — красная кровяная соль. Используетсякак реагент для обнаружения ионов Fe2+.
Гдз химия 11 класc габриелян о.с. остроумов и.г. сладков с.а. §4 ионная химическая связь и ионные кристаллические решётки ответы
Гдз химия 11 класc габриелян о.с. остроумов и.г. сладков с.а. §4 ионная химическая связь и ионные кристаллические решётки ответы
Другие задания смотри здесь…
| Красным цветом даются ответы, а фиолетовым ― объяснения. |
Задание 1
Какая связь называется ионной? Ионная связь — это химическая связь, образовавшаяся между катионами и анионами за счёт их электростатического притяжения. Как она образуется? Атомы одного элемента отдают свои электроны, атомы других — принимают их, при этом образуются положительные и отрицательные ионы, которые за счёт электростатических сил образуют ионное химическое соединение.
Какие группы элементов образуют бинарные соединения с ионной связью? Характерен для соединений, образованных типичными металлами (щелочными и щёлочноземельными) и типичными неметаллами (галогенами, кислородом).
Задание 2
В какие частицы превращаются атомы при окислении? Атомы превращаются в катионы — положительно заряженные ионы, т.к. в процессе окисления отдаются электроны.Какие группы таких частиц можно выделить? Простые катионы (например, K+, Mg2+) и сложные катионы (например, NH4+).
Задание 3
В какие частицы превращаются атомы при восстановлении? Атомы превращаются в анионы — отрицательно заряженные ионы, т.к. при восстановлении присоединяются электроны.Какие группы таких частиц можно выделить? Простые анионы (например, Cl-, S2-) и сложные анионы (например, OH-, SO42-).
Задание 4
В чём причина инертности элементов VIIIА-группы? В атомах инертных элементов внешний энергетический уровень полностью заполнен, поэтому этим атомам просто не нужны «чужие» электроны, а химическая связь осуществляется путем обмена электронами или их перехода от одного атома к другому.Является ли утверждение об инертности благородных газов абсолютным? Нет, т.к. в особых условиях (атомы могут находится в возбужденном состоянии) могут образовывать соединения с фтором, кислородом, например, ксенон взаимодействует с фтором: Xe + F2УФ-свет⟶ XeF2
Задание 5
Запишите схемы образования ионной связи между атомами: а) бария и кислорода;
Ba -2e → Ba2+
O + 2e → O2-Найдем наименьшее общее кратное между зарядами образовавшихся ионов 2 (2 и 2). Чтобы атомы бария отдали 2 электрона их нужно взять 1 (2:2=1), чтобы атомы кислорода приняли 2 электроны их нужно взять 1 (2:2=1).Ba + O → Ba2+O2- → BaOб) калия и брома;
K -1e → K+
Br +1e → Br-Найдем наименьшее общее кратное между зарядами образовавшихся ионов 1 (1 и 1). Чтобы атомы калия отдали 1 электрон их нужно взять 1 (1:1=1), чтобы атомы брома приняли 1 электрон их нужно взять 1 (1:1=1). K + Br → K+Br- → KBr
в) кальция и фтора.
Ca -2e → Ca2+
F +1e → F- Найдем наименьшее общее кратное между зарядами образовавшихся ионов 2 (2 и 1). Чтобы атомы кальция отдали 2 электрона их нужно взять 1 (2:2=1), чтобы атомы фтора приняли 2 электроны их нужно взять 2 (2:1=2).Ca + 2F → Ca2+F2- → CaF2
Задание 6
Запишите приведённые ниже схемы, заменив вопросительный знак на соответствующий символ: цифру, букву, знаки «+» или «-«:
а) Ba -2ē ⟶ Ba2+
б) Br +1ē ⟶ Br- в) Sr -2ē ⟶ Sr2+г) S + 2ē ⟶ S2-д) Fe2+ -1ē ⟶ Fe3+Другие задания смотри здесь…






