- План урока:
- Почему связь между классами веществ считается генетической
- Родственные связи между металлами и неметаллами
- Взаимопревращения между классами веществ
Почему связь между классами веществ считается генетической
Чтобы разобраться в этом вопросе. Вспомним состав классов веществ, с которыми Вы познакомились на предыдущих занятиях.
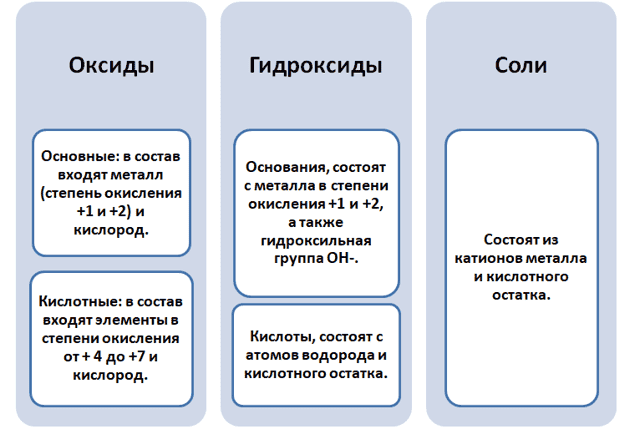
Обратите внимание, что соли содержат в себе частицы как оснований (атомы металла), так и кислот (кислотных остатков). Если соль рассматривать как «венец» превращений, то давайте, попытаемся прийти к истокам. Всё начинается с простого, точнее металла и неметалла, как простых веществ.
Попробуем построить генетический ряд металлов, переходя от одного класса к другому.

Возьмём, к примеру, металлы кальций и медь, подставив их в цепочку уравнений.
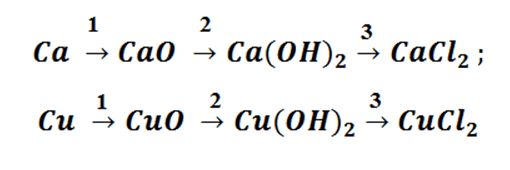
Обратите внимание, что данные металлы отличаются своей реакционной способностью.
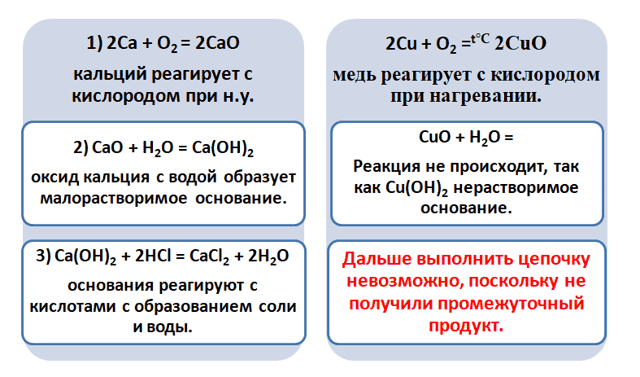
Получается, эта генетическая связь соединений присуща только для активных металлов, оксиды которых, реагируя с водой, дают продукт в виде щёлочи.
Для металлов, которые отличаются малой активностью, переход от вещества, находящегося в простом состоянии, к соли, происходит путём превращений.
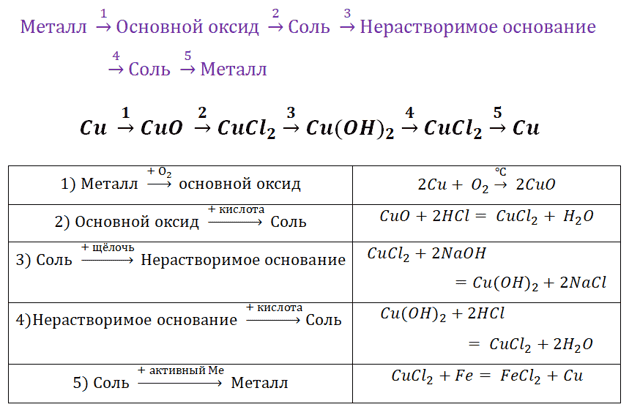
Поскольку основные оксиды реагируют с металлами (более активными, чем металлы, которые входят в состав оксида), то эту схему можно сократить.
Аналогичным способом можно составить генетический ряд неметаллов, начиная от неметалла заканчивая солью или неметаллом.

Подставим в цепочку уравнений фосфор и кремний.
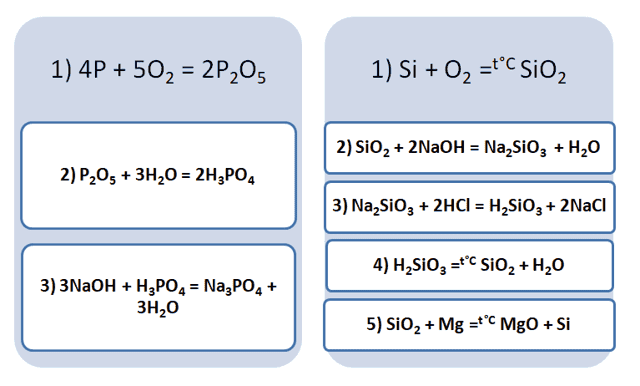
А возможны иные пути решения данных цепочек уравнений. Способы получения кислотных оксидов реализуются путём взаимодействия простых веществ с кислородом. А вот не с каждого оксида можно получить ему соответствующую кислоту, путём прибавления воды. Поскольку кремниевая кислота нерастворима в воде, то необходимо получить сначала соль, а потом уже и кислоту.
В данном решении предлагается добыть соль Na3PO4, взаимодействием основания и кислоты. Однако можно использовать и другие варианты, которые также будут верны.

Если объединить генетические ряды металлов и неметаллов, получим дружную семью неорганических соединений, где каждое вещество связано неразрывной нитью с другими классами. Таблица 1.
Источник
Данная таблица отображает, как реагируют между собой вещества и какие продукты возможны, вследствие реакции.
Промоделируем на примере: В вашем распоряжении имеются следующие вещества: оксид серы (VI), гидроксид бария, соляная кислота, карбонат кальция и железо. Ваша задача спрогнозировать, между какими соединениями возможна реакция и, записать, соответствующие уравнения реакций.
- Подтвердив свои прогнозы молекулярно-ионными уравнениями в сокращённом и полном виде.
Родственные связи между металлами и неметаллами
Кислород является типичным представителем неметаллов. Он является достаточно сильным окислителем, перед которым может устоять только фтор. Получение основных оксидов происходит путём взаимодействия кислорода и металлов. Однако не все металлы охотно с ним реагируют.
Щелочные реагируют бурно, именно поэтому их хранение осуществляется под слоем керосина. Необходимо заметить, что щелочные металлы не образуют оксиды во время взаимодействия с О2.
Их чрезвычайная активность позволяет получать только для их характерные продукты, это будут пероксиды и надпероксиды (за исключением лития, продукт Li2O).
- А вот, чтобы менее активные металлы – железо или медь прореагировали, необходимо нагревание.
- Получение кислотных оксидов происходит аналогично взаимодействием неметаллов с О2.
Металлы и неметаллы в химии рассматриваются как противоположности, которые, как заряды (положительные и отрицательные) имеют свойства притягиваться. Рассмотрим на примере металла кальций и неметалла углерод.
- Соль СаСО3 имеет истоки от простых веществ Са и С, промежуточным звеном являются оксиды этих веществ, для которых свойственно реагировать между собой.
- Вспомним с Вами один с основных постулатов химии, а именно, закон постоянства состава вещества.
- Источник
Представим, что мы с Вами химики-первооткрыватели и нам предстоит сложная задача получить азотную кислоту, которая имеет важную роль в химической промышленности. Получение кислот возможно несколькими способами. Обращаясь к таблице 1, делаем вывод, что нам доступно несколько способов, а именно.
- Взаимодействие кислот с солями приведёт нас к желаемому результату, однако не забывайте, что в продукте должны увидеть газ, осадок либо окрашивание.
Способы получения средних солей доказательно показывают связь между веществами. Снова выручалочкой нам послужит таблица 1. Наша задача получить вещество, без которого, полагаем, Вы не представляете своё существование, это соль NaCl. Используя данные, видим, что доступно для её получения 4 способа (Вы ищете, где продуктом является соль и применяете данные на свой пример).
Рассмотрим подробно каждый с них.
Способы получения солей отличаются, причиной этому является то, какую именно соль мы хотим получить, кислородсодержащей,сильной или слабой кислоты. К примеру, получение Na2SO4 будет отличаться от предыдущего примера с NaCl. Количество способов будет больше, так как это соль кислородсодержащей кислоты.
Здесь следуют отметить особенность щелочных, а также щелочно-земельных металлов, для которых свойственно взаимодействие с водой. По сути, идёт два параллельных процесса.
- Полученная щёлочь реагирует с кислотой.
- Способы получения солей аммония несколько отличаются, от солей металлов, тем, что аммиак непосредственно реагирует с кислотами (смотри урок химическая связь) с образованием донорно-акцепторных связей.
- Гидроксид аммония имеет способность взаимодействовать с кислотами, с образованием необходимого продукта, не иначе как солей аммония.
Наверняка некоторые из Вас пугал вид заданий, который был цепочек уравнений. Обобщая всё выше сказанное, рассмотрим несколько примеров.
Пример 1.
Чтобы справится с данной задачей, проанализируем условие. Первое, что необходимо выделить – это количество уравнений (смотрим по стрелочкам, их 5). Второе определим исходное вещество – цинк, металл средней силы. Чтобы получить с него соль (не забываем о таблице 1), можно использовать 3 способа:
Выбор за Вами, одного из трёх уравнений. Переходим к следующей части цепочки ZnCl2 → Zn(OH)2. Здесь решением будет один вариант, это прибавление щёлочи.
- Zn(OH)2 относится к нерастворимым основанием, поэтому при нагревании распадаются.
И наконец, итоговый продукт, металл. Его необходимо выделить из соли. Для этого необходимо взять металл, сила которого будет больше. Если эту информацию забыли, то освежить эти данные сможете с помощью урока Соли и их свойства.
Решение цепочек химических уравнений на первый взгляд кажется не посильной задачей, но если внимательно изучить свойства веществ, то они кажутся не такими уж и сложными.
Взаимопревращение между классами веществ
Обобщая сведения о свойствах неорганических соединений, составим схему 1. Взаимосвязь между классами неорганических веществ.
Источник
Эта схема и таблица 1 будут служить Вам волшебной палочкой в изучении неорганической химии.
Генетическая цепь. Генетическая связь между классами неорганических соединений
- Между простыми
веществами, оксидами, основаниями,
кислотами и солями существует генетическая
связь, а именно – возможность их взаимного
перехода (превращения). - Например, простое
вещество – кальций в результате
взаимодействия с кислородом превращается
в оксид: 2Ca+O 2 = 2CaO. - Оксид кальция при
взаимодействии с водой образует гидроксид
кальция CaO+H 2 O=Ca(OH) 2, а последний при взаимодействии с
кислотой превращается в соль:Ca(OH) 2 +H 2 SO 4 =CaSO 4 + 2H 2 O. - Эти превращения
можно представить схемой: - Ca→ CaO→
Ca(OH) 2
→CaSO 4 - Подобную схему
можно записать и для неметалла, например,
серы: - S→SO 3 →H 2 SO 4 →CaSO 4
- Итак,
различными путями получена одна и та
же соль. - Возможен и обратный
переход от соли к другим классам
неорганических соединений и простым
веществам: - CuSO 4 →Cu(OH) 2 →CuO→Cu
- CuSO 4
+ 2NaOН = Cu(OH) 2 ↓+
Na 2 SO 4 - Cu(OH) 2 =CuO+H 2 О
- CuO+H 2 =Cu+H 2 O(восстановление меди)
- Подобная связь
между классами неорганических соединений,
основанная на получении веществ одного
класса из веществ другого, называется
генетической.
Свойства сложных
соединений отражает генетическая схема
основных классов неорганических
соединений (см. рисунок). Она отражает
ступени развития неорганического
вещества по двум основным линиям – от
типичных металлов до типичных неметаллов,
обладающих противоположными свойствами.
Металлы, химическим
свойством атома которых является
способность отдавать электроны, и
неметаллы, главным химическим свойством
которых является способность их атомов
присоединять электроны, противоположные
друг другу по свойствам. При усложнении
состава веществ эти противоположные
тенденции продолжают проявляться.
- Типичные металлы
и переходные элементы в низшей степени
окисления образуют основные оксиды, а
типичные неметаллы и переходные элементы
в высокой степени окисления образуют
противоположные по свойствам кислотные
оксиды. - Простые вещества
- Амфотерные
- Неметаллы
- Основные оксиды
- Амфотерные
- Кислотные
- Основания
- Амфотерные
- гидроксиды
- Генетическая схема
основных классов неорганических
соединений
При дальнейшем
усложнении состава веществ образуются
гидроксиды, причем основным оксидам
соответствуют основания, а кислотным
оксидам соответствуют кислоты.
Противоположные по свойствам основания
и кислоты активно реагируют между собой,
образуя соли.
Взаимодействие
противоположностей является движущей
силой реакции.
Поэтому основной и
кислотный оксиды, основания и кислоты
активно взаимодействуют друг с другом,
а два кислотных оксида или два основных
оксида не взаимодействуют, так как
свойства у них близки.
Таким образом,
свойства сложного соединения определяются
на основе свойств образующего его
элементов. Основные закономерности
изменения этих свойств обобщены в
следующих приложениях (табл. 6).
1. В периодах
с увеличением порядкового номера
свойства элементов изменяются от
металлических к неметаллическим.
Увеличивается число электронов на
внешнем уровне, возрастает степень
окисления элемента, уменьшается радиус
атома и иона, увеличивается энергия
ионизации и сродство к электрону. В
соответствии с этим уменьшаются основные
и увеличиваются кислотные свойства
оксидов и гидроксидов.
2. В главных
подгруппах с увеличением порядкового
номера элемента увеличиваются основные
свойства оксидов и гидроксидов. Для
элементов побочных подгрупп с увеличением
порядкового номера характерно более
сложное изменение свойств. Сначала
металлические свойства усиливаются, а
затем уменьшаются.
3. Активным
металлам соответствуют оксиды и
гидроксиды с сильно выраженными
основными свойствами. Самые активные
металлы – щелочные и щелочно-земельные.
Они образуют растворимые в воде оксиды
и сильные растворимые основания –
щелочи.
4. Малоактивные
металлы (все, кроме щелочных и
щелочно-земельных) образуют слабые
основания, трудно растворимые в воде:
Cu(OH) 2 ,Fe(OH) 3 .
5. Активным
неметаллам соответствуют оксиды и
гидроксиды с сильно выраженными
кислотными свойствами.
6. Амфотерные
металлы образуют амфотерные оксиды и
гидроксиды.
7.Если
элемент проявляет различные степени
окисления, то ему соответствуют оксиды
и гидроксиды с различными свойствами.
Тема: ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ металлами и неметаллами и их соединений. 9-класс.
- Цели: образовательные: закрепить понятия «генетический ряд», «генетическая связь»; научить составлять генетические ряды элементов (металлов и неметаллов), составлять уравнения реакций, соответствующих генетическому ряду; проверить, как усвоены знания о химических свойствах оксидов, кислот, солей, оснований;развивающие: развивать умения анализировать, сравнивать, обобщать и делать выводы, составлять уравнения химических реакций; воспитательные: содействовать формированию научного мировоззрения.
- Обеспечение занятия: таблицы «Периодическая система», «Таблица растворимости», «Ряд активности металлов», инструкции для студентов, задания для проверки знаний.
- Ход работы: 1) Орг. момент
- 2) Проверка д/з
- 3) Изучение нового материала
- 4) Закрепление
- 5) Д/З
1) Орг. момент. Приветствие.
2) Проверка д/з.
Генетические связи — это связи между разными классами, основанные на их взаимопревращениях.
Зная классы неорганических веществ, можно составить генетические ряды металлов и неметаллов. В основу этих рядов положен один и тот же элемент.
Среди металлов можно выделить две разновидности рядов:
1
. Генетический ряд, в котором в качестве основания выступает щёлочь. Этот ряд можно представить с помощью следующих превращений:
металл→основный оксид→щёлочь→соль
Например, K→K
2 . Генетический ряд, где в качестве основания выступает нерастворимое основание, тогда ряд можно представить цепочкой превращений:
- металл→основный оксид→соль→нерастворимое основание→
- →основный оксид→металл
- Например, Cu→CuO→CuCl
2 →Cu(OH) 2 . Генетический ряд неметаллов, где в качестве звена ряда выступает растворимая кислота. Цепочку превращений можно представить в следующем виде:
неметалл→кислотный оксид→растворимая кислота→соль
Например, P→P
2 O 5 →H 3 PO 4 →Na 3 PO . Генетический ряд неметаллов, где в качестве звена ряда выступает нерастворимая кислота:
- неметалл→кислотный оксид→соль→кислота→
- →кислотный оксид→неметалл
- Например,
Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Фронтальная беседа по вопросам:
Что такое генетическая связь?Генетические связи — это связи между разными классами, основанные на их взаимопревращениях.Что такое генетический ряд?
Генетический ряд – ряд веществ – представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих превращения данных веществ. В основу этих рядов положен один и тот же элемент.
- Какие виды генетических рядов принято выделять?Среди металлов можно выделить две разновидности рядов:
- а) Генетический ряд, в котором в качестве основания выступает щёлочь. Этот ряд можно представить с помощью следующих превращений:
- металл →основный оксид → щёлочь → соль
- например, генетический ряд калия K → K
2 O → KOH→ KCl
- б) Генетический ряд, где в качестве основания выступает нерастворимое основание, тогда ряд можно представить цепочкой превращений:
- металл → основный оксид → соль→ нерастворимое основание →основный оксид → металл
- например: Cu→ CuO → CuCl
2 → Cu(OH) 2 → CuO → Cu
Среди неметаллов также можно выделить две разновидности рядов:
а) Генетический ряд неметаллов, где в качестве звена ряда выступает растворимая кислота. Цепочку превращений можно представить в следующем виде: неметалл → кислотный оксид → растворимая кислота → соль.
Например: P→ P
2 O 5 → H 3 PO 4 →Na 3 PO 4
б) Генетический ряд неметаллов, где в качестве звена ряда выступает нерастворимая кислота: неметалл → кислотный оксид → соль→ кислота → кислотный оксид → неметалл
Например: Si→ SiO
2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Выполнение заданий по вариантам:
1. Выберите в вашем варианте формулы оксидов, объясните свой выбор, опираясь на знание признаков состава данного класса соединений. Назовите их.
2. В столбце формул вашего варианта найдите формулы кислот и объясните свой выбор на основании анализа состава этих соединений.
3. Определите валентности кислотных остатков в составе кислот.
4. Выберите формулы солей и назовите их.
5. Составьте формулы солей, которые могут быть образованы магнием и кислотами вашего варианта. Запишите их, назовите.
6. В столбце формул вашего варианта найдите формулы оснований и объясните свой выбор на основании анализа состава этих соединений.
7. В вашем варианте выберите формулы веществ, с которыми может реагировать раствор ортофосфорной кислоты (соляной, серной). Составьте соответствующие уравнения реакций.
9. Среди формул своего варианта выберите формулы веществ, способных взаимодействовать между собой. Составьте соответствующие уравнения реакций.
10. Составьте цепочку генетических связей неорганических соединений, в состав которой войдет вещество, формула которого дана в вашем варианте под номером один.
- Вариант 1
- Вариант 2
- CaO
- HNO
2 3 ) 2 SO 2 3 PO 2 O 2 CO 2 SO 4
Из данных веществ составьте генетический ряд, используя все формулы. Напишите уравнения реакций, с помощью которых можно осуществить эту цепочку превращений:
I вариант: ZnSO
4, Zn, ZnO, Zn, Zn(OH) 2 : II вариант: Na 2 SO 4, NaOH , Na , Na 2 O 2 , Na 2 Al → Al 2 O 3 → AlCl 3 → Al (
OH ) 3 → Al 2 O P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4 → Ca 3 (
PO 4 ) 2 →Zn(OH) 2 →ZnO→Zn(NO 3 ) 2 →Cu(OH) 2 2 O 5 →HNO 3 →Fe(NO 3 ) 2 →Fe(OH) 2 →FeS→FeSO составьте схему постепенного перехода от кальция к карбонату кальция и подготовьте сообщение об использовании в медицине любой соли (используя дополнительную литературу).
>> Химия: Генетическая связь между классами веществ Генетической
называется связь между веществами разных классов, основанная на их взаимопревращениях и отражающая единство их происхождения, то есть генезис веществ.
Вначале наши сведения о классификации веществ представим в виде схемы. Зная классы простых веществ, можно составить два генетических ряда: генетический ряд металловнеметаллов .
Генетический ряд металлов отражает взаимосвязь веществ разных классов, в основу которой положен один и тот же металл.
Различают две разновидности генетического ряда металлов
1. Генетический ряд металлов, которым в качестве гидроксида соответствует щелочь. В общем виде такой ряд может быть представлен следующей цепочкой превращений:
2. Генетический ряд металлов, которым соответствует нерастворимое основание. Этот ряд богаче генетическими связями, так как полнее отражает идею взаимных превращений (прямых и обратных). В общем виде такой ряд может быть представлен следующей цепочкой превращений:
- Генетический ряд неметаллов отражает взаимосвязь веществ разных классов, в основу которой положен один и тот же неметалл.
- Здесь также можно выделить две разновидности.
- 1. Генетический ряд неметаллов, которым в качестве гидроксида соответствует растворимая кислота, может быть отражен в виде такой цепочки превращений:
- неметалл -> кислотный оксид -> кислота -> соль
- Например, генетический ряд фосфора:
- 2. Генетический ряд неметаллов, которым соответствует нерастворимая кислота , может быть иредставлен с помощью такой цепочки превращений:неметалл — кислотный оксид — соль — кислота — кислотный оксид — неметалл
- Так как из изученных нами кислот нерастворимой является только кремниевая кислота, в качестве примера последнего генетического ряда рассмотрим генетический ряд кремния:
1. Генетическая связь.
2. Генетический ряд металлов и его разновидности.
3. Генетический ряд неметаллов и его разновидности.
Запишите уравнения реакций, с помощью которых можно осуществить превращения, лежащие в основе приведенных генетических рядов металлов н неметаллов. Дайте названия веществ, уравнения реакций с участием электролитов напишите также и в ионной форме.
Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения (сколько стрелок, столько уравнений реакций):а) Li — Li2O — LiOH — LiNO3
б) S — SO2 — H2SO3 — Na2SO3 — SO2 — CaSO3
Уравнения реакций с участием электролитов запишите также и в ионной форме.
Какие из перечисленных ниже веществ будут взаимодействовать с соляной кислотой: магний, оксид меди (II), гидроксид меди (II), медь, нитрат магния, гидроксид железа (ІІІ), оксид кремния (IV), нитрат серебра, сульфид железа (II)? Запишите уравнения возможных реакций в молекулярной и ионной формах.
Если реакции не могут быть осуществлены, объясните почему.
Какие из перечисленных ниже веществ будут взаимодействовать с гидрокемдом натрия: оксид углерода (IV). гидроксид кальция, оксид меди (II), нитрат меди (II), хлорид аммония, кремниевая кислота, сульфат калия? Запишите уравнения возможных реакций в молекулярной и ионной формах. Если реакции не протекают, объясните почему.
Дайте определения всем классам веществ, приведенных в таблице. На какие группы делится каждый класс веществ?
Содержание урока
конспект урока
опорный каркас презентация урока акселеративные методы интерактивные технологии
Практика
задачи и упражнения самопроверка практикумы, тренинги, кейсы, квесты домашние задания дискуссионные вопросы риторические вопросы от учеников
Иллюстрации
аудио-, видеоклипы и мультимедиа
фотографии, картинки графики, таблицы, схемы юмор, анекдоты, приколы, комиксы притчи, поговорки, кроссворды, цитаты
Дополнения
рефераты
статьи фишки для любознательных шпаргалки учебники основные и дополнительные словарь терминов прочие
Совершенствование учебников и уроков
исправление ошибок в учебнике
обновление фрагмента в учебнике элементы новаторства на уроке замена устаревших знаний новыми
Только для учителей
идеальные уроки
календарный план на год методические рекомендации программы обсуждения
Интегрированные уроки

Среди металлов можно выделить две разновидности рядов: 1.Генетический ряд, в котором в качестве основания выступает щёлочь. Этот ряд можно представить с помощью следуюших превращений: металл— основный оксид — щёлочь — соль, например генетический ряд калия K — K 2 O — KOH — KCl.

2. Генетический ряд, где в качестве основания выступает нерастворимое основание, тогда ряд можно представить цепочкой превращений: металл—основный оксид—соль—нерастворимое основание—основный оксид—металл.
Cu— CuO— CuCl 2 — Cu(OH) 2 – CuO —> Cu генетический ряд меди «> Cu генетический ряд меди»> » title=»2.
Генетический ряд, где в качестве основания выступает нерастворимое основание, тогда ряд можно представить цепочкой превращений: металл—основный оксид—соль—нерастворимое основание—основный оксид—металл. Cu— CuO— CuCl 2 — Cu(OH) 2 – CuO —> «> title=»2.
Генетический ряд, где в качестве основания выступает нерастворимое основание, тогда ряд можно представить цепочкой превращений: металл—основный оксид—соль—нерастворимое основание—основный оксид—металл. Cu— CuO— CuCl 2 — Cu(OH) 2 – CuO —> «>
Среди неметаллов также можно выделить две разновидности рядов: 1. Генетический ряд неметаллов, где в качестве звена ряда выступает растворимая кислота. Цепочку превращений можно представить в следующем виде: неметалл—кислотный оксид—растворимая кислота- -соль. P— P 2 O 5 — H 3 PO 4 — Na 3 PO 4. генетический ряд фосфора

Получение оксидов
| Окисление кислородом | простых веществ | 2Mg +O2=2MgO |
| сложных веществ | 2H2S+3O2=2H2O+2SO2 | |
| Разложение | нагреванием солей | СaCO3=CaO+CO2 |
| нагреванием оснований | Cu (OH)2=CuO+H20 | |
| нагреванием кислородсодержащих кислот | H2SO3=H2O+SO2 | |
| нагреванием высших оксидов | 4CrO3=Cr2O3+3O2 | |
| Окисление низших оксидов | 4FeO+O2=2Fe2O3 | |
| Вытеснение летучего оксида менее летучим | Na2CO3+SiO2=Na2SiO3+CO2 |
Химические
свойства оксидов.
| Основные | Амфотерные | Кислотные |
| Основные-реагируют с избытком кислоты с образованием соли и воды.Основным оксидам соответствуют основания. 1.Взаимодействие с водой(оксиды щелочных и щелочноземельных мет.) CaO+H2O=Ca(OH)2 2.Все-с кислотами AI2O3+6HCl=2AlCl3+3H2O 3.С кислотнями оксидами CaO+CO2=CaCO3 4.С амфотерными оксидами Li2O+Al2O3=2LiAlO2 |
Амфотерные (ZnO, Al2O3,Cr2O3, MnO2 ) 1.Взаимодействуют как с кислотами, так и с основаниями. ZnO+2HCl=ZnCl2+H2O ZnO+2NaOH+H2O=Na2[Zn(OH)4] 2.Реагируют с основными и кислотными оксидами ZnO+CaO=CaZnO2 ZnO+SiO2=ZnSiO3 |
Кислотные-реагируют с избытком щелочи с образованием соли и воды. Кислотным оксидам часто соответствуют кислоты. 1.Большинство взаимодействуют с водой SO3+H2O=H2SO4 2.Со щелочами NaOH+SiO2=Na2SiO3+H2O 3.С основными оксидами SiO2+CaO=CaSiO3 4.С амфотерными оксидами Al2O3+3SO3=Al2(SO4)3 |
ГЕНЕТИЧЕСКАЯ
СВЯЗЬ МЕЖДУ КЛАССАМИ НЕОРГАНИЧЕСКИХ
ВЕЩЕСТВ.
Генетические
связи — это связи между разными классами,
основанные на их взаимопревращениях.
Зная
классы неорганических веществ, можно
составить генетические ряды металлов
и неметаллов. В основу этих рядов положен
один и тот же элемент.
Среди
металлов можно выделить две разновидности
рядов:
1.
Генетический
ряд , в котором в качестве основания
выступает щёлочь. Этот ряд можно
представить с помощью следуюших
превращений: металл—основный
оксид—щёлочь—соль,
например генетический ряд калия
K—K2O—KOH—KCl.
2.
Генетический ряд, где в качестве основания
выступает нерастворимое основание,
тогда ряд можно представить цепочкой
превращений: металл—основный
оксид—соль—нерастворимое основание—основный
оксид—металл.
Например:Cu—CuO—CuCl2—Cu(OH)2—CuO—>Cu
Среди
неметаллов также можно выделить две
разновидности рядов:
1.
Генетический ряд неметаллов, где в
качестве звена ряда выступает растворимая
кислота. Цепочку превращений можно
представить в следующем
виде: неметалл—кислотный
оксид—растворимая
кислота—соль.Например:
P—P2O5—H3PO4—Na3PO4.
2.
Генетический ряд неметаллов, где в
качестве звена ряда выступает нерастворимая
кислота : неметалл—кислотный
оксид—соль—кислота—кислотный
оксид—неметалл,
Например:
Si—SiO2—Na2SiO3—H2SiO3—SiO2—Si.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
Цепочки превращений (практическая часть)
- Химия элементов
- D-элементы VIIIB-подгруппы (семейство железа)
- Fe, Co, Ni
- Характеристики d-элементов VIIIb группы (семейство железа)
| Элементы Характеристики | 26Fe | 27Co | 28Ni |
| Атомная масса | 55,847 | 58,933 | 58,710 |
| Валентные электроны | 3d64s2 | 3d74s2 | 3d84s2 |
| Металлический радиус атома, пм | |||
| Условный радиус иона, пм | |||
| Э3+ | |||
| Э2+ | |||
| Энергия ионизации | |||
| Э0 → Э+, эВ | 7,87 | 7,86 | 7,63 |
| Э+ → Э2+, эВ | 16,1 | 17,3 | 18,15 |
| Э2+ → Э3+, эВ | 30,6 | 33,5 | 35,16 |
| Относительная электроотрицательность | 1,8 | 1,9 | 1,9 |
Все d-элементы семейства железа − металлы, проявляющие положительные в основном переменные степени окисления; обладают значительной твёрдостью, прочностью, высокими температурами плавления и кипения, высокими тепло- и электропроводностью. Все они образуют сплавы между собой и с другими металлами. Для них характерно образование комплексных соединений.
Характерные свойства и важнейшие соединения
Химическая активность элементов семейства железа значительно ниже, чем у d-элементов 4-7 групп. Это связано с увеличением числа электронов на d-подуровне. По этой же причине в ряду Fe−Со−Ni наиболее активным металлом является железо. Максимальная степень окисления, равная номеру группы для них не характерна.
| Элемент | Fe | Со | Ni |
| Валентные электроны | 3d64s2 | 3d74s2 | 3d84s2 |
| | | | |
| Степени окисления: | |||
| — наиболее устойчивые | +2, +3 | +2, +3 | +2 |
| — редко встречающиеся | (+4), (+5) | (+4), (+5) | (+4) |
| — встречающиеся | +6 | +3 |
От железа к никелю наиболее устойчивой становится низкая степень окисления +2. Это Так как в атомах данных элементов на d-подуровне возрастает число парных электронов и одновременно уменьшается радиус атома. Следовательно увеличивается прочность связей электронов и необходимость затраты дополнительной энергии; на их распаривание.
- Все три металла близки по химическим свойствам.
- С водой они реагируют при высокой температуре, разлагая её:
- 3 Fe + 4 Н2О = Fe3O4 + 4 Н2.
Выделяющийся водород частично растворяется в железе, охрупчивая его. Больше всех водород поглощается никелем. На этом основано использование никеля в качестве катализатора при гидрировании.
| Me | Fe | Co | Ni |
| j°(Ме2+/Ме0), В | −0,44 | −0,28 | 0,25 |
| j°(Ме3+/Ме0), В | −0,04 | − | − |
- В ряду напряжений железо, кобальт, никель расположены до водорода, поэтому они вытесняют водород из кислот, проявляющих окислительные свойства за счёт ионов водорода:
- Э° + 2 Н+ → Э2+ + Н2
- Разбавленная и концентрированная азотная и концентрированная серная кислота по-разному действуют на металлы.
В отсутствии влаги при обычных условиях Fe, Со и Ni заметно не реагируют с кислородом, серой, хлором, бромом, углеродом, кремнием, фосфором и другими неметаллами. При нагревании в мелко раздробленном состоянии взаимодействие протекает интенсивнее.
При нагревании мелко раздробленные Fe, Co и Ni в атмосфере оксида углерода (II) СО образуются карбонилы состава Fe(CO)5, [Со(СО)4]2 и Ni(CO)4 за счёт донорно-акцепторного взаимодействия, где степень окисления металла формально можно считать нулевой.
Железо, кобальт и никель в состоянии +2 образуют оксиды общей формулы ЭО. Все они нерастворимы в воде и щелочах, но растворимы в кислотах. При нагревании могут быть восстановлены водородом до металлов^
- MeO + H2 = Me + H2O.
- Оксидам ЭО соответствуют гидроксиды общей формулы Э(ОН)2, получаемые по обменными реакциям^
- CoCl2 + 2 NaOH = Co(OH)2¯ + 2 NaCl.
Гидроксиды нерастворимы в воде и щелочах, но растворимы в кислотах, т.е. проявляют основные свойства.
- Образуемые катионами Э2+ соли сильных кислот почти все хорошо растворимы в воде. Вследствие гидролиза их растворы показывают кислую среду:
- 2NiSO4 + 2H2O ↔ (NiOH)2SO4 + 2H2SO4,
- Ni2+ + H2O ↔ NiOH+ + H+.
- Металлы семейства железа в состоянии Э2+ образуют комплексные соединения с координационными числами: для Fe-6 и очень редко 4, Со в равной степени 6 и 4; для Ni − 4.
- Металлам семейства железа в состоянии +3 соответствуют оксиды общей aормулы Э2О3 и гидроксиды Э(ОН)3. Устойчивость гидроксидов в ряду Fe-Со-Ni уменьшается и возрастает окислительная активность:
- 4 Со(ОН)3 + 4 H2SO4 = 4 CoSO4 + O2 + 10 Н2О.
- Гидроксид никеля (III) по свойствам подобен гидроксиду кобальта (III), но обладает ещё более выраженными окислительными свойствами.
Таким образом, в зависимости от степени окисления химические свойства оксидов и гидроксидов железа, кобальта и никеля различны (табл. 4.4).
Железо и его соединения
Железо существует в четырех модификациях: α-, β-, γ- и δ-Fe. До температуры 770 °С устойчивой является α-модификация железа.
Железо в виде тонкого порошка пирофорно (самовозгорается на воздухе) Пои высоких температурах железо взаимодействует с азотом, образуя нитриды (Fe4N и Fe2N), с фосфором − фосфиды (Fe3P и Fe2P). с углеродом − карбид (Fe3C − цементит), с хлором − галиды (FeCl2 и FeCl3), c кислородом − оксиды (FeO, Fe2O3, Fe3O4, FeO3 − неустойчивый оксид).
Формулы оксидов железа весьма условны, т.к.они, как правило имеют нестехиометрический состав. Так, состав FeO (вюстита) более точно может быть выражен формулой Fe0,95O в стандартных условиях
- Сульфид типа FeS получают действием сульфида аммония на растворимые соли железа (II) или сухим путем − взаимодействием железа с серой. Сульфид железа (II) используют для получения сероводорода:
- 4 FeS + О2 + 10 Н2О = 4 Fe(OH)3 + 4 H2S
- Сульфид железа (II) растворим в кислотах, но нерастворим в воде Кроме FeS существуют сульфиды FeS2 и Fe2S3.
- Соединение с галогенами происходит или непосредственно, или путем обменных реакций:
- 2 Fe + 3 Сl =2 FeCl3 (железо горит в хлоре),
- Fe2O3 + 6 НС1 = 2 FeCl3 + 3 Н2О,
- FeO + 2 НС1 = FeCl2 + H2O.
- Хлорид железа (II) обладает сильными восстановительными свойствами, окисляясь до железа (III):
- 2 FeCl2 + Cl2 =2 FeCl3.
- В растворах хлориды железа (II) и (III) гидролизуются, создавая рН < 7.
- При взаимодействии с кислотами окислителями за счёт иона водорода Н+ железоокисляется до Fe2+.
- Fe + 2 НС1 = FeCl2 + H2
При этом железо растворяется в соляной кислоте любой концентрации. Аналогично протекает реакция в разбавленной серной кислоте. В концентрированных растворах серной кислоты железо окисляется до железа +3.
2 Fe + 6 H2SO4 = Fe2(SO4)3 + 3 SO2 + 6 Н2О.
Однако в серной кислоте с массовой долей, близкой к 100%. железо становится пассивным и взаимодействия практически не происходит.
При взаимодействии железа с азотной кислотой получаются различные продукты реакции. Это зависит от температуры и концентрации кислоты. В умеренно концентрированных растворах азотной кислоты железо растворяется по уравнению:
Fe + 6 HNO3 = Fe(NO3)2 + 3 NO2 + 3 Н2О,
При высоких концентрациях азотной кислоты (р = 1,41 г/мл) растворение замедляется, и железо становится «пассивным», т.е. покрывается защитной малорастворимой плёнкой.
- В разбавленной азотной кислоте на холоду процесс растворения железа протекает следующим образом:
- 8 Fe + 20 HNO3 = 8 Fe(NO3)2 + 2 NН4NO3 + 6 Н2О,
- а в обычных условиях:
- Fe + 4 HNO3 = Fe(NO3)3 + NO + 2 Н2О.
Во влажном воздухе железо очень быстро окисляется, покрываясь ржавчиной − бурым налётом, который вследствие своей рыхлости не защищает железо от дальнейшего разрушения. В воде, при обычных условиях, железо также интенсивно корродирует.
В зависимости от содержания в ней кислорода продукты окисления железа различны: при обильном содержании кислорода образуются гидратные формы оксида железа (III) Fe2O3∙nH2O; при недостатке кислорода образуется смешанный оксид Fe3O4 (Fe2O3∙FeO).
- 4 Fe + 2 Н2О + 3 О2 =2 (Fe2O3∙H2O).
- Оксиду железа (II) соответствует гидроксид Fe(OH)2 − нерастворимое основание, которое получают действием щёлочи на растворимую соль железа (II):
- FeSO4 + 2 NaOH = Fe(OH)2 + Na2SO4.
- Гидроксид железа (II) легко окисляется кислородом воздуха до Fe(OH)3:
- 4 Fe(OH)2 + О2 + 2 Н2О = 4 Fe(OH)3.
Гидроксид железа (II) более сильное основание, чем Fe(OH)3. Поэтому соли железа (II) гидролизованы в меньшей степени, чем соли железа (III). В результате гидролиза образуются основные соли:
- 2 FeSO4 + 2H2O ↔ (FeOH)2SO4 + 2 H2SO4, Кг1 = 10−16/1,3∙10−4 = 0,77∙10−12;
- FeСl3 + 2 Н2О ↔ FeOHCl2 + HCl, Кг1 = 10−16/3∙10−12 = 0,33∙10−4.
- При прокаливании гидроксид железа (III) переходит в оксид железа (II).
- Путём сплавления Fe2O3 с содой или гидроксидом натрия образуется феррит натрия — соль не полученной в свободном состоянии железистой кислоты HFeO2.
- Fe2O3 + 2NaOH = 2NaFeO2 + H2O.
- При нагревании оксида железа (III) с нитратом и гидроксидом калия образуется сплав, содержащий феррат калия K2FeO4 − соль железной кислоты H2FeO4, которая так же не получена в свободном состоянии:
- Fe2O3 + 4 КОН + 3 KNO3 = 2 K2FeO4 + 3 KNO2 + 2 Н2О.
Карбонаты щелочных металлов осаждают из раствора солей железа (II) белый карбонат железа (II) FeCO3. При действии воды, содержащей оксид углерода (IV), нерастворимый карбонат железа, подобно карбонатам кальция и магния, переходит в растворимую соль − гидрокарбонат железа (II), содержащуюся в природных водах.
- Соли железа (II) − восстановители и при действии на них окислителей переходят в соли железа (III):
- 6 FeSO4 + К2Сr2О7 + 7 H2SO4 = 3 Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7 H2O.
- Сульфаты железа (II) и (III) хорошо растворимы в воде. Сульфат железа (II) FeSO4∙7H2O (железный купорос) на воздухе постепенно выветривается и одновременно окисляется с поверхности, переходя в основную соль железа (III):
- 4 FeSO4 + О2 + 2 Н2О = 4 FeOHSO4.
- При нагревании железного купороса выделяется вода и получается безводная белая масса сульфата железа (II). При температуре больше 480 °С происходит процесс разложения:
- 2 FeSO4 = Fe2O3 + SO2 + SO3.
- Сульфат железа (III) Fe2(SО4)3 образует кристаллогидрат Fe2(SО4)3∙9H2O.
- Железо (II) и железо (III) образуют большое число комплексных соединений Так, с ионами CN−(цианид-ионы) железо (II) образует комплексное соединение K4[Fe(CN)6] − гексацианоферрат (II) калия (жёлтая кровяная соль), а железо (III) − К3[Fе(СN)6] − гексацианоферрат (III) калия (красная кровяная соль).
- Жёлтая кровяная соль служит чувствительным реактивом на ионы железа (III), образуя нерастворимую в воде соль − берлинскую лазурь характерного синего цвета:
- Fe3+ + [Fe(CN)6]4+ = Fe4[Fe(CN)6]3.
- Если подействовать красной кровяной солью на раствор, содержащий ионы железа (II), то образуется осадок синего цвета, называемый турнбулевой синью:
- Fe2+ + [Fe(CN)6]3+ = Fe3[Fe(CN)6]2.
- Эти реакции используются для качественного определения присутствия ионов железа (II) и (III) в растворе.
- Качественной реакцией на железо (III) может служить реакция:
- Fe3+ + 3 CNS− = Fe(CNS)3.
- Бесцветные ионы − роданиды CNS− соединяются с ионами железа (III) и образуют кроваво-красный, слабо диссоциированный роданид железа (III) Fe(CNS)3.
- Цепочки превращений (практическая часть)
- Fe FeО Fe2O3 FeCl3 Fe(OH)3 FeOHSO4
- FeOHSO4 Fe2(SO4)3 Fe4[Fe(CN)6]3
- FeO FeCl2 Fe(OH)2 Fe(OH)3 Fe2O3 KFeO2
- FeCl2 Fe3[Fe(CN)6]2






