- Химические свойства металлов
- Урок химии в 11-м классе: "Химические свойства металлов"
- Химические свойства металлов Урок химии в 11 классе Учитель химии: Киреева Марина Николаевна МКОУ «Тормосиновская СОШ» Чернышковского района Волгоградской. — презентация
- Урок 11. обзор металлических элементов а- и в-групп — Химия — 11 класс — Российская электронная школа
Химические
свойства металлов во многом зависят от строения его внешнего или предвнешнего
электронного слоя. Для металлов, расположенных в одной группе периодической
системы и имеющих одинаковое строение внешней электронной оболочки, следует
ожидать определённые сходства в химических свойствах.
В атоме
металлов на внешнем энергетическом уровне небольшое количество электронов и
очень большой радиус атома, что способствует быстрой отдаче электронов атомами
металлов в результат их взаимодействия с другими соединениями.
Металлы
окисляются, сами при этом выступают в роли восстановителя.
Кроме этого,
положение металла в ряду активности характеризует свойства металла и его
катионов в водных растворах и связано с его химической активностью.
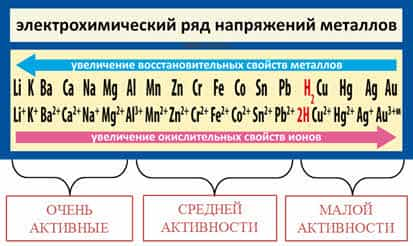
Как известно, самые
активные металлы расположены в начале ряда (слева), а самые
малоактивные – в конце (справа).
На основании
восстановительной способности металлов в ряду напряжений металлы условно можно
разделить на три группы: от лития до алюминия – очень активные
металлы, от алюминия до водорода – металлы средней
активности, от водорода до золота – малоактивные металлы.
Следует отметить,
что высокая электрохимическая активность металла не всегда означает его
химическую активность и наоборот. Обратите внимание на расположение лития и
натрия в ПС и в ряду активности металлов.
На основании положения в ПС натрий
активнее лития, так как радиус у натрия больше, на основании положения их в
ряду активности видно, что литий стоит левее натрия, то есть его восстановительная
способность выше, так как здесь учитывается не только радиус атома, но и
энергия отрыва электрона, энергия разрушения кристалла и энергия гидратации
ионов металла.
Например, с
кислородом активно при комнатной температуре реагируют только щелочные металлы,
при этом образуются оксиды или пероксиды. Так, в реакции лития с кислородом
образуется оксид лития, а в реакции натрия с кислородом – пероксид натрия.
4Li + O2 = 2Li2O
2Na + O2 = Na2O2
Металлы средней
активности реагируют с кислородом при нагревании. Например, проведём
эксперимент горения магния в кислороде. В результате данной реакции образуется
оксид магния, магний горит яркой вспышкой. Эта реакция сопровождается
выделением большого количества и света и ранее использовалась фотографами в
качестве вспышки при съёмке.
2Mg + O2 = 2MgO
Алюминий в
порошке также горит ослепительным пламенем с образованием оксида алюминия. Эта
способность используется в фейерверках, салютах, бенгальских огнях.

Такие металлы,
как Au, Pt не
реагируют с кислородом и поэтому на воздухе практически не изменяют своего
блеска.
Большинство
металлов, кроме Au, Pt реагируют при нагревании с серой, при этом образуются
соответствующие сульфиды.
Так, в реакции
цинка с серой образуется сульфид цинка, в реакции серебра с серой образуется
сульфид серебра (I).
Проведём
эксперимент, для этого на асбестовой сетке поместим цинк с серой, подожжём эту
смесь горящим магнием, в результате у нас образуется сульфид цинка.
Практически все
металлы реагируют с галогенами. Условия протекания этих реакций зависит от
активности металла и галогена.
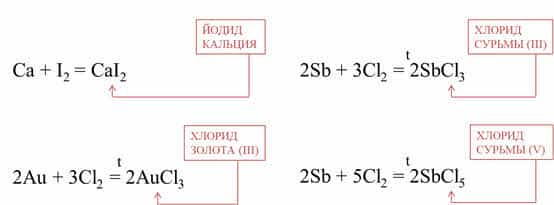
Например, кальций реагирует с йодом при
комнатной температуре, при этом образуется йодид кальция, а золото реагирует с
хлором при сильном нагревании, при это образуется хлорид золота (III).
Очень красиво горит сурьма в хлоре, при этом образуется
смесь хлоридов: хлорид сурьмы (III) и хлорид сурьмы (V).
С металлами
реагируют соединения всех классов – оксиды (в том числе вода), кислоты,
основания и соли.
При нагревании
металлы реагируют и с другими неметаллами. Так, в реакции алюминия с
азотом, образуется нитрид алюминия, в реакции кальция с форфором, образуется
фосфид кальция, в реакции алюминия с углеродом – карбид алюминия, в реакции
магния с кремнием – силицид магния.

С водородом
реагируют только активные металлы. Например, в реакции натрия с водородом
образуется гидрид натрия.
Так, активные
металлы бурно реагируют с водой при комнатной температуре. Например, в реакции
лития с водой образуется гидроксид лития и водород, в реакции бария с водой
образуется гидроксид бария и водород.
Проведём
эксперимент, для этого в воду добавим фенолфталеин и опустим туда кусочек
натрия. Натрий начинает бегать по поверхности из-за выделения водорода, раствор
приобретает малиновую окраску, вследствие образования щёлочи. Таким образом, в реакции
натрия с водой образуется щёлочь – гидроксид натрия и газ – водород.
Поверхность таких
металлов, как магний и алюминий, защищена плотной плёнкой соответствующего
оксида. Это препятствует протеканию реакции с водой.
Но если убрать
эту плёнку, то эти металлы активно будут вступать в реакцию. Например,
порошкообразный магний реагирует с горячей водой, при этом образуется гидроксид
магния и водород.
При повышенной
температуре с водой реагируют и менее активные металлы, но в данном случае
образуется окси д и водород. Например, в реакции цинка с водой образуется оксид
цинка и водород.
Металлы, стоящие
в ряду активности до водорода, реагируют с кислотами (кроме HNO3
любой концентрации и H2SO4
концентрированной) с образованием солей и водорода.
Активные металлы реагируют
с растворами кислот очень быстро.
Например, в реакции кальция с соляной
кислотой образуется соль – хлорид кальция и водород, в реакции алюминия с
разбавленной серной кислотой образуется соль – сульфат алюминия и водород.
Малоактивные
металлы часто практически не растворяются в кислотах. Это обусловлено
образованием на их поверхности плёнки нерастворимой соли. Например, свинец,
стоящий в ряду активности до водорода, практически не растворяется в
разбавленной серной и соляной кислотах вследствие образования на его
поверхности плёнки нерастворимых солей (PbCl2,
PbSO4).
В азотной кислоте
растворяются металлы, стоящие и до, и после водорода. При этом образуются
нитраты, а также различные продукты восстановления азотной кислоты.
Концентрированная
серная кислота также может вступать в реакции с металлами, расположенными в
ряду активности после водорода. Например, в реакции серебра с концентрированной
серной кислотой образуется сульфат серебра (I), сернистый
газ и вода, а в реакции магния с концентрированной серной кислотой образуется
сульфат магния, сероводород и вода.
Al,
Cr, Fe при
комнатной температуре не вступают в реакцию и с концентрированной серной
кислотой из-за образования на их поверхности оксидной плёнки. Это явление
называется пассивацией. Благодаря этому становится возможным транспортировать
концентрированную азотную серную кислоты в стальных цистернах.
- Проведём
эксперимент, поместим в четыре пробирки металлы: в первую – магний, во вторую –
цинк, в третью – железо, а в четвёртую – медь и прильём в каждую пробирку
соляной кислоты. - Интенсивнее всего
выделение наблюдается в первой пробирки, где находится цинк, кроме этого,
реакция сопровождается выделение теплоты, во второй и третье пробирке
интенсивность выделения водорода меньше, а в четвёртой пробирке водород вообще
не выделяется. - Mg + 2HCl = MgCl2
+ H2↑ + Q - Zn + 2HCl = ZnCl2
+ H2↑ - Fe + 2HCl = FeCl2
+ H2↑ - Cu + HCl ≠
Тоже самое
сделаем в другом опыте, но использовать здесь будем уксусную кислоту.
Получается, что при комнатной температуре с уксусной кислотой реагирует
только магний, цинк и железо реагирует с уксусной кислотой только при
нагревании, а медь не вступает во взаимодействие с уксусной кислотой.
- Mg + 2CH3COOH = (CH3COO)2 Mg + H2↑
- Zn + 2CH3COOH = (CH3COO)2 Zn + H2↑
- Fe + 2CH3COOH = (CH3COO)2 Fe + H2↑
- Cu + CH3COOH
≠ - Таким образом, металл
реагирует с раствором кислоты, если он стоит в ряду активности левее водорода,
при этом должна образоваться растворимая соль, концентрированная серная и
азотная кислота иначе реагируют с кислотами, щелочные металлы для данных
реакций лучше не использовать из-за их высокой химической активности. - Некоторые
металлы, такие, как Be, Zn, Al, легко растворяются в водных растворах щелочей с
образованием комплексных соединений. - Например, в
реакции бериллия с раствором гидроксида натрия образуется комплексная соль –
тетрагидроксобериллат натрия, а в реакции цинка с водным раствором гидроксида
калия образуется комплексная соль – тетрагидроксоцинкат калия. - Be + 2H2O + 2NaOH = Na2[Be(OH)4] +
H2↑ - Zn + 2H2O + 2KOH = K2[Zn(OH)4] + H2↑
Металлы, оксиды и
гидроксиды которых амфотерны, взаимодействуют также с расплавами щелочей при
нагревании. Например, в реакции цинка с расплавом гидроксида натрия образуется
соль – цинкат натрия и водород.
Zn + 2NaOH (тв.)
= Na2ZnO2
+ H2↑
Активные
металлы вытесняют малоактивные из растворов их солей. Так, в реакции железа
с хлоридом меди (II) железо замещает медь в его хлориде
и образуется хлорид железа (II) и медь, в реакции меди
с нитратом серебра (I) образуется соль – нитрат меди (II) и серебро.
- Fe + CuCl2 = FeCl2 + Cu↓
- Cu + 2AgNO3 = Cu (NO3)2 +
2Ag↓ - Проведём
эксперимент, опустим железный гвоздь в раствор сульфата меди (II),
через некоторое время на железном гвозде осела медь и раствор стал жёлтого
цвета, если опустить медную платину в раствор сульфата железа (II), то в данной случае признаков реакции не наблюдается,
ведь медь менее активный металл, чем железо. - Fe + CuSO4 = FeSO4 + Cu↓
- Cu + FeSO4 ≠
- В данных реакциях
нужно соблюдать следующие условия: щелочные металлы брать нельзя, так как они
будут взаимодействовать с водой, металл должен находится левее того металла,
который входит в состав соли, в данных реакциях должна образоваться растворимая
соль.
Металлы могут
реагировать и с органическими веществами. Например, в реакции фенола с натрием,
образуется фенолят натрия, в реакции этанола с натрием образуется этилат
натрия.
2C6H5OH + 2Na → 2C6H5ONa + H2↑
2C2H5OH + 2Na → 2C2H5ONa + H2↑
Кроме этого,
натрий вступает в реакцию Вюрца с галогеналканами. Так, в реакции хлорметана с
натрием образуется хлорид натрия и этан.
2H3CCl + 2Na C2H6
+ 2NaCl
Соединение Pb(C2H5)4
– тетраэтилсвинец – применяется как антидетонатор в моторном топливе. Это
сильно ядовитое соединение, если бензин содержит тетраэтилсвинец, тогда его
называют «этилированным».
Таким образом, о
химической активности металлов можно примерно судить по их расположению в
электрохимическом ряду напряжений металлов.
Чем левее расположен
металл, тем выше его химическая активность в водном растворе. Активные
металлы размещаются вначале вытеснительного ряда, а малоактивные – в конце.
Металлы
реагируют как с простыми веществами – неметаллами, так и со сложными: оксидами,
кислотами, основаниями и солями.
Химические свойства металлов


Средняя оценка: 4.4
Всего получено оценок: 792.
Средняя оценка: 4.4
Всего получено оценок: 792.
Металлы – активные восстановители с положительной степенью окисления. Благодаря химическим свойствам металлы широко используются в промышленности, металлургии, медицине, строительстве.
В реакциях атомы металлов отдают валентные электроны и окисляются. Чем больше энергетических уровней и меньше электронов имеет атом металла, тем легче ему отдавать электроны и вступать в реакции. Поэтому металлические свойства увеличиваются сверху вниз и справа налево в таблице Менделеева.
Рис. 1. Изменение металлических свойств в таблице Менделеева.
Активность простых веществ показана в электрохимическом ряду напряжений металлов. Слева от водорода находятся активные металлы (активность увеличивается к левому краю), справа – неактивные.
Наибольшую активность проявляют щелочные металлы, находящиеся в I группе периодической таблицы и стоящие левее водорода в электрохимическом ряду напряжений. Они вступают в реакцию со многими веществами уже при комнатной температуре.
За ними идут щелочноземельные металлы, входящие во II группу. Они реагируют с большинством веществ при нагревании.
Металлы, находящиеся в электрохимическом ряду от алюминия до водорода (средней активности) требуют дополнительных условий для вступления в реакции.
 Рис. 2. Электрохимический ряд напряжений металлов.
Рис. 2. Электрохимический ряд напряжений металлов.
Некоторые металлы проявляют амфотерные свойства или двойственность. Металлы, их оксиды и гидроксиды реагируют с кислотами и основаниями. Большинство металлов реагирует только с некоторыми кислотами, замещая водород и образуя соль. Наиболее ярко выраженные двойственные свойства проявляют:
- алюминий;
- свинец;
- цинк;
- железо;
- медь;
- бериллий;
- хром.
Каждый металл способен вытеснять стоящий правее него в электрохимическом ряду другой металл из солей. Металлы, находящиеся слева от водорода, вытесняют его из разбавленных кислот.
Особенности взаимодействия металлов с разными веществами представлены в таблице химических свойств металлов.
| Реакция | Особенности | Уравнение |
| С кислородом | Большинство металлов образует оксидные плёнки. Щелочные металлы самовоспламеняются в присутствии кислорода. При этом натрий образует пероксид (Na2O2), остальные металлы I группы – надпероксиды (RO2). При нагревании щелочноземельные металлы самовоспламеняются, металлы средней активности – окисляются. Во взаимодействие с кислородом не вступают золото и платина |
|
| С водородом | При комнатной температуре реагируют щелочные, при нагревании – щелочноземельные. Бериллий не вступает в реакцию. Магнию дополнительно необходимо высокое давление |
|
| С азотом | Только активные металлы. Литий вступает в реакцию при комнатной температуре. Остальные металлы – при нагревании |
– 6Li + N2 → 2Li3N; – 3Ca + N2 → Ca3N2 |
| С углеродом | Литий и натрий, остальные – при нагревании |
– 4Al + 3C → Al3C4; – 2Li+2C → Li2C2 |
| С серой | Не взаимодействуют золото и платина |
|
| С фосфором | При нагревании | 3Ca + 2P → Ca3P2 |
| С галогенами | Не реагируют только малоактивные металлы, медь – при нагревании | Cu + Cl2 → CuCl2 |
| С водой | Щелочные и некоторые щелочноземельные металлы. При нагревании, в условиях кислой или щелочной среды реагируют металлы средней активности |
|
| С кислотами | Металлы слева от водорода. Медь растворяется в концентрированных кислотах |
|
| Со щелочами | Только амфотерные металлы | 2Al + 2KOH + 6H2O → 2K[Al(OH)4] + 3H2↑ |
| С солями | Активные замещают менее активные металлы | 3Na + AlCl3 → 3NaCl + Al |
Металлы взаимодействуют между собой и образуют интерметаллические соединения – 3Cu + Au → Cu3Au, 2Na + Sb → Na2Sb.
Общие химические свойства металлов используются для создания сплавов, моющих средств, применяются в каталитических реакциях. Металлы присутствуют в аккумуляторах, электронике, в несущих конструкциях.
Основные отрасли применения указаны в таблице.
| Отрасль | Производство | Металлы |
| Химическая промышленность | Катализаторы, соли, щёлочи | Pt, Fe, Ni, K |
| Пищевая промышленность | Поваренная соль (NaCl), сода (Na2CO3, NaHCO3) | Na, Ca, Ag |
| Металлургия | Сплавы, покрытия, детали разной формы, проволока, облицовка, строительные материалы и инструменты | Fe, Cr, Ni, W, Mo |
| Приборостроение | Микросхемы, фотоэлементы, датчики | Cs, Co, Ni, Cu |
| Ювелирная промышленность | Украшения | Au, Pt, Ag |
| Медицина | Протезы | Ti, Ni, Au |
 Рис. 3. Висмут.
Рис. 3. Висмут.
Из урока 9 класса химии узнали об основных химических свойствах металлов. Возможность взаимодействовать с простыми и сложными веществами определяет активность металлов. Чем активнее металл, тем легче он вступает в реакцию при обычных условиях.
Активные металлы реагируют с галогенами, неметаллами, водой, кислотами, солями. Амфотерные металлы взаимодействуют со щелочами. Малоактивные металлы не реагируют с водой, галогенами, большинством неметаллов. Кратко рассмотрели отрасли применения.
Металлы используются в медицине, промышленности, металлургии, электронике.
Чтобы попасть сюда — пройдите тест.
Средняя оценка: 4.4
Всего получено оценок: 792.
А какая ваша оценка?
Гость завершил
Тест «Алые паруса»с результатом 7/12
Гость завершил
Тест «Князь Михайло Репнин»с результатом 5/7
Гость завершил
Тест «Тихое утро»с результатом 10/10
Гость завершил
Тест «Дубровский»с результатом 10/16
Гость завершил
Тест «Алые паруса»с результатом 10/12
Гость завершил
Тест «Ионыч»с результатом 10/10
Гость завершил
Тест на тему «Полюдье»с результатом 4/5
Гость завершил
Тест «А зори здесь тихие»с результатом 10/16
Гость завершил
Тест Том 1 «Война и Мир»с результатом 11/12
Не подошло? Напиши в х, чего не хватает!
Урок химии в 11-м классе: "Химические свойства металлов"
Cлайд № 1. Приложение 1.
Тип урока: урок изучения нового материала.
Цель урока
: систематизировать и углубить знания о химических свойствах металлов, подчеркнув их функцию как восстановителей.
Задачи урока
.
Обучающие:
Развивающие:
Воспитательные:
Оборудование:
ПК с медиапроектором, экран, документ – камера, фотоаппарат, индивидуальные микролаборатории с набором химических реактивов и оборудованием, тесты, таблица “Протокол исследования”.
Ход урока
I. Оргмомент.
(1 минута)
II. Актуализация опорных знаний.
(5 минут)
1. Блеф-игра “Верите ли вы, что…”. Cлайд № 2
2. Программированный опрос.
Приложение 2.
(2 учащимся предлагается тест из 6 вопросов (2 варианта)).
……………………………………………………………………………
- Вариант 1
- 1. Атом железа имеет электронную конфигурацию внешнего энергетического уровня:
- 1) …3d64s2 2) …4s2 3) …4s24p6 4) …3d54s2
2. В каком ряду химические элементы расположены в порядке увеличения металлических свойств?
1) Sr, Ca, Mg; 2) Na, Mg, Al; 3) Na, K, Rb; 4) Sr, Ba, Ra.
3. Самый тугоплавкий металл: 1) Li; 2) Cr; 3) V; 4) W.
4. К щелочным металлам относится: 1) Са; 2) Cs; 3) Cu; 4) Al.
5. Самый легкий металл: 1) Li; 2) Mg; 3) Al; 4) Cs.
6. Самый пластичный: 1) Hg; 2) Li; 3) Au; 4) Al.
- ……………………………………………………………………
- Вариант 2
- 1. Электронная конфигурация внешнего энергетического уровня … 3d104s2 соответствует атому: 1) Ca; 2) Ti; 3) Zn; 4) Cu
- 2. Способность отдавать электроны уменьшается в ряду:
- 1) Na, Mg, Al; 2) Li, Na, Cs; 3) Sc, Ca, K; 4) Sr, Ba, Ra.
3. Самый легкоплавкий металл: 1) Li; 2) Hg; 3) Cs; 4) Na.
4. К щелочно-земельным металлам относится: 1) Mg; 2) K; 3) Ba; 4) Be.
5. Самый тяжелый металл: 1) Mo; 2) Pb; 3) W; 4) Os.
6. Самый электропроводный: 1) Cu; 2) Ag; 3) Au; 4) Al.
Учащиеся обводят правильные ответы, затем меняются с соседом, проверяют друг у друга, ставят оценку.
Приём пед. техники “Самопроверка”. Слайд № 3
- Объявление результатов:
- 5-6 правильных ответов – “5”
- 4 правильных ответа – “4”
- 3 правильных ответа – “3”
3. Работа с компьютером (тесты, кроссворд) 3 учащихся.
Приложение 3
III. Постановка целей и задач урока.
(3 минуты)
Учитель.
Так ли уж необходимо в жизни знание химических свойств металлов? Слайд № 4-5
Вопрос 1. Новый цинковый бак, в котором приготовили раствор медного купороса для опрыскивания растений, вскоре прохудился. Объясните причину разрушения стенок бака.
(При ответе на вопрос 1 учащиеся сравнивают активность металлов в электрохимическом ряду напряжений и делают вывод о протекании реакции растворимой соли с более активным металлом.
Сравнивая активность металлов в электрохимическом ряду напряжений, учащиеся делают вывод о протекании реакции замещения активным металлом более слабого в растворимой соли, вследствие чего происходит разрушение стенок бака.)
Вопрос 2. Почему алюминиевую посуду нельзя мыть содой?
(Учащиеся делают вывод о разной среде растворов и невозможностью нахождения алюминия в щелочной среде раствора, т.к. будет протекать его взаимодействие со щелочью. Алюминий и его соединения (оксидная пленка на поверхности металла) амфотерные, учащиеся приходят к выводу о щелочной среде раствора соды, образованной в результате гидролиза.)
Учащиеся сразу не могут ответить на данные вопросы, но ищут ответы на них в ходе урока.
Учитель совместно с учащимися формулируют цели и задачи урока на слайде № 6-7.
IV. Изучение нового материала (исследовательская работа). (25 минут)
Учитель. Металлы в реакциях выступают восстановителями.слайд № 8. В зависимости от положения в ряду напряжений металлов они проявлют разную активность по отношению к реагентам: слайд № 9.
Металлы реагируют с неметаллами, водой, кислотами, солями, оксидами, некоторыми органическими веществами. Металлы, образованные переходными элементами, реагируют с растворами щелочей.
- Некоторые металлы взаимодействуют между собой с образованием интерметаллидов.
- Все химические свойства металлов можно представить в виде схемы: слайд № 10.
- М + Неме
Е
+ H2O
Т
+ оксид
А
+ кислота
Л
+ соль
Л
+ щелочь (р-р)
Ы
+ органические вещества
Физминутка.
(2 минуты). Cлайд № 11
Исследовательская работа. Cлайд № 12
Перед началом работы проводится инструктаж по ТБ. Cлайд № 13
Деление на группы. Cлайд № 14. Приложение 4
Результаты работы учащиеся заносят в таблицу “Протокол исследования”.Сначала каждая группа отдельно заполняет по своему свойству, а затем по мере отчётности групп, таблица заполняется полностью каждым учащимся. Отчитываются группы, демонстрируя результаты исследования через документ – камеру на экране. Опыты снимаются учащимися на цифровой фотоаппарат и при отчёте также демонстрируются.
Протокол исследования (Таблица) Приложение 5
Приложение 6
Таблица
V. Закрепление изученного.
(3 минуты)
Учащиеся отвечают на вопросы, поставленные в начале урока.
Учитель. Металлы широко используются человеком в технике, медицине, различных отраслях промышленности, но при использовании надо учитывать их свойства: взаимодействие с кислородом, водой, различными солями.
VI. Рефлексия.
(2 минуты). Приложение 7.
Анкета
, которая позволяет осуществить самоанализ, дать качественную и количественную оценку уроку. Слайд № 15
| 1. На уроке я работал 2. Своей работой на уроке я 3. Урок для меня показался 4. За урок я 5. Материал урока мне был 6.Домашнее задание мне кажется | активно / пассивно доволен / не доволен коротким / длинным не устал / устал понятен / не понятен полезен / бесполезен легким / трудныминтересно / не интересно |
Cлайд № 16.
Жизнь человеческая подобна железу.
Если употреблять его в дело, оно истирается; если не употреблять, ржавчина его съедает. Катон Старший
Так, пусть ваш мозг истирается от работы мысли, а не пожирается ржавчиной от лени.
Учащиеся оценивают свою работу на уроке по результатам теста и своим ответам. Учитель корректирует оценки и выставляет их в журнал. Приложение 8.
VI. Домашнее задание. (3 минуты). Cлайд № 17
1. Всем: с. 212-219, протокол исследования.
2. Сильным на карточках:Закончить уравнение реакции, написать уравнения электронного баланса: Сu + Hg(NO3)2 —>
Используемая литература:
4.07.2013
Химические свойства металлов Урок химии в 11 классе Учитель химии: Киреева Марина Николаевна МКОУ «Тормосиновская СОШ» Чернышковского района Волгоградской. — презентация
1 Химические свойства металлов Урок химии в 11 классе Учитель химии: Киреева Марина Николаевна МКОУ «Тормосиновская СОШ» Чернышковского района Волгоградской области
2 Верите ли вы, что … 1.Металлы занимают верхний левый угол в ПСХЭ. 2.В кристаллах атомы металла связаны металлической связью. 3.Валентные электроны металлов прочно связаны с ядром. 4.У металлов, стоящих в главных подгруппах (А), на внешнем уровне обычно 2 электрона. 5.В группе сверху вниз происходит увеличение восстановительных свойств металлов.
- 3 Самопроверка тестов 5-6 правильных ответов – «5» 4 правильных ответа – «4» 3 правильных ответа – «3»
- 4
- 5 Почему алюминиевую посуду нельзя мыть содой? Na 2 CO 3
- 6 Цель урока: систематизировать и углубить знания о химических свойствах металлов, подчеркнув их функцию как восстановителей.
- 7 Задачи урока развивать умения пользоваться опорными знаниями, закреплять умения и навыки выполнения химического эксперимента; закреплять умения составлять уравнения реакций; сформировать понимание практического значения металлов в жизни человека; развивать познавательный интерес при выполнении теоретических и практических заданий.
8 Ме 0 – ne Me +n Ме 0 – восстановитель 1.Простые вещества (+О 2, Сl 2, S…) 2.Сложные вещества (Н 2 О, кислоты, растворы солей) (+ окислитель)
- 9 Ряд напряжений металлов
- 10 М + неметалл Е + вода Т + оксид А + кислота Л + соль Л + щёлочь Ы + органические вещества
- 11 Физминутка
12 Единственный путь, ведущий к знанию, — это деятельность. (Б. Шоу )
13 Чтобы жизнь свою не подвергать опасности, надо свято соблюдать все правила по технике безопасности!
14 Исследование химических свойств металлов 1 группа Металл + неметалл? 2 группа Металл + вода? Металл + оксид 3 группа Металл + кислота? 4 группа Металл + соль менее активного металла? Металл + щёлочь? 5 группа Металл + органические вещества? Металл + металл?
15
16 Жизнь человеческая подобна железу. Если употреблять его в дело, оно истирается; если же не употреблять, ржавчина его съедает. Так, Пусть ваш мозг истирается от работы мысли, а не пожирается ржавчиной от лени. Катон Старший сказал:
17 Домашнее задание: 1 ВАРИАНТ ЗАДАНИЯ: § 18, с , протокол исследования 2 ВАРИАНТ ЗАДАНИЯ: : Закончить уравнение реакции, написать уравнения электронного баланса: Сu + Hg(NO 3 ) 2 ТВОРЧЕСКОЕ ЗАДАНИЕ: ПРЕЗЕНТАЦИЯ О ПРИМЕНЕНИИ МЕТАЛЛОВ(ПО ЖЕЛАНИЮ)
Урок 11. обзор металлических элементов а- и в-групп — Химия — 11 класс — Российская электронная школа
Химия, 11 класс
Урок № 11. Обзор металлических элементов А- и B-групп
Перечень вопросов, рассматриваемых в теме: урок посвящён характеристике металлов А- и B-групп периодической системы химических элементов Д. И. Менделеева. Учащиеся получат представление о химических свойствах металлов в связи со строением их атомов
- Глоссарий
- d-элементы – элементы, в атомах которых заполняется d-подуровень.
- p-элементы – элементы, в атомах которых заполняется p-подуровень.
- s-элементы – элементы, в атомах которых заполняется s-подуровень.
- Интерметаллид (интерметаллическое соединение) – химическое соединение двух или более металлов.
- Полупроводники – материалы, по своей удельной проводимости занимающие промежуточное место между проводниками и диэлектриками.
- «Провал» электрона – переход электрона с внешнего энергетического уровня на более низкий, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций.
- Сверхпроводники – материалы, электрическое сопротивление которых при понижении температуры до некоторой величины становится равным нулю.
- Щелочноземельные металлы – химические элементы 2А группы периодической таблицы элементов.
- Щелочные металлы – элементы 1А группы периодической таблицы химических элементов.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс: учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Обзор металлических элементов А- и B-групп
- Химические свойства металлических элементов А-групп
- Атомы металлических s- и p-элементов, обладая гораздо большим радиусом по сравнению с атомами неметаллов, способны только отдавать валентные электроны, проявляя восстановительные свойства.
- Металлы вступают в реакции как с простыми, так и со сложными веществами.
- Взаимодействие металлов с простыми веществами
- Реакции металлов с галогенами и кислородом протекают очень энергично.
- 0 0 t +1 -1
- 2 Na + Cl2 = 2NaCl
- 0 0 t +3 -1
- 2Al + 3Cl2 = 2AlCl3
- 0 0 t +2 -2
- 2Mg + O2 = 2MgO
- 0 0 t +3 -2
- 4Al + 3O2 = 2Al2O3
- Не так энергично идет реакция с серой.
- 0 0 t +1 -2
- 2Na + S = Na2S
- 0 0 t +3 -2
- 2Al + 3S = Al2S3
- Гораздо труднее идет взаимодействие с азотом и фосфором.
- 0 0 t +2 -3
- 3Mg + N2 = Mg3N2
- 0 0 t +2 -3
- 3Ca + 2P = Ca3P2
- При определенных условиях возможно также восстановление металлами водорода с образованием гидридов.
- 0 0 t +2 -1
- Ca + H2 = CaH2
Металлы способны также взаимодействовать с другими металлами, образуя интерметаллические соединения. Многие интерметаллиды используются в технике как сильные магниты, полупроводники, сверхпроводники.
Взаимодействие металлов со сложными веществами
С водой при комнатной температуре взаимодействуют щелочные и щелочноземельные металлы (от Cs до Ca), а при нагревании – менее активные (от Mg до Sn). В обоих случаях выделяется водород, но в первом образуются гидроксиды, а во втором оксиды металлов.
- 0 +1 +2 0
- Ca + 2HOH = Ca(OH)2 + H2↑
- 0 +1 t +2 0
- Mg + 2H2O = MgO + H2↑
- Металлы, расположенные в ряду напряжений до водорода, восстанавливают ионы водорода из разбавленных кислот (кроме азотной).
- 0 +1 +2 0
- Mg + H2SO4 = MgSO4 + H2↑
- Одни металлы восстанавливают другие из водных растворов солей, если первые расположены левее вторых в ряду стандартных электродных потенциалов.
- 0 +2 +3 0
- 2Al + 3Pb(NO3)2 = 2Al(NO3)3 + 3Pb
- Не нужно забывать, что такие сильные восстановители как Li, Na, K, Ca будут восстанавливать не металл из соли, а водород из воды.
- Химические свойства металлических элементов B-групп
Металлические элементы B-групп принадлежат к d-элементам. В их атомах заполняются d-орбитали предвнешнего энергетического уровня.
Поскольку структура внешнего уровня d-элементов одного периода одинакова (1-2 s-электрона), а радиусы атомов имеют близкие значения, то и свойства атомов d-элементов изменяются в периоде слева направо более медленно по сравнению с s- и p-элементами.
У атомов некоторых элементов (например, Cr, Cu) в результате «провала» наружных электронов на внешнем уровне остается по одному электрону, что и определяет их свойства.
В B-группах радиусы атомов в направлении сверху вниз изменяются неравномерно, и восстановительные свойства (за некоторыми исключениями) уменьшаются.
В то же время у металлических элементов B-групп прослеживаются и некоторые общие закономерности, такие как:
- совпадение максимальной положительной степени окисления у p-элементов 3-7 B-групп с номером группы;
- образование некоторыми d-элементами (Ru, Os) соединений, в которых их максимальная степень окисления +8 совпадает с номером группы;
- ослабление основных и усиление кислотных свойств с увеличением степени окисления атомов металлов B-групп.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Решение задачи на расчеты по уравнению реакции
Условие задачи: При взаимодействии 3,12 г одновалентного металла с водой выделилось 0,896 л водорода. Определите этот металл. Ответ дайте в виде химического символа.
- Шаг первый: Запишем уравнение реакции металла с водой, зная, что металл одновалентен
- 2Me + 2H2O = 2MeOH + H2↑
- Шаг второй: Найдем количество вещества металла.
- По уравнению реакции
- n(Me) = 2n(H2)
n(H2) = 0,896/22.4=0.4 моль
- n(Me) = 2 х 0.04 = 0,08 моль
- Шаг третий: Вычислим молярную массу металла
- M(Me) = m/n(Me) = 3,12/0,08 = 39 г/моль
Шаг четвёртый: С помощью таблицы Менделеева найдем металл с соответствующей относительной атомной массой, численно совпадающей с молярной. Этот металл – калий.
Ответ: K
2. Решение задачи на химические свойства металла.
Условие задачи: В лаборатории химика имеется порошок желто-коричневого цвета, который при попадании в воду издает сильный чесночный запах. Какое вещество представляет собой порошок, если он получен в результате реакции между алюминием и селеном, протекающей аналогично реакции алюминия с серой или кислородом? Укажите формулу данного вещества.
- Шаг первый: Запишем уравнения реакций алюминия с серой и кислородом
- 2Al + 3S = Al2S3
- 4Al + 3O2 = 2Al2O3
- Шаг второй: аналогичным образом запишем уравнение реакции алюминия с селеном.
- 2Al + 3Se = Al2Se3
- Это селенид алюминия.
- Ответ: Al2Se3






