- Атом и молекула натрия. Формула натрия. Строение натрия:
- Изотопы и модификации натрия:
- Свойства натрия (таблица): температура, плотность, давление и пр.:
- Физические свойства алюминия:
- Химические свойства натрия. Взаимодействие натрия. Реакции с натрием:
- Получение натрия:
- Применение натрия:
- Тест. Ковалентная неполярная связь
- Задания 4. Химическая связь, состав и строение веществ
- Электроны в металлах
- Электронная жидкость
- Электроны и их поведение
Na 11 Натрий
22,98976928(2) 1s2 2s2 2p6 3s1
Натрий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 11. Расположен в 1-й группе (по старой классификации — главной подгруппе первой группы), третьем периоде периодической системы.
Атом и молекула натрия. Формула натрия. Строение натрия
- Изотопы и модификации натрия
- Свойства натрия (таблица): температура, плотность, давление и пр.
- Физические свойства натрия
Химические свойства натрия. Взаимодействие натрия. Реакции с натрием
Получение натрия
Применение натрия
Таблица химических элементов Д.И. Менделеева
Атом и молекула натрия. Формула натрия. Строение натрия:
Натрий (лат. Natrium, от лат.
слова natrium, которое было заимствовано из среднеегипетского языка (nṯr), где оно означало среди прочего – «сода», «едкий натр») – химический элемент периодической системы химических элементов Д. И.
Менделеева с обозначением Na и атомным номером 11. Расположен в 1-й группе (по старой классификации – главной подгруппе первой группы), третьем периоде периодической системы.
Натрий, свойства атома, химические и физические свойства
Натрий – металл. Относится к группе щелочных металлов.
- Натрий обозначается символом Na.
- Как простое вещество натрий при нормальных условиях представляет собой мягкий щелочной металл серебристо-белого цвета в тонких слоях с фиолетовым оттенком.
- Молекула натрия одноатомна.
- Химическая формула натрия Na.
Электронная конфигурация атома натрия 1s2 2s2 2p6 3s1. Потенциал ионизации (первый электрон) атома натрия равен 495,85 кДж/моль (5,1390769(3) эВ).
Строение атома натрия. Атом натрия состоит из положительно заряженного ядра (+11), вокруг которого по трем оболочкам движутся 11 электронов. При этом 10 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку натрий расположен в третьем периоде, оболочек всего три.
Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома натрия – на 3s-орбитали находится один неспаренный электрон. В свою очередь ядро атома натрия состоит из 11 протонов и 12 нейтронов.
Натрий относится к элементам s-семейства.
Радиус атома натрия (вычисленный) составляет 190 пм.
Атомная масса атома натрия составляет 22,98976928(2) а. е. м.
Натрий – шестой по распространённости элемент в земной коре. Содержание его в земной коре составляет 2,3 %, в океанах и морях – 1,1 %.
Натрий очень легко вступает в химические реакции.
Изотопы и модификации натрия:
Свойства натрия (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Натрий |
| 102 | Прежнее название | |
| 103 | Латинское название | Natrium |
| 104 | Английское название | Sodium |
| 105 | Символ | Na |
| 106 | Атомный номер (номер в таблице) | 11 |
| 107 | Тип | Металл |
| 108 | Группа | Щелочной металл |
| 109 | Открыт | Хемфри Дэви, Великобритания, 1807 г. |
| 110 | Год открытия | 1807 г. |
| 111 | Внешний вид и пр. | Мягкий металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации: – натрий с кубической объёмно-центрированной кристаллической решёткой, – натрий с гексагональной кристаллической решёткой |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | 23Na |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 2,3 % |
| 120 | Содержание в морях и океанах (по массе) | 1,1 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,002 % |
| 122 | Содержание в Солнце (по массе) | 0,004 % |
| 123 | Содержание в метеоритах (по массе) | 0,55 % |
| 124 | Содержание в организме человека (по массе) | 0,14 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 22,98976928(2) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s1 |
| 203 | Электронная оболочка | K2 L8 M1 N0 O0 P0 Q0 R0 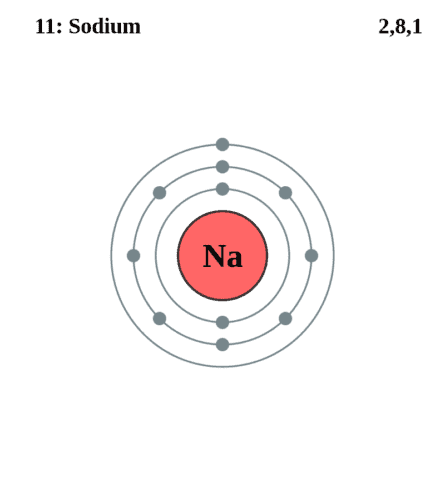 |
| 204 | Радиус атома (вычисленный) | 190 пм |
| 205 | Эмпирический радиус атома* | 180 пм |
| 206 | Ковалентный радиус* | 154 пм |
| 207 | Радиус иона (кристаллический) | Na+
|
| 208 | Радиус Ван-дер-Ваальса | 227 пм |
| 209 | Электроны, Протоны, Нейтроны | 11 электронов, 11 протонов, 12 нейтронов |
| 210 | Семейство (блок) | элемент s-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 1-ая группа (по старой классификации – главная подгруппа 1-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -1; 0; +1 |
| 302 | Валентность | I |
| 303 | Электроотрицательность | 0,93 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 495,85 кДж/моль (5,1390769(3) эВ) |
| 305 | Электродный потенциал | Na+ + e– → Na, Eo = -2,714 В |
| 306 | Энергия сродства атома к электрону | 52,867(3) кДж/моль (0,547926(25) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 0,9725 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело),
|
| 402 | Температура плавления* | 97,794 °C (370,944 K, 208,029 °F) |
| 403 | Температура кипения* | 882,940 °C (1156,090 K, 1621,292 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 2,60 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 97,42 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 1,225 Дж/г·K (при 25 °C) |
| 410 | Молярная теплоёмкость | 28,23 Дж/(K·моль) |
| 411 | Молярный объём | 23,74976 см³/моль |
| 412 | Теплопроводность | 142 Вт/(м·К) (при стандартных условиях), 142 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая объёмно-центрированная 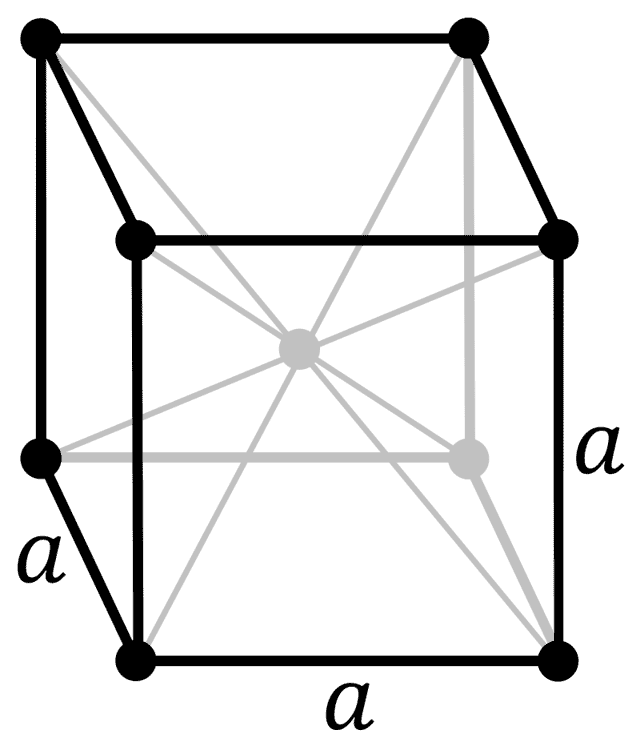 |
| 513 | Параметры решётки | 4,2820 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 150 К |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 521 | Кристаллическая решётка #2 | |
| 522 | Структура решётки | Гексагональная  |
| 523 | Параметры решётки | a = 3,767 Å, c = 6,154 Å |
| 524 | Отношение c/a | 1,633 |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | P63/mmc |
| 527 | Номер пространственной группы симметрии | 194 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-23-5 |
- Примечание:
- 205* Эмпирический радиус атома натрия [1] составляет 186 пм.
- 20* Ковалентный радиус натрия согласно [1] составляет 166±9 пм.
- 401* Плотность натрия согласно [3] составляет 0,971 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело), согласно [4] составляет 0,928 г/см3 (при 98 °C и иных стандартных условиях, состояние вещества – жидкость).
- 402* Температура плавления натрия согласно [3] составляет 97,81 °C (370,96 К, 208,06 °F).
- 403* Температура кипения натрия согласно [3] составляет 882,95 °C (1156,1 К, 1621,31 °F).
- 407* Удельная теплота плавления (энтальпия плавления ΔHпл) натрия согласно [3] составляет 2,64 кДж/моль.
- 408* Удельная теплота испарения (энтальпия кипения ΔHкип) натрия согласно [3] и [4] составляет 97,9 кДж/моль и 86,36 кДж/моль соответственно.
Физические свойства алюминия:
Химические свойства натрия. Взаимодействие натрия. Реакции с натрием:
Получение натрия:
Применение натрия:
Таблица химических элементов Д.И. Менделеева
Таблица химических элементов Д.И. Менделеева
Источники:
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
натрий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле натрия
сколько электронов в атоме свойства металлические неметаллические термодинамические
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
- Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
- Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
- Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
- Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Тест. Ковалентная неполярная связь
Будьте внимательны! У Вас есть 10 минут на прохождение теста. Система оценивания — 5 балльная. Разбалловка теста — 3,4,5 баллов, в зависимости от сложности вопроса. Порядок заданий и вариантов ответов в тесте случайный. С допущенными ошибками и верными ответами можно будет ознакомиться после прохождения теста. Удачи!
- Система оценки: 5 балльная
- Список вопросов теста
- Вопрос 1
- Ковалентная неполярная связь образуется между:
- Варианты ответов
- · между атомами металла и неметалла
- · между атомами различных неметаллов
- · одинаковыми атомами неметалла
- · различными атомами неметалла
- Вопрос 2
- Образование молекулы водорода из атомов, можно изобразить:
- Варианты ответов
- · H + H → H • H
- · H + • H → H •• H
- · H • + H → H • H
- · H • + • H → H •• H
- Вопрос 3
- В результате образования ковалентной связи объединяются:
- Варианты ответов
- · спаренные электроны
- · неспаренные электроны
- · ионы и неспаренные электроны
- · различные ионы
- Вопрос 4
- У какой молекулы двойная связь?
- Варианты ответов
- · Н2
- · Cl2
- · N2
- · О2
- Вопрос 5
- Выберите молекулу с ковалентной неполярной связью:
- Варианты ответов
- · P2O5
- · CO2
- · F2
- · CS2
- Вопрос 6
- Какая связь самая прочная?
- Варианты ответов
- · неполярная
- · одинарная
- · двойная
- · тройная
- Вопрос 7
- Если объединяются по два неспаренных электрона от каждого атома, то образуется связь:
- Варианты ответов
- · ионная
- · одинарная
- · двойная
- · тройная
- Вопрос 8
- Двойная связь:
- Варианты ответов
- · длиннее одинарной
- · длиннее тройной
- · одинакова с тройной
- · короче тройной
- Вопрос 9
- У какой молекулы тройная связь?
- Варианты ответов
- · N2
- · Cl2
- · О2
- · Н2
- Вопрос 10
- При образовании ковалентной неполярной связи общая электронная пара:
- Варианты ответов
- · смещена к более электроотрицательному атому
- · смещена вправо
- · равноценна для двух атомов
- · смещена влево
Тест. Ковалентная полярная связь. Электроотрицательность
Будьте внимательны! У Вас есть 10 минут на прохождение теста. Система оценивания — 5 балльная. Разбалловка теста — 3,4,5 баллов, в зависимости от сложности вопроса. Порядок заданий и вариантов ответов в тесте случайный. С допущенными ошибками и верными ответами можно будет ознакомиться после прохождения теста. Удачи!
- Система оценки: 5 балльная
- Список вопросов теста
- Вопрос 1
- Выберите элемент с переменной валентностью:
- Варианты ответов
- · Cl
- · K
- · Al
- · Na
- Вопрос 2
- Выберите пару, в которой первый элемент более электроотрицательный, чем второй:
- Варианты ответов
- · С и Cl
- · F и O
- · P и O
- · Si и S
- Вопрос 3
- Электротрицательность:
- Варианты ответов
- · увеличивается по периоду слева направо
- · уменьшается по периоду слева направо
- · увеличивается в главных группах сверху вниз
- · уменьшается в группах снизу вверх
- Вопрос 4
- Выберите элемент с постоянной валентностью:
- Варианты ответов
- · C
- · N
- · Mg
- · Fe
- Вопрос 5
- При образовании ковалентной полярной связи электронная пара:
- Варианты ответов
- · смещена влево
- · смещена вправо
- · равноценна между всеми атомами
- · смещена к более электроотрицательному элементу
- Вопрос 6
- Чему равна валентность Р в соединении Р2O5?
- Варианты ответов
- · V
- · III
- · VI
- · II
- Вопрос 7
- В каком соединении валентность Mn максимальна?
- Варианты ответов
- · MnO
- · Mn2O3
- · MnO2
- · Mn2O7
- Вопрос 8
- В каком соединении валентность железа равна III?
- Варианты ответов
- · Fe3O4
- · FeO
- · Fe2O3
- · FeO3
- Вопрос 9
- Ковалентная полярная связь образуется между:
- Варианты ответов
- · между различными атомами металла
- · одинаковыми атомами неметаллов
- · различными атомами неметаллов
- · между атомами металла и неметалла
- Вопрос 10
- Выберите молекулу с ковалентной полярной связью:
- Варианты ответов
- · N2
- · P4
- · H2
- · CO2
- Тест. Металлическая связь
Будьте внимательны! У Вас есть 10 минут на прохождение теста. Система оценивания — 5 балльная. Разбалловка теста — 3,4,5 баллов, в зависимости от сложности вопроса. Порядок заданий и вариантов ответов в тесте случайный. С допущенными ошибками и верными ответами можно будет ознакомиться после прохождения теста. Удачи!
- Система оценки: 5 балльная
- Список вопросов теста
- Вопрос 1
- Металлическая связь обуславливает такое свойство металлов и сплавов, как:
- Варианты ответов
- · летучесть
- · хрупкость
- · пластичность
- · низкие температуры плавления и кипения
- Вопрос 2
- «Электронный газ» — это:
- Варианты ответов
- · электроны внешнего энергетического уровня
- · валентные электроны
- · неспаренные электроны в атоме
- · свободные электроны в кристалле металла
- Вопрос 3
- Сходство металлической связи с ионной в:
- Варианты ответов
- · обобществлении электронов
- · образовании свободных атомов
- · образовании ионов
- · образовании электронов
- Вопрос 4
- Металлическая связь характерна для:
- Варианты ответов
- · атомов различных неметаллов
- · металлов и сплавов
- · атомов одинаковых неметаллов
- · атомов металлов и атомов неметаллов
- Вопрос 5
- Для металлов, находящихся в парообразном состоянии характерная связь:
- Варианты ответов
- · металлическая
- · водородная
- · ионная
- · ковалентная
- Вопрос 6
- Сходство ковалентной и металлической связи в:
- Варианты ответов
- · образовании свободных атомов
- · образовании ионов
- · образовании электронов
- · обобществлении электронов
- Вопрос 7
- Выберите соединение с металлической связью:
- Варианты ответов
- · O2
- · K2O
- · Ca
- · HBr
- Вопрос 8
- У атомов металлов на внешнем уровне находится:
- Варианты ответов
- · от 2 до 4 электронов
- · от 1 до 3 электронов
- · от 4 до 5 электронов
- · от 2 до 3 электронов
- Вопрос 9
- Во фрагменте металла натрия, каждый атом связан с:
- Варианты ответов
- · восьмью другими
- · шестью другими
- · семью другими
- · пятью другими
- Вопрос 10
- Механизм образования металлической связи можно изобразить в виде схемы:
- Варианты ответов
- · Me0 — nē ↔ Men-
- · Me0 — nē ↔ Men+
- · Me0 + nē ↔ Men+
- · Me0 + ē ↔ Me+
- Тест. Обобщение по теме: «Атомы химических элементов»
Будьте внимательны! У Вас есть 10 минут на прохождение теста. Система оценивания — 5 балльная. Разбалловка теста — 3,4,5 баллов, в зависимости от сложности вопроса. Порядок заданий и вариантов ответов в тесте случайный. С допущенными ошибками и верными ответами можно будет ознакомиться после прохождения теста. Удачи!
- Система оценки: 5 балльная
- Список вопросов теста
- Вопрос 1
- Укажите физические свойства меди:
- Варианты ответов
- · растворимость в воде
- · электропроводность
- · серебристо-белый цвет
- · твёрдое состояние в обычных условиях
- Вопрос 2
- Укажите название химического элемента по электронной схеме атома: 2ē, 8ē, 5ē. (Записать название с маленькой буквы)
- Вопрос 3
- Отметьте верные утверждения:
- Варианты ответов
- · побочные группы образованы только металлами
- · номер группы показывает, как правило, число электронов на внешнем уровне
- · большими являются 3 — 7-й периоды
- · с увеличением атомного номера в периодах металлические свойства простых веществ уменьшаются, неметаллические — увеличиваются
- Вопрос 4
- Знак химического элемента правильно указан в следующих случаях:
- Варианты ответов
- · натрий — Na
- · калий — Ка
- · серебро — Se
- · калий — К
- Вопрос 5
- Относительная молекулярная масса правильно указана в следующих случаях:
- Варианты ответов
- · Mr(NO) = 30
- · Mr(Cl2) = 72
- · Mr(HCl) = 36,5
- · Mr(H2S) = 36
- Вопрос 6
- Чему равна сумма относительных атомных масс одного атома углерода и двух атомов кислорода? (Записать число)
- Вопрос 7
- Найдите массовую долю (%) азота в HNO3. (Запишите целое число)
- Вопрос 8
- Отметьте правильные утверждения:
- Варианты ответов
- · по периоду основные свойства ослабевают, а кислотные усиливаются
- · все элементы в периодической таблице расположены в соответствии с увеличением относительных атомных масс
- · каждый химический элемент имеет свой атомный номер, находится в определённом периоде и в определённой группе таблицы
- · атомы элементов одной группы имеют подобные свойства
- Вопрос 9
- Укажите соответствие для всех 4 вариантов ответа:
- Варианты ответов
- · ковалентная полярная
- · ковалентная неполярная
- · ионная
- · металлическая
- Вопрос 10
- Отметьте верные утверждения:
- Варианты ответов
- · большая часть массы атома приходится на массу электронов
- · атомный номер в периодической таблице равен заряду ядра атома и числу электронов и протонов в составе атома
- · число протонов в атоме равно числу электронов
- · число протонов равно числу нейтронов
Задания 4. Химическая связь, состав и строение веществ
Из предложенного перечня выберите два соединения, в которых присутствует ионная химическая связь.
- 1. Ca(ClO2)2
- 2. HClO3
- 3. NH4Cl
- 4. HClO4
- 5. Cl2O7
Запишите в поле ответа номера выбранных соединений.
Решение
Ответ: 13
Определить наличие ионного типа связи в соединении в подавляющем большинстве случаев можно по тому, что в состав его структурных единиц одновременно входят атомы типичного металла и атомы неметалла.
По этому признаку мы устанавливаем, что ионная связь имеется в соединении под номером 1 — Ca(ClO2)2, т.к. в его формуле можно увидеть атомы типичного металла кальция и атомы неметаллов — кислорода и хлора.
Однако, больше соединений, содержащих одновременно атомы металла и неметалла, в указанном списке нет.
Помимо указанного выше признака, о наличии ионной связи в соединении можно говорить, если в составе его структурной единицы содержится катион аммония (NH4+) или его органические аналоги — катионы алкиламмония RNH3+, диалкиламония R2NH2+, триалкиламмония R3NH+ или тетраалкиламмония R4N+, где R — некоторый углеводородный радикал. Например, ионный тип связи имеет место в соединении (CH3)4NCl между катионом (CH3)4+ и хлорид-ионом Cl−.
Среди указанных в задании соединений есть хлорид аммония, в нем ионная связь реализуется между катионом аммония NH4+ и хлорид-ионом Cl−.
- Из предложенного перечня выберите два соединения, в которых тип химической связи такой же, как в молекуле фтора.
- 1) кислород
- 2) оксид азота (II)
- 3) бромоводород
- 4) иодид натрия
- 5) алмаз
- Запишите в поле ответа номера выбранных соединений.
Решение
- Ответ: 15
- Молекула фтора (F2) состоит из двух атомов одного химического элемента неметалла, поэтому химическая связь в данной молекуле ковалентная неполярная.
- Ковалентная неполярная связь может быть реализована только между атомами одного и того же химического элемента неметалла.
Из предложенных вариантов ковалентный неполярный тип связи имеют только кислород и алмаз. Молекула кислорода является двухатомной, состоит из атомов одного химического элемента неметалла. Алмаз имеет атомное строение и в его структуре каждый атом углерода, являющегося неметаллом, связан с 4-мя другими атомами углерода.
Оксид азота (II) — вещество состоящее из молекул, образованных атомами двух разных неметаллов. Поскольку электроотрицательности разных атомов всегда различны, общая электронная пара в молекуле смещена к более электроотрицательному элементу, в данном случае к кислороду. Таким образом, связь в молекуле NO является ковалентной полярной.
Бромоводород также состоит из двухатомных молекул, состоящих из атомов водорода и брома. Общая электронная пара, образующая связь H-Br, смещена к более электроотрицательному атому брома. Химическая связь в молекуле HBr также является ковалентной полярной.
Иодид натрия — вещество ионного строения, образованное катионом металла и иодид-анионом. Связь в молекуле NaI образована за счет перехода электрона с 3s-орбитали атома натрия (атом натрия превращается в катион) на недозаполненную 5p-орбиталь атома иода (атом иода превращается в анион). Такая химическая связь называется ионной.
Из предложенного перечня выберите два вещества, между молекулами которых образуются водородные связи.
- 1. C2H6
- 2. C2H5OH
- 3. H2O
- 4. CH3OCH3
- 5. CH3COCH3
Запишите в поле ответа номера выбранных соединений.
Решение
Ответ: 23
Пояснение:
Водородные связи имеют место в веществах молекулярного строения, в которых присутствуют ковалетные связи H-O, H-N, H-F. Т.е. ковалентные связи атома водорода с атомами трех химических элементов с наивысшей электроотрицательностью.
- Таким образом, очевидно, водородные связи есть между молекулами:
- 1) воды
- 2) спиртов
- 3) фенолов
- 4) карбоновых кислот
- 5) аммиака
- 6) первичных и вторичных аминов
- 7) плавиковой кислоты
Из предложенного перечня выберите два соединения с ионной химической связью.
- 1. PCl3
- 2. CO2
- 3. NaCl
- 4. H2S
- 5. MgO
Запишите в поле ответа номера выбранных соединений.
Решение
- Ответ: 35
- Пояснение:
- Сделать вывод о наличии ионного типа связи в соединении в подавляющем большинстве случаев можно по тому, что в состав структурных единиц вещества одновременно входят атомы типичного металла и атомы неметалла.
- По этому признаку мы устанавливаем, что ионная связь имеется в соединении под номером 3 (NaCl) и 5 (MgO).
- Примечание*
Помимо указанного выше признака, о наличии ионной связи в соединении можно говорить, если в составе его структурной единицы содержится катион аммония (NH4+) или его органические аналоги — катионы алкиламмония RNH3+, диалкиламония R2NH2+, триалкиламмония R3NH+ или тетраалкиламмония R4N+, где R — некоторый углеводородный радикал. Например, ионный тип связи имеет место в соединении (CH3)4NCl между катионом (CH3)4+ и хлорид-ионом Cl−.
- Из предложенного перечня выберите два вещества с одинаковым типом строения.
- 1) вода
- 2) алмаз
- 3) кварц
- 4) поваренная соль
- 5) золото
- Запишите в поле ответа номера выбранных соединений.
Решение
Из предложенного перечня выберите два соединения, у которых ковалентная связь образована по донорно-акцепторному механизму.
- 1. CH3NH2
- 2. CCl4
- 3. NH4Cl
- 4. CH3NH3Br
- 5. SO2Cl2
Запишите в поле ответа номера выбранных соединений.
Решение
Из предложенного перечня выберите два соединения, которые имеют молекулярную кристаллическую решетку.
- 1. Cs2O
- 2. I2
- 3. KBr
- 4. NaI
- 5. HCl
Запишите в поле ответа номера выбранных соединений.
Решение
- Из предложенного перечня выберите два вещества немолекулярного строения.
- 1) фтор
- 2) кислород
- 3) белый фосфор
- 4) бор
- 5) кремний
- Запишите в поле ответа номера выбранных соединений.
Решение
Из предложенного перечня выберите два соединения с наиболее прочными химическими связями.
- 1. Cl2
- 2. Br2
- 3. O2
- 4. I2
- 5. N2
Запишите в поле ответа номера выбранных соединений.
Решение
Из предложенного перечня выберите два соединения, в молекулах которых ковалентная связь образована одной общей электронной парой.
- 1. N2
- 2. Cl2
- 3. NO
- 4. HBr
- 5. O2
Запишите в поле ответа номера выбранных соединений.
Решение
- Из предложенного перечня выберите два вещества, в молекулах которых присутствует двойная связь между атомами углерода и кислорода.
- 1) этанол
- 2) фенол
- 3) формальдегид
- 4) уксусная кислота
- 5) глицерин
- Запишите в поле ответа номера выбранных соединений.
Решение
Из предложенного перечня выберите два вещества с наиболее полярными связями.
- 1. HCl
- 2. HF
- 3. H2O
- 4. H2S
- 5. HI
Запишите в поле ответа номера выбранных соединений.
Решение
Из предложенного перечня выберите два вещества, в которых имеются и ковалентные полярные, и ионные связи.
- 1. NaCl
- 2. NaNO3
- 3. Na2SO4
- 4. Na
- 5. Na2O
Запишите в поле ответа номера выбранных соединений.
Решение
- Из предложенного перечня выберите два вещества с ионной связью.
- 1) кислород
- 2) вода
- 3) оксид углерода (IV)
- 4) хлорид натрия
- 5) оксид кальция
- Запишите в поле ответа номера выбранных соединений.
Решение
- Из предложенного перечня выберите два вещества с таким же типом кристаллической решетки, как у алмаза.
- 1) кремнезем SiO2
- 2) оксид натрия Na2O
- 3) угарный газ CO
- 4) белый фосфор P4
- 5) кремний Si
- Запишите в поле ответа номера выбранных соединений.
Решение
Из предложенного перечня выберите два вещества с ионной связью.
- 1. NH4Cl
- 2. HCOONa
- 3. NH3
- 4. HCOOH
- 5. CO
Запишите в поле ответа номера выбранных соединений.
Решение
Из предложенного перечня выберите два вещества с наибольшей длиной химической связи в молекуле.
- 1. HF
- 2. HCl
- 3. HBr
- 4. HI
- 5. H2O
Запишите в поле ответа номера выбранных соединений.
Решение
Из предложенного перечня выберите два вещества, в молекулах которых есть одна π-связь.
- 1. SO2
- 2. HBr
- 3. HCOOH
- 4. H2
- 5. O2
Запишите в поле ответа номера выбранных соединений.
Решение
Из предложенного перечня выберите два вещества с атомной кристаллической решеткой.
- 1. Cl2
- 2. B
- 3. Cu
- 4. Si
- 5. P4
Запишите в поле ответа номера выбранных соединений.
Решение
Из предложенного перечня выберите два вещества, в молекулах которых есть одна тройная связь.
- 1. HCOOH
- 2. HCOH
- 3. C2H4
- 4. N2
- 5. C2H2
Запишите в поле ответа номера выбранных соединений.
Решение
- Ответ: 45
- Пояснение:
- Для того, чтобы найти правильный ответ, нарисуем структурные формулы соединений из представленного списка:
Таким образом, мы видим, что тройная связь имеется в молекулах азота и ацетилена. Т.е. правильные ответы 45
- Из предложенного перечня выберите два вещества, в молекулах которых есть ковалентная неполярная связь.
- 1) Гидроксид натрия
- 2) Вода
- 3) Метанол
- 4) Этан
- 5) Пероксид водорода
- Запишите в поле ответа номера выбранных соединений.
Решение
Из предложенного перечня веществ выберите два вещества, которые имеют молекулярную кристаллическую решётку.
- 1. CO2
- 2. SiO2
- 3. NH3
- 4. NaH
- 5. PbO2
Запишите в поле ответа номера выбранных веществ.
Решение
- Из предложенного перечня веществ выберите два вещества, для каждого из которых характерно наличие водородной связи между молекулами.
- 1) формальдегид
- 2) глицерин
- 3) бензол
- 4) уксусная кислота
- 5) толуол
- Запишите в поле ответа номера выбранных веществ.
Решение
- Из предложенного перечня веществ выберите два вещества, которые имеют атомную кристаллическую решётку.
- 1) белый фосфор
- 2) сера
- 3) графит
- 4) кремний
- 5) натрий
- Запишите в поле ответа номера выбранных веществ.
Решение
Из предложенного перечня веществ выберите два соединения, в которых одна из ковалентных связей образована по донорно-акцепторному механизму.
- 1. LiOH
- 2. Li3PO4
- 3. (NH4)2HPO4
- 4. NH4F
- 5. H3PO4
Запишите в поле ответа номера выбранных веществ.
Решение
- Из предложенного перечня веществ выберите два соединения, в которых присутствует ковалентная полярная химическая связь.
- 1) оксид кремния
- 2) оксид лития
- 3) хлорид лития
- 4) силикат лития
- 5) кремний
- Запишите в поле ответа номера выбранных веществ.
Решение
Из предложенного перечня веществ выберите два вещества, в которых присутствует ионная химическая связь.
- 1. H2SO4
- 2. KNO3
- 3. PCl3
- 4. KCl
- 5. H3BO3
Запишите в поле ответа номера выбранных веществ.
Решение
- Из предложенного перечня веществ выберите два соединения, в которых присутствует ионная связь.
- 1) хлороводород
- 2) хлорид натрия
- 3) оксид серы(IV)
- 4) аммиак
- 5) оксид натрия
- Запишите в поле ответа номера выбранных соединений.
Решение
- Из предложенного перечня веществ выберите два соединения, в которых присутствует ковалентная неполярная связь.
- 1) аммиак
- 2) иод
- 3) кислород
- 4) вода
- 5) метан
- Запишите в поле ответа номера выбранных соединений.
Решение
Электроны в металлах
Какие силы удерживают атомы в металле? В химических соединениях и в кристаллах, подобных хлористому натрию, атом металла отдает электрон атому другого вещества, который стремится его приобрести. Но куда могут переходить электроны, когда все атомы — это атомы металла?
Рассмотрим два атома натрия, находящихся на близком расстоянии друг от друга. При их сближении внешние, очень слабо связанные электроны каждого атома обнаруживают наличие другого атома и один электрон может даже «перескочить» с одного атома на другой. Тогда у одного атома оказываются два внешних электрона, а у другого — ни одного.
Такая система отнюдь не устойчива, и один или даже оба электрона могут перескочить обратно к другому атому. В течение короткого промежутка времени, когда оба электрона находятся вблизи одного атома, его можно рассматривать как отрицательный ион натрия Na—, который притягивает другой, положительный ион натрия Na+.
Таким образом, между двумя атомами натрия может возникнуть слабая связь благодаря высокой подвижности их внешнего электрона.
Если к первым двум атомам натрия приблизить еще два, то уже четыре слабо связанных электрона будут «бродить» вокруг этих четырех атомов. Так как электроны отталкивают друг друга, они никогда не будут находиться у одного атома, в то время как остальные три атома будут лишены своих внешних электронов.
Однако в течение коротких промежутков времени у одного атома могут быть два внешних электрона, он будет заряжен отрицательно и станет притягивать расположенные вблизи него ионы натрия, заряженные положительно. При добавлении других атомов к этой группе станет еще труднее установить, какому именно атому принадлежит определенный электрон.
Может показаться, что в определенный период странствований электрон принадлежит какому-то одному атому (например, атому.
Электрон в своем движении редко приближается к центру атомов. Первоначально он находился на внешней орбите одного атома и изредка бывал достаточно близко от центральной части этого атома.
Электронная жидкость
Несмотря на то, что эти и другие электроны движутся в основном по траекториям, проходящим между атомами, они притягиваются находящимися поблизости положительными ионами натрия и в свою очередь сами притягивают их.
Таким образом, внешние одиночные электроны каждого иона натрия образуют совместно своего рода жидкость из отрицательных зарядов, в которую погружены положительные ионы Na+.
Эта «электрически отрицательная жидкость», притягивающая положительные ионы натрия, обусловливает целостность куска металла натрия.
Описанная «электронная жидкость» объясняет способность всех металлов легко проводить электрический ток.
Если приложить к металлу электрическое поле, присоединив к куску металла полюса электрической батареи, то быстро движущиеся электроны начнут «дрейфовать» в металле в направлении, определяемом полярностью батареи.
Электроны поступают в металл у одного полюса батареи и удаляются из него у другого. То, что металлы — хорошие проводники тепла, тоже связано с наличием в них этой «электронной жидкости», или «электронного газа», как ее называет большинство физиков.
Если нагревать с одного конца кусок металла, то электроны, составляющие «жидкость», будут двигаться несколько быстрее. Эти более быстрые электроны передают свою избыточную энергию — кинетическую энергию, обусловленную их скоростью, — другим частям куска металла, которые в результате этого нагреваются.
У этой «электронной жидкости», скрепляющей ионы металла, имеется еще одно интересное свойство. «Жидкость» связывает воедино ионы металла в жидком состоянии почти так же хорошо, как в твердом.
Она действует как своеобразная жидкая среда, в которой ионы могут двигаться или образовывать правильную кристаллическую решетку при кристаллизации металла. Сравним электронные орбиты в кристаллическом натрии и кристалле алмаза.
Натрий плавится при 97° С (чуть-чуть ниже температуры кипения воды при нормальном атмосферном давлении). Это — низкая температура по сравнению с точками плавления большинства веществ. Для разрушения кристаллов натрия и превращения их в жидкость требуется лишь немного тепла.
Однако ионы не могут высвободиться из «электронной жидкости», если не подвести значительно большее количество тепла. Чтобы натрий начал испаряться, его нужно нагреть почти до 900° С.
Электроны и их поведение
В алмазе же электроны находятся во вполне определенных связях, и на них не отражаются никакие свойства «электронной жидкости», как, например, в натрии. Чтобы расплавить алмаз, нужно подвести достаточное количество тепла для ослабления существующих в нем межатомных связей.
Эти связи настолько прочны, что для их разрушения кристалл приходится нагревать до температуры свыше 3500° С. Тогда атомы просто испаряются непосредственно из кристалла, минуя стадию образования жидкости. Широкий температурный интервал, в пределах которого сохраняется жидкое состояние, характерен для многих металлов.
Почти каждый знаком с таким жидким металлом, как ртуть.
Другие металлы, как, например, железо, вольфрам и др., имеют более высокую точку плавления.
В них целостность структуры обусловливается двумя разными способами связи — наличием «электронной жидкости», о которой мы только что говорили, и связями между отдельными атомами, как в кристаллической решетке алмаза.
Эти металлы обладают, таким образом, прочностью, основанной на жестких связях и электрических свойствах, обусловленных «электронной жидкостью». Все электроны ведут себя по-разному.
Электроны — удивительные частицы. Все они в известных конкретных условиях ведут себя по-разному. Правда, трудно отличить один электрон от другого по его массе и заряду. Однако вы никогда не сможете найти два электрона, которые одновременно находились бы в одном и том же месте и одинаково двигались в одном направлении.
Если два электрона находятся на близком расстоянии друг к другу, то они всегда движутся с различными скоростями или в разных направлениях.
Если же скорость и направление движения обоих электронов одинаковы, то они могут перемещаться по орбитам вокруг различных атомов.
(У двух электронов есть еще одна возможность вести себя по-разному: каждый электрон вращается вокруг своего центра, подобно крошечному волчку. Направление вращения такого волчка может быть различным у разных электронов).






