- Химические свойства кислот
- Взаимодействие металлов с кислотами
- Кислоты в химии — реакции, свойства и примеры
- Диссоциация
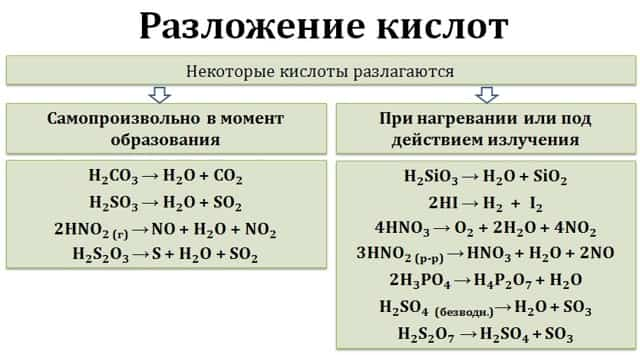
- Разложение
- Взаимодействие кислот с металлами
- Таблица: химические свойства кислот-окислителей
- Взаимодействие кислот с солями
- Взаимодействие кислот с основными и амфотерными оксидами
- Восстановительные свойства бескислородных кислот
- Способность окрашивать индикаторы
- Вопросы для самоконтроля
- Химические свойства кислот, их классификация и реакции
- Химические свойства кислот
- 1. Диссоциация
- 2. Разложение
- 3. Реакция с металлами
- 4. Реакции с основаниями
- 5. Реакции кислот с солями
- 6. Реакция кислот с основными и амфотерными оксидами
- 7. Восстановительные свойства бескислородных кислот
- Физические свойства кислот
- 2.6. Характерные химические свойства кислот
- 1) Наличие атомов кислорода в кислоте
- 2) Основность кислоты
- 3) Летучесть
- 4) Растворимость
- 5) Устойчивость
- 6) Способность к диссоциации
- 7) Окисляющие свойства
- Химические свойства кислот
- 1. Способность к диссоциации
- 2. Взаимодействие кислот с металлами
- 3. Взаимодействие кислот с основными и амфотерными оксидами
- 4. Взаимодействие кислот с основаниями и амфотерными гидроксидами
- 5. Взаимодействие кислот с солями
- 6. Специфические окислительные свойства азотной и концентрированной серной кислот
- 7. Восстановительные свойства бескислородных кислот
- Перед изучением этого раздела рекомендую прочитать следующую статью:
- Классификация неорганических веществ
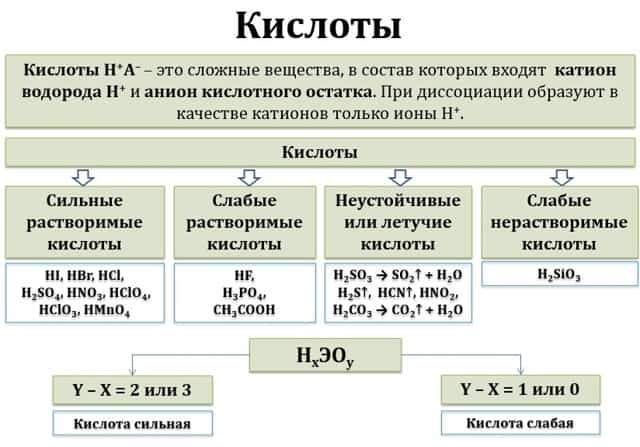
- Кислоты – сложные вещества, которые при взаимодействии с водой образуют в качестве катионов только ионы Н+ (или Н3О+).
По растворимости в воде кислоты можно поделить на растворимые и нерастворимые. Некоторые кислоты самопроизвольно разлагаются и в водном растворе практически не существуют (неустойчивые).
Подробно про классификацию кислот можно прочитать здесь.

1. Взаимодействие кислотных оксидов с водой. При этом с водой реагируют при обычных условиях только те оксиды, которым соответствует кислородсодержащая растворимая кислота.
- кислотный оксид + вода = кислота
- Например, оксид серы (VI) реагирует с водой с образованием серной кислоты:
- SO3 + H2O → H2SO4
- При этом оксид кремния (IV) с водой не реагирует:
- SiO2 + H2O ≠
2. Взаимодействие неметаллов с водородом. Таким образом получают только бескислородные кислоты.
- Неметалл + водород = бескислородная кислота
- Например, хлор реагирует с водородом:
- H20 + Cl20 → 2H+Cl—
3. Электролиз растворов солей. Как правило, для получения кислот электролизу подвергают растворы солей, образованных кислотным остатком кислородсодержащих кислот. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например, электролиз раствора сульфата меди (II):
2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
4. Кислоты образуются при взаимодействии других кислот с солями. При этом более сильная кислота вытесняет менее сильную.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
CaCO3 + H2SO4 → CaSO4 + H2O + CO2
5. Кислоты можно получить окислением оксидов, других кислот и неметаллов в водном растворе кислородом или другими окислителями.
Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
P + 5HNO3 → H3PO4 + 5NO2 + H2O
Химические свойства кислот
1. В водных растворах кислоты диссоциируют на катионы водорода Н+ и анионы кислотных остатков. При этом сильные кислоты диссоциируют почти полностью, а слабые кислоты диссоциируют частично.
- Например, соляная кислота диссоциирует почти полностью:
- HCl → H+ + Cl–
- Если говорить точнее, происходит протолиз воды, и в растворе образуются ионы гидроксония:
- HCl + H2O → H3O+ + Cl–
- Многоосновные кислоты диссоциируют cтупенчато.
- Например, сернистая кислота диссоциирует в две ступени:
- H2SO3 ↔ H+ + HSO3–
- HSO3– ↔ H+ + SO32–
2. Кислоты изменяют окраску индикатора. Водный раствор кислот окрашивает лакмус в красный цвет, метилоранж в красный цвет. Фенолфталеин не изменяет окраску в присутствии кислот.
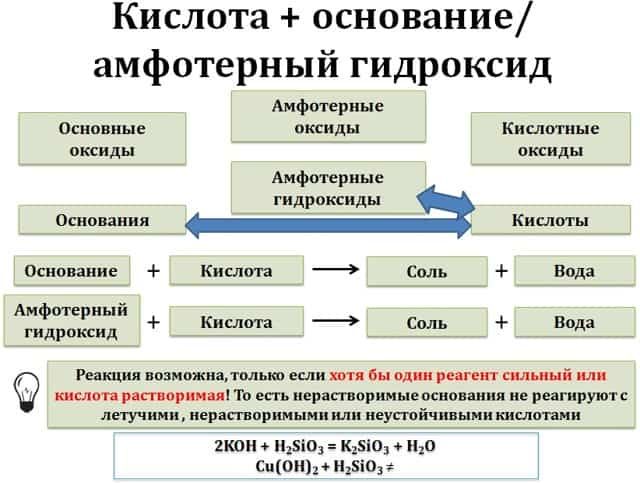
3. Кислоты реагируют с основаниями и основными оксидами.
- С нерастворимыми основаниями и соответствующими им оксидами взаимодействуют только растворимые кислоты.
- нерастворимое основание + растворимая кислота = соль + вода
- основный оксид + растворимая кислота = соль + вода
- Например, гидроксид меди (II) взаимодействует с растворимой бромоводородной кислотой:
- Cu(OH)2 + 2HBr → CuBr2 + 2H2O
- При этом гидроксид меди (II) не взаимодействует с нерастворимой кремниевой кислотой.
- Cu(OH)2 + H2SiO3 ≠
- С сильными основаниями (щелочами) и соответствующими им оксидами реагируют любые кислотами.
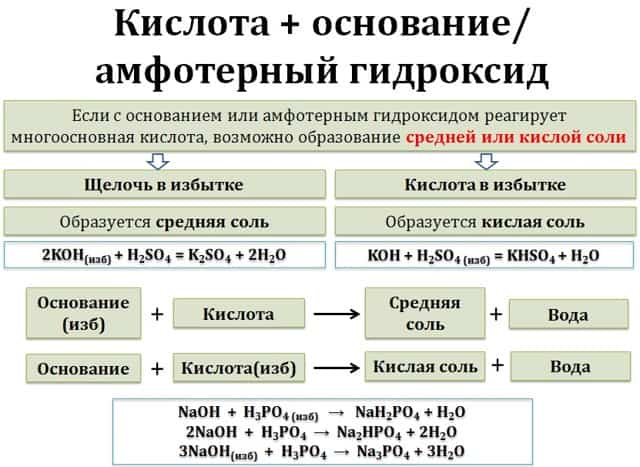
Щёлочи взаимодействуют с любыми кислотами — и сильными, и слабыми. При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации.
Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты.
В избытке щёлочи образуется средняя соль и вода:
- щёлочь(избыток)+ кислота = средняя соль + вода
- щёлочь + многоосновная кислота(избыток) = кислая соль + вода
- Например, гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
- При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
- NaOH + H3PO4 → NaH2PO4 + H2O
- При мольном соотношении количества щелочи и кислоты 1:2 образуются гидрофосфаты:
- 2NaOH + H3PO4 → Na2HPO4 + 2H2O
- В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
- 3NaOH + H3PO4 → Na3PO4 + 3H2O
4. Растворимые кислоты взаимодействуют с амфотерными оксидами и гидроксидами.
- Растворимая кислота + амфотерный оксид = соль + вода
- Растворимая кислота + амфотерный гидроксид = соль + вода
- Например, уксусная кислота взаимодействует с гидроксидом алюминия:
- 3CH3COOH + Al(OH)3 → (CH3COO)3Al + 3H2O
5. Некоторые кислоты являются сильными восстановителями. Восстановителями являются кислоты, образованные неметаллами в минимальной или промежуточной степени окисления, которые могут повысить свою степень окисления (йодоводород HI, сернистая кислота H2SO3 и др.).
Например, йодоводород можно окислить хлоридом меди (II):
4HI— + 2Cu+2 Cl2 → 4HCl + 2Cu+I + I20
6. Кислоты взаимодействуют с солями.
Кислоты реагируют с растворимыми солями только при условии, что в продуктах реакции присутствует газ, вода, осадок или другой слабый электролит. Такие реакции протекают по механизму ионного обмена.
- Кислота1 + растворимая соль1 = соль2 + кислота2/оксид + вода

- Например, соляная кислота взаимодействует с нитратом серебра в растворе:
- Ag+NO3— + H+Cl— → Ag+Cl—↓ + H+NO3—
Кислоты реагируют и с нерастворимыми солями. При этом более сильные кислоты вытесняют менее сильные кислоты из солей.
Например, карбонат кальция (соль угольной кислоты), реагирует с соляной кислотой (более сильной, чем угольная):
CaCO3 + 2HCl → CaCl2 + H2O + CO2
7. Кислоты взаимодействуют с кислыми и основными солями. При этом более сильные кислоты вытесняют менее сильные из кислых солей. Либо кислые соли реагируют с кислотами с образованием более кислых солей.
- кислая соль1 + кислота1 = средняя соль2 + кислота2/оксид + вода
- Например, гидрокарбонат калия реагирует с соляной кислотой с образованием хлорида калия, углекислого газа и воды:
- KHCO3 + HCl → KCl + CO2 + H2O
- Ещё пример: гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
- H3PO4 + K2HPO4 → 2KH2PO4
При взаимодействии основных солей с кислотами образуются средние соли. Более сильные кислоты также вытесняют менее сильные из солей.
Например, гидроксокарбонат меди (II) растворяется в серной кислоте:
2H2SO4 + (CuOH)2CO3 → 2CuSO4 + 3H2O + CO2
Основные соли могут взаимодействовать с собственными кислотами. При этом вытеснения кислоты из соли не происходит, а просто образуются более средние соли.
Например, гидроксохлорид алюминия взаимодействует с соляной кислотой:
Al(OH)Cl2 + HCl → AlCl3 + H2O
8. Кислоты взаимодействуют с металлами.
При этом протекает окислительно-восстановительная реакция. Однако минеральные кислоты и кислоты-окислители взаимодействуют по-разному.
- К минеральным кислотам относятся соляная кислота HCl, разбавленная серная кислота H2SO4, фосфорная кислота H3PO4, плавиковая кислота HF, бромоводородная HBr и йодоводородная кислоты HI и др.
- Такие кислоты взаимодействуют только с металлами, расположенными в ряду активности до водорода:

- При взаимодействии минеральных кислот с металлами образуются соль и водород:
- минеральная кислота + металл = соль + H2↑
- Например, железо взаимодействует с соляной кислотой с образованием хлорида железа (II):
- Fe + 2H+Cl → Fe+2Cl2 + H20
Кислоты-окислители (азотная кислота HNO3 любой концентрации и серная концентрированная кислота H2SO4(конц)) при взаимодействии с металлами водород не образуют, т.к.
окислителем выступает не водород, а азот или сера. Продукты восстановления азотной или серной кислот бывают различными. Определять их лучше по специальным правилам. Эти правила подробно разобраны в статье Окислительно-восстановительные реакции.
Я настоятельно рекомендую выучить их наизусть.
9. Некоторые кислоты разлагаются при нагревании.
- Угольная H2CO3, сернистая H2SO3 и азотистая HNO2 кислоты разлагаются самопроизвольно, без нагревания:
- H2CO3 → H2O + CO2
- H2SO3 → H2O + SO2
- 2HNO2 → NO + H2O + NO2
- Кремниевая H2SiO3, йодоводородная HI кислоты разлагаются при нагревании:
- H2SiO3 → H2O + SiO2
- 2HI → H2 + I2
- Азотная кислота HNO3 разлагается при нагревании или на свету:
- 4HNO3 → O2 + 2H2O + 4NO2
Взаимодействие металлов с кислотами
С разбавленными кислотами, которые проявляют
окислительные свойства за счет ионов водорода (разбавленные серная,
фосфорная, сернистая, все бескислородные и органические кислоты и др.)
реагируют металлы:
• расположенные в ряду напряжений до водорода (эти металлы способны
вытеснять водород из кислоты);
• образующие с этими кислотами растворимые соли (на поверхности этих металлов
не образуется защитная солевая пленка).
В результате реакции образуются растворимые соли и выделяется водород:
2А1 + 6НСI = 2А1С13 + ЗН2↑
Мg
+ Н2SO4 =
МgSu
+ Н2 SO4 →X(так
как Сu
стоит после Н2) разб.
РЬ + Н2
SO4 →X(так
как РЬSO4
нерастворим
в воде) разб.
Некоторые кислоты являются окислителями за счет элемента, образующего кислотный
остаток, К ним относятся концентрированная серная, а также азотная кислота
любой концентрации. Такие кислоты называют кислотами-окислителями.
Анионы
данных кислот содержат атомы серы и азота в высших степенях окисления

Окислительные свойства кислотных остатков и
значительно сильнее, чем нона водорода Н, поэтому азотная и концентрированная
серная кислоты взаимодействуют практически со всеми металлами, расположенными в
ряду напряжений как до водорода, так и после него, кроме золота и платины.
Так как окислителями в этих случаях являются ноны кислотных остатков (за
счет атомов серы и азота в высших степенях окисления), а не ноны водорода Н, то
при взаимодействии азотной, а концентрированной серной кислот с металлами
не выделяется водород.
Металл под действием данных кислот окисляется до характерной
(устойчивой) степени окисления и образует соль, а продукт восстановления
кислоты зависит от активности металла и степени разбавления кислоты

Взаимодействие серной кислоты с металлами
Разбавленная и концентрированная серные кислоты ведут
себя по-разному. Разбавленная серная кислота ведет себя, как обычная
кислота. Активные металлы, стоящие в
ряду напряжений левее водорода
Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu,
Hg, Ag, Au
вытесняют водород из разбавленной серной кислоты. Мы
видим пузырьки водорода при добавлении разбавленной серной кислоты в пробирку с
цинком.
-
H2SO4
+ Zn = Zn SO4 + H2 ↑ -
Медь стоит в ряду напряжений после водорода – поэтому
разбавленная серная кислота не действует на медь. А в концентрированной серной
кислоты, цинк и медь, ведут себя таким образом… -
Цинк, как активный металл, может образовывать с
концентрированной серной кислотой сернистый газ, элементарную серу, и даже
сероводород. -
2H2SO4 + Zn = SO2↑
+ZnSO4 + 2H2O
Медь — менее активный металл. При взаимодействии с
концентрированно серной кислотой восстанавливает ее до сернистого газа.
-
2H2SO4
конц. + Cu = SO2↑ + CuSO4 + 2H2O -
В пробирках с концентрированной серной кислотой
выделяется сернистый газа. -
Следует иметь в виду, что на схемах указаны продукты,
содержание которых максимально среди возможных продуктов восстановления кислот.
На основании
приведенных схем составим уравнения конкретных реакций — взаимодействия меди и
магния с концентрированной серной кислотой: 0 +6
+2 +4
С
u
+ 2Н2SO4
= СuSO4
+ SO2
+ 2Н2Og
+ 5Н2SO4
= 4МgSO4
+ Н2S
+ 4Н2O
Некоторые металлы (Fe.
АI, Сr)
не взаимодействуют с концентрированной серной и азотной кислотами при обычной
температуре,
так как происходит пассивации металла.
Это явление связано с образованием на поверхности металла тонкой, но очень
плотной оксидной пленки, которая и защищает металл. По этой причине азотную и концентрированную
серную кислоты транспортируют в железных емкостях.
Если металл проявляет переменные степени окисления, то с кислотами, являющимися
окислителями за счет ионов Н+, он образует соли, в которых его
степень окисления ниже устойчивой, а с кислотами-окислителями — соли, в которых
его степень окисления более устойчива: 0 +2 Fе+Н2SO4=
FеSO4+Н2
0 разб. +3
Fе+Н2SO4=
Fе2(SO4)3 + 3SO2 + 6Н2O
И.И.Новошинский
Н.С.Новошинская Химия
не забудь….) поделиться с друзьями
Кислоты в химии — реакции, свойства и примеры
Кислоты — это сложные химические вещества, состоящие из одного или нескольких атомов водорода, способных замещаться атомами металла, и кислотных остатков.
Кислоты проявляют ряд общих химических свойств: диссоциацию и разложение, взаимодействуют с металлами, основаниями, солями, основными и амфотерными оксидами. Для ряда кислот характерны специфические свойства. Все кислоты имеют определенную окраску в индикаторах.
Рассмотрим подробнее общие свойства кислот.
Диссоциация
Кислоты — это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Диссоциация кислот происходит ступенчато. По способности к диссоциации кислоты разделяют на две группы:
-
Хорошо диссоциирующие (сильные): H2SO4, HCl, HBr, HNO3, HClO4, HI.
-
Малодиссоциирующие (слабые): H2CO3, H2SO3, H2SiO3.
H2SO4 = H+ +HSO4−
HSO4− = H+ + SO42−
Разложение
В результате реакций разложения кислородсодержащих кислот образуются кислотный оксид и вода. Бескислородные кислоты образуют простые вещества. Для разложения некоторых кислот необходимо нагревание или излучение (HCl, HNO3, H3PO4) другие же разлагаются самопроизвольно в момент образования (H2CO3, H2SO3, HNO2).
H2CO3 = CO2 + H2O
2HCl = H2 + Cl2
Взаимодействие кислот с металлами
Металл может вытеснять водород из кислоты только в том случае, если металл стоит левее водорода в ряду активности металлов. Продукты реакции — соль и водород.

- Mg + 2HCl = MgCl2 + H2
- Zn + H2SO4 = ZnSO4 + Н2
- При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Высокая окислительная способность серной и азотной кислот позволяет им вступать в реакции с металлами. Продукты реакции будут зависеть от активности металла и от концентрации кислот.
Таблица: химические свойства кислот-окислителей
| HNO3(разб) | NaNO3 + NH4NO3 +H2O | Mg(NO3)2 + в зависимости от концентрации +NO2, NO, N2O, N2, NH4NO3 + H2O | Al(NO3)3 + в зависимости от разбавления кислоты N2O, NH4NO3 + H2O | Zn(NO3)2 + в зависимости от концентрации +NO2, NO, N2O, N2, NH4NO3 + H2O | Fe(NO3)3 + NO + H2O | Cu(NO3)2 + NO + H2O |
| HNO3(конц) | NaNO3 + N2O + H2O | На холоду — пассивация | На холоду — пассивация | Cu(NO3)2 + NO2 + H2O | ||
| H2SO4(разб) | Na2SO4 + H2 | MgSO4 + H2 | При нагревании Al2(SO4)3 + H2 | ZnSO4 + H2 | При нагревании FeSO4 +H2 | Реакция не проходит |
| H2SO4(конц) | Na2SO4 + H2S + H2O | MgSO4 + H2S + H2O | На холоду — пассивация | ZnSO4 + SO2 + H2O | На холоду — пассивация | CuSO4 + SO2 + H2O |
| При нагревании Al2(SO4)3 + SO2 + H2O | При нагревании ZnSO4 +H2S + H2O | При нагревании Fe2(SO4)3 + SO2 + H2O |
Кислоты реагируют с основаниями и амфотерными гидроксидами, в результате образуются соль и вода. Взаимодействие кислот с основаниями называют реакцией нейтрализации.
NaOH + HCl = NaCl + H2O
Fe(OH)2 + 2HBr → FeBr2 + 2H2O
Взаимодействие кислот с солями
Сильные кислоты вытесняют слабые из растворов их солей, при этом образуются новая соль и новая кислота. Условие протекания реакции кислот с солями — одним из продуктов реакции должны быть нерастворимая соль или слабая кислота, вода, газ.
H2SO4 + BaCl2 = BaSO4↓ + HCl
HCl + CaCO3 = CaCl2 + H2O + CO2
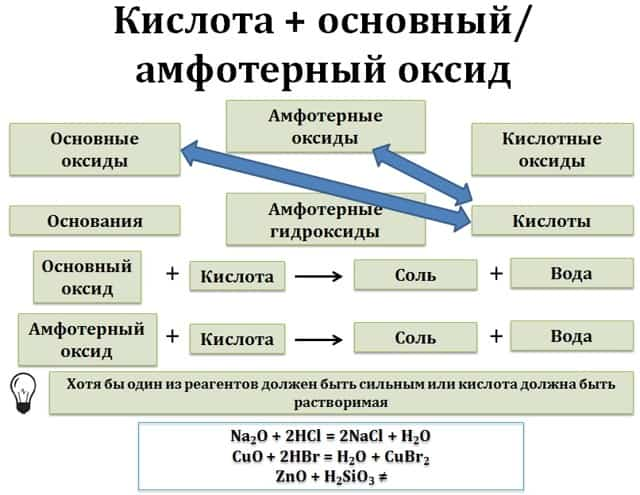
Взаимодействие кислот с основными и амфотерными оксидами
Кислоты вступают в реакцию с основными и амфотерными оксидами (последние ведут себя как основные оксиды). В результате реакции образуется соль и вода.
ZnO + H2SO4 → ZnSO4 + H2O
2HCl + MgO = MgCl2 + H2O
Восстановительные свойства бескислородных кислот
- Бескислородные кислоты (кроме HF) проявляют восстановительные свойства за счет химического элемента, который входит в состав аниона, при действии на них различных окислителей.
- Например, в качестве окислителей для всех галогеноводородных кислот выступают диоксид марганца MnO2, перманганат калия KMnO4, дихромат калия K2Cr2O7.
- Результат этих реакций — образование свободных галогенов.
- 4HCl + MnO2 =MnCl2 + Cl2 + 2H2O
- 14HBr + K2Cr2O7 = 2CrBr3 + 3Br2 + 2KBr + 7H2O
- 16HI + 2KMnO4 = 2MnI2 + 5I2 + 2KI + 8H2O
Из галогеноводородных кислот наибольшая восстановительная активность — у йодоводородной.
Ее могут окислять оксид железа (III) и соль трехвалентного железа.
- 6HI + Fe2O3 = 2FeI2 + I2 + 3H2O
- Высокая восстановительная активность характерна для сероводородной кислоты, она может быть окислена диоксидом серы.
- 2H2S + SO2 = 3S + 2H2O
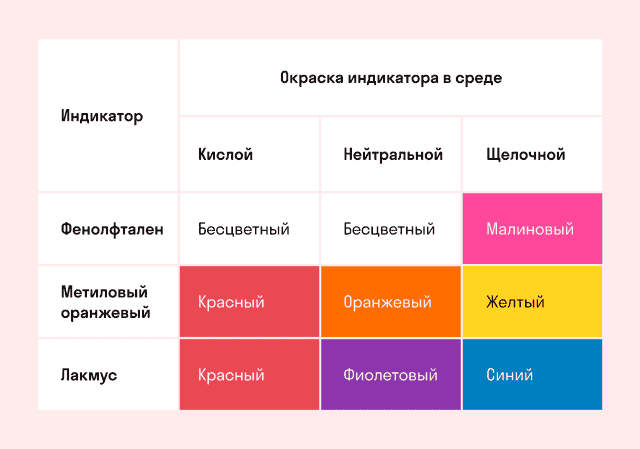
Способность окрашивать индикаторы
Индикаторы кислот — это специальные вещества, при помощи которых определяют наличие кислот в растворе.
Вопросы для самоконтроля
-
С чем реагируют кислоты?
-
При каких условиях кислоты взаимодействуют с солями? Приведите пример.
-
- Составьте уравнения реакций и назовите продукты реакций:
- Ca + HCl
- Na + H2SO4
- CaO + HNO3
- Fe2O3 + H2SO4
- KOH + HNO3
- Al(OH)3 + HF
- HNO3 + CaCO3
-
Разбавленный раствор серной кислоты реагирует с: медью, хлоридом меди, сульфатом меди, цинком?
-
- Соляная кислота вступает в реакцию с каждым из двух веществ:
- а. водой и цинком;
- б. магнием и оксидом серы (IV);
- в. железом и оксидом кальция;
г. сульфатом натрия и углеродом.
Летняя перезагрузка
Бесплатный телеграм-марафон для мам и пап. Узнайте, как провести семейное лето с пользой, и подготовьтесь к нему уже сейчас!

Химические свойства кислот, их классификация и реакции
Кислоты — класс сложных химических веществ, состоящих из атомов водорода и кислотных остатков.
В первую очередь кислоты делятся на:
- органические или карбоновые и
- неорганические или минеральные.
Свойства карбоновых кислот подробно разбираются в статье Карбоновые кислоты (ссылка на статью)
В зависимости от количества атомов водорода, которые могут замещаться в химических реакциях различают:
- одноосновные кислоты
- двухосновные кислоты
- трехосновные кислоты.
Не смотря на то, что в уксусной кислоте четыре атома водорода, три из них принадлежат кислотному остатку и в реакциях замещения не участвуют. Соответственно, уксусная кислота — одновалентная.
Свойства неорганических кислот также зависят от наличия в их составе кислорода и делятся на
- бескислородные
- кислородсодержащие.
Растворы кислот способны диссоциировать и проводить электрический ток т.е. являются электролитами. В зависимости от степени диссоциации делятся на:
- сильные
- слабые электролиты.

Химические свойства кислот
1. Диссоциация
- При диссоциации кислот образуются катионы водорода и анионы кислотного остатка.
- HNO3 → H+ + NO-3
- HCl → H+ + Cl-
- Многоосновные кислоты диссоциируют ступенчато.
- Н3РО4 ↔ Н+ + Н2РО-4 (первая ступень)
- Н2РО-4 ↔ Н+ + НРO2-4 (вторая ступень)
- НРО2-4 ↔ Н+ + PОЗ-4 (третья ступень)
2. Разложение
- Кислородсодержащие кислоты разлагаются на оксиды и воду.
- H2CO3 → H2O + CO2↑
- Бескислородные на простые вещества
3. Реакция с металлами
Кислоты реагируют лишь с теми металлами, что стоят в ряду активности до кислорода. В результате взаимодействия образуется соль и выделяется водород.
Mg + 2HCl → MgCl2 + H2↑
Найти ряд активности можно на последней странице электронного учебника «Химия 9 класс» под редакцией В. В. Еремина.
Бдительные ученики могут сказать: «Золото стоит в ряду активности металлов после водорода, а с „царской водкой“ реагирует. Как же так?»
Из всех правил есть исключения.
Поскольку в состав азотной кислоты входит азот со степенью окисления +5, а в состав серной — сера со степенью окисления +6, то с металлами реагируют не ионы водорода, а более сильные окислители. Образуется соль, но не происходит выделения водорода.
Au + HNO3 + 4HCl → HAuCl4 + NO + 2H2O.
4. Реакции с основаниями
В результате образуются соль и вода, происходит выделение тепла.
Na2CO3 + 2CH3 — COOH → 2CH3 — COONa + H2O + CO2↑.
Реакции такого типа называются реакциями нейтрализации. Простейшая реакция, которую можно провести на собственной кухне — гашение соды столовым уксусом или 9%раствором уксусной кислоты.
5. Реакции кислот с солями
Вспомним, когда мы разбирали ионные уравнения ( ссылка на статью), одним из условий протекания реакций было образование в ходе взаимодействия нерастворимой соли, выделение летучего газа или слабо диссоциирующего вещества — например, воды. Те же условия сохраняются и для реакций кислот с солями.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl↑
6. Реакция кислот с основными и амфотерными оксидами
В ходе реакции образуется соль и происходит выделение воды.
K2O + 2HNO3 → 2KNO3 + H2O
7. Восстановительные свойства бескислородных кислот
Если в окислительных реакциях первую скрипку играет водород, то в восстановительных реакциях основная роль принадлежит анионному остатку. В результате реакций образуются свободные галогены.
4HCl + MnO2 → MnCl2 + Cl2↑ + 2H2O
Физические свойства кислот
При нормальных условиях (Атмосферное давление = 760 мм рт. ст. Температура воздуха 273,15 K = 0°C) кислоты чаще жидкости, хотя встречаются и твердые вещества: например ортофосфорная H3PO4 или кремниевая H2SiO3.
- Некоторые кислоты представляют собой растворы газов в воде: фтороводородная-HF, соляная-HCl, бромоводородная-HBr.
- Кислотные свойства кислот в ряду HF → HCl → HBr → HI усиливаются.
- Для некоторых кислот (соляная, серная, уксусная) характерен специфический запах.
- Благодаря наличию ионов водорода в составе, кислоты обладают характерным кислым вкусом.
- Химическая лаборатория не ресторан, и в целях безопасности существует жесткий запрет на опробование на вкус химических веществ.
- Как же можно определить кислота в пробирке или нет?
В 1300 году был открыт лакмус, и с тех пор алхимикам и химикам не пришлось рисковать своим здоровьем, пробуя на вкус содержимое пробирок. Запомните, что лакмус в кислой среде краснеет.
Вторым широко используемым индикатором является фенолфталеин.
Простой мнемонический стишок поможет запомнить, как ведут себя индикаторы в разных средах.
Индикатор лакмус — красный Кислоту укажет ясно. Индикатор лакмус — синий, Щёлочь здесь — не будь разиней, Когда ж нейтральная среда, Он фиолетовый всегда. Фенолфталеиновый — в щелочах малиновый
Но несмотря на это в кислотах он без цвета.
Что ещё почитать? Неметаллы Биография Д.И. Менделеева. Интересные факты из жизни великого химика Карбоновые кислоты Массовая доля вещества
18HBr + 2KMnO4 →2KBr + 2MnBr2 + 8H2O + 5Br2
14НI + K2Cr2O7 →3I2↓ + 2Crl3 + 2KI + 7H2O
#ADVERTISING_INSERT#
2.6. Характерные химические свойства кислот
Кислоты можно классифицировать исходя из разных критериев:
1) Наличие атомов кислорода в кислоте
| Кислородсодержащие | Бескислородные |
| H3PO4,HNO3,HNO2,H2SO4,H3PO4,H2CO3,H2CO3, HClO4 все органические кислоты (HCOOH, CH3COOH и т.д.) | HF, HCl, HBr, HI, H2S |
2) Основность кислоты
Основностью кислоты называют число «подвижных» атомов водорода в ее молекуле, способных при диссоциации отщепляться от молекулы кислоты в виде катионов водорода H+, а также замещаться на атомы металла:
| одноосновные | двухосновные | трехосновные |
| HBr, HCl, HNO3, HNO2, HCOOH, CH3COOH | H2SO4, H2SO3, H2CO3, H2SiO3 | H3PO4 |
3) Летучесть
Кислоты обладают различной способностью улетучиваться из водных растворов.
| Летучие | Нелетучие |
| H2S, HCl, CH3COOH, HCOOH | H3PO4, H2SO4, высшие карбоновые кислоты |
4) Растворимость
| Растворимые | Нерастворимые |
| HF, HCl, HBr, HI, H2S, H2SO3, H2SO4, HNO3, HNO2, H3PO4, H2CO3, CH3COOH, HCOOH | H2SiO3, высшие карбоновые кислоты |
5) Устойчивость
| Устойчивые | Неустойчивые |
| H2SO4, H3PO4, HCl, HBr, HF | H2CO3, H2SO3 |
6) Способность к диссоциации
| хорошо диссоциирующие (сильные) | малодиссоциирующие (слабые) |
| H2SO4, HCl, HBr, HI, HNO3, HClO4 | H2CO3, H2SO3, H2SiO3 |
7) Окисляющие свойства
| слабые окислители (проявляют окислительные свойства за счет катионов водорода H+) | сильные окислители (проявляют окислительные свойства за счет кислотообразующего элемента) |
| практически все кислоты кроме HNO3 и H2SO4 (конц.) | HNO3 любой концентрации, H2SO4 (обязательно концентрированная) |
Химические свойства кислот
1. Способность к диссоциации
- либо в таком виде: HCl = H+ + Cl—
- либо в таком: HCl → H+ + Cl—
- По сути направление стрелки говорит нам о том, что обратный процесс объединения катионов водорода с кислотными остатками (ассоциация) у сильных кислот практически не протекает.
- В случае, если мы захотим написать уравнение диссоциации слабой одноосновной кислоты, мы должны использовать в уравнении вместо знака две стрелки . Такой знак отражает обратимость диссоциации слабых кислот — в их случае сильно выражен обратный процесс объединения катионов водорода с кислотными остатками:
- CH3COOH CH3COO— + H+
Многоосновные кислоты диссоциируют ступенчато, т.е. катионы водорода от их молекул отрываются не одновременно, а по очереди. По этой причине диссоциация таких кислот выражается не одним, а несколькими уравнениями, количество которых равно основности кислоты. Например, диссоциация трехосновной фосфорной кислоты протекает в три ступени с поочередным отрывом катионов H+ :
- H3PO4 H+ + H2PO4—
- H2PO4— H+ + HPO42-
- HPO42- H+ + PO43-
Следует отметить, что каждая следующая ступень диссоциации протекает в меньшей степени, чем предыдущая. То есть, молекулы H3PO4 диссоциируют лучше (в большей степени), чем ионы H2PO4— , которые, в свою очередь, диссоциируют лучше, чем ионы HPO42-. Связано такое явление с увеличением заряда кислотных остатков, вследствие чего возрастает прочность связи между ними и положительными ионами H+.
Из многоосновных кислот исключением является серная кислота. Поскольку данная кислота хорошо диссоциирует по обоим ступеням, допустимо записывать уравнение ее диссоциации в одну стадию:
H2SO4 2H+ + SO42-
2. Взаимодействие кислот с металлами
Седьмым пунктом в классификации кислот мы указали их окислительные свойства. Было указано, что кислоты бывают слабыми окислителями и сильными окислителями. Подавляющее большинство кислот (практически все кроме H2SO4(конц.
) и HNO3) являются слабыми окислителями, так как могут проявлять свою окисляющую способность только за счет катионов водорода.
Такие кислоты могут окислить из металлов только те, которые находятся в ряду активности левее водорода, при этом в качестве продуктов образуется соль соответствующего металла и водород. Например:
H2SO4(разб.) + Zn ZnSO4 + H2
2HCl + Fe FeCl2 + H2
Что касается кислот-сильных окислителей, т.е. H2SO4 (конц.) и HNO3, то список металлов, на которые они действуют, намного шире, и в него входят как все металлы до водорода в ряду активности, так и практически все после.
То есть концентрированная серная кислота и азотная кислота любой концентрации, например, будут окислять даже такие малоактивные металлы, как медь, ртуть, серебро.
Более подробно взаимодействие азотной кислоты и серной концентрированной с металлами, а также некоторыми другими веществами из-за их специфичности будет рассмотрено отдельно в конце данной главы.
3. Взаимодействие кислот с основными и амфотерными оксидами
- Кислоты реагируют с основными и амфотерными оксидами. Кремниевая кислота, поскольку является нерастворимой, в реакцию с малоактивными основными оксидами и амфотерными оксидами не вступает:
- H2SO4 + ZnO ZnSO4 + H2O
- 6HNO3 + Fe2O3 2Fe(NO3)3 + 3H2O
- H2SiO3 + FeO ≠
4. Взаимодействие кислот с основаниями и амфотерными гидроксидами
HCl + NaOH H2O + NaCl
3H2SO4 + 2Al(OH)3 Al2(SO4)3 + 6H2O
5. Взаимодействие кислот с солями
- Данная реакция протекает в случае, если образуется осадок, газ либо существенно более слабая кислота, чем та, которая вступает в реакцию. Например:
- H2SO4 + Ba(NO3)2 BaSO4↓ + 2HNO3
- CH3COOH + Na2SO3 CH3COONa + SO2↑ + H2O
- HCOONa + HCl HCOOH + NaCl
6. Специфические окислительные свойства азотной и концентрированной серной кислот
Как уже было сказано выше, азотная кислота в любой концентрации, а также серная кислота исключительно в концентрированном состоянии являются очень сильными окислителями. В частности, в отличие от остальных кислот они окисляют не только металлы, которые находятся до водорода в ряду активности, но и практически все металлы после него (кроме платины и золота).
Так, например, они способны окислить медь, серебро и ртуть.
Следует однако твердо усвоить тот факт, что ряд металлов (Fe, Cr, Al) несмотря на то, что являются довольно активными (находятся до водорода), тем не менее, не реагируют с концентрированной HNO3 и концентрированной H2SO4 без нагревания по причине явления пассивации — на поверхности таких металлов образуется защитная пленка из твердых продуктов окисления, которая не позволяет молекулами концентрированной серной и концентрированной азотной кислот проникать вглубь металла для протекания реакции. Однако, при сильном нагревании реакция все таки протекает.
В случае взаимодействия с металлами обязательными продуктами всегда являются соль соответствующего метала и используемой кислоты, а также вода. Также всегда выделяется третий продукт, формула которого зависит от многих факторов, в частности, таких, как активность металлов, а также концентрация кислот и температура проведения реакций.
Высокая окислительная способность концентрированной серной и концентрированной азотной кислот позволяет им реагировать не только практическим со всеми металлами ряда активности, но даже со многими твердыми неметаллами, в частности, с фосфором, серой, углеродом. Ниже в таблице наглядно представлены продукты взаимодействия серной и азотной кислот с металлами и неметаллами в зависимости от концентрации:
7. Восстановительные свойства бескислородных кислот
Все бескислородные кислоты (кроме HF) могут проявлять восстановительные свойства за счет химического элемента, входящего в состав аниона, при действии различных окислителей. Так, например, все галогеноводородные кислоты (кроме HF) окисляются диоксидом марганца, перманганатом калия, дихроматом калия. При этом галогенид-ионы окисляются до свободных галогенов:
- 4HCl + MnO2 MnCl2 + Cl2↑ + 2H2O
- 16HBr + 2KMnO4 2KBr + 2MnBr2 + 8H2O + 5Br2
- 14НI + K2Cr2O7 3I2↓ + 2Crl3 + 2KI + 7H2O
Среди всех галогеноводородных кислот наибольшей восстановительной активностью обладает иодоводородная кислота. В отличие от других галогеноводородных кислот ее могут окислить даже оксид и соли трехвалентного железа.
- 6HI + Fe2O3 2FeI2 + I2↓ + 3H2O
- 2HI + 2FeCl3 2FeCl2 + I2↓ + 2HCl
- Высокой восстановительной активностью обладает также и сероводородная кислота H2S. Ее может окислить даже такой окислитель, как диоксид серы:
- 2H2S + SO2 3S↓+ 2H2O






