- ХИМИЯ
- Новые слова и понятия
- Задания для самостоятельной работы
- Щелочноземельные металлы [1970 Кирюшкин Д.М., Полосин В.С. — Методика обучения химии]
- Особенности строения атомов щелочноземельных металлов
- Щелочноземельные металлы. ХАРАКТЕРИСТИКА МЕТАЛЛОВ ГЛАВНОЙ ПОДГРУППЫ II ГРУППЫ Атомы этих элементов имеют на внешнем электронном уровне два s-электрона: — презентация
- Щелочные и щелочноземельные металлы. Строение атомов. Основные кислородные водородные соединения, характерные химические свойства
>>> Перейти на мобильный размер сайта >>>
Учебник для 9 класса
ХИМИЯ
Строение и свойства атомов. Бериллий Be, магний Mg и щёлочноземельные металлы: кальций Са, стронций Sr, барий Ва и радий Ra — элементы главной подгруппы II группы (IIA группы) Периодической системы Д. И. Менделеева.
Атомы этих элементов содержат на внешнем энергетическом уровне два электрона, которые они отдают при химических взаимодействиях, и поэтому являются сильнейшими восстановителями. Во всех соединениях они имеют степень окисления +2.
С увеличением порядкового номера сверху вниз в подгруппе восстановительные свойства элементов усиливаются, что связано с увеличением радиусов их атомов.
Радий — радиоактивный элемент, содержание его в природе невелико.
Бериллий, магний и щёлочноземельные металлы — простые вещества. Лёгкие серебристо-белые металлы, стронций имеет золотистый оттенок. Он значительно твёрже бария, барий же по мягкости напоминает свинец.
На воздухе при обычной температуре поверхность бериллия и магния покрывается защитной оксидной плёнкой. Щёлочноземельные металлы взаимодействуют с кислородом воздуха более активно, поэтому их хранят под слоем керосина или в запаянных сосудах, как и щелочные металлы.
При нагревании на воздухе все рассматриваемые металлы (обозначим их М) энергично сгорают с образованием оксидов:
Реакция сжигания магния сопровождается ослепительной вспышкой, раньше её применяли при фотографировании объектов в тёмных помещениях. В настоящее время используют электрическую вспышку.
Бериллий, магний и все щёлочноземельные металлы взаимодействуют при нагревании с неметаллами — хлором, серой, азотом и т. д., образуя соответственно хлориды, сульфиды и нитриды:
При высоких температурах металлы главной подгруппы II группы (IIA группы) Периодической системы Д. И. Менделеева окисляются водородом до гидридов:
Гидриды — это твёрдые солеподобные соединения металлов с водородом, похожие на галогениды — соединения металлов с галогенами. Теперь, очевидно, вам стало понятно, почему водород находится и в главной подгруппе VII группы (VIIA группы).
Из всех металлов главной подгруппы II группы (IIA группы) Периодической системы Д. И. Менделеева только бериллий практически не взаимодействует с водой (препятствует защитная плёнка на его поверхности), магний реагирует с ней медленно, остальные металлы бурно взаимодействуют с водой при обычных условиях (рис. 54):
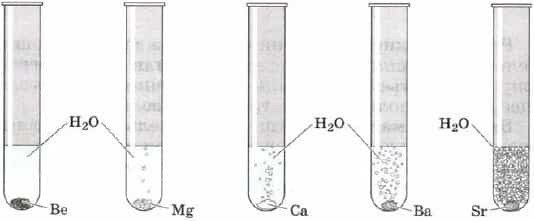
Рис. 54. Взаимодействие с водой металлов главной подгруппы II группы (IIА группы) Периодической системы Д. И. Менделеева
Подобно алюминию, магний и кальций способны восстанавливать редкие металлы — ниобий, тантал, молибден, вольфрам, титан и др. — из их оксидов, например:
Такие способы получения металлов по аналогии с алюминотермией называют магниетермией и кальциетермией.
Магний и кальций применяют для производства редких металлов и лёгких сплавов. Например, магний входит в состав дюралюминия, а кальций — один из компонентов свинцовых сплавов, необходимых для изготовления подшипников и оболочек кабелей.
Соединения бериллия, магния и щёлочноземельных металлов. В природе щёлочноземельные металлы, как и щелочные металлы, находятся только в форме соединений вследствие своей высокой химической активности.
Оксиды МО — твёрдые белые тугоплавкие вещества, устойчивые к воздействию высоких температур. Проявляют основные свойства, кроме оксида бериллия, имеющего амфотерный характер.
- Оксид магния малоактивен в реакции с водой, все остальные оксиды очень бурно взаимодействуют с ней:
- МО + Н2O = М(ОН)2.
- Оксиды получают обжигом карбонатов:
- МСO3 = МО + СO2↑.
В технике оксид кальция СаО называют негашёной известью, a MgO — жжёной магнезией. Оба этих оксида используют в производстве строительных материалов.
Лабораторный опыт № 15
Получение гидроксида кальция и исследование его свойств
| Небольшой кусочек или немного порошка оксида кальция поместите в стаканчик, прилейте в 5 раз больше воды. Размешайте содержимое с помощью стеклянной палочки и дайте постоять 2—3 мин. Отфильтруйте по 1—2 мл содержимого стаканчика в две пробирки. С помощью стеклянной трубочки осторожно продувайте выдыхаемый воздух через раствор в 1-й пробирке. Что наблюдаете? Как называется реакция? Запишите уравнение. К раствору во 2-й пробирке добавьте 2—3 капли спиртового раствора фенолфталеина. Что наблюдаете? Что можно утверждать на основании опыта о растворимости гидроксида кальция? |
- Гидроксиды щёлочноземельных металлов относятся к щелочам. Их растворимость в воде увеличивается в ряду
- Са(ОН)2 → Sr(OH)2 → Ва(ОН)2.
- Эти гидроксиды получают взаимодействием соответствующего оксида с водой.
- Реакция оксида кальция с водой сопровождается выделением большого количества теплоты и называется гашением извести (рис. 55), а образующийся Са(ОН)2 — гашёной известью:
- СаО + Н2O = Са(ОН)2.
Рис. 55. Гашение извести
Прозрачный раствор гидроксида кальция называют известковой водой, а белую взвесь Са(ОН)2 в воде — известковым молоком. Гашёную известь широко используют в строительстве. Известковое молоко применяют в сахарной промышленности для очистки свекловичного сока.
Соли бериллия, магния и щёлочноземельных металлов получают взаимодействием их с кислотами. Галогениды (фториды, хлориды, бромиды и иодиды) этих металлов — белые кристаллические вещества, большинство из них растворимо в воде.
Из сульфатов хорошо растворимы в воде только сульфаты бериллия и магния. Растворимость сульфатов элементов главной подгруппы II группы Периодической системы Д. И. Менделеева уменьшается от BeSO4 к BaSO4.
Карбонаты этих металлов малорастворимы или нерастворимы в воде.
Сульфиды щёлочноземельных металлов, содержащие в малых количествах примеси тяжёлых металлов, после предварительного освещения начинают светиться различными цветами — красным, оранжевым, голубым, зелёным. Они входят в состав специальных светящихся красок, которые называют фосфорами. Их используют для изготовления светящихся дорожных знаков, циферблатов часов и других изделий.
Рассмотрим наиболее важные соединения элементов главной подгруппы II группы (IIA группы) Периодической системы Д. И. Менделеева.
СаСО3 — карбонат кальция — одно из самых распространённых на Земле соединений. Вам хорошо известны такие содержащие его минералы, как мел, мрамор, известняк (рис. 56).
Рис. 56. Природные соединения кальция: а — мел; б — мрамор; в — известняк; г — кальцит
Мрамор — это минерал скульпторов, архитекторов и облицовщиков. Из него создавали свои прекрасные творения многие скульпторы (рис. 57).
Рис. 57. Скульптура М. М. Антокольского «Царь Иоанн Васильевич Грозный» изготовлена из мрамора
Стены всемирно известного индийского мавзолея Тадж-Махал выложены из мрамора (рис. 58), им же облицованы многие станции московского метро (рис. 59).
Рис. 58. Тадж-Махал — мавзолей-мечеть, находящийся в Агре (Индия), выполнен из мрамора
Рис. 59. Станция московского метрополитена «Трубная» отделана мрамором
Однако самый важный из этих минералов — известняк, без которого не обходится ни одно строительство. Во-первых, он сам является прекрасным строительным камнем (вспомните знаменитые одесские катакомбы — бывшие каменоломни, в которых добывали камень для строительства города), во-вторых, это сырьё для получения других материалов: цемента, гашёной и негашёной извести, стекла и др.
Известковой щебёнкой укрепляют дороги, а порошком уменьшают кислотность почв.
Природный мел представляет собой остатки раковин древних животных. Один из примеров его использования — это школьные мелки, зубные пасты. Мел применяют в производстве бумаги, резины, побелки.
MgCO2 — карбонат магния, необходим в производстве стекла, цемента, кирпича, а также в металлургии для перевода пустой породы, т. е. не содержащей соединения металла, в шлак.
CaSO4 — сульфат кальция, встречается в природе в виде минерала гипса CaSO4 • 2Н2O, представляющего собой кристаллогидрат. Используют в строительстве, в медицине для наложения фиксирующих гипсовых повязок, получения слепков (рис. 60). Для этого применяют полуводный гипс 2CaSO4 • Н2O — алебастр, который при взаимодействии с водой образует двуводный гипс:
- 2CaSO4 • Н2O + ЗН2O = 2(CaSO4 • 2Н2O).
- Эта реакция идёт с выделением теплоты.
Рис. 60. Гипс применяется:
в медицине для изготовления гипсовых повязок (1), искусственных облицовочных и отделочных камней (2), в строительстве для изготовления скульптур и скульптурных элементов (3), гипсокартона (4)
MgSO4 — сульфат магния, известный под названием горькая, или английская, соль, используют в медицине в качестве слабительного средства. Содержится в морской воде и придаёт ей горький вкус.
BaSO4 — сульфат бария, благодаря нерастворимости и способности задерживать рентгеновские лучи применяют в рентгенодиагностике («баритовая каша») для диагностики заболеваний желудочно-кишечного тракта (рис. 61).
Рис. 61. «Баритовую кашу» используют в медицине для рентгенодиагностики
Са3(РO4)2 — фосфат кальция, входит в состав фосфоритов (горная порода) и апатитов (минерал), а также в состав костей и зубов. В организме взрослого человека содержится более 1 кг кальция в виде соединения Са3(РO4)2.
Кальций имеет важное значение для живых организмов, это материал для постройки костного скелета. Он играет существенную роль в процессах жизнедеятельности: ионы кальция необходимы для работы сердца, участвуют в процессах свёртывания крови.
На долю кальция приходится более 1,5% массы тела человека, 98% кальция содержится в костях. Однако кальций необходим не только при формировании скелета, но и для работы нервной системы.
Человек должен получать в день 1,5 г кальция. Наибольшие количества кальция содержатся в сыре, твороге, петрушке, салате.
Магний также является необходимым биоэлементом, играя роль стимулятора обмена веществ, содержится в печени, костях, крови, нервной ткани и мозге.
Магния в человеческом организме намного меньше, чем кальция, — всего около 40 г. Магний входит в состав хлорофилла, а следовательно, участвует в процессах фотосинтеза.
Без хлорофилла не было бы жизни, а без магния — хлорофилла, ведь в нём содержится 2% этого элемента.
Соли щёлочноземельных металлов окрашивают пламя в яркие цвета, поэтому эти соединения добавляют в составы для фейерверков (рис. 62).
Рис. 62. Соли щёлочноземельных металлов добавляют в составы для фейерверков
Открытие магния и кальция. Магний был впервые получен Г. Дэви в 1808 г. из белой магнезии — минерала, найденного близ греческого города Магнезия. По названию минерала и дали название простому веществу и химическому элементу.
Полученный Г. Дэви металл был загрязнён примесями, а чистый магний получил француз А. Бюсси в 1829 г.
Кальций был впервые получен также Г. Дэви в 1808 г. Название элемента происходит от латинского слова кальс, что означает «известь, мягкий камень».
Новые слова и понятия
- Строение атомов бериллия и магния, щёлочноземельных металлов.
- Химические свойства бериллия, магния и щёлочноземельных металлов: образование оксидов, хлоридов, сульфидов, нитридов, гидридов и гидроксидов.
- Магниетермия и кальциетермия.
- Оксиды кальция (негашёная известь) и магния (жжёная магнезия). 5. Гидроксиды кальция (гашёная известь, известковая вода, известковое молоко) и других щёлочноземельных металлов.
- Соли: карбонаты кальция (мел, мрамор, известняк) и магния; сульфаты (гипс, горькая соль, «баритовая каша»); фосфаты.
Задания для самостоятельной работы
- Массовая доля костей человека составляет 20% от общей массы организма. На долю фосфата кальция, входящего в состав костей, приходится также 20% от массы костей. Зная массу своего тела, рассчитайте, сколько килограммов фосфата кальция содержится в вашем организме.
Сколько килограммов кальция содержится в нём?
- Вспомните из курса анатомии, что такое гемофилия.
Почему гемофиликам вводят при кровотечениях раствор хлорида кальция?
- Вычислите количество вещества гашёной извести, которое может быть получено из 2 т известняка, содержащего 25% примесей.
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Какие металлы главной подгруппы II группы (IIA группы) Периодической системы Д. И. Менделеева могут быть использованы для этих превращений, а какие — нет? Почему?
- Напишите уравнения реакций для осуществления превращений:
Уравнение последней реакции запишите также в ионной форме.
- Используя в качестве примера приведённое в предыдущем параграфе сочинение ученицы, напишите своё сочинение о химическом веществе или процессе, посвящённое химии щёлочноземельных металлов.
- Почему в медицине для гипсовых повязок используют не гипс CaSO4 • 2Н2O, а алебастр 2CaSO4 • Н2O? Какой процесс происходит при наложении такой повязки?
Щелочноземельные металлы [1970 Кирюшкин Д.М., Полосин В.С. — Методика обучения химии]
Новости Библиотека Таблица эл-тов Биографии Карта сайтов Ссылки О сайте
К числу основных учебно-воспитательных задач преподавания «по данной теме относятся следующие:
1. Более подробно ознакомить учащихся с группой типичных металлов, в которой наиболее ярко выявляются закономерности в изменении свойств и электронной структуры в зависимости от порядкового номера элемента.
2. Научить учащихся пользоваться периодической системой и электронной теорией при изучении химии.
3. Повторить и углубить основы теории электролитической диссоциации.
В программе предусмотрено подробно изучить одного представителя этой группы — кальций и дать некоторые сведения о магнии. Для составления же характеристики группы можно обобщить краткие сведения о строении атомов и свойствах пяти металлов этой группы. При этом можно воспользоваться следующей таблицей:
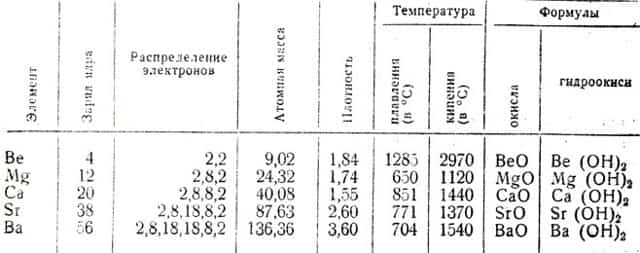 Таблица 19. Свойства элементов главной подгруппы второй группы
Таблица 19. Свойства элементов главной подгруппы второй группы
Следуя общей схеме ознакомления с химическими элементами, можно рассмотреть положение кальция и магния в периодической системе, строение их атомов, некоторые физические и химические свойства, а также свойства из окислов, и гидроокисей.
При этом следует сравнивать строение атомов и свойства щелочных и щелочноземельных металлов, находящихся в одном, к том же ряду периодической системы.
Сравнив строение, атомов натрия и магния, калия и кальция, учитель отмечает увеличение числа валентных электронов у атомов щелочноземельных металлов и усиление прочности связи электронов с ядрами атомов, что должно привести к ослаблению химической активности их атомов в отношении к ионам водорода.
Для проверки этих предположений можно показать опыт — действие на воду натрия и магния или калия и кальция. Чтобы показать увеличение химической активности в группе щелочноземельных металлов по мере увеличения их атомных масс, нужно сравнить скорость реакции магния и кальция с водой.
На основе этих сравнений учащиеся должны убедиться в правильности сделанных ими предположений о том, что с увеличением числа валентных электронов химическая активность металлов, находящихся в одном и том же ряду, уменьшается и что с увеличением числа электронных слоев, атомной массы (атомного номера) активность металлов в одной и той же группе увеличивается.
После этого можно сравнить состав и свойства гидроокисей натрия и магния, калия и кальция и сообщить, что едкие щелочи являются более сильными основаниями, чем гидроокиси щелочноземельных металлов. Сила оснований щелочноземельных металлов увеличивается по мере возрастания атомной массы (или порядкового номера) в этой подгруппе II группы элементов периодической системы.
Важнейшие соединения кальция. Вследствие того что вещества, содержащие кальций, уже изучались в предыдущих классах, урок на эту тему должен быть проведен как повторение. Учащиеся в порядке домашней работы должны подготовиться и на уроке ответить на следующие вопросы:
1. Состав и свойства окиси и гидроокиси кальция.
2. Карбонаты и бикарбонаты кальция, их термическая нестойкость и растворимость в воде.
3. Соли кальция в природе.
4. Производство извести.
При рассмотрении схемы известково-обжигательной печи и процесса обжига известняка следует обратить внимание на непрерывность этого процесса, применение принципа противотока в движении твердых веществ и горячих газов, на возможность использования газообразных продуктов этого производства.
Жесткость воды и способы ее устранения. Учебные задачи этого задания состоят в ознакомлении учащихся с причинами жесткости воды и со способами ее устранения. В водной части к уроку следует напомнить о примесях, растворимых в речной и особенно в колодезной воде, и отметить нахождение ионов кальция и магния в жесткой воде.
Чтобы показать характерные признаки жесткой воды, можно предложить учащимся прилить мыльный раствор к воде, не содержащей ионов кальция и магния, а затем добавить туда же раствор, содержащий ионы их. Выпадение осадка нужно объяснить образованием нерастворимых солей стеариновой кислоты и этих металлов.
Учащимся сообщалось еще в VII классе, что при нейтрализации стеариновой кислоты едким натром получается стеарат натрия, который был назван мылом. Учащиеся могут написать уравнения реакций обмена между стеаратом натрия и растворами солей кальция и магния.
Ознакомившись с тем, что стеараты кальция и магния нерастворимы в воде, учащиеся поймут, почему жесткая вода непригодна для стирки белья, а также и в тех производствах, где используется мыло. Затем следует сообщить, из чего и как образуется накипь в паровых котлах и какие от этого ущербы производству.
Таким образом учащиеся убеждаются в том, что смягчение воды имеет большое хозяйственное значение. При ознакомлении со способами смягчения воды сначала рассматривается способ устранения так называемой временной жесткости, обусловленной наличием бикарбоната кальция в воде.
Учащимся уже известна малая стойкость этой соли и условия перехода ее в карбонат.
Поэтому им нетрудно понять, на чем основано устранение временной жесткости, — предварительный нагрев в особых котлах и добавление извести к жесткой воде для перевода бикарбоната кальция в карбонат:
Са(НСО3)2+Са(ОН)2=2СаСО3+2Н2О
И в этом и в другом случае ионы кальция уходят из раствора в осадок в составе карбоната кальция.
Для устранения постоянной жесткости, обусловленной присутствием в растворе сульфатов и хлоридов кальция и магния, следует показать взаимодействие концентрированных растворов этих солей с раствором соды. Наблюдая выпадение осадка, учащиеся должны прийти к выводу, что растворимость карбоната кальция меньше, чем сульфата кальция. На этом основании они могут записать уравнение следующей реакции:
CaSО4+Na2CО3=CaCО3+Na2SО4
Таким образом учащиеся познакомятся с реакциями, применяемыми в содово-известковом способе смягчения воды, наиболее широко распространенном в парокотельных установках. Желательно провести экскурсию на предприятие, где осуществляется такой способ устранения жесткости воды.
В заключение можно предложить учащимся провести лабораторный опыт приготовления воды с постоянной жесткостью и устранения ее.
В настоящее время широко применяется устранение жесткости при помощи катионитов, которые являются сложными соединениями (алюмосиликаты или высокомолекулярные органические соединения), поэтому на данном этапе обучения учитель не может вдаваться в подробности, рассказывая о составе и. строении этих веществ. Дается только общая формула катионитов Na2R, где R — сложный кислотный остаток.
Если пропустить через него жесткую воду, то в нем ионы натрия замещаются на ионы магния или кальция, и вода смягчается. Удобство использования такого способа умягчения воды заключается в том, что после пропускания раствора поваренной соли использованный катионит регенерируется (в нем ионы кальция или магния замещаются на ионы натрия, и его можно снова использовать для устранения жесткости воды).
Особенности строения атомов щелочноземельных металлов
На внешнем электронном уровне элементов второй главной группы находятся два s-электрона. В возбужденном состоянии происходит их «распаривание» и поэтому для них характерна валентность ІІ.
У них маленькая энергия ионизации и низкая ЭО, степень окисления постоянная: +2.
В ряду Ве-Ва увеличиваются атомные и ионные радиусы, уменьшаются потенциалы ионизации, закономерно усиливаются основные и восстановительные свойства.
Особенности физических свойств щелочноземельных металлов
Все простые вещества этой подгруппы являются металлами и имеют серебристо белый цвет. Эти металлы называют щелочноземельными, т.к. они образуют малорастворимые оксиды (земли), которые при смачивании водой дают щелочную среду.
Температуры плавления у них выше, чем у щелочных металлов, потому что более прочная металлическая связь. Но все они, кроме Ве, легкоплавкие. Нарушения в ряду изменения свойств связаны с неодинаковым кристаллическим строением вещества (низкая плотность Са).
Все щелочноземельные металлы легкие. Магний достаточно мягкий металл, кальций более твердый.
Особенности химических свойствщелочноземельных металлов
При н.у. на поверхности магния обычно образуется тонкая, но прочная окисная пленка. Магний горит в кислороде, и даже в углекислом газе.
Mg + CO2 → MgO + CO
Кальций на воздухе при н.у. легко окисляется, а при нагревании загорается (пламя красного цвета); его хранят под слоем керосина.
Эти металлы окисляются так же галогенами, серой, азотом и др. неметаллами.
Магний медленно растворяется в холодной воде, и бурно реагирует с перегретым водяным паром.
Mg + H2O → Mg(OH)2 + H2
Кальций реагирует с водой достаточно активно и при н.у.
Все щелочноземельные металлы растворяются в растворах кислот, вытесняя из кислот водород.
Нахождение в природещелочноземельных металлов
Кальций относится к наиболее распространенным в природе элементам (3,4% по массе). Встречается только в виде соединений. Очень распространены силикаты и алюмосиликаты кальция.
Кроме них промышленное значение имеет кальцит (карбонат кальция), более известный нам под именами известняк, мрамор, мел.
Встречается часто также гипс CaSO4∙2H2O, флюорит CaF2, апатиты (смесь фосфатов и галогенидов кальция).
Магний чаще всего встречается в виде доломита (MgCO3∙CaCO3), и магнезита (MgCO3), а так жев виде сульфата и хлорида, которые содержаться в морской воде и сообщают ей горький вкус. Природные силикаты магния – тальк (3MgO∙4SiO2∙H2O) и асбест (CaO∙3MgO∙4SiO2).
Получениещелочноземельных металлов
Магнийполучаютизморскойводы. Его ионыосаждают в виде гидроксида, затем превращают в хлорид и восстанавливают электролизом расплава. Кальций тоже обычно получают электролизом хлорида, который получают из различных природных нерастворимых минералов кальция.
Применениещелочноземельных металлов
Кальций используют при производстве сталей и тугоплавких металлов (титан, цирконий) — как восстановитель.
Магний входит в состав многих сплавов (дюраль, электрон). Входит в составы для осветительных ракет и пиротехнические смеси. Магнийорганические соединения широко используются как катализаторы в органическом синтезе.
15. Роль кальция и магния в организме и применение их соединений в медицине.Магний и кальций относятся к важнейшим макроэлементам, входящим в состав организма человека.
Магний– содержание в организме 0,04%, суточная потребность 10 мг на 1 кг. В организме большая часть находится в виде ионов во внеклеточной жидкости, и, в зависимости от концентрации, обеспечивает или блокирует нервно-мышечную передачу, работу дыхательного, сосудодвигательного центров.
Часть ионов магния находится в клетках в виде комплексных соединений с белками. В таком виде магний входит в состав многих ферментных систем или является их активатором (холинэстераза, карбоксипептидаза).
Магний тормозит выделение ацетилхолина, способствует выделению холестерина, стимулирует перистальтику кишечника и желчевыделение, влияет на углеводно-фосфорный обмен и синтез белка.
В медицине используют: растворы сульфата магния – при судорогах, гипертонической болезни, для обезболивания родов; горькая соль (MgSO4∙7H2O) дает желчегонный, слабительный и мочегонный эффект; белая глина (смесь силикатов магния, кальция и аммония) имеет обволакивающее, адсорбирующее, подсушивающее действие, входит в состав паст, присыпок, таблеток и т.д. Жженая магнезия (оксид магния), и белая магнезия (смесь карбоната и гидрокарбоната магния используется для снижения кислотности в желудке. Природный силикат магния (тальк) не смачивается водой, используется как наполнитель и адсорбент в пудрах и присыпках в косметике и медицине.
Кальций – содержание в организме 1,4%, суточная потребность 0,8-0,9 г. Поступает с пищей в значительном количестве, но его усвоение регулируется гормонами паращитовидной железы и витамином D, работой почек и печени.
Поэтому даже при избытке кальция в пище может наблюдаться недостаток его в организме. Кальций ходит в состав костей в составе фосфата кальция, определяя их твердость и рост. Ионы кальция принимают участие в передаче нервных импульсов и сокращении мышц, понижая возбуждение нервной системы.
Кальций участвует в процессе свертывания крови. Он входит в состав некоторых ферментных систем, например, способствует выделению ацетилхолина. Ионы кальция влияют на кислотно-щелочное равновесие; оказывают противовоспалительное и десенсибилизирующее действие.
В медицине используют: хлорид кальция – он уменьшает проницаемость сосудов, имеет противоаллергическое и противовоспалительное действие; карбонат кальция (мел) – имеет антрацитное и адсорбирующее действие, принимают внутрь при заболеваниях ЖКТ, наружно – в качестве присыпки и зубной пасты).
Обезвоженный сульфат кальция (2CaSO4∙H2O) называют жженым гипсом или алебастром. Его используют для гипсовых повязок в медицине и для изготовления различных отливочных форм и слепков.
Щелочноземельные металлы. ХАРАКТЕРИСТИКА МЕТАЛЛОВ ГЛАВНОЙ ПОДГРУППЫ II ГРУППЫ Атомы этих элементов имеют на внешнем электронном уровне два s-электрона: — презентация
1 Щелочноземельные металлы
2 ХАРАКТЕРИСТИКА МЕТАЛЛОВ ГЛАВНОЙ ПОДГРУППЫ II ГРУППЫ Атомы этих элементов имеют на внешнем электронном уровне два s-электрона: ns 2. В реакциях атомы элементов подгруппы легко отдают оба электрона внешнего энергетического уровня и образуют соединения, в которых степень окисления элемента равна +2.
3 ФИЗИЧЕСКИЕ СВОЙСТВА Бериллий, магний, кальций, барий и радий — металлы серебристо- белого цвета. Стронций имеет золотистый цвет. Эти металлы легкие, особенно низкие плотности имеют кальций, магний, бериллий. Радий является радиоактивным химическим элементом.
4 ХИМИЧЕСКИЕ СВОЙСТВА Щелочноземельные элементы — химически активные металлы. Они являются сильными восстановителями. Из металлов этой подгруппы несколько менее активен бериллий, что обусловлено образованием на поверхности этого металла защитной оксидной пленки. кальций магний бериллий
5 ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИ Все легко взаимодействуют с кислородом и серой, образуя оксиды и сульфиды: 2Be + O 2 = 2BeO Ca + S = CaS Бериллий и магний реагируют с кислородом и серой при нагревании, остальные металлы — при обычных условиях.
Все металлы этой группы легко реагируют с галогенами: Mg + Cl 2 = MgCl 2 При нагревании все реагируют с водородом, азотом, углеродом, кремнием и другими неметаллами: Ca + H 2 = CaH 2 (гидрид кальция) 3Mg + N 2 = Mg 3 N 2 (нитрид магния) Ca + 2C = CaC 2 (карбид кальция)
6 ВЗАИМОДЕЙСТВИЕ С КИСЛОТАМИ Все взаимодействуют с хлороводородной и разбавленной серной кислотами с выделением водорода: Be + 2HCl = BeCl 2 + H 2 Разбавленную азотную кислоту металлы восстанавливают главным образом до аммиака или нитрата аммония: 2Ca + 10HNO 3 (разб.) = 4Ca(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O В концентрированных азотной и серной кислотах (без нагревания) бериллий пассивирует, остальные металлы реагируют с этими кислотами.
7 ВЗАИМОДЕЙСТВИЕ СО ЩЕЛОЧАМИ Бериллий взаимодействует с водными растворами щелочей с образованием комплексной соли и выделением водорода: Be + 2NaOH + 2H 2 O = Na 2 [Be(OH) 4 ] + H 2 Остальные металлы II группы с щелочами не реагируют.
8 ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ ЗНАНИЙ: Осуществить цепочку превращений: Ca CaСl 2 Ca(ОН) 2 CaCl2
9 НАЙДИ СООТВЕТСТВИЕ 1. Активные металлы 2. Металлы средней активности 3. Благородные металлы А) Au, Ag, Pt Б) Zn, Fe, Cu В) Na, K, Ca
10 ВСТАВЬТЕ ПРОПУЩЕННОЕ СЛОВО: Наиболее выраженные металлические свойства проявляет: ? алюминий ? натрий ? магний ? бериллий ? железо Активнее других реагирует с кислородом…. ? алюминий ? серебро ? цинк ? Барий Калий взаимодействует с водой с образованием…. и…. ? соли ? водорода ? щелочи ? оксида калия
11 Домашнее задание §51, задание 5, § 52 Сделать презентацию об открытии щелочноземельных металлов и/или применении
Щелочные и щелочноземельные металлы. Строение атомов. Основные кислородные водородные соединения, характерные химические свойства
Все химические элементы, стоящие в I и II подгруппе периодической таблицы Д.И. Менделеева, являются металлами. В I группе стоят щелочные, во II находятся щелочно-земельные (кроме бериллия и магния). Франций, который стоит внизу I группы, является радиоактивным.
- Эти металлы относят к s-элементам, так как на внешнем уровне у них 1-2 валентных электрона, которые металлы легко отдают, при этом образовываются стабильные ионы (катионы) с устойчивыми конфигурациями благородных газов.
- Все эти металлы – сильные восстановители.
- Физические свойства щелочных и щелочно-земельных металлов.
Металлы I группы – мягкие, имеют малую плотность. Щелочные металлы (Li, Na, K) легче воды и плавают на поверхности, при этом с ней реагируя.
Металлы II группы – более тяжелые, более плотные по сравнению с щелочными.
Металлические связи образуются валентными электронами. С увеличением утомного радиуса, растет восстановительная способность металла (франций — самый сильный восстановитель, у него валентный электрон расположен дальше всех от ядра, поэтому франций может легко его отдавать).
Все металлы обладают металлическим блеском, имеют низкий потенциал ионизации и малую электроотрицательность.
Распространенность в природе щелочных и щелочно-земельных металлов.
Металлы можно встретить в природе только в виде соединений, или в составе минеральных солей (карбонат кальция, поваренная соль и т.д.), или в виде ионов в морской воде.
Строение атомов
Субатомные частицы
Хотя слово атом в первоначальном значении обозначало частицу, которая не делится на меньшие части, согласно научным представлениям он состоит из более мелких частиц, называемых субатомными частицами. Атом состоит из электронов, протонов, все атомы, кроме водорода-1, содержат также нейтроны.
Электрон является самой лёгкой из составляющих атом частиц с массой 9,11·10−31 кг, отрицательным зарядом и размером, слишком малым для измерения современными методами. Протоны обладают положительным зарядом и в 1836 раз тяжелее электрона (1,6726·10−27 кг). Нейтроны не обладают электрическим зарядом и в 1839 раз тяжелее электрона (1,6749·10−27 кг).
При этом масса ядра меньше суммы масс составляющих его протонов и нейтронов из-за явления дефекта массы. Нейтроны и протоны имеют сравнимый размер, около 2,5·10−15 м, хотя размеры этих частиц определены плохо.[
В стандартной модели элементарных частиц как протоны, так и нейтроны состоят из элементарных частиц, называемых кварками. Наряду с лептонами, кварки являются одной из основных составляющих материи. И первые и вторые являются фермионами.
Существует шесть типов кварков, каждый из которых имеет дробный электрический заряд, равный +2⁄3 или (−1⁄3) элементарного. Протоны состоят из двух u-кварков и одного d-кварка, а нейтрон — из одного u-кварка и двух d-кварков. Это различие объясняет разницу в массах и зарядах протона и нейтрона.
Кварки связаны между собой сильными ядерными взаимодействиями, которые передаются глюонами.
Электроны в атоме
При описании электронов в атоме в рамках квантовой механики обычно рассматривают распределение вероятности в 3n-мерном пространстве для системы n электронов.
Электроны в атоме притягиваются к ядру, между электронами также действует кулоновское взаимодействие. Эти же силы удерживают электроны внутри потенциального барьера, окружающего ядро. Для того чтобы электрон смог преодолеть притяжение ядра, ему необходимо получить энергию от внешнего источника. Чем ближе электрон находится к ядру, тем больше энергии для этого необходимо.
Электронам, как и другим частицам, свойственен корпускулярно-волновой дуализм. Иногда говорят, что электрон движется по орбитали, что неверно.
Состояние электронов описывается волновой функцией, квадрат модуля которой характеризует плотность вероятности нахождения частиц в данной точке пространства в данный момент времени, или, в общем случае, оператором плотности.
Существует дискретный набор атомных орбиталей, которым соответствуют стационарные чистые состояния электронов в атоме.
Каждой орбитали соответствует свой уровень энергии. Электрон в атоме может перейти на уровень с большей энергией при столкновении данного атома с другим атомом, электроном, ионом, или же поглотив фотон соответствующей энергии.
При переходе на более низкий уровень электрон отдает энергию путём излучения фотона, либо путём передачи энергии другому электрону (безызлучательный переход, удары второго рода). Как и в случае поглощения, при излучательном переходе энергия фотона равна разности энергий электрона на этих уровнях.
Частота испускаемого излучения ν связана с энергией фотона E соотношением E = hν, где h — постоянная Планка.
Основные кислородные водородные соединения, характерные химические свойства.
С кислородом неметаллы образуют кислотные оксиды. В одних оксидах они проявляют максимальную степень окисления, равную номеру группы (например, SO2, N2O5), а других – более низкую (например, SO2, N2O3).
Кислотным оксидам соответствуют кислоты, причем из двух кислородных кислот одного неметалла сильнее та, в которой он проявляет более высокую степень окисления.
Например, азотная кислота HNO3 сильнее азотистой HNO2, а серная кислота H2SO4 сильнее сернистой H2SO3.
Характеристики кислородных соединений неметалов:
1. Свойства высших оксидов (т.е. оксидов, в состав которых входит элемент данной группы с высшей степенью окисления) в периодах слева направо постепенно изменяются от основных к кислотным.
2. В группах сверху вниз кислотные свойства высших оксидов постепенно ослабевают. Об этом можно судить по свойствам кислот, соответствующих этим оксидам.
3. Возрастание кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
4. В главных подгруппах периодической системы химических элементов в направлении сверху вниз кислотные свойства высших оксидов неметаллов уменьшаются.
Общие формулы водородных соединений по группам периодической системы химических элементов приведены в таблице.
Общие формулы соединений по группам
| I | II | III | IV | V | VI | VII |
| RH | RH2 | RH3 | RH4 | RH3 | H2R | HR |
| Нелетучие водородные соединения | Летучие водородные соединения |
С металлами водород образует (за некоторым исключением) нелетучие соединения, которые являются твердыми веществами немолекулярного строения. Поэтому их температуры плавления сравнительно высоки.
С неметаллами водород образует летучие соединения молекулярного строения. В обычных условиях это газы или летучие жидкости.
В периодах слева направо кислотные свойства летучих водородных соединений неметаллов в водных растворах усиливается. Это объясняется тем, что ионы кислорода имеют свободные электронные пары, а ионы водорода – свободную орбиталь, то происходит процесс, котроый выглядит следующим образом:
H2O + HF à H3O + F
Фтороводород в водном растворе отщепляет положительные ионы водорода, т.е. проявляет кислотные свойства. Этому процессу способствует и другое обстоятельство: ион кислорода имеет неподеленную электронную пару, а ион водорода – свободную орбиталь, благодаря чему образуется донорно-акцепторная связь.
При растворении аммиака в воде происходит противоположный процесс. А так как ионы азота имеют неподеленную электронную пару, а ионы водорода – свободную орбиталь, возникает дополнительная связь и образуются ионы аммония NH4+ и гидроксид-ионы ОН-. В результате раствор приобретает основные свойства. Этот процесс можно выразить формулой:
H2O + NH3 à NH4 + OH
Молекулы аммиака в водном растворе присоединяют положительные ионы водорода, т.е. аммиак проявляет основные свойства.
Теперь рассмотрим, почему водородное соединение фтора – фтороводород HF – в водном растворе является кислотой, но более слабой, чем хлороводородная. Это объясняется тем, что радиусы ионов фтора значительно меньше, чем ионов хлора.
Поэтому ионы фтора гораздо сильнее притягивают к себе ионы водорода, чем ионы хлора. В связи с этим степень диссоциации фтороводородной кислоты значительно меньше, чем соляной кислоты, т.е. фтороводородная кислота слабее соляной кислоты.
Из приведенных примеров можно сделать следующие общие выводы:
1. В периодах слева направо у ионов элементов положительный заряд увеличивается. В связи с этим кислотные свойства летучих водородных соединений элементов в водных растворах усиливаются.
2. В группах сверху вниз отрицательно заряженные анионы все слабее притягивают положительно заряженные ионы водорода Н+. В связи с этим облегчается процесс отщепления ионов водорода Н+ и кислотные свойства водородных соединений увеличиваются.
3. Водородные соединения неметаллов, обладающие в водных растворах кислотными свойствами, реагируют со щелочами. Водородные же соединения неметаллов, обладающие в водных растворах основными свойствами, реагируют с кислотами.
Элементы подгруппы углерода. Строение атомов, изменение химических свойств. Химические свойства углерода. Неорганические соединения углерода: диоксид углерода, угольная кислота, карбонаты, гидрокарбонаты, монооксид углерода.
Подгруппа углерода — химические элементы 14-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы IV группы). В группу входят углерод С, кремний Si, германий Ge, олово Sn, свинец Pb и недавно открытый искусственный радиоактивный элемент флеровий Fl.
Элементы подгруппы азота, строение атомов, изменение химических свойств. Аммиак и соли аммония. Оксиды азота, азотная и азотистая кислоты и их соли. Характерные химические свойства (в т.ч. окислительно-восстановительные).
Подгруппа азота, или пниктогены, также пниктиды — химические элементы 15-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы V группы). В группу входят азот N, фосфор P, мышьяк As, сурьма Sb, висмут Bi и искусственно полученный Московий Mc.
Элементы главной подгруппы V группы, имеют пять электронов на внешнем электронном уровне. В целом характеризуются как неметаллы. Способность к присоединению электронов выражена значительно слабее, по сравнению с халькогенами и галогенами.
Все элементы подгруппы азота имеют электронную конфигурацию внешнего энергетического уровня атома ns²np³ и могут проявлять в соединениях степени окисления от −3 до +5. Вследствие относительно меньшей электроотрицательности связь с водородом менее полярна, чем связь с водородом халькогенов и галогенов.
Водородные соединения этих элементов не отщепляют в водном растворе ионы водорода, иными словами, не обладают кислотными свойствами. Первые представители подгруппы — азот и фосфор — типичные неметаллы, мышьяк и сурьма проявляют металлические свойства, висмут — типичный металл.
Таким образом, в данной группе резко изменяются свойства составляющих её элементов: от типичного неметалла до типичного металла. Химия этих элементов очень разнообразна и, учитывая различия в свойствах элементов, при изучении её разбивают на две подгруппы — подгруппу азота и подгруппу мышьяка.
Аммиак
Физические свойства: аммиак (NH3) – бесцветный газ с резким запахом, растворим в воде, в 2 раза легче воздуха; при охлаждении до -33,4 °C и нормальном давлении превращается в прозрачную жидкость, при 77,8 °C затвердевает. Массовая доля аммиака в концентрированном растворе – 25 %. Раствор NH3 в воде – аммиачная вода или нашатырный спирт.
Медицинский нашатырный спирт – 10 %. При низкой температуре образует в растворе кристаллогидрат NH3 ? Н2О. Строение молекулы: характерна sp3-гибридизация. В образовании молекулы участвуют 3 неспаренных р-электрона азота и 1s – атомов водорода. Молекула имеет форму правильной пирамиды, в вершине которой стоят атомы азота, а в углах – водорода.
- Химические свойства:
- 1) при растворении NH3 в воде образуются гидратированные молекулы аммиака и частично ионы аммония – NH4+ и ОН-ионы – водный раствор аммиака имеет слабощелочную реакцию.
- 2) NH3 взаимодействует с кислотами: NH3 + Н2SO4 = NH4НSO4;
- 3) аммиак – сильный восстановитель. Из СuО при нагревании восстанавливает Сu: 3СuО + 2NH3 = Сu + N2 + 3Н2О;
- 4) в кислороде NH3 горит желтым пламенем: 4NH3 + 3О2 = 2N2? + 6Н2О;
- 5) кислородом воздуха NH3 окисляется в присутствии катализаторов: Pt, Cr2O3, Rh: 4NH3 + 5О2 = 4NО? + 6Н2О;
- 6) при замещении водорода на металлы образуются амиды: Na + NH3 = NaNH2 + 1/2 Н2;
7) водород в NH3 может замещаться на галогены. При действии на раствор хлорида аммония газообразным хлором образуется хлорид азота: NH4Cl + 3Cl2 = 4HCl + NCl3.
Соли аммония — соли, содержащие аммоний, NH4+; по строению, цвету и другим свойствам похожи на соответствующие соли натрия. Все соли аммония хорошо растворимы в воде и полностью диссоциируют в водном растворе. Соли аммония проявляют общие свойства солей. При действии на них щёлочи выделяется газообразный аммиак. Все соли аммония при нагревании разлагаются.
- Химические свойства солей аммония
- Сильные электролиты (диссоциируют в водных растворах):
- NH4Cl ↔ NH4+ + Cl−
- Разложение при нагревании:
- а) если кислота летучая
- NH4Cl → NH3↑ + HCl
- NH4HCO3 → NH3↑ + Н2O + CO2
- б) если анион проявляет окислительные свойства
- NH4NO3 → N2O↑ + 2Н2O
- (NH4)2Cr2O7 → N2↑ + Cr2O3+ 4Н2O
- С кислотами (реакция обмена):
- (NH4)2CO3 + 2HCl → 2NH4Cl + Н2O + CO2 ↑
- 2NH4+ + CO32− + 2H+ + 2Cl− → 2NH4+ + 2Cl− + Н2O + CO2 ↑
- CO32− + 2H+ → Н2O + CO2 ↑
- C солями (реакция обмена):
- (NH4)2SO4 + Ba(NO3)2 → BaSO4 ↓ + 2NH4NO3
- 2NH4+ + SO42− + Ba2+ + 2NO3− → BaSO4 ↓ + 2NH4+ + 2NO3−
- Ba2+ + SO42− → BaSO4 ↓
- Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) — среда кислая:
- NH4Cl + Н2O ↔ NH4OH + HCl
- NH4+ + Н2O ↔ NH4OH + H+
- При нагревании со щелочами выделяют аммиак (качественная реакция на ион аммония)
- NH4Cl + NaOH → NaCl + NH3 ↑ + Н2O






