- Химические свойства основных оксидов
- Урок 28. Химические свойства воды
- Урок 28. Химические свойства воды – HIMI4KA
- Взаимодействие с оксидами неметаллов
- Взаимодействие с металлами
- Химические свойства оксидов
- Обсуждение: «Химические свойства оксидов»
- Слава воде — химические свойства воды
- Конспект урока по химии на тему: "Взаимодействие оксидов металлов с водой" (8 класс)

Химические свойства основных оксидов
Подробно про оксиды, их классификацию и способы получения можно прочитать здесь.
1. Взаимодействие с водой. С водой способны реагировать только основные оксиды, которым соответствуют растворимые гидроксиды (щелочи). Щелочи образуют щелочные металлы (литий, натрий, калий, рубидий и цезий) и щелочно-земельные (кальций, стронций, барий). Оксиды остальных металлов с водой химически не реагируют. Оксид магния реагирует с водой при кипячении.
CuO + H2O ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
2. Взаимодействие с кислотными оксидами и кислотами. При взаимодействии основным оксидов с кислотами образуется соль этой кислоты и вода. При взаимодействии основного оксида и кислотного образуется соль:
- основный оксид + кислота = соль + вода
- основный оксид + кислотный оксид = соль
- При взаимодействии основных оксидов с кислотами и их оксидами работает правило:
- Хотя бы одному из реагентов должен соответствовать сильный гидроксид (щелочь или сильная кислота).
Иными словами, основные оксиды, которым соответствуют щелочи, реагируют со всеми кислотными оксидами и их кислотами. Основные оксиды, которым соответствуют нерастворимые гидроксиды, реагируют только с сильными кислотами и их оксидами (N2O5, NO2, SO3 и т.д.).
| Основные оксиды, которым соответствуют щелочи | Основные оксиды, которым соответствуют нерастворимые основания |
| Реагируют со всеми кислотами и их оксидами | Реагируют только с сильными кислотами и их оксидами |
| Na2O + SO2 → Na2SO3 | CuO + N2O5 → Cu(NO3)2 |
3. Взаимодействие с амфотерными оксидами и гидроксидами.
При взаимодействии основных оксидов с амфотерными образуются соли:
основный оксид + амфотерный оксид = соль
С амфотерными оксидами при сплавлении взаимодействуют только основные оксиды, которым соответствуют щелочи . При этом образуется соль. Металл в соли берется из более основного оксида, кислотный остаток — из более кислотного. В данном случае амфотерный оксид образует кислотный остаток.
CuO + Al2O3 ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
(чтобы определить кислотный остаток, к формуле амфотерного или кислотного оксида добавляем молекулу воды: Al2O3 + H2O = H2Al2O4 и делим получившиеся индексы пополам, если степень окисления элемента нечетная: HAlO2. Получается алюминат-ион AlO2 — . Заряд иона легко определить по числу присоединенных атомов водорода — если атом водорода 1, то заряд аниона будет -1, если 2 водорода, то -2 и т.д.).
Амфотерные гидроксиды при нагревании разлагаются, поэтому реагировать с основными оксидами фактически не могут.
4. Взаимодействие оксидов металлов с восстановителями.
При оценке окислительно-восстановительной активности металлов и их ионов можно использовать электрохимический ряд напряжений металлов:
![]()
Восстановительные свойства (способность отдавать электроны) у простых веществ-металлов здесь увеличиваются справа налево, окислительные свойства ионов металлов — увеличиваются наоборот, слева направо. При этом некоторые ионы металлов в промежуточных степенях окисления могут проявлять также восстановительные свойства (например ион Fe 2+ можно окислить до иона Fe 3+ ).
Более подробно про окислительно-восстановительные реакции можно прочитать здесь.
Таким образом, ионы некоторых металлов — окислители (чем правее в ряду напряжений, тем сильнее). При взаимодействии с восстановителями металлы переходят в степень окисления 0.
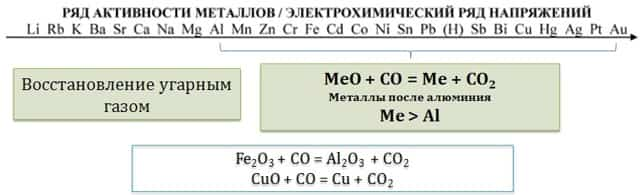
4.1. Восстановление углем или угарным газом.
Углерод (уголь) восстанавливает из оксидов до простых веществ только металлы, расположенные в ряду активности после алюминия. Реакция протекает только при нагревании.
FeO + C = Fe + CO

- Активные металлы, расположенные в ряду активности левее алюминия, активно взаимодействуют с углеродом, поэтому при взаимодействии их оксидов с углеродом образуются карбиды и угарный газ:
- CaO + 3C = CaC2 + CO
- Угарный газ также восстанавливает из оксидов только металлы, расположенные после алюминия в электрохимическом ряду:
- CuO + CO = Cu + CO2
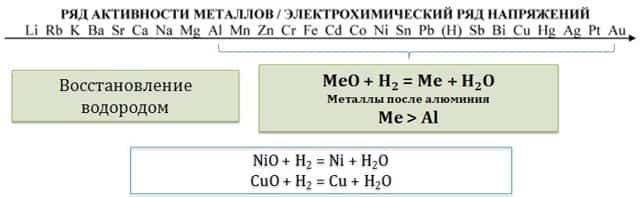
4.2. Восстановление водородом .
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Реакция с водородом протекает только в жестких условиях – под давлением и при нагревании.
CuO + H2 = Cu + H2O
4.3. Восстановление более активными металлами (в расплаве или растворе, в зависимости от металла)
При этом более активные металлы вытесняют менее активные. То есть добавляемый к оксиду металл должен быть расположен левее в ряду активности, чем металл из оксида. Реакции, как правило, протекают при нагревании.
- Например , оксид цинка взаимодействует с алюминием:
- 3ZnO + 2Al = Al2O3 + 3Zn
- но не взаимодействует с медью:
- ZnO + Cu ≠
Восстановление металлов из оксидов с помощью других металлов — это очень распространенный процесс. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
- Алюмотермия – это восстановление металлов из оксидов алюминием.
- Например : алюминий восстанавливает оксид меди (II) из оксида:
- 3CuO + 2Al = Al2O3 + 3Cu
- Магниетермия – это восстановление металлов из оксидов магнием.
- CuO + Mg = Cu + MgO

Железо можно вытеснить из оксида с помощью алюминия:
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
4.4. Восстановление аммиаком.
Аммиаком можно восстанавливать только оксиды неактивных металлов. Реакция протекает только при высокой температуре.
Например , аммиак восстанавливает оксид меди (II):
3CuO + 2NH3 = 3Cu + 3H2O + N2
5. Взаимодействие оксидов металлов с окислителями.
Под действием окислителей некоторые основные оксиды (в которых металлы могут повышать степень окисления, например Fe 2+ , Cr 2+ , Mn 2+ и др.) могут выступать в качестве восстановителей.
Например , оксид железа (II) можно окислить кислородом до оксида железа (III):
Источник
Урок 28. Химические свойства воды
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.

При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).

При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):

Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам.
Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах.
Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
- Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
- При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
- В этих реакциях выделяется водород и образуются растворимые в воде основания.
- Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
- Краткие выводы урока:
- Вода — химически активное вещество. Она вступает в реакции с кислотными и основными оксидами, активными металлами.
- При взаимодействии воды с большинством кислотных оксидов образуются соответствующие кислоты.
- Некоторые основные оксиды при реакции с водой образуют растворимые основания.
- При обычных условиях вода реагирует с наиболее активными металлами. При этом образуются растворимые основания и водород.
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Если в цилиндр с водой опустить стружки кальция, то от поверхности кальция начнут отрываться пузырьки газа, как от поверхности цинка, помещенного в раствор серной кислоты.
При поднесении зажженной лучинки к отверстию цилиндра мы будем наблюдать вспышки. Это горит водород. Вода в цилиндре мутнеет. Появившиеся в цилиндре белые взвешенные частицы — гидроксид кальция Са(ОН)2.
Протекающая реакция выражается уравнением:
Са + 2Н 2 0 = 2Са (ОН) 2 + Н 2 ↑
При этой реакции из молекулы воды Н 2 О, которую можно представить как Н—ОН (группа — ОН — гидроксогруппа), —ОН переходит в состав гидроксида кальция. Так как атом кальция двухвалентен, то он вытесняет из двух молекул воды два атома водорода, а оставшиеся две группы —ОН соединяются с атомом кальция.
Еще энергичнее протекает реакция натрия с водой. Опустим кусочек натрия в стакан с водой. Натрий всплывает на ее поверхность, плавится, превращаясь в блестящую каплю. Она быстро перемещается по поверхности воды, издавая шипение и уменьшаясь в размерах. Выпарив раствор, мы обнаружим твердое белое вещество — гидроксид натрия NaOH
2Na + 2НОН = 2NaOH + Н 2 ↑
Натрий и кальций принадлежат к числу наиболее химически активных.
Сожжем в банке на ложечке красный фосфор. Прильем немного воды и подождем, пока получившийся оксид фосфора (V) Р 2 0 5 растворится. Добавим к раствору несколько капель фиолетового лакмуса. Лакмус окрасится в красный цвет. Значит, в растворе содержится кислота. Оксид фосфора (V) соединяется с водой, и получается фосфорная кислота Н 3 Р0 4 :
Р 2 0 5 + ЗН 2 0 = 2Н 3 Р0 4
Сожжем в банке, в которую налито немного воды, серу и получившийся раствор исследуем раствором лакмуса. Он тоже окрасится в красный цвет. Оксид серы (IV) S0 2 , образовавшийся при сгорании серы, соединился с водой, и получилась сернистая кислота:
- S0 2 + H 2 0 = H 2 S0 2
- Оксид серы (VI), взаимодействуя с водой, образует серную кислоту H 2 S0 4 :
- SO 2 + Н 2 О = H 2 S0 4
- Азот может образовать оксид N205, при взаимодействии которого с водой образуется азотная кислота:
- N 2 0 5 + Н 2 0 = 2HN0 3
- Соединения оксидов неметаллов с водой относят к кислотам.
Рассмотрим теперь отношение к воде оксидов металлов. Насыплем в стаканчики оксид меди СиО, оксид железа Fe 2 0 3 , оксид цинка ZnO и оксид кальция СаО и прильем в каждый немного воды. Оксиды меди, железа и цинка в воде не растворяются и не соединяются с ней. Иначе ведет себя оксид кальция, или негашеная известь.
- При обливании кусков негашеной извести водой наблюдается такое сильное разогревание, что часть воды превращается в пар, а куски негашеной извести, рассыпаясь, превращаются в сухой рыхлый порошок — гашеную известь, или гидроксид кальция Ca(OH) 2 :
- СаО + Н 2 0 = Са(ОН) 2
- Подобно оксиду кальция, соединяются с водой оксиды натрия и калия:
- Na 2 0 + H 2 0 = 2NaOH
- К 2 0+Н 2 0 = 2КОН
- При этих реакциях образуются гидроксид натрия NaOH и гидроксид калия КОН.
Таким образом, одни оксиды металлов не реагируют с водой (их большинство) другие (оксид калия, оксид натрия, оксид кальция, оксид бария и др.) соединяются с ней, образуя гидроксиды, которые относятся к основаниям.
(Неорганическая химия 7-8 класс автор Ю. В. Ходаков и др.)
Источник
Урок 28. Химические свойства воды – HIMI4KA
Архив уроков › Химия 8 класс
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.

При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).

При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):

Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам.
Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах.
Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
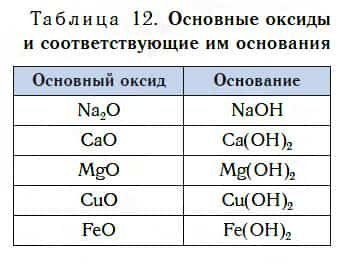
Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
- В этих реакциях выделяется водород и образуются растворимые в воде основания.
- Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
- Краткие выводы урока:
- Вода — химически активное вещество. Она вступает в реакции с кислотными и основными оксидами, активными металлами.
- При взаимодействии воды с большинством кислотных оксидов образуются соответствующие кислоты.
- Некоторые основные оксиды при реакции с водой образуют растворимые основания.
- При обычных условиях вода реагирует с наиболее активными металлами. При этом образуются растворимые основания и водород.
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Химические свойства оксидов
Вопрос А10 ГИА (ОГЭ) по химии —
Химические свойства оксидов: основных, амфотерных, кислотных

Классификация оксидов:
| Оксиды, образованные металлами | Оксиды, образованные неметаллами | ||
| Основные | Амфотерные | Кислотные | Несолеобразующие |
|
Оксиды металлов щелочных и щелочно-земельных металлов — Na2O, CaO; |
Оксиды: Al2O3, ZnO, d-элементы в средней с.о. — Cr2O3, Fe2O3, MnO2 |
1) оксиды неметаллов в высших и средних степенях окисления CO2, N2O3, N2O5, SO3, SO2 2) оксиды d-элементов в высшей с.о.: CrO3, Mn2O7 |
оксиды неметаллов в промежуточных степенях окисления: |
Химические свойства основных оксидов:
- Основные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химической реакции с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами.
- Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием щелочей:
- K2O + H2O = 2KOH
- 1. Окисление кислородом:
- если металл — d-элемент и «ему есть до чего окисляться»: 2FeO + O2 = Fe2O3
- 2. Взаимодействие с неметаллами:
- 2Na2O + S = 4Na + SO2
- Fe2O3 + C = 2FeO + CO
- 3. Восстановление — реакции с водородом:
- CuO + H2 = Cu + H2O
- 4. Образование солей с кислотными оксидами:
- CaO + CO2 = CaCO3 (соль)
- 5. Взаимодействие с кислотами:
- BaO + 2HNO3 = Ba(NO3)2 (соль) + H2O
- Химические свойства амофтерных оксидов:
- Амфотерные оксиды — это сложные химические вещества, также относящиеся к окислам, которые образуют соли
при химическом взаимодействии и с кислотами (или кислотными оксидами) и основаниями (или основными оксидами).
1. Взаимодействие в растворе(!) с щелочами:
Al2O3 + 2H2O + 2NaOH = 2Na[Al(OH)4] + 3H2
2. Образование солей с кислотами:
ZnO + H2SO4 = ZnSO4 + H2O
- Ответ: 3)
- Химические свойства кислотных оксидов:
Кислотные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химическом взаимодействии с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами.
- Реакция с водой: образование кислот:
- N2O3 + H2O = 2HNO2
- 1. + O2
если элемент, образующий оксид в средней с.о.:
- 2SO2 + O2 = 2SO3
- 2. + H2
- восстановление до несолеобразующего оксида или простого вещества:
- CO2 + H2 = CO + H2O
- SO2 + H2 = S + H2O
3. + вещества. образованные металлами:
- SO2 + 2Ca = 2CaO + S
- SO2 + CaO = CaSO3 (соль)
- SO2 + 2LiOH = Li2SO3 + H2O
- Химические свойства несолеобразующих оксидов
- здесь все просто — они только
окисляются до кислотных и восстанавливаются до простых веществ:
- N2O + O2 = N2O3
- CO + H2 = C + H2O
- Ответ: 3)
Обсуждение: «Химические свойства оксидов»
(Правила комментирования)
Слава воде — химические свойства воды
Взаимодействие воды с металлами.
Если в цилиндр с водой опустить стружки кальция, то от поверхности кальция начнут отрываться пузырьки газа, как от поверхности цинка, помещенного в раствор серной кислоты.
При поднесении зажженной лучинки к отверстию цилиндра мы будем наблюдать вспышки. Это горит водород. Вода в цилиндре мутнеет. Появившиеся в цилиндре белые взвешенные частицы — гидроксид кальция Са(ОН)2.
Протекающая реакция выражается уравнением:
Са + 2Н20 = 2Са (ОН)2 + Н2 ↑
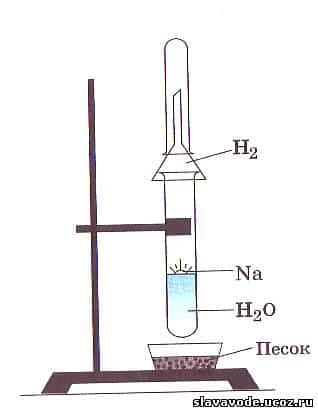 При этой реакции из молекулы воды Н2О, которую можно представить как Н—ОН (группа — ОН — гидроксогруппа), —ОН переходит в состав гидроксида кальция. Так как атом кальция двухвалентен, то он вытесняет из двух молекул воды два атома водорода, а оставшиеся две группы —ОН соединяются с атомом кальция.
При этой реакции из молекулы воды Н2О, которую можно представить как Н—ОН (группа — ОН — гидроксогруппа), —ОН переходит в состав гидроксида кальция. Так как атом кальция двухвалентен, то он вытесняет из двух молекул воды два атома водорода, а оставшиеся две группы —ОН соединяются с атомом кальция.
Еще энергичнее протекает реакция натрия с водой. Опустим кусочек натрия в стакан с водой. Натрий всплывает на ее поверхность, плавится, превращаясь в блестящую каплю. Она быстро перемещается по поверхности воды, издавая шипение и уменьшаясь в размерах. Выпарив раствор, мы обнаружим твердое белое вещество — гидроксид натрия NaOH
- 2Na + 2НОН = 2NaOH + Н2 ↑
- Натрий и кальций принадлежат к числу наиболее химически активных.
- Взаимодействие воды с оксидами неметаллов.
Сожжем в банке на ложечке красный фосфор. Прильем немного воды и подождем, пока получившийся оксид фосфора (V) Р205 растворится. Добавим к раствору несколько капель фиолетового лакмуса. Лакмус окрасится в красный цвет. Значит, в растворе содержится кислота. Оксид фосфора (V) соединяется с водой, и получается фосфорная кислота Н3Р04:
Р205 + ЗН20 = 2Н3Р04
Сожжем в банке, в которую налито немного воды, серу и получившийся раствор исследуем раствором лакмуса. Он тоже окрасится в красный цвет. Оксид серы (IV) S02, образовавшийся при сгорании серы, соединился с водой, и получилась сернистая кислота:
- S02 + H20 = H2S02
- Оксид серы (VI), взаимодействуя с водой, образует серную кислоту H2S04:
- SO 2 + Н2О = H2S04
- Азот может образовать оксид N205, при взаимодействии которого с водой образуется азотная кислота:
- N205 + Н20 = 2HN03
- Соединения оксидов неметаллов с водой относят к кислотам.
- Взаимодействие воды с оксидами металлов.
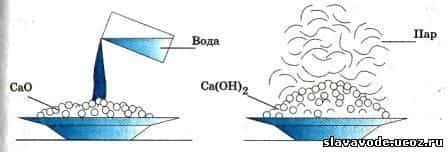 Рассмотрим теперь отношение к воде оксидов металлов. Насыплем в стаканчики оксид меди СиО, оксид железа Fe203, оксид цинка ZnO и оксид кальция СаО и прильем в каждый немного воды. Оксиды меди, железа и цинка в воде не растворяются и не соединяются с ней. Иначе ведет себя оксид кальция, или негашеная известь.
Рассмотрим теперь отношение к воде оксидов металлов. Насыплем в стаканчики оксид меди СиО, оксид железа Fe203, оксид цинка ZnO и оксид кальция СаО и прильем в каждый немного воды. Оксиды меди, железа и цинка в воде не растворяются и не соединяются с ней. Иначе ведет себя оксид кальция, или негашеная известь.
- При обливании кусков негашеной извести водой наблюдается такое сильное разогревание, что часть воды превращается в пар, а куски негашеной извести, рассыпаясь, превращаются в сухой рыхлый порошок — гашеную известь, или гидроксид кальция Ca(OH)2 :
- СаО + Н20 = Са(ОН)2
- Подобно оксиду кальция, соединяются с водой оксиды натрия и калия:
- Na20 + H20 = 2NaOH
- К20+Н20 = 2КОН
- При этих реакциях образуются гидроксид натрия NaOH и гидроксид калия КОН.
Таким образом, одни оксиды металлов не реагируют с водой (их большинство) другие (оксид калия, оксид натрия, оксид кальция, оксид бария и др.) соединяются с ней, образуя гидроксиды, которые относятся к основаниям.
(Неорганическая химия 7-8 класс автор Ю. В. Ходаков и др.)
Конспект урока по химии на тему: "Взаимодействие оксидов металлов с водой" (8 класс)
Урок №27 «Взаимодействие воды с оксидами
неметаллов»
Задачи: Сформировать
первоначальные представления об основаниях как о
классе неорганических соединений.
Познакомить с возможностями использования индикаторов для определения реакции
среды.
Основное содержание (впервые
вводимое)
Взаимодействие воды с оксидами металлов:
оксидом натрия, оксидом бария, оксидом кальция. Индикаторы. Окраска
метилоранжа, лакмуса и фенолфталеина в нейтральной и щелочной среде.
Первоначальные представления об основаниях. Прогнозирование возможности
взаимодействия воды с оксидами металлов с помощью таблицы растворимости.
Химический эксперимент
Д Отношение
воды к оксидам бария и железа. Испытание растворов метилоранжем, лакмусом и
фенолфталеином.
Л Лабораторный
опыт №10. Взаимодействие оксида кальция с водой. (инструкционная карточка
прилагается).
Планируемые результаты обучения
Предметные: уметь
составлять уравнения изученных химических реакций с участием воды,
прогнозировать возможность взаимодействия воды с оксидами металлов с помощью
таблицы растворимости, выдвигать гипотезы о возможности взаимодействия оксидов
металлов с водой на основе данных таблицы растворимости. Наблюдать опыты,
демонстрируемые учителем. Осуществлять превращение веществ.
Метапредметные:
устанавливать причинно-следственные связи, строить логическое рассуждение,
умозаключение (индуктивное, дедуктивное и по аналогии) и делать выводы.
Фиксировать наблюдения и формулировать выводы из наблюдаемых опытов.
- Личностные: соотносить
свои действия с планируемыми результатами, осуществлять контроль своей
деятельности в процессе достижения результата, определять способы действий в
рамках предложенных условий и требований, корректировать свои действия в
соответствии с изменяющейся ситуацией. - Ресурсы
- Основные: учебник
(с. 84-85,п 29) - Дополнительные:
— Большая иллюстрированная энциклопедия
эрудита. – М. Махаон, 2006
— Занимательная химия для детей и взрослых
– Леенсон И.А М.Мир энциклопедий 2010
— Занимательные задания и эффективные
опыты по химии. – Степин Б.Д. М. Дрофа 2002
— Химия 8 класс Журин А.А. М. Просвещение
2015
- Ход урока
- 1. Проверка
усвоенного материала - А. Самостоятельная
работа: «Написать уравнения реакций взаимодействия металлов с водой и
расставить коэффициенты» - Взаимопроверка и сдача
работ. - 2. Переход
к изучению нового материала - — Химические свойства какого
вещества мы начали изучать на прошлом уроке (воды) - — Взаимодействие воды с
какими веществами мы рассмотрели на прошлом уроке (металлами) - — Что при этом необходимо
учитывать ( ряд Бекетова «активность металлов») - — Проявится ли эта
закономерность при взаимодействии воды с оксидами металлов (да) - — Формулирование темы
урока: Взаимодействие воды с оксидами металлов. - 3.Изучение нового материала
- Для элементов первой группы
главной подгруппы запишите формулу металла и составьте формулу соответствующего
для него оксида. - (Li2O
Na2O K2O Rb2O Cs2O Fr2O) - На примере оксида натрия рассматривается
правило составления уравнений реакций взаимодействия оксидов с водой. - При взаимодействии оксида с водой
образуется основание.
Основания – сложные вещества, в состав
которых входит один атом металла и группа атомов OH
— гидроксогруппа. Валентность гидроксогруппы равна единице, число гидроксогрупп
в составе основания равно валентности атомов металла.
- Задание: составить формулы оснований
образованных металлами 2 группы главной подгруппы Ca(OH)2
Ba(OH)2
Sr(OH)2 - Взаимодействие оксидов магния и кальция с
водой (видео). - Вопрос учителя: « Что еще не отметили при
теоретическом рассмотрении материала?» - Ответ учеников: «Щелочь»
Щелочь – растворимое основание.
Очень едкие жидкости, при попадании на кожу они могут вызывать сильнейшие
ожоги. При работе сними необходимо соблюдать осторожность: надевать защитные
очки, использовать шпатель. При попадании на кожу — промыть большим количеством
воды.
- Переходим к классификации оснований
- Растворимые и нерастворимые основания.
- Для определения растворимости оснований
используют таблицу растворимости. (Форзац учебника) - Если металлу соответствует растворимое или
малорастворимое основание, оксид металла взаимодействует с водой с
образованием основания. - Растворимые основания образуются при
взаимодействии оксида металла с водой. - Нерастворимые основания образуются при
взаимодействии соли с растворимым основанием. - Чтобы определить образование растворимых
оснований в результате химических реакций воды с металлами и оксидами металлов,
используют специальные вещества – индикаторы. - Индикатор – сложное органическое вещество,
изменяющее свою окраску под действием растворов веществ. - Когда раствор индикатора добавляют к
раствору основания, наблюдается изменение окраски раствора. - 3. Закрепление
изученного - Эксперимент: «Взаимодействие оксида
кальция с водой» - Заполнение таблицы изменение окраски
индикатора
| Название индикатора | Цвет в воде | Цвет в растворе основания |
| метилоранж | оранжевы | желтый |
| лакмус | фиолетовый | синий |
| фенолфталеин | бесцветный | малиновый |
Запишите уравнение реакции и расставьте
коэффициенты
CaO + H2O
= Ca(OH)2+Q
(Коэффициенты расставлять не надо)
4. Домашнее
задание 1. Учебник с 86, написать уравнения
реакций взаимодействия оксидов металлов первой и второй групп главных подгрупп
с водой.
5. Рефлексия.
Составить синквейн к понятиям «основания» и
«индикатор», вспомнить, какую цель ставили в начале урока, достигли цели или
нет.
6. Переход
к теме следующего урока.
При взаимодействии
оксида металла с водой образуются основания.
А что образуется при
взаимодействии оксидов неметаллов с водой? Об этом поговорим на следующем
уроке.
- Эксперимент
- Взаимодействие оксида кальция с водой
- Цель: определить, какое вещество
образуется в результате взаимодействия оксидов активных металлов с водой, как
изменяется окраска индикаторов в щелочной среде. - Оборудование: чистые пробирки, стеклянная
палочка, ложка-дозатор, пипетка. - Вещества: оксид кальция, растворы
индикаторов: метилоранж, лакмус, фенолфталеин. - Ход работы:
1. В
сухую чистую пробирку поместите ¼ ложку-дозатора оксида кальция, рассмотрите
его и запишите наблюдения в тетрадь.
2. С
помощью пипетки добавить воду к оксиду кальция. Запишите наблюдения. Осторожно
потрогай те дно пробирки. Долейте в пробирку воду до ¼ объема и тщательно
перемешайте. Разделите раствор на три части.
3. К
первой части добавить раствор метилоранжа (1-2 капли), обратить внимание на
изменение окраски раствора. Записать наблюдения.
4. Ко
второй части добавить раствор лакмуса (1-2 капли), обратить внимание на
изменение окраски. Записать наблюдения.
5. К
третьей части добавить раствор фенолфталеина (1-2 капли), обратить внимание на
изменение окраски. Записать наблюдения.
6. Полученные
результаты записать в таблицу
| Название индикатора | Цвет в воде | Цвет в растворе основания |
| метилоранж | ||
| лакмус | ||
| фенолфталеин |
7. Записать
уравнение реакции взаимодействия оксида кальция с водой, расставить
коэффициенты.






