- Азотная кислота [HNO3]: структура Льюиса / свойства / применение
- Азотная кислота HNO3 свойства
- Структура
- Структура Льюиса
- Как она производится?
- Производство слабой азотной кислоты
- Производство сильной азотной кислоты
- Производство в лаборатории
- Свойства
- Области применения
- Вопросы и ответы
- Проводит ли HNO3 электричество?
- Растворяет ли HNO3 золото?
- Как нейтрализуется HNO 3?
- Что такое кислота Льюиса?
- Кислотность и основность органических соединений по Льюису
- Большая Рнциклопедия Нефти Рё Газа
Кислотность и основность — важнейшие понятия, определяющие многие фундаментальные физико-химические свойства и биологическую активность органических соединений. В органической химии существует несколько концепций кислот и оснований.
Общепринятой является протолитическая теория Брёнстеда—Лоури (1923). Почти одновременно Г. Льюис предложил более общую концепцию кислот и оснований, на основе которой в дальнейшем Р.
Пирсон (1963) разработал принцип жестких и мягких кислот и оснований.
Кислотность и основность по Брёнстеду-Лоури.В соответствии с теорией Брёнстеда-Лоури кислотность и основность соединений связывают с переносом протона Н+.
Кислоты — вещества, способные отдавать протон (доноры прогона); основания — вещества, способные принимать протон (акцепторы протона). Кислота и основание образуют сопряженную кислотно-основную пару. Кислотные свойства проявляются в присутствии основания, основные — в присутствии кислоты.
В общем виде кислотно-основное взаимодействие описывается уравнением
В принципе большинство органических соединений можно рассматривать как потенциальные кислоты, поскольку в них содержатся атомы водорода, связанные с разными элементами (О, S, N, С). Элемент и связанный с ним атом водорода называют кислотным центром.
Органические кислоты соответственно классифицируют по кислотному центру как ОН-, SH-, NH- и СН-кислоты. Кислотами могут быть не только нейтральные молекулы, но и положительно заряженные ионы, а также диполярные ионы.
Органические основания для образования ковалентной связи с протоном кислоты должны либо иметь неподеленную пару электронов у гетероатома (нейтральные молекулы), либо быть анионами. В целом основания, имеющие в молекулах гетероатом, называются n-основаниями.
Существует еще одна группа оснований — π-основания, в которых центром основности являются электроны локализованной π-связи или π-электронного облака сопряженной системы. π-Основания образуют с протоном не ковалентные связи, а короткоживущие π-комплексы.
Кислотность и основность веществ по Брёнстеду-Лоури характеризуется количественно. Применяя закон действующих масс, можно выразить кислотные свойства кислоты А—Н через константу равновесия Kp, представленной выше реакции обратимого кислотно-основного взаимодействия:
Очевидно, что константа равновесия реакции ионизации кислоты имеет постоянное значение только для данной системы и по отношению к каждому основанию существует своя шкала констант кислотности. Наиболее важным случаем является ионизация кислот в водном растворе (вода играет роль основания):
Поскольку вода присутствует в большом избытке, то ее концентрация остается практически постоянной, равной 55,5 моль/л. Это значение включают в константу равновесия и получают характеристику, называемую константой кислотности Ка:
Чем больше Ка, тем сильнее кислота. Однако даже такая сравнительно сильная по меркам органических соединений кислота, как уксусная, имеет Ка= 1,75 • 10-5. Для большинства органических соединений Ка имеют еще меньшие значения.
Поэтому для оценки силы органических кислот значительно удобнее пользоваться значениями рКапредставляющими собой отрицательный логарифм констант кислотности: рКа = —lgКа. При этом чем меньше рКа, тем сильнее кислота.
Кислоты, у которых рКа > 7, не изменяют цвет нейтральной индикаторной бумаги; кислоты с рКа >10 не имеют кислого вкуса.
Основность соединений в водном растворе можно охарактеризовать величиной рКb, которая связана с рКа через ионное произведение воды: рКb = 14 — рКа.
Однако в настоящее время для характеристики основности чаще используют величину рКасопряженной основанию В кислоты ВН+, обозначаемую как рKBH+.
Такой подход позволяет применять одну и ту же шкалу для характеристики ионизации как кислот, так и оснований. В этом случае чем больше pKBH+, тем сильнее основание.
Слабые кислоты и основания в биологических системах. Большинство биологически активных органических соединений, в частности лекарственных веществ, являются слабыми кислотами или основаниями.
Степень ионизации таких соединений в той или иной среде имеет важное значение для проявления биологического действия.
Известно много лекарственных веществ, терапевтическая активность которых определяется долей присутствующих неионизированных молекул, хотя существуют и другие примеры, когда, наоборот, ионизированная часть вещества обусловливает биологический эффект за счет взаимодействия с катионными или анионными центрами рецепторов. Различия в степени ионизации обеспечивают избирательность действия, и это связано с такими факторами, как, например, проникновение через мембраны в плазму крови или клетку, адсорбцией на поверхностях ферментов, возможной ионизацией центров рецептора в зависимости от pH и т. д.

Степень ионизации органических кислот и оснований в растворе определяется значениями двух параметров: pH раствора и рКа кислоты (или рКBH+ основания). Если значения рКа (или pKBH+) вещества и pH раствора известны, то степень ионизации может быть рассчитана следующим образом:
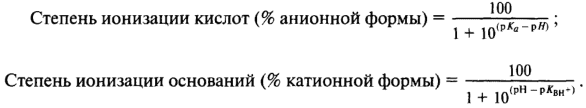
Степень ионизации имеет важное значение для процессов проникновения веществ через различные мембраны в организме, например при всасывании (абсорбции) лекарств из желудочно-кишечного тракта. Мембраны эпителия пищеварительного тракта можно рассматривать как липидный бислой, в который встроены белковые молекулы.
Гидрофобные участки мембранных белков погружены во внутреннюю полость мембраны, а ионизированные участки обращены к водной фазе внутри и снаружи.
Согласно классической теории, мембраны подобного типа препятствуют прохождению ионов, так как, во-первых, ионы вследствие гидратации имеют относительно большой размер и, во-вторых, если заряд иона и заряд белковой поверхности, к которой он приближается, аналогичны по знаку, то происходит отталкивание, а если противоположны, то происходит адсорбция иона на поверхности мембраны.
Через природные мембраны проникают только те ионы, для которых существуют специфические транспортные системы или переносчики. Нейтральные липидорастворимые молекулы проникают через мембраны и тем быстрее, чем выше их липофильные свойства. Таким образом в желудочно-кишечном тракте происходит всасывание неионизированных молекул лекарственных веществ.
Препараты кислотной природы будут лучше всасываться из желудка (pH 1—3), а всасывание лекарств-оснований будет происходить только после того, когда они пройдут из желудка в кишечник (содержимое тонкого кишечника имеет pH 7—8).
В течение одного часа из желудка крыс всасывается почти 60% ацетилсалициловой кислоты и только 6% анилина от введенной дозы. В кишечнике крыс всасывается уже 56% от введенной дозы анилина.
Примечательно, что такое слабое основание, как кофеин (рKВH+ 0,8), всасывается за то же время в гораздо большей степени (36%), так как даже в сильнокислой среде желудка кофеин в значительной степени находится в неионизированном состоянии.
Эффективность действия лекарственных веществ обусловливается способностью их проникновения к рецептору. Дли веществ, способных к ионизации, биологическая активность может определяться долей неионизированных молекул или, наоборот, ионизированной частью вещества.
Имеются многочисленные примеры и того, и другого вариантов.
Так, и фенол и уксусная кислота прекращают рост различных плесневых грибов; их биологическое действие обусловлено неионтированными молекулами, и поэтому наибольшая эффективность уксусной кислоты проявляется при pH ниже 4, а для фенола при любых значениях pH ниже 9, так как в этих диапазонах значений pH и фенол и уксусная кислота находятся в неионизированном состоянии. Также только неионизированный теофиллин, в отличие от своего аниона, стимулирует деятельность сердца черепахи. На примере ряда сульфаниламидных препаратов, наоборот, установлено, что их антибактериальная активность обусловлена анионами. Оптимальное для проявления активности значение рКа сульфаниламидов находится в интервале 6—8. Через мембрану в клетку проникают неионизированные молекулы, но при физиологических значениях pH вновь образуются ионы, пока по обе стороны мембраны не установится равная степень ионизации:
![]()
Антибактериальная активность сульфаниламидов пропорциональна степени ионизации, но зависит также и от липофильности молекул.
И еще один пример, когда биологическая активность обусловлена ионизированной формой вещества: антибактериальное (бактериостатическое) действие аминоакридинов проявляется только в катионной форме этих соединений и возрастает при повышении степени их катионной ионизации. Изменение степени ионизации в зависимости от pH среды широко используют для выделения лекарственных веществ из биологических жидкостей (кровь, моча) с целью их последующего анализа, например, при проведении фармакокинетических исследований.
Кислоты и основания Льюиса. Согласно теории Льюиса, кислотно-основные свойства соединений определяются их способностью принимать или отдавать пару электронов с образованием новой связи. Кислоты Льюиса — акцепторы пары электронов. Основания Льюиса доноры пары электронов.
Основания Брёнстеда и основания Льюиса являются донорами пары электронов — либо неподеленной, либо находящейся на р-орбитали, т. е. понятия тождественны в той и другой теории. Кислотность по Льюису имеет новый и более широкий смысл.
Кислотой считается любая частица с вакантной орбиталью, которая способна дополнить свою электронную оболочку парой электронов.
По Брёнстеду кислота — это донор протона, а по Льюису — сам протон Н+ является кислотой, так как имеет вакантную орбиталь.
Кислотами Льюиса являются галогениды элементов второй и третьей групп периодической системы (BF3, А1С13, FeCl3, FeBr3, ZnCl2 и др.). К кислотам Льюиса также относятся галогениды других элементов, имеющих вакантные орбитали — SnX4, SbX5, AsX5 и даже оксид серы (VI) SО3.
Галогениды бора, алюминия имеют по шесть электронов на внешней оболочке и способны принимать пару электронов с образованием ковалентной связи.
Тетрахлорид олова, например, имеет 8 электронов на внешней оболочке, но как элемент, имеющий вакантные орбитали, способен принять еще пару электронов. К кислотам Льюиса относятся также катионы металлов (Na+, Mg2+, Ag+), карбокатионы R3C+, нитроил-катион NО2+ и др.
В гетеролитических реакциях кислоты Льюиса участвуют как электрофильные реагенты. Ниже приведены некоторые примеры взаимодействия между кислотами и основаниями Льюиса:

Многие распространенные органические реакции относятся к кислотноосновным взаимодействиям в рамках теории Льюиса. Однако в этой теории гораздо сложнее дать количественную оценку кислотности и основности, и такая оценка может быть лишь относительной.
Для этого определяют энергии взаимодействия различных соединений в строго определенных условиях (растворитель, температура) с одним и тем же стандартом, являющимся соответственно кислотой или основанием Льюиса.
Поэтому количественных измерений для кислот и оснований Льюиса сделано намного меньше, чем для кислот и оснований Брёнстеда.
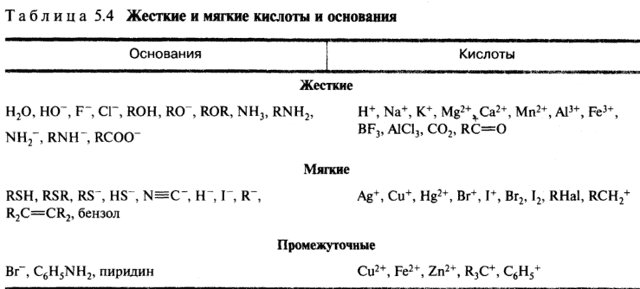
Жесткие и мягкие кислоты и основания. Развитие теории Льюиса привело к созданию принципа жестких и мягких кислот и оснований (принцип ЖМКО, принцип Пирсона). Согласно принципу Пирсона, кислоты и основания подразделяются на жесткие и мягкие.
Жесткие кислоты — это кислоты Льюиса, в которых акцепторные атомы малы по размеру, обладают большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью. Мягкие кислоты Льюиса содержат акцепторные атомы большого размера с малым положительным зарядом, небольшой электроотрицательностью и высокой поляризуемостью.
Низшая свободная молекулярная орбиталь (НСМО), которая участвует в связывании с орбиталью донора пары электронов, у жестких кислот имеет низкую энергию. Самой жесткой кислотой является протон.
НСМО мягких кислот имеет высокую энергию. Мягкие кислоты содержат легко поляризуемые вакантные орбитали.
Положительный заряд у атома — акцептора пары электронов мал вследствие делокализации или вообще отсутствует (так, мягкой кислотой является молекула иода).
Жесткие основания — это донорные частицы, обладающие высокой электроотрицательностью, низкой поляризуемостью, трудно окисляющиеся. Мягкие основания, напротив, — это донорные частицы с низкой электроотрицательностью, высокой поляризуемостью, довольно легко окисляющиеся.
Термин «жесткое основание» подчеркивает, что соединение — донор пары электронов — прочно удерживает свои электроны.
У жестких оснований высшая занятая молекулярная орбиталь (ВЗМО), которая участвует в связывании с орбиталью акцептора пары электронов, имеет низкую энергию (расположена близко к ядру атома). Атомами-донорами в жестких основаниях являются азот, кислород, фтор, хлор.
Мягкие основания слабо удерживают свои валентные электроны, ВЗМО донора имеет высокую энергию. Донорами пары электронов выступают атомы углерода, серы, фосфора, иода.
Следует отметить, что понятия «жесткие» и «мягкие» кислоты и основания не равноценны понятиям «сильные» и «слабые» кислоты и основания. Это две независимые характеристики кислот и оснований.
Принцип ЖМКО используется для качественного описания эффективности протекания кислотно-основного взаимодействия: (!) жесткие кислоты лучше координируются с жесткими основаниями, мягкие кислоты — с мягкими основаниями.
Концепция Пирсона основана на том, что взаимодействие между орбиталями с близкими энергиями более эффективно, чем между орбиталями, имеющими разную энергию.
Действие принципа ЖМКО можно проиллюстрировать следующим примером. При взаимодействии галогеноалканов с нуклеофилами (являющимися также и основаниями) могут происходить конкурентные реакции — нуклеофильного замещения или элиминирования.
Реакция нуклеофильного замещения осуществляется посредством взаимодействия нуклеофила с атомом углерода, связанным с галогеном. В реакции элиминирования происходит также и отщепление протона от соседнего атома углерода под влиянием основания.
При взаимодействии 1,2-дихлороэтана с жестким основанием (метоксид-ионом) вследствие атаки реагента на жесткую кислоту — протон преимущественно происходит реакция элиминирования. Мягкое основание — тиофеноксид-ион — предпочтительно реагирует с более мягкой кислотой — атомом углерода, в результате чего образуется продукт реакции нуклеофильного замещения:
Поиск на сайте:
Азотная кислота [HNO3]: структура Льюиса / свойства / применение
Азотная кислота — это сильная одноосновная кислота с pH около 3,01. Это «липкая» молекула, которая легко впитывается в поверхность, особенно если на поверхности есть вода. По физическому состоянию чистая азотная кислота представляет собой бесцветную жидкость, но более старые образцы часто приобретают желтоватый оттенок из-за разложения на оксиды азота и воду.
Химическая формула азотной кислоты — HNO3, она также известна как aqua fortis, что в переводе с латинского означает «Сильная вода».
Это очень агрессивное и токсичное вещество, которое может вызвать серьезные повреждения кожи при использовании без мер предосторожности. Кислота вступает в реакцию с оксидами, гидроксидами и металлами, такими как серебро, медь и железо, образуя нитратные соли.
Обычно азотная кислота, доступная в магазинах, представляет собой 68-процентный водный раствор. Когда ее концентрация (в воде) превышает 86 процентов, она называется дымящейся азотной кислотой. Она хранится в плотно закрытой емкости в сухом, прохладном и хорошо проветриваемом помещении.
Ниже мы рассмотрим, как производится эта кислота, как она выглядит в молекулярном масштабе, каковы ее химические и физические свойства и где она в основном используется.
Азотная кислота HNO3 свойства
Молярная масса: 63,012 г / моль
Внешний вид: Бесцветная или дымящаяся жидкость желто-красного цвета
Запах: неприятно горький или острый, удушающий
Основание конъюгата: Нитратная
Показатель кислотности (pKa): -1,4
Температура плавления: 231 K или -42 °C.
Температура кипения: 356 K или 83 °C (чистой кислоты).
Плотность: 1,51 г/см3 (чистая кислота); 1,41 г/см3 (68% водный раствор)
Структура
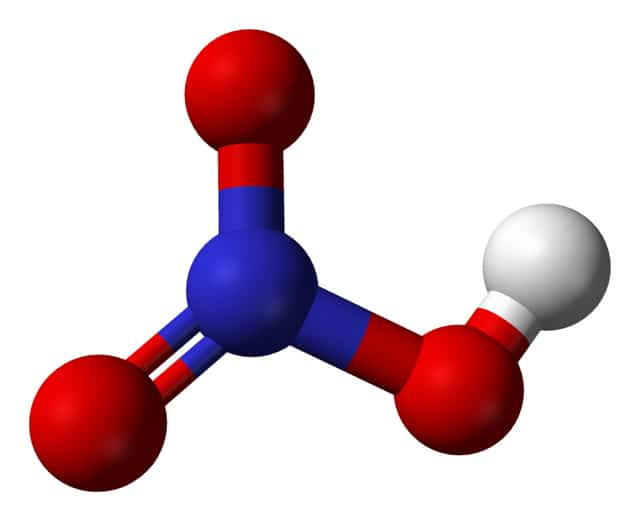
HNO3 имеет один атом азота (синий), один атом водорода (белый) и три атома кислорода (красный). Атом азота связан со всеми тремя атомами кислорода и несет заряд +1. Один атом кислорода несет заряд -1, один связан с водородом, а другой образует двойную связь с азотом.
Поскольку кислород имеет большую тенденцию притягивать к себе общие электроны, чем азот, он несет отрицательный заряд, а атом азота несет положительный заряд.
Структура Льюиса
Чтобы нарисовать льюисовскую структуру азотной кислоты, нам нужно подсчитать общее количество валентных электронов в молекуле HNO3.
- Валентный электрон в одном атоме азота = 5
- Валентный электрон в одном атоме водорода = 1
- Валентный электрон в трех атомах кислорода = 18 (6*3)
Это дает нам общее количество валентных электронов (5 + 1 + 18) в одной молекуле HNO3. Поскольку у азота больше валентных электронов, чем у кислорода, мы можем поместить атом азота в центр структуры.
Следующим шагом является формирование связи и маркировка одиночной пары на атомах. Затем идет заряд каждого атома: атом азота получит заряд +2, а два атома кислорода — заряд -1.
Наконец, нам нужно минимизировать заряды на атомах, чтобы сделать структуру стабильной. Это может быть сделано путем преобразования одинокой пары на одном атоме кислорода в связь. Конечная структура состоит из двух одиночных связей между атомом азота и двумя атомами кислорода, а также двойной связи между атомом азота и оставшимся атомом кислорода.
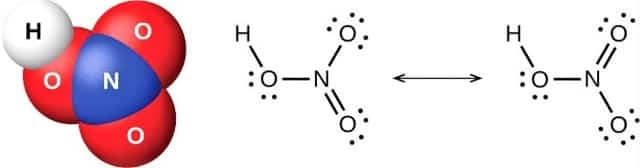
Есть два правильных способа нарисовать структуру Льюиса HNO3. Таким образом, он имеет две основные формы резонанса. Двунаправленная стрелка на изображении выше указывает на то, что существует более одного способа нарисовать структуру азотной кислоты.
Как она производится?
Для производства HNO3 используются два метода. Первый использует окисление, конденсацию и абсорбцию для синтеза слабой HNO3 с концентрациями от 30 до 70 процентов. Второй метод производит сильную HNO3 (с концентрацией 90 процентов) из слабой HNO3 путем объединения процессов обезвоживания, отбеливания, конденсации и абсорбции.
Производство слабой азотной кислоты
Большая часть азотной кислоты образуется в результате высокотемпературного каталитического окисления аммиака. Это называется процессом Оствальда. Он состоит из трех этапов:
1) Окисление аммиака
4 NH 3 + 5 O 2 → 4 NO + 6 H 2 O
Смесь аммиака и воздуха (1:9) окисляется до высокой температуры (750-800 ℃) при прохождении через каталитический преобразователь. Катализатор обычно изготавливается из 90% платины и 10% родиевой сетки. Эта (экзотермическая) реакция приводит к образованию оксида азота и воды в виде пара.
2) Окисление оксида азота
2 NO + O2 → 2 NO2
Окись азота, образовавшаяся в предыдущей реакции, окисляется: она некаталитически реагирует с остаточным кислородом с образованием диоксида азота. Это медленная, однородная реакция, которая сильно зависит от давления и температуры. При высоком давлении и низких температурах эта реакция приводит к образованию максимального количества диоксида азота за очень короткое время.
3) Поглощение
3 NO2 + H2O → 2 HNO3 + NO
В конечной реакции оксид азота поглощается водой. Это дает желаемый продукт (азотную кислоту в разбавленной форме) вместе с оксидом азота. Концентрация HNO 3 зависит от давления, температуры, количества стадий абсорбции, а также от концентрации оксидов азота, поступающих в абсорбер.
Производство сильной азотной кислоты
Высокопрочная HNO 3 получается путем концентрирования слабой HNO 3 экстрактивной дистилляцией. Дистилляция проводится в присутствии дегидратирующего агента, например 60% серной кислоты.
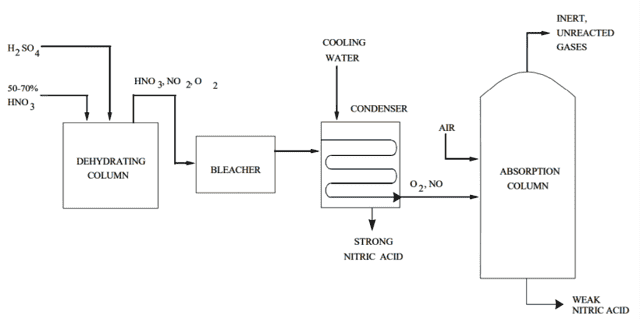 Блок — схема высокопрочного HNO 3 производств
Блок — схема высокопрочного HNO 3 производств
Процесс протекает следующим образом: сильная серная кислота и слабая азотная кислота попадают в насадочную дегидратирующую колонну при атмосферном давлении. Концентрированная HNO 3 выходит из верхней части колонны в виде 99% пара. Он также состоит из небольшого количества кислорода и оксида азота от диссоциации азотной кислоты.
Кислота проходит через отбеливатель и попадает в систему конденсатора, который отделяет ее от оксида азота и кислорода.
Абсорбционная колонна забирает эти побочные продукты и объединяет оксид азота со вспомогательным воздухом для получения диоксида азота.
Этот газообразный диоксид азота затем рекуперируется в виде слабой HNO 3, а небольшие непрореагировавшие и инертные газы выбрасываются в атмосферу.
Производство в лаборатории
В лаборатории HNO 3 обычно синтезируется путем термического разложения нитрата меди. Это дает оксид меди, диоксид азота и кислород. Последние два пропускаются через воду для получения азотной кислоты.
- 2 Cu (NO 3 ) 2 → 2 CuO + 4 NO 2 + O 2
- А затем реализовать процесс Оствальда
- 2 NO2 + H2O → HNO2 + HNO3
В последние пару десятилетий исследователи разработали электрохимические средства для получения безводной кислоты из концентрированного HNO 3. Этот процесс осуществляется путем регулирования тока электролиза до тех пор, пока не будут получены необходимые продукты.
Свойства
68% раствор HNO 3 имеет температуру кипения 120,5 °C при давлении 1 атм. С другой стороны, чистая HNO 3 кипит при 83 °C. При комнатной температуре эта концентрированная форма выглядит как бесцветная жидкость.
Поскольку азотная кислота имеет свойство разлагаться на открытом воздухе, ее хранят в стеклянных бутылках.
4 HNO3 → 2 H2O + 4 NO2 + O2
Оксиды азота, образующиеся в результате реакции разложения, полностью или частично растворяются в кислоте, вызывая незначительные изменения давления пара над жидкостью. Когда он остается растворенным, он дает кислотно-желтый цвет или красный при более высоких температурах.
Концентрированная азотная кислота выделяет белые пары при контакте с воздухом, в то время как кислота, растворенная в диоксиде азота, образует красновато-коричневые пары.
По концентрации сильную HNO 3 можно разделить на две группы: красная и белая дымящаяся азотная кислота. Первый содержит 84% азотной кислоты, 13% тетроксида диазота и 1-2% воды. Напротив, белая дымящаяся азотная кислота содержит не более 2% воды и очень небольшое количество растворенного диоксида азота (0,5%).
 HNO3 с растворенным оксидом азота
HNO3 с растворенным оксидом азота
Среди нескольких важных реакций HNO3 можно выделить следующие –
- Нейтрализация аммиаком с образованием нитрата аммония.
- Нитрование толуола и глицерина с образованием взрывчатого тринитротолуола (TNT) и нитроглицерина соответственно.
- Окисление металлов до соответствующих нитратов или оксидов.
- Приготовление нитроцеллюлозы.
А так как это сильный окислитель, то он бурно реагирует с различными неметаллическими веществами. Продукты таких взрывных реакций зависят от температуры, концентрации кислоты и используемого восстановителя.
Области применения
Химические и физические свойства азотной кислоты делают ее ценным веществом. Она имеет несколько различных применений в различных областях, особенно в химической и фармацевтической промышленности.
Удобрения: Почти 80% производимой азотной кислоты используется для производства удобрений. Точнее, она используется для производства аммиачной селитры (NH 4 NO 3) и кальций-аммиачной селитры, которые находят применение в качестве удобрений.
HNO 3 + NH 3 → NH 4 NO 3
Взрывчатые вещества: аммиачная селитра также используется в качестве взрывчатого вещества в горнодобывающей промышленности, гражданском строительстве, карьерах и других областях применения. Примеры взрывчатых веществ, содержащих нитрат аммония, включают ANFO, Amatol и DBX.
Красители и пластмассы: Нитрат кальция и аммония используется в некоторых упаковках со льдом/гелем в качестве альтернативы аммиачной селитре. Она также используется для производства химикатов и растворов, которые используются в производстве красителей и пластмасс.
Ракетное топливо: красная и белая дымящаяся азотная кислота используется в жидкостных ракетах в качестве окислителя. Во время Второй мировой войны немецкие военные использовали дымящуюся красную азотную кислоту в нескольких ракетах.
Деревообработка: Очень слабая HNO3 (с концентрацией 10%) используется для искусственного старения древесины сосны и клена. Придает дереву винтажный вид с масляной отделкой.
Другие применения: слегка концентрированный раствор под названием Nital используется для травления металла, чтобы выявить его структуру на микроуровне. Рефлюксная азотная кислота используется в процессах очистки углеродных нанотрубок. В электрохимии HNO3 используется в качестве химического легирующего агента для органических полупроводников.
Вопросы и ответы
Проводит ли HNO3 электричество?
Как и другие сильные кислоты, азотная кислота является хорошим проводником электричества. Исследования показывают, что обработка материала этой кислотой может улучшить его электропроводность до 200 раз.
Растворяет ли HNO3 золото?
Азотная кислота не реагирует с некоторыми драгоценными металлами, такими как металлы платиновой группы и чистое золото. Однако она может растворять некоторые сплавы золота, содержащие менее благородные металлы, такие как серебро и медь. Цветное золото, например, растворяется в азотной кислоте и меняет цвет своей поверхности.
Хотя чистое золото не проявляет никакого эффекта при контакте с азотной кислотой, оно реагирует с царской водкой, смесью азотной и соляной кислот, оптимально в молярном соотношении 1:3. Некоторые ювелирные магазины используют азотную кислоту как дешевое средство для быстрого обнаружения сплавов с низким содержанием золота (менее 14 карат).
Как нейтрализуется HNO 3?
При более высоких концентрациях выделение азотной кислоты может быть весьма значительным, и поэтому необходима хорошая вентиляция. Ее можно нейтрализовать любым неорганическим основанием, например, гидроксидом натрия или известью.
Такие реакции нейтрализации выделяют много тепла. Например, нейтрализация 10% раствора азотной кислоты приведет к повышению температуры на 20 °C, а нейтрализация 70% раствора приведет к повышению температуры на 120 °C, что достаточно для того, чтобы вызвать паровые взрывы.
Что такое кислота Льюиса?
Кислоты и основания являются общими терминами в химии. Но кислота Льюиса — это нечто иное. Некоторые реакции имеют характеристики кислотно-основных реакций, но не соответствуют теории кислотно-щелочной химии, выдвинутой химиками Бренстедом и Лоури.
Вместо химика Г.Н. Льюис понял, что общая концепция кислотно-основных реакций может также включать другие типы реакций, включая реакции переноса протона. Читайте дальше, чтобы узнать больше о том, что такое кислоты Льюиса и являются ли определенные молекулы кислотами или основаниями Льюиса.
Льюис провел свои эксперименты в 1923 году, используя водород (положительный ион) и гидроксид (ОН-, анион). Согласно теории Бренстеда, гидроксид-ион принимает протон, образуя ковалентную связь, что приводит к воде, H2O.
В теории Льюиса, ион водорода является важным компонентом, потому что он принимает электроны от иона гидроксида, чтобы сформировать ковалентную связь.
Определение кислоты Льюиса
Согласно Льюису, кислота Льюиса — это химическая разновидность, которая может образовывать ковалентную связь, принимая электронную пару от другой химической разновидности. Многие вещи, которые не считаются кислотами, могут быть определены как кислоты Льюиса, если они способны принимать электроны. Кислоты Льюиса часто описываются как имеющие свободные орбитали.
Существует также определение базы Льюиса. Основание Льюиса является противоположным в том смысле, что оно определяется как вид, который может образовывать ковалентную связь, жертвуя электронную пару другому виду.
Катионы металлов, такие как AL3 + и FE3 +, представляют собой кислоты Льюиса. Положительный заряд катиона металла притягивает электроны.
Что такое кислотный катализатор Льюиса?
Кислотный катализатор Льюиса — это тот, который работает, как и все катализаторы. Катализаторы увеличивают скорость химической реакции. Кислотный катализатор Льюиса увеличивает реактивность субстрата, принимая электроны, но не участвует в самой реакции.
Является ли AlCl3 кислотой Льюиса?
Кислота Льюиса притягивает электроны и имеет свободные орбитали, куда могут попасть притянутые электроны. С алюминием в общей сложности 17 валентных электронов присутствуют. Поскольку у него неполный набор электронов, есть место для другого электрона. Это означает, что ALCl3 является кислотой Льюиса. AlCl3 может принимать электроны.
Является ли NH3 кислотой Льюиса или основанием?
NH3, или аммиак, имеет неподеленную пару электронов. Он может пожертвовать эти электроны химическим веществам, которые будут принимать электроны. Из-за этого NH3 является базой Льюиса.
Когда NH3 нейтрализуется HCL в воде, NH3 является донором электронов для иона водорода. Результат — NH4.
Концепции Льюиса и Бренстеда-Лоури описывают похожие вещи, но они представляют собой разные способы взглянуть на химические реакции. В то время как объяснение Бренстеда-Лоури является строгим способом определения химического состава кислотных оснований, Льюис дал нам другой взгляд на реакции, которые также можно описать с помощью подобной химии.
Кислотность и основность органических соединений по Льюису
- По Льюису, кислотные и основные свойства органических соединений оцениваются по способности принимать или предоставлять электронную пару с последующим образованием связи.
- Кислота Льюиса — любая молекула или частица, способная принимать электронную пару на вакантную орбиталь.
- Основание Льюиса — любая частица, способная выступать донором пары электронов.
- К кислотам Льюиса относят:
- • незаряженные (нейтральные) молекулы, содержащие атомы с вакантными (незаполненными до октета) орбиталями:
png»>
• положительно заряженные частицы (катионы):
К основаниям Льюиса относят:
• нейтральные молекулы, содержащие на отдельных атомах неподелейные электронные пары:
• отрицательно заряженные частицы (анионы):
• л-доноры (л-основания): алкены, бензол и его производные, другие арены.
По сравнению с протонной теорией Брёнстеда теория Льюиса носит более общий характер и охватывает более широкий круг соединений. Как видно из определений, основания Льюиса тождественны основаниям Брёнстеда: те и другие являются донорами пары электронов. Разница лишь в том, куда расходуется эта электронная пара.
Основания Брёнстеда предоставляют её для связи с протоном и поэтому являются частным случаем оснований Льюиса, которые предоставляют электронную пару любой частице с вакантной орбиталью. Более существенные различия отмечаются в трактовке кислот.
Теория Брёнстеда охватывает лишь протонные кислоты, тогда как кислоты Льюиса — это любые соединения, содержащие атомы со свободной орбиталью.
При взаимодействии кислот и оснований Льюиса образуются донорно-акцепторные комплексы самой различной природы, например:
Органическая химия богата примерами подобных взаимодействий, в которых ковалентная связь образуется в результате взаимодействия частицы, имеющей заполненную орбиталь, с частицей, имеющей вакантную орбиталь.
В разделе 7.1 приведена реакция бромэтана с этилнатрием. Этот процесс мы рассматривали как взаимодействие нуклеофила (этилнатрия) с электрофилом (бромэтаном). Эту же реакцию можно рассматривать как кислотно-основное взаимодействие: реакция основания (этилнатрия) с кислотой (бромэтаном):
Продукт реакции (бутан) можно рассматривать как результат нейтрализации указанных кислоты и основания. Аналогичный подход можно распространить на многие другие реакции.
Многие процессы могут рассматриваться как кислотноосновные реакции Льюиса.
Более широкий охват конкретных объектов, характерный для теории Льюиса, более существенные различия в природе соединений приводят к тому, что ряд относительной силы кислот и оснований Льюиса не носит столь универсального характера, как для кислот и оснований Брён- стеда.
Для кислот Льюиса невозможно составить таблицу со строгими количественными характеристиками кислотности, как это сделано для кислот Брёнстеда (см. табл. 10). Для них имеется лишь качественная приблизительная последовательность кислотности. Так, для кислот Льюиса типа галогенидов металлов кислотность падает в ряду:
Суммируя изложенное, отметим, что в настоящее время в оценке кислотно-основных свойств органических соединений есть две теории. Можно ли сказать, что одна из них имеет существенные преимущества перед другой? Однозначного ответа на подобный вопрос не может быть.
Да, теория Льюиса имеет более общий характер и охватывает более широкий круг конкретных объектов. Теория Брёнстеда характеризуется более строгим учётом количественных характеристик кислотности и основности.
Предпочтение той или другой теории можно дать лишь с учётом конкретного содержания обсуждаемого вопроса.
Если обсуждаются процессы, протекающие с участием водородсодержащих веществ, в которых важную роль играют реакции переноса протона и существенное влияние оказывают водородные связи, видимо, предпочтение надо отдать теории Брёнстеда.
Важным достоинством теории Льюиса является то, что любое органическое соединение может быть представлено как кислотно-основный комплекс.
При обсуждении гетеролитиче- ских реакций, в которых кислоты Льюиса участвуют как электрофильные реагенты, а основания Льюиса — как нуклеофилы, предпочтение должно быть отдано теории Льюиса.
Химики научились умело использовать достоинства каждой из названных теорий.
Большая Рнциклопедия Нефти Рё Газа
- Cтраница 1
- Кислоты Льюиса также выделяют диборан из боргидридов щелочных металлов. [1]
- Кислоты Льюиса также повышают реакционную способность гало-геноводородов по отношению к двойным связям. [2]
- Кислоты Льюиса, например хлорид олова ( III), также катализируют присоединение хлористого водорода в апротонных растворителях [226]; предполагается, что они увеличивают подвижность протона. [3]
Кислоты Льюиса образуются РІ слое отверждаемого СЌРїРѕРєСЃРёРґР° РїСЂРё разложении РїРѕРґ действием света дифторфосфатов, фосфоро-молибдатов, фосфоровольфраматов, вольфрамогерманатов, силико-вольфраматов, молибдосиликатов диазониев, содержащих РІ фе-нильном СЏРґСЂРµ алкокси -, 4-арилмеркапто — или 4-ариламидогруппы [ пат. Среди последних оптимальным сочетанием стабильности Рё светочувствительности обладают соли 2 5-диалкокси — 4-морфолино — Рё 2 5-диалкокси — 4-тиотолилфенид-диазониев. [4]
Кислоты Льюиса в присутствии воды, спиртов или гало-геноводородов ведут себя как протонные кислоты. [5]
Кислоты Льюиса определены как частицы, способные быть акцепторами пары электронов и образовывать при этом ковалентную связь.
Основаниями соответственно называются частицы, которые являются донорами пары электронов и тоже образуют при этом ковалентную связь.
Поскольку эти частицы РјРѕРіСѓС‚ присоединять протон, РѕРЅРё РїРѕРґС…РѕРґСЏС‚ Рё РїРѕРґ определение оснований Бренстеда — Лоури. Р�наче обстоит дело РІ случае кислот.
По Бренстеду кислота всегда содержит протон, в то время как, согласно Льюису, она в нем не нуждается и обычно не содержит протона. [6]
Кислоты Льюиса являются очень активными катализаторами: хлористый алюминий ( 0 5 вес. [7]
Кислоты Льюиса, образуя устойчивые комплексы с а-оксидной группой, увеличивают ее реакционную способность. [9]
Кислоты Льюиса ( например, комплексы три-фторида Р±РѕСЂР° СЃ аминами) способствуют гомополимеризации РїРѕ эпоксигруппам РїСЂРё умеренных температурах. Полифенолы действуют только РїСЂРё повышенных температурах, так же, как Рё органические РґРё — Рё поликислоты. [10]
- Кислота Льюиса используется в количестве, эквимолекулярном ацилирующему агенту, так как после реакции он остается связанным кетоном. [11]
- Кислоты Льюиса, например BF3 и ВС13, вытесняют двуокись углерода из суспензии карбоната натрия в смеси ацетона и четыреххлористого углерода. [12]
- Кислоты Льюиса используют и совместно с ацилгалогенидами. [13]
Кислоты Льюиса, такие, как хлористый алюминий, трехфтористый бор, хлорное олово, хлористый цинк и хлорное железо, исключительно важные катализаторы некоторых органических реакций. � обратно, даже слабые основные свойства кислородных и галоидных соединений могут играть решающую роль при определении течения реакций. [14]
Кислоты Льюиса способствуют гомополимеризации и обеспечивают исключительно экзотермические реакции как с глицидиловым эфиром, так и с эпоксидирован-ными смолами на основе кислот олефинового ряда при комнатной температуре. Реакционная способность может быть снижена реакцией кислоты Льюиса ( чаще всего трехфтористый бор) с аминами, что позволяет использовать комплексные соединения в латентных однокомпонентных системах. Отверждение может происходить быстро при температуре диссоциации комплексного соединения. [15]
Страницы: 1 2 3 4






