- Определение и физическая характеристика
- Химическое строение и свойства
- Нахождение в природе
- Промышленное получение
- Применение вещества
- Бром в организме
- Опасность и вред
- Признаки избытка и нехватки
- Бром, свойства атома, химические и физические свойства
- Атом и молекула брома. Формула брома. Строение атома брома:
- Изотопы и модификации брома:
- Свойства брома (таблица): температура, плотность, давление и пр.:
- Физические свойства брома:
- Химические свойства брома. Взаимодействие брома. Химические реакции с бромом:
- Получение брома:
- Применение брома:
- Бром (Br, Bromum)
- Общая характеристика Брома
- Нахождение брома в природе
- Физические и химические свойства брома
- Суточная потребность организма в броме
- Продукты питания богатые бромом
- Опасность и вред брома
- Признаки избытка брома
- Признаки нехватки брома
- Полезные свойства брома и его влияние на организм
- Усвояемость брома
- Бром и его влияние на мужскую потенцию
- Применение брома в жизни
- Бром | это… Что такое Бром?
- История
- Происхождение названия
- Нахождение в природе
- Получение
- Физические свойства
- Химические свойства
- Бромсодержащие кислоты
- Применение
- В химии
- В технике
- В медицине
- В производстве оружия
- Физиологическое действие
- Особенности работы
- Мифы и легенды
- См. также
- Примечания

Определение и физическая характеристика
Бром, обозначаемый символом Вг, является галогеном и входит в VII группу периодической таблицы химических элементов. Вещество имеет атомный номер 35, а его атомная масса составляет 79,904 дальтонов.
Молярная масса составляет 79,904 г/моль. Относительная молекулярная масса молекулы равна 159,808, а её молярная масса — 160 г/моль.
Бром, встречающийся в природе, состоит из двух нуклидов с массовыми числами 79 и 81.
Существует множество искусственных радиоактивных изотопов. Среди них самым интересным считается 80Вr, поскольку на его примере советский физик И. В. Курчатов открыл изомерию атомных ядер.

Вещество представляет собой жидкость красно-бурого оттенка, отличающуюся сильным неприятным запахом. Температура застывания брома составляет -7,2°С. Замёрзший элемент имеет форму красно-коричневых игольчатых кристаллов, блестящих как металл. Кипит элемент при температуре 58,78 °С, превращаясь в пар жёлто-бурого цвета. Плотность вещества в жидком виде — 3,1 г/см3.
Бром плохо растворяется в воде. Так, если её температура не превышает 5,84 °С, то вещество образует тёмно-красные кристаллы. Лучше всего для его растворения подходят органические составы. Извлекать элемент из различных водных соединений позволяет именно это физическое свойство.
Бром в любом физическом виде состоит из двухатомных молекул. Распад на атомы становится хорошо заметен при температуре 800 °C. Но также его можно наблюдать при действии света.
Химическое строение и свойства
Внешние электроны атома имеют конфигурацию 4s24p5. Необходимо отметить, что такое химическое свойство брома, как степень окисления, разнится в зависимости от соединения, к примеру, у гипобромитов этот показатель равен +1, а у броматов он составляет +5.
В соединениях валентность брома переменна. Атом вещества имеет заряд только тогда, когда является ионом, заряд ядра атома составляет 35. Представить электронную формулу брома можно следующим образом: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5. Структурная же формула имеет вид: Br-Br.
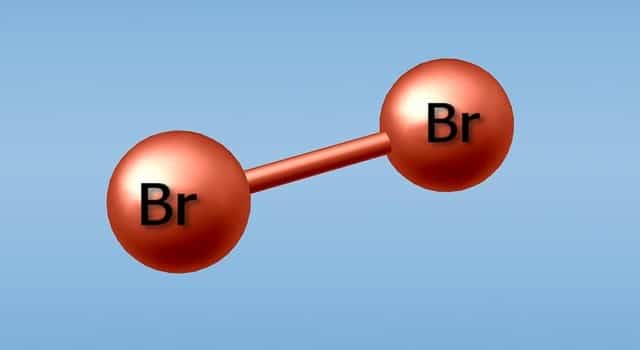
Неметалл является химически активным, а потому по способности к реакции располагается между хлором и йодом. Сильное разогревание, иногда сопровождающееся горением, возникает, когда вещество взаимодействует со следующими реагентами:
- сера;
- селен;
- теллур;
- фосфор;
- мышьяк;
- сурьма.
Так же протекает реакция вещества с некоторыми металлами, к примеру, калием и алюминием. Но большинство металлических элементов плохо реагирует с безводным бромом, потому что на их поверхности образуется защитная плёнка бромида, который не растворяется в этом реагенте.
Самыми устойчивыми к такой реакции, даже при высокой температуре и наличии воды, считаются следующие металлы:
- платина;
- свинец;
- серебро;
- тантал.

У золота с бромом взаимодействие проходит довольно активно. Кислород, азот и углерод не создают с элементом прямых соединений даже при повышенной температуре.
Чтобы эти вещества соединились, химики применяют различные косвенные методы. К примеру, очень непрочный оксид Вr3О8 получают посредством воздействия озона на бром при 80 °C.
Реагировать непосредственно с элементом способны галогены, в результате их взаимодействия образуются BrF3, BrCl и другие соединения.
Бром относится к сильным окислителям. Элемент способен вытеснить из химических соединений йод. Само же вещество подвергается вытеснению хлором и фтором.
Выделить чистый неметалл из бромидов на основе воды можно посредством использования сильных окислителей, поместив все реагенты в кислую среду. Растворяясь в воде, вещество вступает с нею в слабую реакцию, результатом которой становится образование бромистоводородной и бромноватистой кислот. Водный раствор элемента называется бромной водой.
Неметалл растворяется в щелочах:
- При низких температурах соединение брома и гидроксидов даёт бромиды и гипобромиты.
- При температуре около 100 °C получаются бромиды и броматы.
Взаимодействие брома и органических соединений чаще всего проходит с характерным присоединением углерода по двойной связи и замещением водорода. Обычно это происходит при воздействии различных катализаторов или света.
Ещё одной распространённой химической реакций является бромирование, суть которого заключается во введении атома реагента в соединение посредством химической реакции вещества с ненасыщенной молекулой или замещения водорода.
Нахождение в природе

Основная часть природного брома рассеяна в земной коре. Больше всего вещества содержится в породах, сформированных магмой. Этот элемент можно обнаружить рядом с хлором. Так, соли элемента встречаются в солевых хлорных отложениях, в морской воде, насыщенном растворе соляных озёр и рассолах, находящихся под землёй, которые зачастую связаны с месторождениями соли и нефти. Так как вещество хорошо растворяется в воде, его соли скапливаются в рассолах, оставшихся на месте озёр и заливов.
Неметалл перемещается в форме хорошо растворимых соединений, а потому его довольно сложно встретить в твёрдой минеральной форме. Минералами становятся бромирит AgBr, эмболит Ag (Cl, Вг) и йодэмболит Ag (Cl, Вr, I), которые образуются в зонах окисления сульфидных месторождений серебра, сформировавшихся в областях пустынь и полупустынь.
Промышленное получение
В промышленности для получения брома используют морскую воду, озёрные и подземные рассолы, а также калийные щёлоки. Для выделения вещества применяют хлор. Процедура состоит из следующих этапов:

- В гранитные, керамические или другие устойчивые к бромовому воздействию колонны сверху подают подогретое сырьё.
- Снизу в них направляют хлор и водяной пар или воздух.
- После выхода из устройства бромовые пары оседают в виде жидкости в специальных холодильных установках.
- Полученное вещество отделяют от воды.
- Посредством дистилляции его очищают от хлора.
- Из смеси реактива и воздуха бром выделяют с помощью химических поглотителей. В таких установках может использоваться газообразный сернистый ангидрид. Он реагирует с реактивом при наличии водяного пара, образуя бромистоводородную и серную кислоты.
- Для получения чистого вещества полупродукты подвергают воздействию хлора или кислоты.
- При необходимости проводится их переработка на бромистые соединения без выделения искомого элемента.
Метод с применением воздуха позволяет получать бром из рассолов даже с небольшим количеством вещества. Применять к таким смесям паровой способ экономически невыгодно, поскольку на выделение малого количества реагента тратится значительное количество пара.
Применение вещества
Прежде всего, вещество является основой для создания бромистых солей и различных производных на основе органики. Но и сам реактив, и его соединения довольно широко используются во многих областях жизнедеятельности человека:

- Органические бромиды — синтезирование красителей и лекарств.
- Бромиды щелочных металлов — успокоительные препараты, используемые для лечения неврозов, повышенной раздражительности, гипертонии, эпилепсии.
- Бромид серебра — фотография.
- Бром — изготовление бромистого этила и дибромэтана, участвующих в производстве этиловой жидкости, которую добавляют к бензинам, чтобы снизить их способность к детонации.
- Бромистый метил — инсектициды.
- Органические соединения вещества — производство эффективных огнетушителей.
- Бромная вода — химические анализы, позволяющие определять многие вещества.
Бром в организме
Вещество содержится в тканях всех животных и растений. Его обнаружили практически во всех жидкостях тела. Если человек здоров, то в его организме уровень брома составляет от 0,11 до 2,00 мг/%. Для поддержания этого показателя в сутки необходимо получать не больше 0,8−1 г реактива.
Радиоактивный бром позволил выявить, что вещество поглощается щитовидной железой, почками и мозгом. Бромиды, которые были введены в животные организмы, увеличили концентрацию процессов торможения, проходящих в головном мозге. Они способствовали приведению в норму нервной системы, которая пострадала от чрезмерного напряжения, возникшего в результате подобного процесса.

Но следует учитывать, что химический элемент задерживается в щитовидной железе, вступая в конкуренцию с йодом. Это влияет на работу органа, что отражается на обмене веществ.
Бром плохо усваивается, если в реакции будут участвовать хлор, алюминий, йод и фтор. Чтобы избежать такой ситуации, перед началом лечения препаратами, содержащими бромные соли, необходимо проконсультироваться с врачом.
Опасность и вред
Элементарный бром представляет собой сильнодействующий яд, отнесённый ко второму классу опасности. Его ни в коем случае нельзя принимать внутрь.
Очень опасны пары вещества:
- При концентрации 1 мг/м3 и более газ вызывает кашель, насморк, кровотечение из носа, головокружение и головную боль.
- При концентрациях, превышающих указанный порог, у человека может начаться отёк лёгких, удушье, бронхит, в некоторых случаях возможен смертельный исход.
- Максимальное допустимое значение — 2 мг/м3.
Во избежание отравления все работы с реагентом необходимо осуществлять в специальных шкафах, оборудованных хорошей вытяжной системой.
Если же защититься от паров не удалось, то следует подышать сильно разбавленным водным раствором аммиака, возможно применение раствора на этиловом спирте.
Для устранения боли в горле, возникшей из-за воздействия отравляющего газа, нужно выпить хорошо нагретое молоко.

В жидком виде попавшее на кожу вещество вызывает ожоги, которые плохо заживают. В случае поражения кожи реагент необходимо тщательно смыть большим количеством воды или сдуть мощной воздушной струёй. Место ожога следует смазать ланолином.
Представителям профессий, требующих постоянной концентрации внимания, к примеру, водителям и альпинистам, применять лекарства на основе брома не рекомендуется. Это обусловлено свойством вещества снимать возбуждённое состояние нервной системы, расслаблять её.
Признаки избытка и нехватки
Чаще всего переизбыток вещества в организме возникает при неправильном употреблении бромосодержащих препаратов. Это состояние может привести к серьёзным проблемам со здоровьем. Признаки избытка микроэлемента:
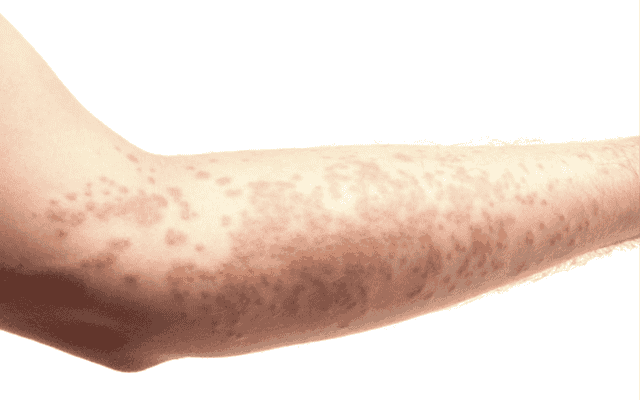
- Кожные воспаления и высыпания.
- Нарушения в работе пищеварительной системы.
- Ощущение усталости, вялости и подавленности.
- Частые бронхиты и риниты при отсутствии простудных и вирусных заболеваний.
Нехватка брома не менее серьёзная проблема. Из-за отсутствия в организме необходимого количества вещества у беременных женщин повышается вероятность выкидыша на разных сроках.
Проявляться недостаток микроэлемента может в виде таких симптомов:
- бессонница;
- замедление роста у детей;
- понижение уровня гемоглобина.
Эти проблемы редко ассоциируются именно с нехваткой брома, но всё же лучше обратиться к врачу и сдать необходимые анализы. Такая мера позволит установить причину недомогания и исключить возможность развития более серьёзных заболеваний.
Бром является важным химическим элементом. Он необходим для нормальной жизнедеятельности растений и животных. Недостаток этого неметалла, как и его избыток, может привести к развитию заболеваний. Кроме того, вещество активно применяется в различных сферах деятельности человека. На его основе создаются лекарственные препараты, химические реагенты и инсектициды.
Бром, свойства атома, химические и физические свойства
Br 35 Бром
79,901-79,907* 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5
Бром — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 35. Расположен в 17-й группе (по старой классификации — главной подгруппе седьмой группы), четвертом периоде периодической системы.
Атом и молекула брома. Формула брома. Строение атома брома
- Изотопы и модификации брома
- Свойства брома (таблица): температура, плотность, давление и пр.
- Физические свойства брома
Химические свойства брома. Взаимодействие брома. Химические реакции с бромом
Получение брома
Применение брома
Таблица химических элементов Д.И. Менделеева
Атом и молекула брома. Формула брома. Строение атома брома:
Бром (лат. Bromum, от др.-греч. βρῶμος – «дурной запах, зловоние») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Br и атомным номером 35. Расположен в 17-й группе (по старой классификации – главной подгруппе седьмой группы), четвертом периоде периодической системы.
Бром – неметалл. Относится к группе галогенов.
Бром обозначается символом Br.
Как простое вещество бром при нормальных условиях представляет собой тяжёлую едкую жидкость красно-бурого цвета с сильным неприятным «тяжёлым» запахом, отдалённо напоминающим запах одновременно йода и хлора. Бром – летучее вещество. Бром является единственным жидким неметаллом при нормальных условиях.
Молекула брома двухатомна.
Химическая формула брома Br2.
Электронная конфигурация атома брома 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5. Потенциал ионизации (первый электрон) атома брома равен 1139,86 кДж/моль (11,81381(6) эВ).
Строение атома брома. Атом брома состоит из положительно заряженного ядра (+35), вокруг которого по четырем оболочкам движутся 35 электронов. При этом 28 электронов находятся на внутреннем уровне, а 7 электронов – на внешнем.
Поскольку бром расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями.
Четвертая – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома брома на 4s-орбитали находятся два спаренных электрона, на 4p-орбитали – четыре спаренных и один неспаренный электрон.
В свою очередь ядро атома брома состоит из 35 протонов и 45 нейтронов. Бром относится к элементам p-семейства.
Радиус атома брома (вычисленный) составляет 94 пм.
Атомная масса атома брома составляет 79,901-79,907 а. е. м.
Бром – химически активный неметалл. Ядовит.
Бром, свойства атома, химические и физические свойства
Изотопы и модификации брома:
Свойства брома (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Бром |
| 102 | Прежнее название | |
| 103 | Латинское название | Bromum |
| 104 | Английское название | Bromine |
| 105 | Символ | Br |
| 106 | Атомный номер (номер в таблице) | 35 |
| 107 | Тип | Неметалл |
| 108 | Группа | Галоген |
| 109 | Открыт | Карл Якоб Лёвих, Германия, 1825 г., Антуан Жером Балар, Франция, 1826 г. |
| 110 | Год открытия | 1825 г. |
| 111 | Внешний вид и пр. | Красно-бурая жидкость с сильным неприятным, «тяжёлым» запахом. Летуч, ядовит |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,0003 % |
| 120 | Содержание в морях и океанах (по массе) | 0,0067 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 7,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | |
| 123 | Содержание в метеоритах (по массе) | 0,00012 % |
| 124 | Содержание в организме человека (по массе) | 0,00029 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 79,901-79,907 а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 |
| 203 | Электронная оболочка | K2 L8 M18 N7 O0 P0 Q0 R0  |
| 204 | Радиус атома (вычисленный) | 94 пм |
| 205 | Эмпирический радиус атома* | 115 пм |
| 206 | Ковалентный радиус* | 120 пм |
| 207 | Радиус иона (кристаллический) | Br–
|
| 208 | Радиус Ван-дер-Ваальса | 185 пм |
| 209 | Электроны, Протоны, Нейтроны | 35 электронов, 35 протонов, 45 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 17-ая группа (по старой классификации – главная подгруппа 7-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -1, 0, +1, +3, +4, +5, +7 |
| 302 | Валентность | I, III, V, VII |
| 303 | Электроотрицательность | 2,96 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 1139,86 кДж/моль (11,81381(6) эВ) |
| 305 | Электродный потенциал | Br2 + 2e– → 2Br–, Eo = +1,065 В, Br3– + 2e– → 3Br–, Eo = +1,05 В |
| 306 | Энергия сродства атома к электрону | 324,5369(3) кДж/моль (3,363588(3) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность | 3,4 г/см3 (при -7,3 °C и иных стандартных условиях, состояние вещества – твердое тело), 3,1193 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – жидкость), 3,102 г/см3 (при 25 °C и иных стандартных условиях, состояние вещества – жидкость), 3,0848 , г/см3 (при 30 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | -7,2 °C (265,8 K, 19 °F) |
| 403 | Температура кипения* | 58,8 °C (332,0 K, 137,8 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 10,571 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 29,96 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость* | 75,69 Дж/(K·моль) |
| 411 | Молярный объём | 25,610256 см³/моль |
| 412 | Теплопроводность | 0,122 Вт/(м·К) (при стандартных условиях), 0,005 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Орторомбическая 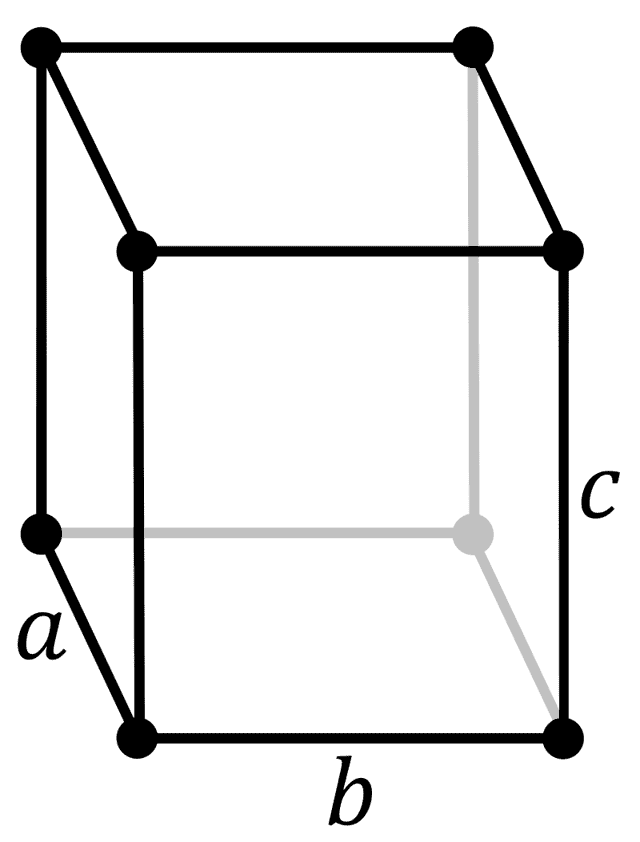 |
| 513 | Параметры решётки | a = 6,67 Å, b = 4,48 Å, c = 8,72 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | Cmca |
| 517 | Номер пространственной группы симметрии | 64 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7726-95-6 |
- Примечание:
- 201* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
- 205* Эмпирический радиус атома брома согласно [1] составляет 120 пм.
- 206* Ковалентный радиус брома согласно [1] и [3] составляет 120±3 пм и 114 пм соответственно.
- 402* Температура плавления брома согласно [3] и [4] составляет -7,25 °С (265,9 K, 18,95 °F).
- 403* Температура кипения брома согласно [3] составляет 58,6 °С (331,9 K, 137,48 °F).
- 407* Удельная теплота плавления (энтальпия плавления ΔHпл) брома согласно [3] и [4] составляет 10,57 кДж/моль и 9,44 кДж/моль соответственно.
- 408* Удельная теплота испарения (энтальпия кипения ΔHкип) брома согласно [3] и [4] составляет 29,56 кДж/моль и 29,5 кДж/моль соответственно.
- 410* Молярная теплоёмкость брома согласно [3] составляет 75,69 Дж/(K·моль).
Физические свойства брома:
Химические свойства брома. Взаимодействие брома. Химические реакции с бромом:
Получение брома:
Применение брома:
Таблица химических элементов Д.И. Менделеева
Таблица химических элементов Д.И. Менделеева
Источники:
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
бром атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле брома
сколько электронов в атоме свойства металлические неметаллические термодинамические
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
- Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
- Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
- Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
- Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Бром (Br, Bromum)
Открытие брома произошло в первой трети XIX столетия, независимо друг от друга немецкий химик Карл Якоб Лёвих в 1825 году, а француз Антуан Жером Балар – в 1826 представили миру новый химический элемент. Интересный факт – изначально Балар назвал свой элемент муридом (от латинского muria – рассол), потому что открытие своё сделал, изучая средиземноморские соляные промыслы.

Общая характеристика Брома
Бром (от древне-греческого βρῶμος , в дословном переводе «вонючий», «зловоние», «вонючка») является элементом главной подгруппы VII группы четвёртого периода периодической системы химических элементов Д.И.
Менделеева (в новой классификации – элементом 17-й группы). Бром – галоген, химически активный неметалл, с атомным номером 35 и молекулярной массой 79,904.
Для обозначения применяется символ Br (от латинского Bromum).
Нахождение брома в природе
Бром – широко распространённый химический элемент, во внешней среде встречается практически везде. Особенно много брома находится в солёной воде – морей и озёр, там он имеется в виде бромида калия, бромида натрия и бромида магния. Наибольшее количество брома образуется при испарении морской воды, есть он и в некоторых горных породах, а также в растениях.
В организме человека находятся до 300 мг брома, в основном в щитовидной железе, так же бром содержит кровь, почки и гипофиз, мышцы и костная ткань.
Физические и химические свойства брома
Бром обычно представляет собой едкую тяжёлую жидкость, имеет красно-бурый цвет и резкий, очень неприятный (зловонный) запах. Является единственным из неметаллов, при комнатной температуре находящийся в жидком состоянии.
Бром (а также – пары брома)– токсичное и ядовитое вещество, при работе с ним необходимо применять средства химической защиты, потому что при попадании на кожу и слизистые человека бром образует ожоги.
Состав природного брома – два стабильных изотопа (79Br и 81Br), молекула брома состоит из двух атомов и имеет химическую формулу Br2.
Суточная потребность организма в броме
Потребность здорового организма в броме – не более 0,8-1 г.
Продукты питания богатые бромом
Наряду с имеющимся в организме, бром человек получает с пищевыми продуктами. Основными поставщиками брома являются орехи (миндаль, фундук, арахис), бобовые (фасоль, горох и чечевица), пшеница и макаронные изделия из твёрдых сортов пшеницы, ячневая крупа, молочные продукты, водоросли и практически все виды морской рыбы.

Опасность и вред брома
Элементарный бром – сильнодействующий яд, принимать внутрь его категорически запрещено. Пары брома могут вызвать отёк лёгких, особенно у тех, кто склонен к аллергическим реакциям или имеет заболевания лёгких и дыхательных путей (очень опасны пары брома для астматиков).
Не рекомендуется применять препараты брома людям, в силу специфики работы нуждающимся в стабильной концентрации внимания (водителям, альпинистам, монтажникам-высотникам).
Признаки избытка брома
Переизбыток данного вещества обычно бывает при передозировке препаратов брома, для людей категорически нежелательна, потому что может представлять реальную опасность для здоровья.
Основные признаки избытка брома в организме – воспаления и высыпания на коже, сбои в работе пищеварительной системы, общая вялость и подавленность, постоянные бронхиты и риниты, не связанные с простудами и вирусами.
Признаки нехватки брома
Нехватка в организме брома проявляется бессонницей, замедлением роста у детей и подростков, понижением уровня гемоглобина в крови, но, не всегда эти симптому связывают именно с недостаточным количеством брома, поэтому для подтверждения подозрений, нужно посетить доктора и сдать необходимые анализы. Часто из-за нехватки брома повышается риск самопроизвольного прерывания беременности (выкидыш на разных сроках, вплоть до третьего триместра).
Полезные свойства брома и его влияние на организм
Бром (в виде бромидов) применяется при различных заболеваниях, основное его действие – седативное, поэтому препараты брома часто назначаются при нервных расстройствах и нарушениях сна.
Соли брома являются эффективным средством для лечения заболеваний, вызывающих судороги (особенно эпилепсии), а также нарушений деятельности сердечно-сосудистой системы и некоторых желудочно-кишечных недугов (язвы желудка и двенадцатиперстной кишки).
Усвояемость брома
Усвояемость брома замедляют хлор, алюминий, йод и фтор, поэтому принимать препараты, содержащие соли брома нужно только после консультации с врачом.
Бром и его влияние на мужскую потенцию
Вопреки ничем не подтверждённым слухам (больше похожим на анекдоты), бром не оказывает угнетающего воздействия на половое влечение и потенцию мужчин.
Якобы бром в виде белого порошка добавляют в еду молодым бойцам в армии, а также пациентам мужского пола в псих-диспансерах и заключённым в тюрьмах и колониях.
Этому нет ни одного научного подтверждения, а слухи можно объяснить способностью брома (его препаратов) оказывать успокаивающее воздействие.
По некоторым источникам, бром способствует активизации половой функции у мужчин и увеличению как объёма эякулянта, так и количества сперматозоидов, в нём содержащихся.

Применение брома в жизни
Бром применяется не только в медицине (бромид калия и бромид натрия), но и в других областях, например в фотографии, нефтедобыче, в производстве моторного топлива. Бром используется при изготовлении боевых отравляющих веществ, что ещё раз подчёркивает необходимость осторожного обращения с данным элементом.
Бром | это… Что такое Бром?
| 35 | Бром |
| 3d104s24p5 |
Бром (от др.-греч. βρῶμος «вонючка», «вонючий») — элемент 17-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы VII группы), четвёртого периода, с атомным номером 35[2].
Обозначается символом Br (лат. Bromum). Химически активный неметалл, относится к группе галогенов. Простое вещество бром (CAS-номер: 7726-95-6) при нормальных условиях — тяжёлая жидкость красно-бурого цвета с сильным неприятным запахом.
Молекула брома двухатомна (формула Br2).
История
Бром был открыт в 1826 году молодым преподавателем колледжа города Монпелье А. Ж. Баларом. Открытие Балара сделало его имя известным всему миру.
Из одной популярной книги в другую кочует утверждение, что огорчённый тем, что в открытии брома никому неизвестный Антуан Балар опередил самого Юстуса Либиха, Либих воскликнул, что, дескать, не Балар открыл бром, а бром открыл Балара. Однако это неправда, или, точнее, не совсем правда: фраза принадлежала не Ю.
Либиху, а Шарлю Жерару, который очень хотел, чтобы кафедру химии в Парижском университете занял Огюст Лоран, а не избранный на должность профессора А. Балар.
Происхождение названия
Название элемента происходит от др.-греч. βρῶμος — дурной запах, зловоние[3].
Нахождение в природе
Ампула с бромом внутри акрилового куба
Кларк брома — 1,6 г/т. Бром широко распространён в природе и в рассеянном состоянии встречается почти повсеместно. Почти все соединения брома растворимы в воде и поэтому легко выщелачиваются из горных пород. Как примесь, он есть в сотнях минералов. Но имеется лишь небольшое количество нерастворимых в воде минералов — галогенидов серебра и меди. Самый известный из них — бромаргирит AgBr. Другие минералы — йодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br). Собственных минералов брома мало еще и потому, что его ионный радиус очень большой и ион брома не может надежно закрепиться в кристаллической решетке других элементов, вместе с катионами средних размеров. В накоплении брома основную роль играют процессы испарения океанической воды, в результате чего он накапливается как в жидкой, так и в твёрдой фазах. Наибольшие концентрации отмечаются в конечных маточных рассолах. В горных породах бром присутствует главным образом в виде ионов, которые мигрируют вместе с грунтовыми водами. Часть земного брома связана в организмах растений в сложные и большей частью нерастворимые органические соединения. Некоторые растения активно накапливают бром. Это в первую очередь бобовые — горох, фасоль, чечевица, а также морские водоросли. В море сосредоточена большая часть брома. Есть он и в воде соленых озер, и в подземных водоносных пластах, сопутствующих месторождениям горючих ископаемых, а также калийных солей и каменной соли. Есть бром и в атмосфере, причем содержание этого элемента в воздухе приморских районов всегда больше, чем в районах с резко континентальным климатом.
В качестве исходного сырья для производства брома служат:
- Морская вода (65 мг/л[4])
- Рассолы соляных озёр
- Щёлок калийных производств
- Подземные воды нефтяных и газовых месторождений
Получение
Австралийский эмболит — Ag(Cl, Br)
Бром получают химическим путём из рассола Br−:
Физические свойства
При обычных условиях бром — красно-бурая жидкость с резким неприятным запахом, ядовит, при соприкосновении с кожей образуются ожоги. Бром — одно из двух простых веществ (и единственное из неметаллов), наряду со ртутью, которое при комнатной температуре является жидким.
Плотность при 0 °C — 3,19 г/см³. Температура плавления (затвердевания) брома −7,2 °C, кипения 58,8 °C, при кипении бром превращается из жидкости в буро-коричневые пары, при вдыхании раздражающие дыхательные пути.
Стандартный электродный потенциал Br2/Br− в водном растворе равен +1,065 В.
Природный бром состоит из двух стабильных изотопов 79Br (50,56 %) и 81Br (49,44 %). Искусственно получены многочисленные радиоактивные изотопы брома.
Химические свойства
В свободном виде существует в виде двухатомных молекул Br2. Заметная диссоциация молекул на атомы наблюдается при температуре 800 °C и быстро возрастает при дальнейшем росте температуры. Диаметр молекулы Br2 равен 0,323 нм, межъядерное расстояние в этой молекуле — 0,228 нм.
Бром немного, но лучше других галогенов растворим в воде (3,58 г в 100 г воды при 20 °C), раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот:
С большинством органических растворителей бром смешивается во всех отношениях, при этом часто происходит бромирование молекул органических растворителей.
По химической активности бром занимает промежуточное положение между хлором и иодом. При реакции брома с растворами иодидов выделяется свободный иод:
Напротив, при действии хлора на бромиды, находящиеся в водных растворах, выделяется свободный бром:
При реакции брома с серой образуется S2Br2, при реакции брома с фосфором — PBr3 и PBr5. Бром реагирует также с неметаллами селеном и теллуром.
Реакция брома с водородом протекает при нагревании и приводит к образованию бромоводорода HBr. Раствор HBr в воде — это бромоводородная кислота, по силе близкая к соляной кислоте HCl.
Соли бромоводородной кислоты — бромиды (NaBr, MgBr2, AlBr3 и др.).
Качественная реакция на присутствие бромид-ионов в растворе — образование с ионами Ag+ светло-желтого осадка бромида серебра AgBr, практически нерастворимого в воде.
С кислородом и азотом бром непосредственно не реагирует. Бром образует большое число различных соединений с остальными галогенами.
Например, со фтором бром образует неустойчивые BrF3 и BrF5, с иодом — IBr. При взаимодействии со многими металлами бром образует бромиды, например, AlBr3, CuBr2, MgBr2 и др.
Устойчивы к действию брома тантал и платина, в меньшей степени — серебро, титан и свинец.
Жидкий бром легко взаимодействует с золотом, образуя трибромид золота AuBr3:[5].
Бром — сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион — до нитрата и т. д.
При взаимодействии с органическими соединениями, содержащими двойную связь, бром присоединяется, давая соответствующие дибромпроизводные:
Присоединяется бром и к органическим молекулам, в составе которых есть тройная связь. Обесцвечивание бромной воды при пропускании через нее газа или добавлении к ней жидкости свидетельствует о том, что в газе или в жидкости присутствует непредельное соединение.
При нагревании в присутствии катализатора бром реагирует с бензолом с образованием бромбензола C6H5Br (реакция замещения).
При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия или калия образуются соответствующие бромиды и броматы, например:
Бромсодержащие кислоты
Помимо бескислородной бромоводородной кислоты HBr, бром образует ряд кислородных кислот: бромную HBrO4, бромноватую HBrO3, бромистую HBrO.
Применение
В химии
- Вещества на основе брома широко применяются в основном органическом синтезе.
- «Бромная вода» (водный раствор брома) применяется как реагент для качественного определения непредельных органических соединений.
В технике
- Бромид серебра AgBr применяется в фотографии как светочувствительное вещество.
- Используется для создания антипиренов — добавок, придающих пожароустойчивость пластикам, древесине, текстильным материалам.
- Пентафторид брома иногда используется как очень мощный окислитель ракетного топлива.
- 1,2-дибромэтан в настоящее время применяют как антидетонирующую добавку в моторном топливе, взамен тетраэтилсвинца.
- Растворы бромидов используются в нефтедобыче.
- Растворы бромидов тяжёлых металлов используются как «тяжёлые жидкости» при обогащении полезных ископаемых методом флотации.
- Многие броморганические соединения применяются как инсектициды и пестициды.
В медицине
В производстве оружия
Со времен Первой мировой войны бром используется для производства боевых отравляющих веществ.
Физиологическое действие
Бром и его пары сильно токсичны. Уже при содержании брома в воздухе в концентрации около 0,001 % (по объёму) наблюдается раздражение слизистых оболочек, головокружение, носовые кровотечения, а при более высоких концентрациях — спазмы дыхательных путей, удушье. ПДК паров брома 0,5 мг/м³.
Летальная доза, при которой происходит гибель 50 % животных, при пероральном введении для крыс составляет 1700 мг/кг. Для человека смертельная доза перорально составляет 14 мг/кг. (источник — каталог фирмы MERCK).
При отравлении парами брома пострадавшего нужно немедленно вывести на свежий воздух (как можно в более ранней стадии показаны ингаляции кислорода); для восстановления дыхания можно на небольшое время пользоваться тампоном, смоченным нашатырным спиртом, на короткое время периодически поднося его к носу пострадавшего.
Дальнейшее лечение должно проводиться под наблюдением врача. Рекомендуются ингаляции тиосульфата натрия в виде 2 % водного раствора, обильное питьё теплого молока с минеральной водой или содой, кофе.
Особенно опасно отравление парами брома людей, страдающих астмой и заболеваниями лёгких, так как при вдыхании паров брома очень высока вероятность отёка лёгких. Жидкий бром при попадании на кожу вызывает болезненные и долго не заживающие ожоги.
Утечкой брома из железнодорожного вагона было вызвано чрезвычайное происшествие в городе Челябинске, вызвавшее отравление сотен жителей. Более 50 человек на следующий день лежали в больницах города с острым отравлением. Большинство — жители Ленинского района.
Особенности работы
При работе с бромом следует пользоваться защитной спецодеждой, противогазом, специальными перчатками.
Из-за высокой химической активности и токсичности, как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно укупоренной толстостенной посуде.
Сосуды с бромом располагают в ёмкостях с песком, который предохраняет сосуды от разрушения при встряхивании. Из-за высокой плотности брома сосуды с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда бром окажется на полу).
По реакции, указанной ниже, целесообразно посыпать проливы карбонатом натрия:
либо влажной пищевой содой:
Однако реакция элементарного брома с содой носит сильно экзотермический характер, что ведёт к увеличению испарения брома, к тому же, выделяющаяся углекислота также способствует испарению, поэтому пользоваться вышеописанными методами не рекомендуется.
Лучше всего для дегазации брома подходит водный раствор тиосульфата натрия Na2S2O3. Для локализации больших проливов брома можно использовать раствор тиосульфата натрия с добавками пенообразующих веществ и аэросила.
Этот же раствор (3-5 % тиосульфат натрия) используется для смачивания ватно-марлевых повязок, которые помогают защитить органы дыхания от паров брома.
Мифы и легенды
Существует широко распространенная легенда о том, что в армии будто бы добавляют бром в еду для снижения полового влечения. Происхождение этого мифа неизвестно.
Препараты брома солёные на вкус[6] и не влияют ни на влечение, ни на потенцию. Они обладают снотворным и успокаивающим эффектом[7].
Ни в коем случае нельзя путать «аптечный бром» (водные растворы бромида калия или натрия), который применяют при расстройствах нервной системы и элементарный бром, который является высокотоксичным веществом. Принимать элементарный бром внутрь ни в коем случае нельзя — это яд.[8]
См. также
- Утечка брома в Челябинске






