- Характеристика амфотерных металлов
- Характеристики элементов-металлов
- Физические свойства
- Способы получения
- Химические свойства
- Оксиды алюминия и цинка
- Гидроксиды алюминия и цинка
- Важнейшие химические свойства солей
- Фактчек
- Проверь себя
- Получение и сферы применения амфотерных металлов
- Какие элементы относятся к амфотерным?
- Получение
- Амфотерные металлы
- Амфотерные металлы
- Что такое амфотерные металлы
- Свойства амфотерных металлов
- Как отличить металл от неметалла
- Основания амфотерных металлов
- Урок 8: Амфотерные элементы
- Основное понятие амфотерности
- Расположение амфотерных элементов в таблице Менделеева
- Строение атома амфотерных элементов
- Представители амфотерных элементов
- Цинк как амфотерный элемент
- Алюминий как амфотерный элемент
- Свойства металлов Al и Zn как простых веществ
- Получение алюминия и цинка
- Химические свойства алюминия и цинка
- Взаимодействие с неметаллами
- Взаимодействие с металлами
- Взаимодействие с кислотами и щелочами
- Взаимодействие с водой
- Оксиды цинка и алюминия
- Применение алюминия и цинка
- Сплавы алюминия и цинка
- Сплавы алюминия
- Сплавы цинка
- Особенности строения атомов амфотерных металлов;
- Физические и химические свойства;
- И нашим, и вашим: обсудим амфотерность цинка и алюминия.
Кто-то любит соленое, кто-то любит сладкое, а кто-то — и то, и другое. То же самое происходит и с амфотерными металлами.
Характеристика амфотерных металлов
Под амфотерностью понимают способность соединений проявлять одновременно и кислотные, и основные свойства в зависимости от условий и природы реагентов, участвующих в реакции.
Список амфотерных металлов включает в себя множество наименований. Из них мы рассмотрим цинк и алюминий.
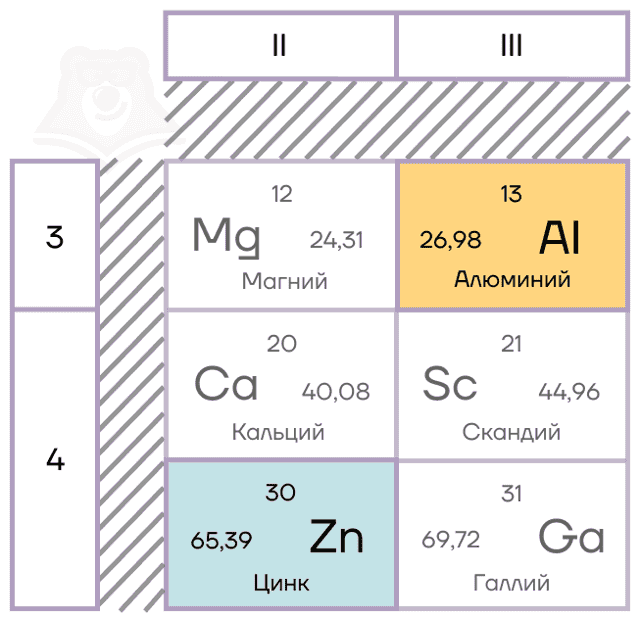
Характеристики элементов-металлов
Алюминий — элемент IIIA группы третьего периода. Его электронная конфигурация [Ne]3s23p1.
В возбужденном состоянии электронная пара на 3s-орбитали распаривается. В результате образуются три неспаренных электрона, которые способны образовывать химические связи. Поэтому у алюминия постоянная степень окисления +3.
Цинк — расположен во IIВ группе в четвертом периоде. Цинк относится к d-элементам, при этом атом цинка имеет полностью заполненные 3d– и 4s– электронные подуровни.
Его электронная конфигурация в основном состоянии [Ar]3d104s2. В соединениях цинк проявляет постоянную степень окисления +2.
Физические свойства

Алюминий — лёгкий серебристо-белый металл, покрывающийся на воздухе оксидной плёнкой из-за взаимодействия с кислородом (на фото расположен слева). Из алюминия часто делают тысячи вещей, которые окружают нас в быту: от фольги на баночке йогурта до стильного корпуса смартфона.
Цинк — голубовато-белый металл (на фото расположен справа).
Способы получения

Химические свойства
По химическим свойствам они являются типичными восстановителями, а значит, способны реагировать с окислителями. Как и другие металлы, они будут взаимодействовать со своими противоположностями — неметаллами. Также они будут вступать в реакции вытеснения с водой, кислотами-неокислителями, щелочами и солями менее активных металлов.
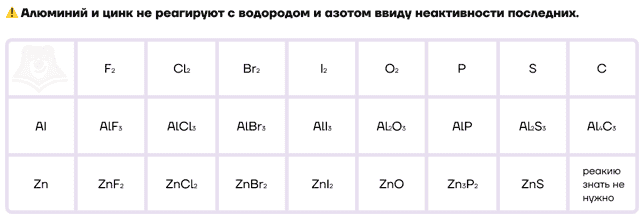
Как типичные металлы, алюминий и цинк способны вступать в реакции с неметаллами и образовывать различные бинарные соединения.
Ввиду низких значений электроотрицательности алюминий и цинк, как и другие металлы, являются отличными восстановителями. Настолько сильными, что они даже способны восстанавливать некоторые металлы и неметаллы из их оксидов. Этот процесс называется металлотермией.
| Активные металлы (стоящие до алюминия в ряду активности) не получают путём восстановления из оксидов. |
Алюминий является очень активным металлом, который, помимо этого, ещё и является одним из наиболее распространённых в земной коре.
Его очень часто используют в металлургии для получения других металлов из их оксидов. Этот процесс называется алюмотермией.
Так как алюминий и цинк — металлы, стоящие в ряду активности левее водорода, то они способны вытеснять водород из воды.

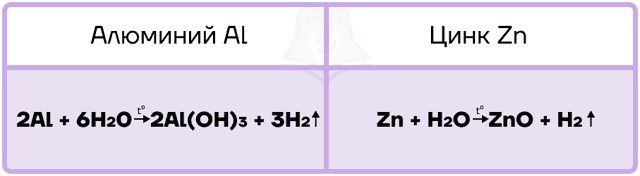
Алюминий, подобно другим активным металлам, при взаимодействии с водой образует гидроксид и водород.
Цинк является уже менее активным металлом, поэтому нуждается в создании более жёстких условий для реакции с водой. Он взаимодействует только с перегретым водяным паром и в таких жёстких условиях вытесняет из воды ОБА атома водорода, превращаясь в оксид.
Алюминий и цинк также способны вытеснять водород не только из воды, но и из кислот-неокислителей.
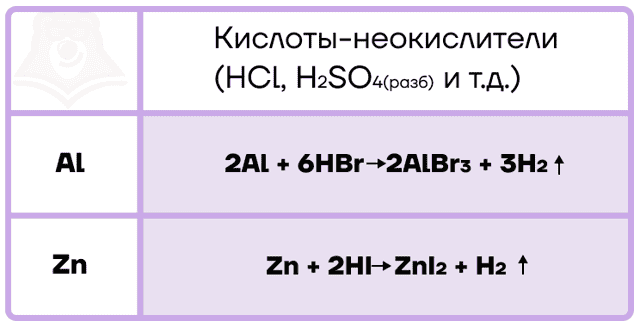
С кислотами-окислителями протекают более сложные ОВР, при этом помним, что в холодных концентрированных растворах кислот-окислителей алюминий пассивируется из-за наличия оксидной плёнки на его поверхности.
Амфотерные металлы реагируют со щелочами, причем продукты зависят от определенных условий:
Как и другие металлы, алюминий и цинк способны вытеснять менее активные металлы из их солей.
Оксиды алюминия и цинка
Оксиды алюминия и цинка по физическим свойствам представляют собой бесцветные порошки, нерастворимые в воде.
По химическим свойствам это типичные амфотерные оксиды, которые способны вступать в основно-кислотные взаимодействия как с основным, так и с кислотным. Как и другие оксиды, они могут вступать в ОВР с сильными восстановителями с восстановлением из них металла.
Оксидам алюминия и цинка соответствуют нерастворимые гидроксиды Al(OH)3 и Zn(OH)2, поэтому и сами оксиды с водой не взаимодействуют.
- Амфотерные свойства оксидов
Как типичные амфотерные оксиды, оксиды алюминия и цинка будут реагировать как с веществами, проявляющими основные свойства (основаниями, основными оксидами), так и с веществами, проявляющими кислотные свойства (кислотами, кислотными оксидами):
- ОВР с сильными восстановителями
Как и другие оксиды, оксид цинка может вступать в ОВР с сильными восстановителями (C, CO, H2, Al, Mg, Ca и т. д.) с восстановлением из них металла.
Гидроксиды алюминия и цинка
По физическим свойствам гидроксиды алюминия и цинка представляют собой белые порошкообразные вещества, нерастворимые в воде. Все их химические свойства обусловлены тем, что они являются амфотерными гидроксидами: они способны вступать в реакции как с основным, так и с кислотным.
Помимо этого, как и для других нерастворимых гидроксидов, для гидроксидов алюминия и цинка характерны реакции термического разложения.
- Гидроксиды алюминия и цинка как амфотерные гидроксиды
- Термическое разложение гидроксидов
Подобно другим нерастворимым гидроксидам, нерастворимые Al(OH)3 и Zn(OH)2 способны разлагаться при нагревании на соответствующий оксид и воду.
Важнейшие химические свойства солей
- Реакции с растворами щелочей
Соли алюминия и цинка реагируют с растворами щелочей.
- Разрушение комплексных солей и их аналогов кислотами
Если сильная кислота находится в недостатке, её хватает только для самого сильного металла (щелочного или щелочно-земельного). В результате образуется соль и амфотерный гидроксид, возможно также образование воды.
Если сильная кислота находится в избытке, её хватает на оба металла: образуются две соли и вода.
Со слабыми кислотами (угольной CO2(р-р), сернистой SO2(р-р), сероводородной H2S) ситуация немного сложнее:
- Если слабая кислота находится в недостатке, её также хватает только для самого сильного металла (щелочного или щелочно-земельного).
— Если слабая кислота находится в избытке, в продуктах образуется кислая соль (из-за избытка кислотного) и амфотерный гидроксид.Со слабой кислотой он не взаимодействует, так как сам слабый.
При нагревании комплексной соли будет происходить выпаривание из неё воды. В анионе там, где нет воды (например, в расплаве), образуются средние соли с амфотерными металлами.
Самые “страшные” реакции с участием комплексных солей — их реакции с солями. Чтобы их написать, можно для себя представить комплексную соль как совокупность щёлочи и амфотерного гидроксида.
Фактчек
- Алюминий и цинк относятся к амфотерным металлам, то есть таким, которые могут реагировать и с кислотами, и со щелочами в зависимости от природы реагирующих веществ.
- Алюминий относится к p-элементам, его постоянная степень окисления +3; цинк относится к d-элементам, его постоянная степень окисления +2.
- Алюминий и цинк реагируют с рядом веществ: неметаллами, водой, кислотами, щелочами, солями.
- Оксиды и гидроксиды алюминия и цинка также обладают амфотерными свойствами ,что определяет их химическое поведение в различных реакциях.
- Алюминий и цинк способны образовывать особый тип солей, называемый комплексными.
Проверь себя
Задание 1.Какими свойствами обладают алюминий, цинк и их оксиды и гидроксиды?
- Основными свойствами;
- Кислотными свойствами;
- Амфотерными свойствами;
- Нейтральными свойствами.
Задание 2.Цинк реагирует с водой с образованием:
- Оксида цинка и водорода;
- Гидроксид цинка и водорода;
- Цинката и водорода;
- Гидрида цинка и кислорода.
Задание 3.Что можно наблюдать при приливании раствора гидроксида натрия к раствору хлорида алюминия?
- Выделение газа;
- Выпадение осадка;
- Видимых изменений не наблюдается;
- Выпадение осадка, а затем его растворение.
Задание 4.Что образуется в реакции оксида цинка и сернистого газа?
- Сульфат цинка;
- Сульфит цинка;
- Сульфид цинка и кислород;
- Реакция не идет.
Задание 5.Какая соль образуется при взаимодействии тетрагидроксоалюмината натрия и избытка сероводорода?
- Средняя соль;
- Комплексная соль;
- Кислая соль;
- Основная соль.
ОТВЕТЫ: 1. — 3; 2. — 1; 3. — 4; 4. — 4; 5. — 3
Получение и сферы применения амфотерных металлов
Амфотерные металлы — группа простых элементов, которые похожи с материалами из металлической группы. Сходства проявляются в свойствах, характеристиках. Сами по себе компоненты из металлической группы не проявляют подобных свойств, но их соединения часто становятся амфотерными.
 Амфотерные металлы
Амфотерные металлы
Какие элементы относятся к амфотерным?
Амфотерными называют — соединения, которые проявляют химическую двойственность. Они делятся на 3 группы:
- Оксиды — Cu2O, Cr2O, PbO2, PbO, SnO
- Гидроксиды — Al(OH)3, Fe(OH)3, Zn(OH)2.
К третьей группе относятся металлы — алюминий, медь, железо, цинк, бериллий, свинец и т. д. Они занимают значительную часть в периодической таблице Менделеева и находятся под порядковыми номерами — 22–32, 40–51. Другие идут по отдельности.
Представители металлов:
- Железо. Относится к группе амфотерных. Представляет собой простое вещество. Характерные свойства — серебристо-белый цвет, ковкость, универсальность. Если поместить железо в чистый кислород, оно полностью перегорит, а если сделать его мелкодисперсным, может произойти самовозгорание на открытом воздухе. Оксид железа образуется при его горении в среде, насыщенной чистым кислородом. Он представляет собой окалину.
- Алюминий. На открытом воздухе покрывается прочной оксидной пленкой, которая защищает его от образования ржавчины. Если раздробить его до мелких частиц, начинает взаимодействовать с кислородом. При контакте с кислородом выделяется большое количество тепла. Если нагреть алюминий до 200°C, он начинает взаимодействовать серой. В результате такой реакции образуется сульфид алюминия.
Амфотерные металлы — простые элементы, которые являются аналогами группы веществ металлического типа. Сходства можно увидеть в химических, физических свойствах.
Получение
Для получения амфотерных металлов, ученые применяют тот же процесс, что при выделении нерастворимых в воде оснований. Перед проведением работ нужно получить больше информации о взаимодействии амфотерных соединений с щелочами, поскольку с помощью щелочного раствора будет выделяться металл.
Примеры:
- Для получения гидроксида цинка нужно смешать раствор сульфата цинка с гидроксидом натрия.
- Для получения гидроксида алюминия нужно смешать раствор сульфата алюминия с раствором гидроксида калия.
- Для получения трехвалентных гидроксидов хрома, алюминия нужно смешать раствор карбоната с раствором на основе солей этих металлов.
Амфотерные металлы

Амфотерные тела – это такие вещества, которые напоминают своим строением, характеристиками металлические элементы. К тому же им свойственна и химическая двойственность.
Амфотерные тела – это не металлы, а их формы: оксиды, соли и т. д. Ряд оксидов может сочетать в себе 2 свойства и при определенных условиях проявлять параметры как кислот, так и щелочей.
Известными не понаслышке амфотерными материалами является алюминий, хром, цинк и т. д.
Впервые сам термин «амфотерность» появился в начале 19 столетия. На тот период химические компоненты классифицировали на основании их похожих свойств, которые можно наблюдать во время протекания реакций.
Амфотерные металлы: особенности, виды
Перечень амфотерных металлов немалый, причем далеко не все из них являются чистыми амфотерными, а лишь условными.
Вещества все обозначены в таблице Менделеева под определенными порядковыми номерами. Так, железо, бериллий, хром и стронций считаются основными аморфными элементами. Также типичным и распространенным в природе представителем является алюминий.
Металл алюминий повсеместно применяется в быту и промышленности в самых различных областях. Его используют для изготовления фюзеляжей самолетов, кухонной посуды, автомобильных кузовов, электрических приборов, электронной техники, приборов для тепловых сетей.
Алюминий отличается от других металлов тем, что всегда остается химически активным. На поверхности стабильно располагается оксидная пленка, которая защищает материал от окисления. Благодаря этому при нормальных условиях и возникновении реакций металл с восстановительным веществом.
Алюминий вступает в реакцию с кислородом, если предварительно был разделен на более мелкие фракции. Также для такой манипуляции потребуются повышенные температуры. Примечательно, что сама реакция продуцирует уйму тепловой энергии. Если повысить температуру до 200 ºC, то прореагировать алюминий может и с серой.
При смешивании с различными металлами алюминий может давать различные функциональные сплавы с получением дополнительных свойств.
Не при всех условиях вещество вступает с реакцию с водородом.
Еще один типичный представитель амфотерных металлов – железо, который располагается под номером 26 в Таблице и находится между марганцем и кобальтом.
Железо считается одним из самых доступных элементов, залежи которого расположены в земной коре. Он одновременно является компонентом бело-серебристого цвета с хорошей ковкостью при высоких температурах. В то же время вещество может быть коррозировать при сильном нагревании.
А в случае помещения его в среду чистого кислорода можно ожидать воспламенения и даже перегорания железа. Также, находясь на открытом воздухе, железо под воздействием высокой влажности начинает стремительно окисляться и даже ржаветь.
А в процессе горения в массе с кислородом железо дает определенную окалину – это и есть его оксид.
Свойства амфотерных веществ
Главные характеристики этих веществ заключены в самом понятии амфотерности. Так, в своем обычном состоянии при подходящих условиях внешней среды большинство металлов являются твердыми веществами. При этом ни один металл не растворим в обычной воде.
А щелочные же основания могут выделяться только после начала некоторых химических реакций. И тогда в процессе соли в составе метала начинают реагировать.
Необходимо обратить внимание, что правила безопасности требуют повышенной осторожности во время наблюдения за такими реакциями.
В процессе соединения амфотерных материалов с кислотными реагентами или оксидами они показывают химическую реакцию, характерную для оснований. В случае, когда металлы реагируют с основаниями, регистрируются, наоборот кислотные характеристики.
Если амфотерные гидроксиды подвергнуть нагреванию, то в результате они распадутся на оксид и воду.
Отметим, что амфотерные материалы обладают самыми различными свойствами, которые изучаются научными светилами до сих пор. Свойства также можно разобрать, сравнивая их с характеристиками обычных материалов. Так, многие металлы демонстрируют малый потенциал ионизации, что наделяет их свойствами восстановителя во время реакции.
Амфотерные тела демонстрируют сразу 2 свойства: окислительное и восстановительное. При этом некоторые соединения имеют отрицательный уровень окисления.
Все металлы, представленные в таблице Менделеева, образуют основные оксиды и гидроксиды.
Интересный момент – металлы могут окисляться далеко не со всеми кислотами в реакциях. Само окисление может не давать взаимодействие с азотной кислотой.
Простые амфотерные материалы имеют различную структуру и характеристики.
Некоторые вещества имеют такие характеристики, что их принадлежность к определенному классу можно выявить даже визуально. Так, мы сразу понимаем, что медь и алюминий – это металл.
Неметалл и металл: в чем же разница
Известно, что металлы выделяют электроны со своего внешнего электронного поля (облака). В свою очередь неметаллы притягивают такие электроны.
Также металлы хорошо проводят электроток и тепло, в отличие от неметаллов, полностью лишенных таких свойств.
Основания амфотерных маметиралов
При располагающих условиях основания нерастворимы в воде, можно сказать, являются довольно слабыми электролитами. Образуются они в результате химической реакции солей металла и щелочной жидкости. Такая химическая реакция опасна для лаборанта, поэтому для получения гидроксидов необходимо вводить едкие вещества осторожно, капля за каплей.
Амфотерные материалы реагируют с кислотами в роли оснований. В случае когда гидроксид цинка реагирует с соляной кислотой, то на выходе получится хлорид цинка. При реакции с основаниями материалы, напротив, выступают кислотами.
Амфотерные металлы
Простые вещества сходные с металлическими элементами по структуре и ряду химических и физических параметров называют амфотерными, т.е. это те элементы, проявляющие химическую двойственность.
Надо отметить, что это не сами металли, а их соли или оксиды.
К, примеру, оксиды некоторых металлов могут обладать двумя свойствами, при одних условиях они могут проявлять свойства присущие кислотам, в других, они ведут себя как щелочи.
К основным амфотерным металлам относят алюминий, цинк, хром и некоторые другие.
Термин амфотерность был введен в оборот в начале XIX века. В то время химические вещества разделяли на основании их сходных свойств, проявляющиеся при химических реакциях.
Что такое амфотерные металлы
Список металлов, которые можно отнести амфотерным, достаточно велик. Причем некоторые из них можно назвать амфотерными, а некоторые – условно.
Перечислим порядковые номера веществ, под которыми они расположены в Таблице Менделеева. В список входят группы с 22 по 32, с 40 по 51 и еще много других. Например, хром, железо и ряд других можно с полным основанием называть основными, к последним можно отнести и стронций с бериллием.
Кстати, самым ярким представителем амфорных металлов считают алюминий.
Именно его сплавы в течение длительного времени используют практически во всех отраслях промышленности. Из него делают элементы фюзеляжей летательных аппаратов, кузовов автомобильного транспорта, и кухонную посуду.
Он стал незаменим в электротехнической промышленности и при производстве оборудования для тепловых сетей. В отличии от многих других металлов алюминий постоянно проявляет химическую активность. Оксидная пленка, которая покрывает поверхность металла, противостоит окислительным процессам.
В обычных условиях, и в некоторых типах химических реакций алюминий может выступать в качестве восстановительного элемента.
Этот металл способен взаимодействовать с кислородом, если его раздробить на множество мелких частиц. Для проведения операции такого рода необходимо использование высокой температуры. Реакция сопровождается выделением большого количества тепловой энергии.
При повышении температуры в 200 ºC, алюминий вступает в реакцию с серой. Все дело в том, что алюминий, не всегда, в нормальных условиях, может вступать в реакцию с водородом. Между тем, при его смешивании с другими металлами могут возникать разные сплавы.
Еще один ярко выраженный металл, относящийся к амфотерным – это железо. Этот элемент имеет номер 26 и расположен между кобальтом и марганцем. Железо, самый распространенный элемент, находящийся в земной коре.
Железо можно классифицировать как простой элемент, имеющий серебристо-белый цвет и отличается ковкостью, разумеется, при воздействии высоких температур. Может быстро начинать коррозировать под воздействием высоких температур.
Железо, если поместить его в чистый кислород полностью прогорает и может воспламениться на открытом воздухе.
Такой металл обладает способностью быстро переходить в стадию корродирования при воздействии высокой температуры. Помещенное в чистый кислород железо полностью перегорает. Находясь на воздухе металлическое вещество, быстро окисляется вследствие чрезмерной влажности, то есть, ржавеет. При горении в кислородной массе образуется своеобразная окалина, которая называется оксидом железа.
Свойства амфотерных металлов
Они определены самим понятием амфотерности. В типовом состоянии, то есть обычной температуре и влажности, большая часть металлов представляет собой твердые тела. Ни один металл не подлежит растворению в воде.
Щелочные основания проявляются только после определенных химических реакций. В процессе прохождения реакции соли металла вступают во взаимодействие.
Надо отметить что правила безопасности требуют особой осторожности при проведении этой реакции.
Соединение амфотерных веществ с оксидами или самими кислотами первые показывают реакцию, которая присуща основаниями. В тоже время если их соединять с основаниями, то будут проявляться кислотные свойства.
Нагрев амфотерных гидроксидов вынуждает их распадаться на воду и оксид. Другими словами свойства амфотерных веществ весьма широки и требуют тщательного изучения, которое можно выполнить во время химической реакции.
Свойства амфотерных элементов можно понять, сравнив их с параметрами традиционных материалов. Например, большинство металлов имеют малый потенциал ионизации и это позволяет им выступать в ходе химических процессов восстановителями.
Амфотерные — могут показать как восстановительные, так и окислительные характеристики. Однако, существуют соединения которые характеризуются отрицательным уровнем окисления.
Абсолютно все известные металлы имеют возможность образовывать гидроксиды и оксиды.
Всем металлам свойственна возможность образования основных гидроксидов и оксидов. Кстати, металлы могут вступать в реакцию окисления только с некоторыми кислотами. Например, реакция с азотной кислотой может протекать по-разному.
Амфотерные вещества, относящиеся к простым, обладают явными различиями по структуре и особенностям. Принадлежность к определенному классу можно у некоторых веществ определить на взгляд, так, сразу видно что медь – это металл, а бром нет.
Как отличить металл от неметалла
Главное различие заключается в том, что металлы отдают электроны, которые находятся во внешнем электронном облаке. Неметаллы, активно их притягивают.
Все металлы являются хорошими проводниками тепла и электричества, неметаллы, такой возможности лишены.
Основания амфотерных металлов
В нормальных условиях это вещества не растворяются в воде и их можно спокойно отнести к слабым электролитам. Такие вещества получают после проведения реакции солей металла и щелочи. Эти реакции довольно опасны для тех, кто их производит и поэтому, например, для получения гидроксида цинка в емкость с хлоридом цинка медленно и аккуратно, по капле надо вводить едкий натр.
Вместе тем, амфотерные — взаимодействуют с кислотами как основания. То есть при выполнении реакции между соляной кислотой и гидроксидом цинка, появится хлорид цинка. А при взаимодействии с основаниями, они ведут себя как кислоты.
Урок 8: Амфотерные элементы
- План урока:
- Основное понятие амфотерности
- Расположение амфотерных элементов в таблице Менделеева
- Представители амфотерных элементов
- Свойства металлов Al и Zn как простых веществ
- Получение алюминия и цинка
- Химические свойства алюминия и цинка
- Оксиды цинка и алюминия
- Применение алюминия и цинка
- Сплавы алюминия и цинка
Основное понятие амфотерности
Что такое металлы и неметаллы – понять нетрудно. Металлы обладают восстановительными свойствами и в химической реакции отдают электроны. При этом, гидроксиды металлов – это основания. Неметаллы, напротив, являются окислителями и забирают электроны. Гидроксиды неметаллов – это кислоты.
Источник
Амфотерные соединения могут проявлять как окислительные, так и восстановительные свойства в зависимости от реакционной среды. Гидроксиды таких атомов могут выступать в качестве кислот или оснований.
Расположение амфотерных элементов в таблице Менделеева
В таблице Менделеева положение того или иного атома сообщает значительную часть информации о строении атома этого элемента и его химических свойствах.
Периодической эта система называется, потому что в разных периодах (горизонтальные строчки) и группах (вертикальные столбцы) повторяется определенное качество элементов.
Так, вся первая группа является щелочными металлами, а седьмая – галогенами (неметаллами), восьмая – инертными газами. Но, это характерно только для главной подгруппы. В побочной группе располагаются амфотерные элементы.
Строение атома амфотерных элементов
Особенность химических свойств амфотерных элементов связана со строением их атомов. У них происходит предзаполнение s-подуровня, из-за этого, незаполненным оказывается всегда d-подуровень. Все представители побочных подгрупп являются p- или d-элементами. В различных условиях может происходить перескок электронов с подуровней и увеличение неспаренных электронов.
Таблица. Строение атомов некоторых амфотерных элементов
Для некоторых из них характерен проскок электрона. Это состояние, при котором электрон с последнего уровня перескакивает на следующий. По этой причине оказывается неспаренным s-электрон.
Представители амфотерных элементов
Все элементы побочных групп являются амфотерными и проявляют сходные химические свойства. Наиболее распространены в природе три элемента: Al, Zn и Cr.
Цинк как амфотерный элемент
Цинк — это относительно мягкий светло-серый металл. Является одним из самых распространенных амфотерных элементов. В природе цинк встречается в составе 66 минералов, наиболее распространенные представлены в таблице.
Таблица. Минералы, в состав которых входит Zn
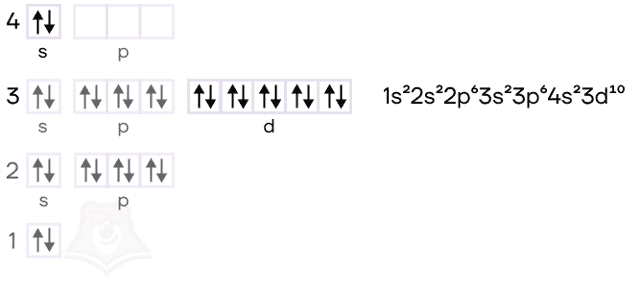
Цинк является d-элементом.
1s22s22p63s23p63d104s2
Химические свойства цинка обусловлены наличием незаполненной p-обитали. С s-подуровня происходит перескок электрона, за счет чего появляется два неспаренных электрона: Zn* 1s22s22p63s23p63d104s14p1.
Алюминий как амфотерный элемент
Al является самым распространенных элементом не только среди металлов, но и во всей таблице Менделеева. Он занимает 3 место после кислорода (O2) и кремния (Si).
Это мягкое вещество серебристо-серого цвета с низкой температурой плавления. В природе встречается как в виде минералов, так и в виде самородков. Является примесью многих минералов.
Наиболее распространенные минералы, содержащие Al:
- Авгит ((Ca,Na)(Mg,Fe,Al,Ti)(Si,Al)2O6)
- Боксит (Al2O3xH2O)
- Нефелин (Элиолит) ((NaK)AlSiO4)
- Алунит (K2SO4Al2(SO4)3·4Al(OH)3)
- Силлиманит ((Al2O3)(SiO2))
- Корунд (Al2O3)
Последний минерал в зависимости от примесей имеет разный окрас. Применяется в ювелирном деле и считается полудрагоценным камнем.
Его атом содержит 13 электронов, распределенных по 3 электронным уровням: 1s22s22p63s23p1. Это р-элемент, у которого может происходить переход электрона с s-подуровня на свободную р-орбиталь. За счет этого, металл приобретает 3 неспаренных электрона: Al* 1s22s22p63s13p2
Свойства металлов Al и Zn как простых веществ
Цинк – довольно плотный металл. Сохраняет свои качества в небольшом диапазоне температур: при низких значениях (до -30) становится хрупким, при температурах выше 1000 С очень пластичен. Это используется в металлургии, прокатывая цинковые листы толщиной несколько миллиметров (цинковая фольга). Некоторые примеси резко повышают хрупкость металла, поэтому используется очищенный материал.
Al – сильно пластичный легкий металл с низкой температурой плавления. Обладает высокой ковкостью и электропроводностью.
На воздухе он покрывается оксидной пленкой поэтому практически не подвергается коррозии. Благодаря этому он используется при изготовлении проводов и корпусов машинной техники.
Получение алюминия и цинка
Основной способ получения металлов – выделение их из состава руды. Для этого используется наиболее богатая металлом горная порода. Алюминий получают из боксита. Этот процесс состоит из трех этапов:
- Добыча горной породы;
- Обогащение (увеличение концентрации метала за счет очистки от примесей);
- Выделение чистого вещества путем электролиза.
- Получение цинка производится несколькими методами – электролитическим (так же как и Al) и пирометаллургический. Второй способ основан на восстановлении цинка из его оксида углеродом или оксидом углерода II (угарным газом):
- ZnO + C ⇄ Zn + CO
- ZnO + CO ⇄ Zn + CO2
- Достоинство этого метода в том, что продукты первой реакции могут использоваться во второй, что снижает количество выбросов в атмосферу.
Химические свойства алюминия и цинка
Оба вещества способны реагировать как обычные металлы. Так же, есть ряд специфических реакций.
Взаимодействие с неметаллами
С неметаллами и оба вещества взаимодействуют с образованием бинарных соединений – солей. Как правило, скорость течения реакции и условия зависят от активности неметалла. Так, с кислородом реакция идет реакция образования оксида при нагревании с цинком:
- 2Zn + O2 = 2ZnO
- с алюминием в обычных условиях:
- 4Al + 3O2 = 2Al2O3
- Оксид алюминия покрывает изделие плотной пленкой (оксидная пленка) и доступ кислорода прекращается, поэтому, для полной реакции его нужно брать в порошке.
- Zn не реагирует с Br, N2, Si, C, H2.
- Al не вступает в реакцию только с H2.
Взаимодействие с металлами
С восстановителями оба металла образуют сплавы:
- Алюминиды CuAl2, CrAl7, FeAl3
- Латунь ZnCu
Это не является химической реакцией, так как не происходит передачи электронов или изменения химических свойств веществ.
Взаимодействие с кислотами и щелочами
- С кислотами и алюминий, и цинк взаимодействуют при обычных условиях с образованием солей:
- 8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15H2O;
- 2Al + 6HCl = 2AlCl3 + 3H2;
- Zn + 2HCl = ZnCl2 + H2;
- Zn + H2SO4 = ZnSO4 + H2.
- Результат реакции со щелочами зависит от условий реакции: если реакция идет в растворе (в присутствии воды), то образуются комплексные соли:
- 2Al + 2NaOH + 10H2O = 2Na[Al(H2O)2(OH)4] + 3H2;
- Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2.
- В безводной среде (сплавление) образуются соли металлических кислот:
- Zn + 2KOH = K2ZnO2 + H2 (K2ZnO2 – цинкат калия);
- 2Al + 6KOH = 2KAlO2 + 2K2O + 3H2 (KAlO2 – алюминат калия).
Взаимодействие с водой
- Алюминий активно взаимодействует с водой, если очистить оксидную пленку. Реакцию нужно проводить быстро, так как пленка образуется практически мгновенно:
- 2Al + 6H2O = 2Al(OH)3 + 3H2;
- Zn реагирует с водой при очень высокой температуре (при накаливании до красного состояния):
- Zn + H2O = ZnO + H2.
Оксиды цинка и алюминия
ZnO – оксид, широко используемый в химической промышленности. Он применяется для получения солей. В реакции со щелочами образуются комплексные соли, легко разрушаемые кислотами.
Al2O3 –глинозем. Имеет очень плотную кристаллическую решетку, из-за чего практически не реагирует при обычных условиях. При экстремально высоких температурах вступает в реакцию со щелочами:
Al2O3 + 2KOH = 2KAlO2 + H2O
Может вступать в реакцию с кипящими кислотами с образованием комплексных солей.
Применение алюминия и цинка
Al как самый распространенный элемент широко используется в химической промышленности. Он способен вытеснять восстановители из соединений, поэтому применяется для получения металлов. Такой метод называется алюмотермия.
Благодаря оксидной пленке и низкой плотности используется в автомобиле-, самолето- и ракетостроении для снижения массы изделия. В строительстве алюминий применяется для изготовления каркасов высотных зданий.
Zn применяется для снижения коррозии металлических изделий –цинкование. Порошок этого металла используется для изготовления масляных красок с металлическим блеском. Также, оксид служит в качестве антисептика. Мази на основе цинкового порошка используются в лечении лишаев и других инфекционных поражений кожи.
Сплавы алюминия и цинка
В металлургии практически не применяются в чистом виде из-за высокой пластичности. Для того чтобы сохранить достоинства металлов, но убрать недостатки осуществляют сплавление с другими металлами.
Сплавы алюминия
Сплавы алюминия делятся на две группы:
- Литейные (без сохранения пластичности);
- Конструкционные (деформируемые).
Таблица. Характеристика основных сплавов алюминия
Сплавы цинка
Самый используемый сплав цинка – латунь (Cu — Zn). Он обладает хорошими сварными свойствами, поэтому применяется в изготовлении кухонной утвари и различных изделий интерьера.
Если к этому сплаву добавляют свинец, этот сплав называется мунц-металл. Оба сплава применяются при литье труб и каркасов.