- Физические свойства
- Переходные металлы — характеристика, свойства и строение
- Общее понятие
- Место в периодической таблице
- Химические свойства
- Значение переходных элементов
- Характеристики железа
- 11 класс. Химия.Переходные металлы — Переходные металлы
- Переходные элементы
- Разница между переходными металлами и внутренними переходными металлами
- Основное отличие — переходные металлы от внутренних переходных металлов
- Что такое переходные металлы
- Определение
- Расположение в периодической таблице
- Атомные номера
- изобилие
- Наиболее заметное состояние окисления
- Заключение
- Рекомендации:
- Переходные металлы | это… Что такое Переходные металлы?
- Общая характеристика переходных элементов
- Подгруппа меди
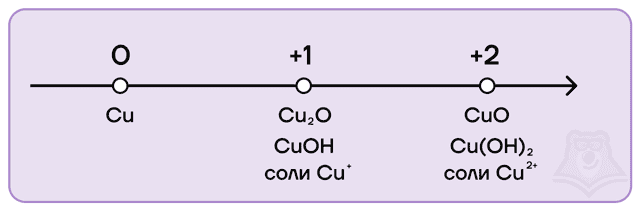
- Медь
- Оксид меди(II)
- Гидроксид меди(II)
- Соединения одновалентной меди
- Серебро
- Золото
- Платиновые металлы
- Примечания
- Литература
- См. также
- Ссылки
- Переходные металлы комплексы и строение
- Что такое переходные металлы;
- Основные характеристики меди, хрома и железа;
- Их физические и химические свойства.
К переходным элементам относятся такие, которые расположены в побочных подгруппах больших периодов периодической системы Д.И. Менделеева. К ним принадлежат d– и f–элементы.
Название «переходные» связано с тем, что переходные элементы расположены между s– и р–элементами.
Мы рассмотрим три металла: железо, хром и медь.
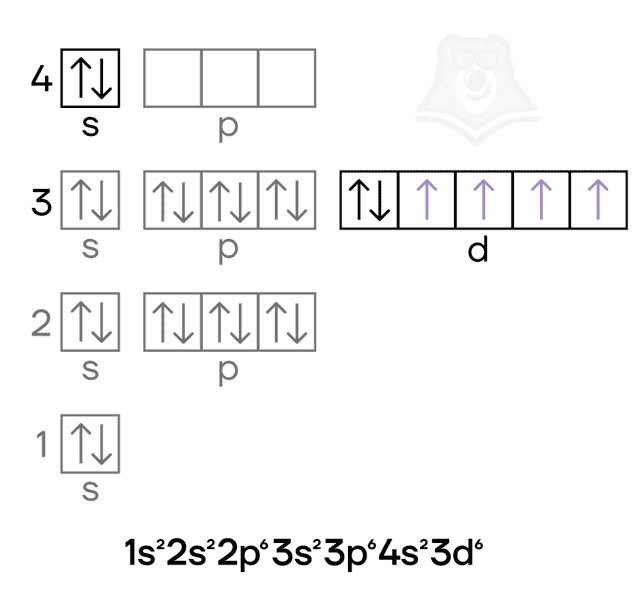
Железо — металл VIIIB-группы четвёртого периода. Его особенностью, как и особенностью других переходных металлов, является наличие валентных электронов как на внешнем (4s), так и на предвнешнем (3d) подуровнях.
Хром — металл VIB-группы четвёртого периода. Как и железо, это d-элемент, у которого валентные электроны находятся и на внешнем слое и на предвнешнем подуровне. Помимо этого, в атоме хрома в основном состоянии происходит провал электрона.
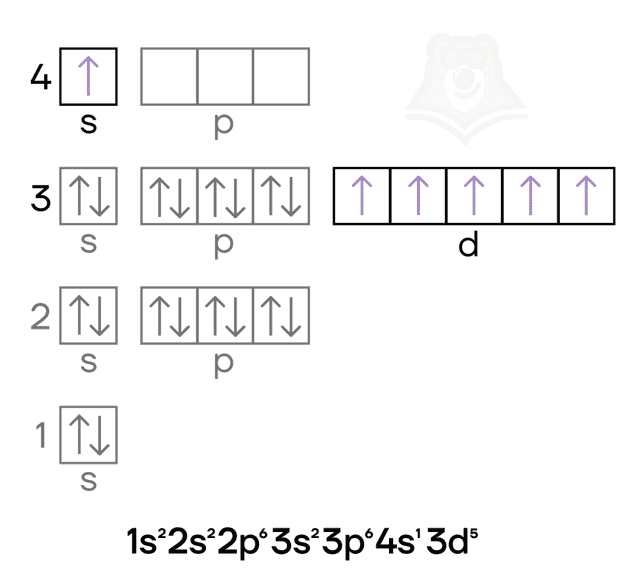
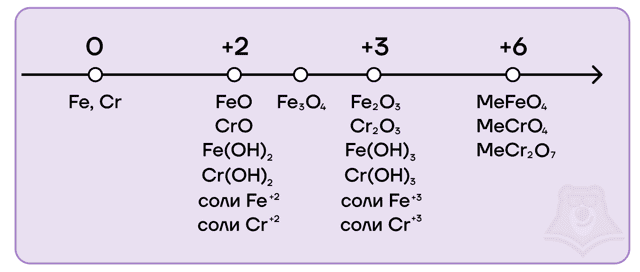
Железо и хром имеют идентичный набор степеней окисления, а также возможных оксидов и гидроксидов: 0, +2, +3, +6.
Медь — металл IB-группы четвёртого периода. Как и в случае других элементов побочных подгрупп, особенностью для неё является наличие валентных электронов как на внешнем (4s), так и на предвнешнем (3d) подуровнях. Как и у хрома, у меди в электронной конфигурации наблюдается провал электрона.
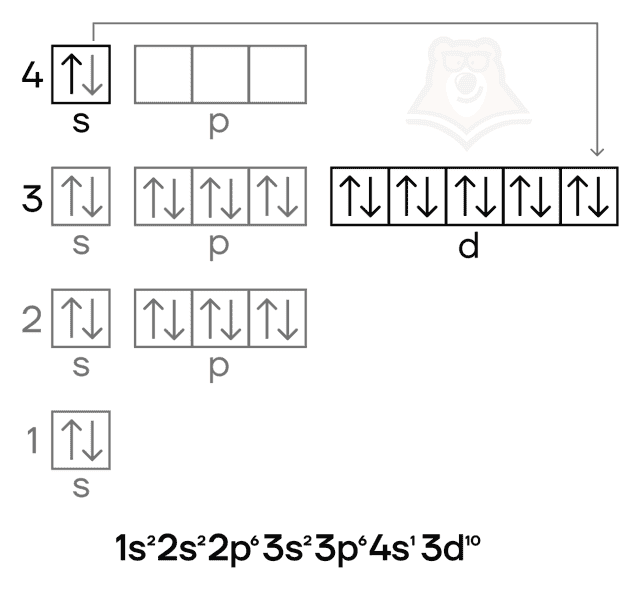
Степени окисления меди следующие:
- низшая степень окисления равна 0, как и у всех металлов;
- высшая равна +2;
- промежуточная равна +1.
Физические свойства
По физическим свойствам железо и хром — совершенно типичные металлы серебристо-белого цвета, которые не растворяются в воде, а на воздухе покрываются прочной оксидной плёнкой.
Особенностью железа является его быстрая коррозия (то есть окисление) кислородом во влажном воздухе, а особенностью хрома — высокая твёрдость: он является одним из самых твёрдых металлов.
Медь же — металл красного цвета, один из четырёх металлов, имеющих явную цветовую окраску, которая отлична от серой или серебристой.
Переходные металлы — характеристика, свойства и строение
Время на чтение: 10 минут 
Общее понятие
Переходные металлы образуют соединения, в которых проявляют положительные степени окисления. Наиболее заметно различие свойств в IV-VIII подгруппах, где побочные составляют металлы, а главные — неметаллы.
Находящиеся в самой таблице символы обозначаются — d, а буквой f — лантаноиды и актиноиды. Самые выраженные из этой категории: Cr, Mn, Fe, Cu, Zn, и Ag. История открытия указывает на то, что все они в свободном состоянии являются металлами.
Внешний номер электронной оболочки совпадает с номером периода.

К самым известным на Земле d-металлам относится железо, следующее сразу после алюминия. Большая часть представлена оксидами или сульфидами. В свободном виде встречается лишь медь. Соединения d-металлов также обнаружены на Луне.
Из всех групп химических элементов переходные достаточно трудно идентифицировать из-за разногласий по поводу того, что именно должно быть в них включено. По одной версии переходными считаются вещества с не полностью заполненной d-электронной подоболочкой.
Место в периодической таблице
Переходные металлы расположены в группах от IB до VIIIB с:
- 21 (скандия) — по (29 медь).
- 39 (иттрия) — по 47 (серебро).
- 57 (лантана) — до 79 (золота).
- 89 (актиния) — до 112 (коперниция).
Последние представлены лантаноидами и актиноидами — f-элементами, входящими в особую группу. Остальные составляют d-элементы.
Химические свойства
В соединениях атомы используются как валентные s- и p, так и d-электроны. Исходя из этого, d-элементы обладают переменной валентностью, что не наблюдается в основных подгруппах. По этой причине они могут образовывать комплексные соединения.
Все переходные металлы по структуре твердые, имеют высокую температуру плавления и кипения.
При перемещении слева направо в таблице у 5 d-орбиталей обнаруживается большая заполняемость. Из-за слабой связи электронов увеличивается электропроводность и гибкость.
Всем им присуща низкая энергия ионизации, необходимая при удалении электрона от свободного атома. До сих пор ученые спорят относительно классификации элементов на границе между основной группой и переходными металлами, размещенными в правой части таблицы. Ими являются цинк (Zn), кадмий (Cd) и ртуть (Hg). Внешне они напоминают металлы:
- Податливы и пластичны.
- Проводят тепло и электричество.
- Образуют положительные ионы.
Схожесть физических свойств элементов двух этих групп проявляется в том, что лучше всего электричество проводят переходный металл медь и относящийся к основной группе алюминий. Особенность — элементы основной группы легко образуют стабильные соединения с нейтральными молекулами воды или аммиака.
Значение переходных элементов
В жизнедеятельности человека они выполняют важную функцию. Без них организм не может существовать:
- Железо — главный источник гемоглобина.
- Цинк — вырабатывает инсулин.
- Кобальт — основной компонент витамина В12.
- Медь, марганец и молибден — входят в состав ферментов.
Яркие представители — чугун и сталь, используемые в тяжелой промышленности.

В черной металлургии их получают из железной руды. Вначале выплавляется чугун, а затем из него — сталь. Углерода в чугуне больше 1,7%, а в стали — меньше этого значения.
Благодаря добавкам — хрому, марганцу и никелю — стали обретают другие качества. Так, хром повышает прочность и устойчивость к действию кислот. Наиболее употребительные сплавы на основе меди: бронза, латунь и мельхиор. Особенно широкое применение нашли: сталь, чугун и бронза. Велика значимость железа, неслучайно по его содержанию сплавы подразделяются на черные и цветные.
Характеристики железа
Этот элемент представляет наибольший интерес, поскольку составляет важные соединения, среди которых железная кислота и соли. Чаще всего не используется как чистое вещество, а в виде сплавов с углеродом и другими элементами. Взаимодействует с:

- Неметаллами — при нагревании, преимущественно в виде порошка.
- Кислородом — образование оксидов.
- Водой — при большой температуре. При повышенной влажности вступает в реакцию с водяными парами и кислородом, что служит возникновению ржавчины.
- Кислотами — с выделением водорода.
- Растворами солей — вытесняет менее активные металлы.
Переходные металлы играют огромную роль в жизни людей.
По этой причине их изучение включено в обязательный курс школьной программы. Наиболее подробно о свойствах рассказывается на уроках химии в старших классах при проведении лабораторных работ.
11 класс. Химия.Переходные металлы — Переходные металлы
Общие свойства переходных металлов
Переходные элементы располагаются в побочных подгруппах Периодической системы Д.И. Менделеева. Их подразделяют на d-элементы и f-элементы. f-элементы – это лантаноиды и актиноиды.
При образовании соединений атомы металлов могут использовать не только валентные s- и p-электроны , но и d-электроны. Поэтому для d-элементов гораздо более характерна переменная валентность, чем для элементов главных подгрупп. Благодаря этому свойству переходные металлы часто образуют комплексные соединения.
Переходные элементы – это металлы. Поэтому в своих соединениях они проявляют положительные степени окисления. Очень сильно видно различие в свойствах у элементов IV–VIII подгрупп периодической системы.
Элементы побочных подгрупп – это металлы, а главных подгрупп – неметаллы. Однако, когда элементы главных и побочных подгрупп находятся в высших степенях окисления, их соединения проявляют заметное сходство.
Например, оксид CrO3 близок по свойствам SO3. Оба эти вещества в обычных условиях находятся в твердом состоянии и образуют при взаимодействии с водой кислоты состава H2ЭO4. Точно также – оксиды марганца и хлора. Соответствующие им высшие оксиды – Mn2O7 и Cl2O7. Им соответствуют кислоты состава HЭО4.
Подобная близость свойств объясняется тем, что часто элементы главных и побочных подгрупп в высших степенях окисления приобретают сходное электронное строение. Что касается химических свойств d-элементов, то обращает на себя внимание тот факт, что в пределах одной декады переходных элементов число стабильных степеней окисления сначала увеличивается, а потом уменьшается.
См. Табл. 1. Химические свойства переходных элементов довольно сложны.
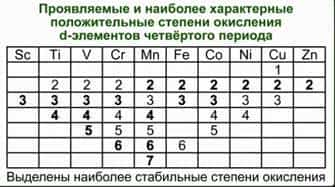
Табл. 1
Значение переходных металлов для организма и жизнедеятельности
Без переходных металлов наш организм существовать не может. Железо – это действующее начало гемоглобина. Цинк участвует в выработке инсулина. Кобальт – центр витамина
В-12. Медь, марганец и молибден, а также некоторые другие металлы входят в состав ферментов.
Многие переходные металлы и их соединения используются в качестве катализаторов. Например, реакция гидрирования алкенов на платиновом или палладиевом катализаторе. Полимеризация этилена проводится с помощью титансодержащих катализаторов.
Рис. 1
Большое использование сплавов переходных металлов: сталь, чугун, бронза, латунь, победит. Рис. 1. При исследовании сплавов прослеживается уникальное значение железа для человека. Сплавы даже разделяют на черные и цветные по содержанию в них железа.
Химические свойства железа и его соединений
Железо – это химический элемент №26, который находится в побочной подгруппе VIII группы, в четвертом периоде. Электронная конфигурация атома железа – 1s22s22p63s23p63d64s2.
Рис. 2
Распределение валентных электронов на орбиталях представлено на Рис. 2.
Степени окисления железа: 0, +2, +3. Соединения железа (III) проявляют слабые окислительные свойства, образуемые оксиды и гидроксиды Fe2O3 и Fe(OH)3 проявляют амфотерные свойства, хотя основные свойства у этих соединений значительно преобладают.
1. Взаимодействие с неметаллами
При нагревании железо, особенно порошкообразное, способно взаимодействовать практически со всеми неметаллами. Хлор и фтор окисляют железо до Fe+3. Бром может окислить и до Fe+2, и до Fe+3 в зависимости от количества, а йод окисляет только до степени окисления +2 Fe+2. При реакции с серой сначала образуется сульфид железа, а затем дисульфид железа.
Он используется для получения серной кислоты, а также железа и соединений железа.
Рис. 3
2. Взаимодействие железа с кислородом
При взаимодействии железа с кислородом, в зависимости от его количества, могут образовываться разные оксиды. В том числе и смешанный оксид Fe3O4.
3. Взаимодействие железа с водой
При сильном нагревании металлическое железо взаимодействует с водой.
Во влажном воздухе при обычных условиях железо реагирует с парами воды и кислородом, с образованием ржавчины. Она состоит из смешенных оксидов, гидроксидов и соединений кислорода. Это не индивидуальное вещество.
- Примерная схема ржавления железа:
- 4Fe + 6Н2О + 3О2 → 4Fe(ОН)3
- 4. Взаимодействие железа с кислотами
- Как и другие типичные металлы, железо взаимодействует с кислотами-неокислителями с выделением водорода.
- Fe + 2НCl → FeCl2 + Н2↑
С кислотами-окислителями железо не реагирует из-за пассивации. Но с разбавленными кислотами реакция происходит.
- Fe + 4НNO3 → Fe(NO3)3 +NO↑ + 2Н2O
- 5. С растворами солей
- Металлическое железо вытесняет менее активные металлы из растворов их солей.
- Fe + CuSO4 → Cu + FeSO4
- Амфотерные свойства железа
- Железо и некоторые его соединения способны проявлять амфотерные свойства.
- Fe + 2NaOH + 2H2O → Na2[Fe(OH)4] + H2↑ В горячем концентрированном растворе щелочи образуется комплексное соединение, и выделяется водород.
- Соединения железа (II)
- Соли железа (II) можно получить при взаимодействии металлического железа с кислотами-неокислителями или восстановлением железа (III).
- 2FeCl3 + Fe→ 3FeCl2
- Соединения железа (II) обладают восстановительными свойствами.
FeCl2 + 2NaOH → Fe(OH)2 ↓+ 2NaCl. На воздухе Fe(OH)2 ↓окисляется кислородом.
4Fe(OH)2 ↓+2H2O + O2 → 4Fe(OH)3↓
Соединения железа (III)
Соли железа (III) получают либо окислением железа галогенами, либо при его взаимодействии с разбавленными кислотами-окислителями. Соли железа (III) могут проявлять слабые окислительные свойства.
2FeCl3 +2 KI → 2FeCl2 + I2↓ + 2KCl. На этой реакции основан йодометрический способ определения солей железа.
Качественная реакция на соли железа (III)
FeCl3 + 6NaSCN →Na3[Fe(SCN)6] + 3NaCl. При взаимодействии с роданидами образуются ярко-красные, похожие на кровь комплексы различного состава.
- Взаимодействие со щелочью.
- FeCl3 + 3NaOH → Fe(OH)3 ↓+ 3NaCl
- Fe(OH)3 ↓как и Fe(OH)2 ↓ амфотерен, с преобладанием основных свойств.
- Fe(OH)3 ↓+3HCl → FeCl3 + 3H2O
- Fe(OH)3 + NaOH → NaFeO2+ 2H2O
- Железная кислота и её соли
- При окислении Fe(OH)3 ↓ или при электролизе раствора щелочи на железном аноде образуются соли, содержащие железо в составе аниона:
- 2Fe(OH)3 + 3Cl2 + 10NaOH →2Na2FeO4 + 6NaCl + 8H2O
- Fe + 2KOH + 2H2O K2FeO4 + 3H2↑
Железо имеет степень окисления +6. Такие соли называются ферраты: Na2FeO4, K2FeO4. Это соли не существующей в свободном виде железной кислоты Н2FeO4. Они относятся к наиболее сильным органическим окислителям и способны медленно окислять даже воду.
Источники
http://www.youtube.com/watch?v=rxVZvj66vTA
источник презентации — http://ppt4web.ru/khimija/khimicheskie-svojjstva-metallov0.html
http://interneturok.ru/ru/school/chemistry/11-klass
http://nsportal.ru/shkola/khimiya/library/2012/12/30/urok-kharakteristika-perekhodnogo-elementa
Переходные элементы


 А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
Переходные элементы (переходные металлы; хим. элементы, расположенные в побочных подгруппах больших периодов периодической системы; являются d- и f-элементами. Назв. «переходные» связано с тем, что в периодах переходные элементы вклиниваются между s- и р-элементами. Всего известно 65 переходных элементов, включая элемент 109 в 7-м периоде; 4-, 5- и 6-й периоды содержат по 10 d-элементов, 6-й период включает также 14 f-элементов (лантаноиды); в незавершенном 7-м периоде известно 7 d-элементов, начиная с Ac, и 14 f- элементов (актиноиды). В отличие от s- и p-элементов, у к-рых заполняются внеш. оболочки (соотв. ns- и np-оболочки), у переходных элементов заполняются внутренние (п — 1) d-оболочки (d-элемен-ты) или (n — 2)f-оболочки (f-элементы).
Переходные элементы, кроме Fe и Ti, мало распространены в земной коре.
Все переходные элементы металлы. Mн. особенности, характерные для d-элементов, наблюдаются также и для f-элементов, к-рые более похожи на d-элементы, чем на s- и р-элементы. О св-вах f-элементов см. Актиноиды, Редкоземельные элементы. Св-ва d-элементов в виде простых в-в весьма разнообразны; так, среди них имеется наиб. легкоплавкий металл-Hg и наиб. тугоплавкий-W.
Как правило, d-металлы отличаются высокой энтальпией возгонки, значит, электрич. проводимостью, уникальными магн. св-вами. Химия d-элементов во многом отличается от химии s- и p-элементов, что связано с большим числом степеней окисления d-элементов (напр., Ru проявляет все степени окисления от 0 до +8) и образованием координац. соединений.
В отличие от s- и р-элементов, d-элементы имеют много общих черт.
Для каждой декады d-элементов наиб. устойчивы электронные конфигурации d0 (Sc, Y, La), d5 (Mn, Tc, Re) и d10 (Zn, Cd, Hg). По этой причине являются стабильными, напр.
, Ti4 + (d0), Fe3+ (d5) и Zn2+ (d10); напротив, Cr2+ и Mn3 + , имеющие конфигурацию d4, нестабильны. Особенности d-элементов большой набор их валентных состояний и, как правило, широкие пределы изменения окислит.-восстановит. и др. св-в.
По многообразию валентных состояний d-элементы отличаются от всех других, в т. ч. и от f-элементов.
В каждой подгруппе св-ва первых элементов (4-го периода) заметно отличаются от св-в остальных, в пределах каждой подгруппы растет устойчивость высших степеней окисления (напр., наиб. стабильные оксиды d-элементов VI rp. Cr2O3, MoO3, WO3). Для нек-рых d-элементов характерно сходство не только по вертикали, но и по горизонтали; так, Fe, Со и Ni более схожи между собой, чем Fe. Ru и Os.
Большинство соед. d-элементов координационные, в частности карбонилы, «сэндвичевые». Для d-элементов характерно образование кластеров, а также нестехиометрич. соед. (оксиды, сульфиды и др.). Соед. d-элементов, как правило, окрашены.
Окраска объясняется расщеплением уровней энергии d-электронов в поле лигандов; это делает возможным переход (при поглощении квантов света) d-электронов с низшего уровня на высший. Доля ковалентной связи в соед. d-элементов больше, чем в соед. s-металлов (но меньше, чем в соед.
р-элементов), что сказывается на св-вах соединений переходных элементов они более легкоплавки, более летучи и более подвержены гидролизу, чем аналогичные соед. s-эле-ментов.
Mн. d-элементы в виде металлов имеют очень высокую каталитич. активность, особенно выделяются в этом отношении Pt и Pd; велика каталитич. активность и мн. соединений П.Э. С И. Дракин
А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
Разница между переходными металлами и внутренними переходными металлами
Основное отличие — переходные металлы от внутренних переходных металлов
Периодическая таблица элементов состоит из металлов, неметаллов и металлоидов. Химические элементы классифицируются как металлы, если они обладают металлическими свойствами, такими как пластичность, хорошая электропроводность, легко удаляют электроны и т. Д.
Переходные металлы и внутренние переходные металлы также являются металлическими элементами, которые классифицируются как таковые, учитывая их электронную конфигурацию. Большинство элементов d-блока рассматриваются как переходные металлы.
Элементы блока F рассматриваются как внутренние переходные металлы.
Основное различие между переходными металлами и внутренними переходными металлами состоит в том, что Атомы переходного металла имеют свои валентные электроны на самой внешней орбите, тогда как внутренние атомы переходного металла имеют свои валентные электроны на орбитали внутренней предпоследней электронной оболочки.
1. Что такое переходные металлы — Определение, свойства по отношению к электронной конфигурации 2. Что такое металлы внутреннего перехода — Определение, свойства по отношению к электронной конфигурации 3. В чем разница между переходными металлами и внутренними переходными металлами — Сравнение основных различий
- Ключевые слова: актиниды, D-орбиталь, F-орбиталь, внутренний переходный металл, лантаноиды, переходный металл

Что такое переходные металлы
Переходные металлы — это химические элементы, состоящие из атомов с неспаренными d-электронами; даже стабильные катионы этих элементов имеют неспаренные d-электроны. Большинство элементов d-блока являются переходными металлами.
Однако Скандий (Sc) и Цинк (Zn) не рассматриваются как переходные металлы, поскольку у них нет неспаренных d-электронов даже в стабильных катионах, которые они образуют. Скандий формы Sc+3 как единственный стабильный катион, и он не имеет d электронов.
Zn образует Zn+2 катион как единственный стабильный катион. У него есть d электронов, но все они спарены.
В периодической таблице элементов все переходные металлы находятся среди элементов d-блока. Эти элементы d-блока расположены между элементами s-блока и элементами p-блока. Элементами блока S являются металлы. Элементы блока P являются неметаллами. Поэтому элементы d-блока показывают переход металлов в неметаллы и называются переходными металлами.
Переходные металлы могут образовывать разные соединения в разных степенях окисления. Все катионы, образованные переходными металлами, являются красочными.
Поэтому составы, сделанные этими металлами, также очень красочны. Соединения, образованные одним и тем же элементом переходного металла, встречаются в разных цветах.
Это потому, что разные степени окисления одного и того же элемента показывают разные цвета.

Рисунок 1: Цвета различных никелевых комплексов
Переходные металлы могут образовывать сложные соединения. Они называются координационными соединениями. Атом переходного металла центрируется несколькими лигандами, которые отдают свои неподеленные электронные пары центральному атому металлов.
Внутренние переходные металлы — это химические элементы, которые состоят из валентных электронов на их орбиталях предпоследней электронной оболочки. Элементы F-блока известны как внутренние переходные металлы, так как они состоят из валентных электронов на своих f-орбиталях, и эти f-орбитали окружены другими атомными орбиталями.
Ряды лантаноидов и рядов актинидов являются двумя периодами блока f. Ряд лантаноидов состоит из химических элементов, которые имеют валентные электроны на своей 4f-орбитали. Ряд актинидов состоит из химических элементов, которые имеют свои валентные электроны на 5f-орбитали.

Рисунок 2: блоки в периодической таблице
Внутренние переходные металлы состоят из очень больших атомов, поскольку они имеют большое количество оболочек. Поэтому большинство из них нестабильны и радиоактивны. Почти все актиниды являются радиоактивными элементами, но лантаноиды являются нерадиоактивными за некоторыми исключениями.
Наиболее заметное состояние окисления внутренних переходных металлов +3. Но актиниды могут иметь степень окисления до +6. Внутренние переходные металлы показывают атомные номера в диапазоне от 57 до 103.
Определение
Переходные металлы: Переходные металлы — это химические элементы, которые состоят из атомов, имеющих неспаренные d-электроны, даже их стабильные катионы имеют неспаренные d-электроны.
Внутренние переходные металлы: Внутренние переходные металлы — это химические элементы, которые имеют валентные электроны на своих орбиталях предпоследней электронной оболочки.
Расположение в периодической таблице
Переходные металлы: Переходные металлы находятся в блоке d периодической таблицы.
Внутренние переходные металлы: Внутренние переходные металлы находятся в блоке f периодической таблицы.
Атомные номера
Переходные металлы: Переходные металлы имеют атомные номера в диапазоне от 21 до 112.
Внутренние переходные металлы: Внутренние переходные металлы имеют атомные номера от 57 до 103.
изобилие
Переходные металлы: Переходные металлы в изобилии на земле.
Внутренние переходные металлы: Внутренние переходные металлы менее распространены на земле.
Наиболее заметное состояние окисления
Переходные металлы: Наиболее заметное состояние окисления переходных металлов составляет +2.
Внутренние переходные металлы: Наиболее заметное состояние окисления внутренних переходных металлов +3.
Заключение
Переходные металлы и внутренние переходные металлы являются химическими элементами, которые имеют более высокий атомный номер и большие атомные размеры. Поэтому большинство из них считаются тяжелыми металлами.
Основное различие между переходными металлами и внутренними переходными металлами состоит в том, что атомы переходных металлов имеют свои валентные электроны на самой внешней орбите, тогда как внутренние атомы переходных металлов имеют свои валентные электроны на орбитали внутренней предпоследней электронной оболочки.
Рекомендации:
1. «Элементы перехода». Элементы перехода, внутренние элементы перехода | [электронная почта защищена],
Переходные металлы | это… Что такое Переходные металлы?
Перехо́дные мета́ллы (перехо́дные элеме́нты) — элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, в атомах которых появляются электроны на d- и f-орбиталях.
[1] В общем виде электронное строение переходных элементов можно представить следующим образом: . На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на -орбитали. Поскольку число валентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами.
Общая характеристика переходных элементов
Все переходные элементы имеют следующие общие свойства: [2]
- Для всех переходных элементов характерно образование комплексных соединений.
Подгруппа меди
Подгруппа меди, или побочная подгруппа I группы Периодической системы химических элементов Д. И. Менделеева, включает в себя элементы: медь Cu, серебро Ag и золото Au.
Свойства металлов подгруппы меди [3]
| 29 | Медь Cu | [Ar] 3d104s1 | 0, +1, +2 | 8,96 [4][5] | 1083 [4][5] | 2543 [4][5] |
| 47 | Серебро Ag | [Kr] 4d105s1 | 0, +1, +3 | 10,5 [6] | 960,8 [6] | 2167 [6] |
| 79 | Золото Au | [Xe] 4f145d106s1 | 0, +1, +3 | 19,3 [7] | 1063,4 [7] | 2880 [7] |
Для всех металлов характерны высокие значения плотности, температур плавления и кипения, высокая тепло- и электропроводность. [8]
Особенностью элементов подгруппы меди является наличие заполненного предвнешнего -подуровня, достигаемое за счёт перескока электрона с ns-подуровня. Причина такого явления заключается в высокой устойчивости полностью заполненного d-подуровня. Эта особенность обусловливает химическую инертность простых веществ, их химическую неактивность, поэтому золото и серебро называют благородными металлами.[9]
Медь
Основная статья: Медь
Металлическая медь в стеклянной пробирке
Медь представляет собой довольно мягкий металл красно-жёлтого цвета [10]. В электрохимическом ряду напряжений металлов она стоит правее водорода, поэтому растворяется только в кислотах-окислителях (в азотной кислоте любой концентрации и в концентрированной серной кислоте):
В отличие от серебра и золота, медь окисляется с поверхности кислородом воздуха уже при комнатной температуре. В присутствии углекислого газа и паров воды её поверхность покрывается зелёным налётом, представляющим собой основной карбонат меди(II).
Для меди наиболее характерна степень окисления +2 [11], однако существует целый ряд соединений, в которых она проявляет степень окисления +1.
Оксид меди(II)
Основная статья: Оксид меди(II)
Оксид меди(II) в порошкообразной форме
Оксид меди(II) CuO — вещество чёрного цвета. Под действием восстановителей при нагревании он превращается в металлическую медь:
- Растворы всех солей двухвалентной меди окрашены в голубой цвет, который им придают гидратированные ионы .
- При действии на растворимые соли меди раствором питьевой соды образуется малорастворимый основной карбонат меди (II) — малахит:
Гидроксид меди(II)
Основная статья: Гидроксид меди(II)
Свежеосаждённый гидроксид меди(II)
Гидроксид меди(II) Cu(OH)2 образуется при действии щелочей на растворимые соли меди(II) [12]:
Это малорастворимое в воде вещество голубого цвета. Гидроксид меди(II) — амфотерный гидроксид с преобладанием основных свойств. При сильном нагревании или стоянии под маточным раствором он разлагается:
- При добавлении аммиака Cu(OH)2 растворяется с образованием ярко-синего комплекса:
Соединения одновалентной меди
Соединения одновалентной меди крайне неустойчивы, поскольку медь стремится перейти либо в Cu2+, либо в Cu0. Стабильными являются нерастворимые соединения CuCl, CuCN, Cu2S и комплексы типа . [13]
Серебро
Основная статья: Серебро
Металлическое серебро в стеклянной пробирке
- Серебро более инертно, чем медь[14] , но при хранении на воздухе оно чернеет из-за образования сульфида серебра:
- Серебро растворяется в кислотах-окислителях:
- Наиболее устойчивая степень окисления серебра +1. В аналитической химии широкое применение находит растворимый нитрат серебра AgNO3, который используют как реактив для качественного определения ионов Cl−, Br−, I−:
- При добавлении к раствору AgNO3 раствора щёлочи образуется тёмно-коричневый осадок оксида серебра Ag2O:
- Многие малорастворимые соединения серебра растворяются в веществах-комплексообразователях, например, аммиаке и тиосульфате натрия:
Золото
Основная статья: Золото
Золотой самородок
- Золото представляет собой металл, сочетающий высокую химическую инертность и красивый внешний вид, что делает его незаменимым в производстве ювелирных украшений. [15] В отличие от меди и серебра, золото крайне инертно по отношению к кислороду и сере, но реагирует с галогенами при нагревании:
- Чтобы перевести золото в раствор, необходим сильный окислитель, поэтому золото растворимо в смеси концентрированных соляной и азотной кислот («царской водке»):
Платиновые металлы
Основная статья: Металлы платиновой группы
Платиновые металлы — семейство из 6 химических элементов побочной подгруппы VIII группы Периодической системы, включающее рутений Ru, родий Rh, палладий Pd, осмий Os, иридий Ir и платину Pt. Эти металлы подразделяются на две триады: лёгкие — триада палладия (Ru, Rh, Pd) и тяжёлые — триада платины (Os, Ir, Pt).
Примечания
Литература
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.
- Ерёмина Е. А., Рыжова О. Н. Глава 17. Переходные элементы // Справочник школьника по химии. — М.: Экзамен, 2009. — С. 250-275. — 512 с. — 5000 экз. — ISBN 978-5-377-01472-0
- Кузьменко Н. Е. , Ерёмин В. В., Попков В. А. Начала химии. Современный курс для поступающих в вузы. — М.: Экзамен, 1997-2001.
- Лидин Р. А., Андреева Л. Л., Молочко В. А. Справочник по неорганической химии. — М.: Химия, 1987.
- Некрасов Б. В. Основы общей химии. — М.: Химия, 1974.
- Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Л., 1977. — С. 98.
- Спицын В. И., Мартыненко Л. И. Неорганическая химия. — М.: МГУ, 1991, 1994.
- Турова Н. Я. Неорганическая химия в таблицах. Учебное пособие. — М.: Высший химический колледж РАН, 1997.
См. также
- Благородные металлы
- Металлы
- Щелочные металлы
- Щёлочноземельные металлы
Ссылки
Переходные металлы комплексы и строение
Переходные металлы, Переходные металлы. переходные металлы — простые и сложные комплексы переходных металлов. Переходные металлы (переходные элеме́нты) — элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, в атомах которых появляются электроны на d- и f-орбиталях.
В общем виде электронное строение переходных элементов можно представить следующим образом: . На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на -орбитали.
Поскольку число валентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами.
Общая характеристика переходных элементов. Все переходные элементы имеют следующие общие свойства:Небольшие значения электроотрицательности.Переменные степени окисления. Почти для всех d-элементов, в атомах которых на внешнем ns-подуровне находятся 2 валентных электрона, известна степень окисления +2.
Начиная с d-элементов III группы Периодической системы химических элементов Д. И. Менделеева, элементы в низшей степени окисления образуют соединения, которые проявляют основные свойства, в высшей — кислотные, в промежуточной — амфотерные. Например:
Для всех переходных элементов характерно образование комплексных соединений.
Подгруппа меди. Подгруппа меди, или побочная подгруппа I группы Периодической системы химических элементов Д. И. Менделеева, включает в себя элементы: медь Cu, серебро Ag и золото Au.
Для всех металлов характерны высокие значения плотности, температур плавления и кипения, высокая тепло- и электропроводность. [8]
Особенностью элементов подгруппы меди является наличие заполненного предвнешнего -подуровня, достигаемое за счёт перескока электрона с ns-подуровня.
Причина такого явления заключается в высокой устойчивости полностью заполненного d-подуровня.
Эта особенность обусловливает химическую инертность простых веществ, их химическую неактивность, поэтому золото и серебро называют благородными металлами.[9]
Медь, Медные группы. Медь представляет собой довольно мягкий металл красно-жёлтого цвета. В электрохимическом ряду напряжений металлов она стоит правее водорода, поэтому растворяется только в кислотах-окислителях (в азотной кислоте любой концентрации и в концентрированной серной кислоте):
таб?В отличие от серебра и золота, медь окисляется с поверхности кислородом воздуха уже при комнатной температуре. В присутствии углекислого газа и паров воды её поверхность покрывается зелёным налётом, представляющим собой основной карбонат меди (II).
Для меди наиболее характерна степень окисления +2, однако существует целый ряд соединений, в которых она проявляет степень окисления +1.
Платиновые металлыОсновная статья: Металлы платиновой группы
Платиновые металлы — семейство из 6 химических элементов побочной подгруппы VIII группы Периодической системы, включающее рутений Ru, родий Rh, палладий Pd, осмий Os, иридий Ir и платину Pt. Эти металлы подразделяются на две триады: лёгкие — триада палладия (Ru, Rh, Pd) и тяжёлые — триада платины (Os, Ir, Pt).
Нас находят по запросам:
— переходные металлы— комплексы переходных металлов— строение переходные металлы— простые и переходные металлы— галогениды переходных металлов— нитриды переходных металлов— комплексы переходных металлов— сплав переходных металлов— расчёт комплексов переходных металлов— водорастворимые полимеры переходные металлы— свойства комплексов переходных металлов— структура переходных металлов






