- Атом и молекула натрия. Формула натрия. Строение натрия:
- Изотопы и модификации натрия:
- Свойства натрия (таблица): температура, плотность, давление и пр.:
- Физические свойства алюминия:
- Химические свойства натрия. Взаимодействие натрия. Реакции с натрием:
- Получение натрия:
- Применение натрия:
- Натрий — соль жизни
- От Библии до наших дней
- Свойства натрия
- Минералы, месторождения
- Добыча и переработка
- Плюсы и минусы
- Натрий вокруг нас
- Купить металл
- Натрий – полезные свойства и опасность металла
- Что представляет собой
- История
- Формы нахождения в природе
- Месторождения, добыча
- Способы получения
- Физико-химические характеристики
- Где используется
- Промышленность
- Другие сферы
- Цены
- Значение для человека
- Питание
- Симптомы дефицита/избытка вещества
- Предостережение
- №11 Натрий
- Нахождение в природе, получение:
- Физические свойства:
- Химические свойства:
- Важнейшие соединения:
- Применение:
- Натрий: химические свойства и получение
- Способ получения
- Качественная реакция
- Химические свойства
Na 11 Натрий
22,98976928(2) 1s2 2s2 2p6 3s1
Натрий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 11. Расположен в 1-й группе (по старой классификации — главной подгруппе первой группы), третьем периоде периодической системы.
Атом и молекула натрия. Формула натрия. Строение натрия
- Изотопы и модификации натрия
- Свойства натрия (таблица): температура, плотность, давление и пр.
- Физические свойства натрия
Химические свойства натрия. Взаимодействие натрия. Реакции с натрием
Получение натрия
Применение натрия
Таблица химических элементов Д.И. Менделеева
Атом и молекула натрия. Формула натрия. Строение натрия:
Натрий (лат. Natrium, от лат.
слова natrium, которое было заимствовано из среднеегипетского языка (nṯr), где оно означало среди прочего – «сода», «едкий натр») – химический элемент периодической системы химических элементов Д. И.
Менделеева с обозначением Na и атомным номером 11. Расположен в 1-й группе (по старой классификации – главной подгруппе первой группы), третьем периоде периодической системы.
Натрий, свойства атома, химические и физические свойства
Натрий – металл. Относится к группе щелочных металлов.
- Натрий обозначается символом Na.
- Как простое вещество натрий при нормальных условиях представляет собой мягкий щелочной металл серебристо-белого цвета в тонких слоях с фиолетовым оттенком.
- Молекула натрия одноатомна.
- Химическая формула натрия Na.
Электронная конфигурация атома натрия 1s2 2s2 2p6 3s1. Потенциал ионизации (первый электрон) атома натрия равен 495,85 кДж/моль (5,1390769(3) эВ).
Строение атома натрия. Атом натрия состоит из положительно заряженного ядра (+11), вокруг которого по трем оболочкам движутся 11 электронов. При этом 10 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку натрий расположен в третьем периоде, оболочек всего три.
Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома натрия – на 3s-орбитали находится один неспаренный электрон. В свою очередь ядро атома натрия состоит из 11 протонов и 12 нейтронов.
Натрий относится к элементам s-семейства.
Радиус атома натрия (вычисленный) составляет 190 пм.
Атомная масса атома натрия составляет 22,98976928(2) а. е. м.
Натрий – шестой по распространённости элемент в земной коре. Содержание его в земной коре составляет 2,3 %, в океанах и морях – 1,1 %.
Натрий очень легко вступает в химические реакции.
Изотопы и модификации натрия:
Свойства натрия (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Натрий |
| 102 | Прежнее название | |
| 103 | Латинское название | Natrium |
| 104 | Английское название | Sodium |
| 105 | Символ | Na |
| 106 | Атомный номер (номер в таблице) | 11 |
| 107 | Тип | Металл |
| 108 | Группа | Щелочной металл |
| 109 | Открыт | Хемфри Дэви, Великобритания, 1807 г. |
| 110 | Год открытия | 1807 г. |
| 111 | Внешний вид и пр. | Мягкий металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации: – натрий с кубической объёмно-центрированной кристаллической решёткой, – натрий с гексагональной кристаллической решёткой |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | 23Na |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 2,3 % |
| 120 | Содержание в морях и океанах (по массе) | 1,1 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,002 % |
| 122 | Содержание в Солнце (по массе) | 0,004 % |
| 123 | Содержание в метеоритах (по массе) | 0,55 % |
| 124 | Содержание в организме человека (по массе) | 0,14 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 22,98976928(2) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s1 |
| 203 | Электронная оболочка | K2 L8 M1 N0 O0 P0 Q0 R0 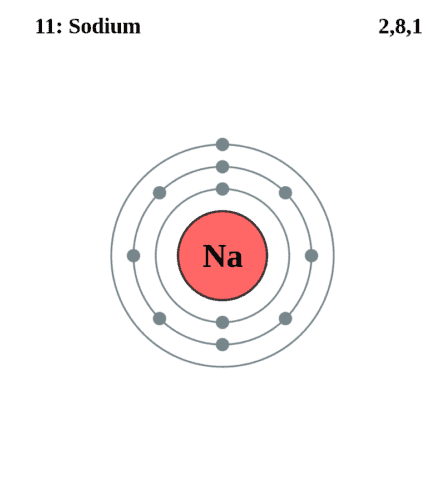 |
| 204 | Радиус атома (вычисленный) | 190 пм |
| 205 | Эмпирический радиус атома* | 180 пм |
| 206 | Ковалентный радиус* | 154 пм |
| 207 | Радиус иона (кристаллический) | Na+
|
| 208 | Радиус Ван-дер-Ваальса | 227 пм |
| 209 | Электроны, Протоны, Нейтроны | 11 электронов, 11 протонов, 12 нейтронов |
| 210 | Семейство (блок) | элемент s-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 1-ая группа (по старой классификации – главная подгруппа 1-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -1; 0; +1 |
| 302 | Валентность | I |
| 303 | Электроотрицательность | 0,93 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 495,85 кДж/моль (5,1390769(3) эВ) |
| 305 | Электродный потенциал | Na+ + e– → Na, Eo = -2,714 В |
| 306 | Энергия сродства атома к электрону | 52,867(3) кДж/моль (0,547926(25) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 0,9725 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело),
|
| 402 | Температура плавления* | 97,794 °C (370,944 K, 208,029 °F) |
| 403 | Температура кипения* | 882,940 °C (1156,090 K, 1621,292 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 2,60 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 97,42 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 1,225 Дж/г·K (при 25 °C) |
| 410 | Молярная теплоёмкость | 28,23 Дж/(K·моль) |
| 411 | Молярный объём | 23,74976 см³/моль |
| 412 | Теплопроводность | 142 Вт/(м·К) (при стандартных условиях), 142 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая объёмно-центрированная 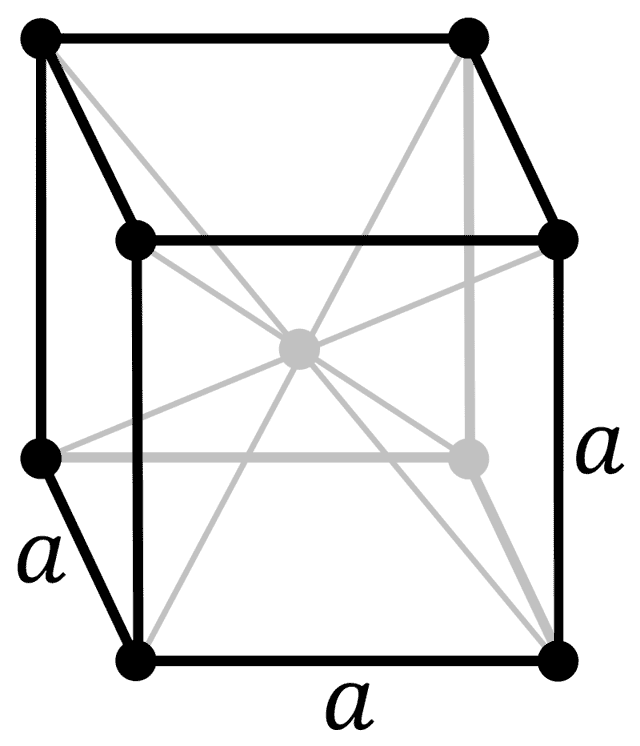 |
| 513 | Параметры решётки | 4,2820 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 150 К |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 521 | Кристаллическая решётка #2 | |
| 522 | Структура решётки | Гексагональная  |
| 523 | Параметры решётки | a = 3,767 Å, c = 6,154 Å |
| 524 | Отношение c/a | 1,633 |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | P63/mmc |
| 527 | Номер пространственной группы симметрии | 194 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-23-5 |
- Примечание:
- 205* Эмпирический радиус атома натрия [1] составляет 186 пм.
- 20* Ковалентный радиус натрия согласно [1] составляет 166±9 пм.
- 401* Плотность натрия согласно [3] составляет 0,971 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело), согласно [4] составляет 0,928 г/см3 (при 98 °C и иных стандартных условиях, состояние вещества – жидкость).
- 402* Температура плавления натрия согласно [3] составляет 97,81 °C (370,96 К, 208,06 °F).
- 403* Температура кипения натрия согласно [3] составляет 882,95 °C (1156,1 К, 1621,31 °F).
- 407* Удельная теплота плавления (энтальпия плавления ΔHпл) натрия согласно [3] составляет 2,64 кДж/моль.
- 408* Удельная теплота испарения (энтальпия кипения ΔHкип) натрия согласно [3] и [4] составляет 97,9 кДж/моль и 86,36 кДж/моль соответственно.
Физические свойства алюминия:
Химические свойства натрия. Взаимодействие натрия. Реакции с натрием:
Получение натрия:
Применение натрия:
Таблица химических элементов Д.И. Менделеева
Таблица химических элементов Д.И. Менделеева
Источники:
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
натрий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле натрия
сколько электронов в атоме свойства металлические неметаллические термодинамические
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
- Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
- Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
- Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
- Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Натрий — соль жизни
Главная › Металлы
10.10.2020
Соединения металлов натрия-калия контролируют солевой баланс в наших организмах. Нарушения этого баланса опасно для жизни. В составе крови соединения этих металлов создают своеобразный электролит, необходимый для работы любой клетки организма.
От Библии до наших дней
История героя статьи тянется с библейских времен. Именно в Библии упомянуто вещество, которым пользовались для мытья, отбеливания хлопковых тканей. В переводе слово νίτρον (нитрон) означает мыло или щелок.

Природной содой или щелоком из золы многие века люди пользовались для домашних нужд.
Свойства натрия
Характеристики:
- Легко режется ножом.
- Чистый натрий имеет белый серебристый цвет; на воздухе быстро покрывается слоем оксида Na2O.
- Структура кристаллической решетки объемноцентрированная, кубическая.
- Natrium легче воды; если бросить кусочек в воду, он будет плавать на ее поверхности.
Металл настолько активный, что хранят его в минеральном масле или в керосине, без доступа воздуха.
Химические свойства:
- Натрий реагирует с разбавленными кислотами, как рядовой металл.
- В реакции с концентрированными кислотами образуются продукты восстановления.
- Бурная реакция с водой идет с выделением водорода, поэтому металл загорается или взрывается.
- Как все щелочные металлы, активно реагирует со многими неметаллами.
Известен один стабильный изотоп — 23-Na.
| На́трий / Natrium (Na), 11 |
| 22,98976928 ± 0,00000002 а.е.м.[1] а. е. м. (г/моль) |
| [Ne] 3s1, 1s22s22p63s1 |
| 190 пм |
| 154 пм |
| 97 (+1e) пм |
| 0,93 (шкала Полинга) |
| -2,71 В |
| −1 (в алкалидах)[2]; 0; +1 (наиболее частая) |
| 495,6(5,14) кДж/моль (эВ) |
| 0,971 г/см³ |
| 370,96 К; 97,81 °C |
| 1156,1 К; 882,95 °C |
| 2,64 кДж/моль |
| 97,9 кДж/моль |
| 28,23[3] Дж/(K·моль) |
| 23,7 см³/моль |
| кубическая объёмноцентрированная |
| 4,2820 Å |
| 150 K |
| (300 K) 142,0 Вт/(м·К) |
| 7440-23-5 |
Рекомендуем: ТАНТАЛ — твёрдый, редкий и дорогой
Минералы, месторождения
В природе встречаются минералы:
- мирабилит (глауберова соль);
- галит (каменная соль);
- бура (формула Na2В4О7 • 10Н2О);
- криолит.

Месторождений металлического натрия на планете нет. В любом месте (даже в пустынях) найдется вода, с которой металл мгновенно прореагирует.
Добыча и переработка
Для производства натрия ведется добыча минералов во многих странах:
- Россия;
- США;
- Германия;
- Мексика;
- Италия.
 Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью соды, угля и мела; B — холодильник Донни и Мареска; R — приёмник с нефтью
Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью соды, угля и мела; B — холодильник Донни и Мареска; R — приёмник с нефтью
Основной способ промышленного получения натрия — электролиз NaOH или NaCl.
Возможно получение с помощью термического разложения NaN3.
Качественное определение натрия с помощью пламени — ярко-жёлтый цвет эмиссионного спектра «D-линии натрия», спектральный дублет 588,9950 и 589,5924 нм
Плюсы и минусы
Достоинства соединений натрия не перечислить. Самое главное — без него невозможна биологическая жизнь на планете.
К недостаткам можно отнести дороговизну натриевых реакторов (необходимость промежуточного контора, усиленные системы безопасности). Реакторы на БН дороже, чем ВВЭР (водо-водяные).
Натрий вокруг нас
Применение металла и его соединений чрезвычайно широко:
- Металлический Na работает теплоносителем в реакторах на быстрых нейтронах (БН) и в ионных ракетных двигателях.
 Металлический натрий, сохраняемый в минеральном масле
Металлический натрий, сохраняемый в минеральном масле - Восстановительные свойства применяют в получении тугоплавких металлов.
- NaCl, поваренная cоль — самый известный консервант и применяемое большинством вкусовое средство.
- Бензоат C6H5COONa — пищевая добавка Е211. Применяется в пищевой промышленности для производства газированных напитков, консервации мясных, рыбных, плодово-овощных изделий.
- Металл работает в натрий-серных аккумуляторах.
- Чилийская селитра (NaNO3) работает в качестве удобрений, в производстве стекла. В пищевой промышленности значится как пищевая добавка Е251.
Купить металл
Цена металлического Natrium за килограмм у разных производителей колеблется от 900 до 1500 руб/кг.
Натрий — соль жизни Ссылка на основную публикацию 
Натрий – полезные свойства и опасность металла
Этот химический элемент известен каждому. На бытовом уровне натрий – это родная поваренная соль. Без нее еда не еда.

Что представляет собой
- Натрий – это элемент периодической системы Дмитрия Менделеева под № 11.
- Мягкое серебристо-белое вещество, относится к металлам щелочной группы.
- Структура кристаллической решетки вещества – куб.
По составу вещество представляет собой два десятка изотопов, из которых только один стабилен.
Большинство не «живет» дольше минуты, «долгожитель» – радиоактивный изотоп Na-22 (более года).
Официальное обозначение вещества: Na, Natrium.
История
История взаимодействия человека с натрием исчисляется тысячелетиями:
- Натуральную соду использовали еще древние египтяне и иудеи: как мыло, консервант (при бальзамировании), отбеливатель, компонент красок, эмалей, пищевую приправу. На местных рынках продавали кусковую соду.
- Вещество упоминается Ветхим Заветом.
- Натрий как металл выделил в 1807 году Гемфри Дэви. Английский химик расплавил гидроксид вещества методом электролиза.
Термин «натрий» восходит к древнеегипетскому ntr. Одно из его значений – сода. Его переняла латынь: natrium – сода.
Название предложил шведский ученый Йенс Берцелиус – автор, «окрестивший» многие химические вещества.
Формы нахождения в природе
В свободном виде вещество в природе не зафиксировано, только минералы либо соединения.
Самые известные минералы: содалит, галит («каменная соль»), полевые шпаты.
Тонна земной коры содержит в среднем 25 кг натрия, литр воды морей и океанов – 10,5 г соединений вещества.
Месторождения, добыча
Залежи натриевого сырья, особенно полевые шпаты, рассредоточены по планете.
Например, галит добывают Украина, Индия, США, Польша, ФРГ.
В России крупнейшие месторождения разрабатываются в Крыму, Красноярском и Пермском краях, Архангельской, Иркутской, Волгоградской, Астраханской областях, Оренбуржье.
Добыча ведется открытым либо шахтным способом.
Способы получения
Традиционный способ получения натрия – восстановление металла по способу Девиля. Карбонат натрия загружают в емкость с углем и нагревают до 1000°C.
 Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью соды, угля и мела; B — холодильник Донни и Мареска; R — приёмник с нефтью
Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью соды, угля и мела; B — холодильник Донни и Мареска; R — приёмник с нефтью
Со времен промышленной революции основным стал электролиз. Исходное вещество – расплав хлорида натрия либо едкого натра.
Физико-химические характеристики
 Металлический натрий, сохраняемый в минеральном масле
Металлический натрий, сохраняемый в минеральном масле
Физические характеристики вещества:
- Режется ножом. По этому признаку его легко отличить от прочих металлов.
- Хорошо проводит тепло и ток. Это достоинство оценили промышленники.
- Свежесрезанная поверхность металла блестит.
- Тонкие пластины отсвечивают фиолетом.
- Под давлением серебристо-белый металл становится прозрачно-красным.
Более интересны химические свойства.
Это очень активный металл:
- На воздухе мгновенно окисляется.
- Вступает в реакцию с большинством веществ.
Взаимодействие вещества с водой подобно шоу. Кусочек натрия всплывает, нагревает воду, плавится. Наконец становится белым шариком, который хаотично плавает по водной поверхности.
| На́трий / Natrium (Na), 11 |
| 22,98976928 ± 2,0E−8 а. е. м. (г/моль) |
| [Ne] 3s1, 1s22s22p63s1 |
| 190 пм |
| 154 пм |
| 97 (+1e) пм |
| 0,93 (шкала Полинга) |
| -2,71 В |
| −1 (в алкалидах); 0; +1 (наиболее частая) |
| 495,6(5,14) кДж/моль (эВ) |
| 0,971 г/см³ |
| 370,96 К; 97,81 °C |
| 1156,1 К; 882,95 °C |
| 2,64 кДж/моль |
| 97,9 кДж/моль |
| 28,23 Дж/(K·моль) |
| 23,7 см³/моль |
| кубическая объёмноцентрированная |
| 4,2820 Å |
| 150 K |
| (300 K) 142,0 Вт/(м·К) |
| 7440-23-5 |
Реакцию венчает фонтан водорода. Однако газ способен самопроизвольно загореться.
Присутствие натрия в образце обнаруживают по ярко-желтому цвету пламени.
Где используется
Человек использует натрий как чистый металл и соединения.
Промышленность
Главные потребители сырья – металлургия и химия. Здесь металл нашел применение как восстановитель.
Сферы использования, ассортимент продукции из металла:
- Качественный анализ органических веществ.
- Производство энергоемких аккумуляторов.
- Материал проводов, работающих под высоким напряжением.
- Теплоноситель для АЭС, других объектов (в сплаве с калием, цезием, рубидием).
- Основа ионных ракетных двигателей (в сплаве с калием и цезием).
- Наполнитель газоразрядных ламп для освещения больших пространств.
 Свежесрезанный натрий
Свежесрезанный натрий
Металлурги с помощью соединений щелочного металла выделяют золото из руды, наносят золотое, серебряное гальванопокрытие. Обходчики – убирают растительность на железнодорожном полотне.
Другие сферы
Ученые задействуют изотопы натрия в исследованиях. С их помощью диагностируют и лечат лейкемию.
Самая известная «натриевая» формула – NaCl. Это хлорид натрия, или поваренная соль.
Вещество – один из первых консервантов и вкусовых приправ. Сегодня пищепром без него не обходится.
Речь о добавках:
- Глутамат натрия (Е621) – усилитель вкуса (особенно мясного).
- Бензоат (Е215) – консервант.
- Нитрит (Е250) – консервант.
- Цитрат (Е331) – эмульгатор, стабилизатор.
Плюс пищевая сода.
Цены
На рынке представлен ассортимент продукции из соединений натрия.
Цена определяется видом (руб./кг):
- Бихромат – 180-200.
- Сульфат – 17-25.
- Нитрит (технический) – 46-48.
Один из самых дорогих вольфрамосиликат – 7,4 тыс. руб. за кг.
Значение для человека
Натрий критично важен для жизнедеятельности человека.
Суточная потребность в микроэлементе для взрослых – до 510 мг, для детей до 18 лет – 500-900 мг, в зависимости от возраста.
Беременным требуется 500 мг. При физических, эмоциональных нагрузках, вызывающих обезвоживание, еще больше.
Чайная ложка содержит 2,3 г соли.
Питание
80% натрия человек получает из поваренной соли.
Другие источники вещества:
- Субпродукты, рыба, морепродукты (включая морскую капусту).
- Крупы – рис, гречка, перловка, овсянка, пшенка.
- «Борщевой набор» – морковь, томаты, капуста, свекла.
- Металлом насыщены бобовые, куриные яйца, сельдерей, молочный ассортимент.
- Натрий аккумулируется в межклеточной жидкости.
- Задействован в следующих биологических процессах:
- Кислотно-щелочной баланс.
- Водно-солевой обмен.
- Выработка желудочного сока.
- Работа мышц, нервной системы.
- Регулирование кондиций крови.
В этом его почти всегда дополняет калий.
Симптомы дефицита/избытка вещества
О нехватке натрия организм сигнализирует повышенной потливостью.
Ее могут дополнять:
- Головокружение.
- Забывчивость.
- Утрата аппетита.
- Быстрая утомляемость.
- Судороги.
Возможны высыпания на коже, проблемы с ЖКТ (вздутие, тошнота, рвота, спазмы).
Избыток натрия проявляется отечностью, аллергией, неутолимой жаждой.
Предостережение
Опасен металлический натрий. На воздухе самопроизвольно воспламеняется. При контакте с водой, увлажненной поверхностью взрывается либо создает ожог.
- Этими недостатками металла обусловлены условия хранения и правила работы.
- Условия хранения вещества:
- Плотно закрываемая стеклянная тара.
- В ней вещество залито бензином, керосином, вазелиновым маслом.
- Тару держат в закрытом несгораемом коробе.
При работе с веществом соблюдается строгий алгоритм:
- Надеть защитные очки либо маску.
- Не брать вещество руками – только щипцами либо пинцетом. От кожной влаги оно взрывается либо оставляет сильный ожог.
- Нужное количество металла отрезать ножом на сухом стекле (не на столе).
- Остаток сразу возвратить обратно.
- С куском металла работать не откладывая.
- По окончании работы посуду и остатки материала залить крепким спиртом, затем «обезвредить» слабым раствором кислоты.
Остатки вещества нельзя выбрасывать в мусоропровод либо канализацию. В первом случае возникнет пожар, во втором – взрыв и разрушение водопровода.
Перед работой с натрием обязателен инструктаж по технике безопасности.
Это актуально для уроков химии в школе/вузе и любителей домашних химических опытов. Хотя домашние манипуляции с веществом не приветствуются.
Проверить совместимость мужчины и женщины по Знаку Зодиака
№11 Натрий
Натрий в минеральном масле
- и натрий в ампуле
- (фото сайта periodictable.ru)
Натроном первоначально называли гидроксид натрия. В 1807 г. Дэви путем электролиза слегка увлажненных твердых щелочей получил свободные металлы — калий и натрий, назвав их потассий (Potassium) и содий (Sodium). Берцелиус, и затем Гесс в России предложили названия Natrium / Натрий, которое и закрепилось.
Нахождение в природе, получение:
В природе щелочные металлы в свободном виде не встречаются. Натрий входит в состав различных соединений. Наиболее важным является соединение натрия с хлором NaCl, которое образует залежи каменной соли (Донбасс, Соликамск, Соль-Илецк и др.). Хлорид натрия содержится также в морской воде и соляных источниках.
Натрий относится к числу распространенных элементов. Содержание натрия в земной коре составляет 2,64%.
Получают электролизом расплавленного хлорида натрия или гидроксида натрия. Применяется также и восстановление его оксидов, хлоридов, карбонатов алюминием, кремнием, кальцием, магнием при нагревании в вакууме.
Физические свойства:
Натрий — серебристо-белый металл, его плотность — 0,97 г/см3, очень мягкий, легко режется ножом. Между атомами металлическая связь. Для вещества с такой связью характерны металлический блеск, пластичность, мягкость, хорошая электрическая проводимость и теплопроводность.
Химические свойства:
Атом натрия при химическом взаимодействии легко отдает валентные электроны, переходя в положительно заряженный ион. На воздухе быстро окисляется, поэтому его хранят под слоем керосина.
При сгорании в избытке кислорода образует пероксид натрия, Na2O2
С водородом при нагревании образует гидрид Na + H2 = 2NaH
Легко взаимодействует со многим неметаллами — галогенами, серой, фосфором и др.
Бурно реагирует с водой:
2Na + 2H2O = 2NaOH + H2
Важнейшие соединения:
Оксид натрия, Na2O (бесцветный), реагирует с парами воды, углекислым газом, потому хранить лучше в безводном бензоле. При непосредственной реакции натрия с кислородом получается смесь оксида и пероксида натрия.
Для получения чистого оксида можно использовать реакцию: Na2O2 + 2Na = 2Na2O
Пероксид натрия, Na2O2 (желтый) кристаллическое вещество с ионной решеткой, взаимодействует с влажным углекислым газом воздуха, выделяя кислород:
2Na2O2 + 2CO2 = 2Na2CO3 + O2
Гидроксид натрия, NaOH — кристаллическое белое вещество, сравнительно легкоплавкое, термически очень устойчиво. При нагревании испаряется без потери воды. Хорошо растворяется в воде, в спиртах.
Галогениды натрия, бесцветные кристаллические вещества, хорошо растворимы в воде, за исключением NaF. Для них характерны восстановительные свойства.
Сульфид натрия, — Na2S. Бесцветное кристаллическое вещество с ионной решеткой. Хорошо растворимо в воде, является сильным восстановителем.
Соли, все соли хорошо растворимы, являются сильными электролитами.
Гидрид натрия, NaH — бесцветное кристаллическое вещество с кристаллической решеткой типа NaCl, анионом является H -. Получают пропусканием водорода над расплавленными металлом. Подвергается термической диссоциации не плавясь, легко разлагаются водой:
2NaH = 2Na + H2
NaH + H2O = NaOH + H2
Применение:
Соединения натрия — важнейшие компоненты химических производств. Используются в мыловарении, производстве стекла, средств бытовой химии. Натрий важен для большинства форм жизни, включая человека. В живых организмах ионы натрия вместе с ионами калия выполняют функцию передатчиков нервного импульса. Также его ионы играют важную роль в поддержании водного режима организма.
Бондарева Мария Александровна
ХФ ТюмГУ, 561 группа.
Источники: Г.П. Хомченко «Пособие по химии для поступающих в ВУЗы»
«Неорганическая химия в схемах и таблицах»
| КонТрен – Химия для школьников, студентов, учителей … подготовка к экзаменам и олимпиадам |
Натрий: химические свойства и получение
Натрий — это щелочной металл, серебристо-белого цвета. Легкий, очень мягкий, низкая температура плавления.
Относительная молекулярная масса Mr = 22,990; относительная плотность по твердому состоянию d = 0,968; относительная плотность по жидкому состоянию d = 0, 27; tпл = 97,83º C; tкип = 886º C.
Способ получения
1. Натрий получают в промышленности электролизом расплава гидроксида натрия, в результате образуется натрий, кислород и вода:
4NaOH → 4Na + O2↑ + 2H2O
Качественная реакция
Качественная реакция на натрий — окрашивание пламени солями натрия в желтый цвет.

Химические свойства
Натрий — активный металл; на воздухе реагирует с кислородом и покрывается оксидной пленкой. Воспламеняется при умеренном нагревании; окрашивает пламя газовой горелки в темно-красный цвет.
1. Натрий — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами:
1.1. Натрий легко реагирует с галогенами с образованием галогенидов:
2Na + I2 = 2NaI
1.2. Натрий реагирует с серой с образованием сульфида натрия:
2Na + S = Na2S
1.3. Натрий активно реагирует с фосфором и водородом. При этом образуются бинарные соединения — фосфид натрия и гидрид натрия:
3Na + P = Na3P
2Na + H2 = 2NaH
1.4. С азотом натрий реагирует при температуре 100º С и электрическом разряде с образованием нитрида:
6Na + N2 = 2Na3N
1.5. Натрий реагирует с углеродом с образованием карбида:
2Na + 2C = Na2C2
1.6. При взаимодействии с кислородом при температуре 250–400º C натрий образует пероксид натрия:
2Na + O2 = Na2O2
2. Натрий активно взаимодействует со сложными веществами:
2.1. Натрий реагирует с водой. Взаимодействие натрия с водой приводит к образованию щелочи и водорода:
2Na0 + 2H2O = 2Na+OH + H20
2.2. Натрий взаимодействует с кислотами. При этом образуются соль и водород.
Например, натрий реагирует с разбавленной соляной кислотой:
2Na + 2HCl = 2NaCl + H2 ↑
2.3. Натрий может реагировать с аммиаком, при этом образуются амид натрия и водород:
2Na + 2NH3 = 2NaNH2 + H2 ↑
2.4. Натрий может взаимодействовать с гидроксидами:
Например, натрий взаимодействует с гидроксидом натрия при температуре 600º С:
2Na + 2NaOH = 2Na2O + H2






