- Остается ли металл металлом, когда он превращается в газ?
- Почему металлы вообще твердые?
- Металлическая химическая связь
- Обсуждение: «Металлическая химическая связь»
- МЕТАЛЛЫ-ЖИДКОСТИ, МЕТАЛЛ-ГАЗ (!) [1968 Власов Л.Г., Трифонов Д.Н. — Занимательно о химии]
- Могут ли железо, ртуть и свинец стать газами
- Мы видим мир снаружи
- Химики видят вещества изнутри
- Ученые научились превращать жидкий металл в плазму
- Парадоксальный металл
- Твердый водород и нетвердые доказательства

Да, металлы могут быть газами, в зависимости от того, насколько высока их температура кипения. Но действительно ли газообразные металлы считаются металлами?
Закройте на мгновение глаза и позвольте слову «металл» всплыть в вашей голове. А теперь ответьте: какой первый образ приходит вам на ум, когда вы думаете о «металле»?
Большинство из вас увидят твердый, блестящий твердый предмет — может быть, блестящий меч, гладкую машину или чистую посуду?
Слово «металл» ассоциируется у нас с твердыми объектами, потому что большинство металлов вокруг нас — это твердые тела. Но ограничиваются ли металлы только твердым телом? Могут ли они быть газом?
Да, конечно! Хотя металлы обычно находятся в твердом состоянии при комнатной температуре (вероятно, поэтому мы ассоциируем слово «металл» с твердыми объектами), металлы также могут быть газами.
Дело в том, что состояния вещества универсальны: металл может быть твердым, жидким или газообразным. Но это состояние определяется на основе правильных условий температуры и давления.
Например, металл, скажем, свинец, имеет температуру кипения 1740 градусов по Цельсию. Теперь вы знаете, что свинец в своем «естественном состоянии» представляет собой твердое вещество. Но когда вы начнете его нагревать, он сначала превратится в жидкость при 327 градусах Цельсия, а если вы продолжите подавать больше тепла, он превратится в газ при 1740 градусах Цельсия.
 Свинец превращается в пар при 1740 градусах Цельсия.
Свинец превращается в пар при 1740 градусах Цельсия.
Другой отличный пример — ртуть. Фактически, это металл с самой низкой температурой кипения (356,7 °C), что означает, что из всех металлов он превращается в газ при относительно более низкой температуре.
Но учтите, что пары ртути очень вредны. По данным Всемирной организации здравоохранения, «вдыхание паров ртути может оказывать вредное воздействие на нервную, пищеварительную и иммунную системы, легкие и почки и может быть фатальным. Неорганические соли ртути разъедают кожу, глаза и желудочно-кишечный тракт, а при попадании внутрь могут вызывать токсическое воздействие на почки».
 Ртуть весьма примечательна — это металл, который существует в жидком виде при комнатной температуре, а затем закипает при небольшой температуре.
Ртуть весьма примечательна — это металл, который существует в жидком виде при комнатной температуре, а затем закипает при небольшой температуре.
А теперь давайте обсудим еще один аспект этой саги о превращении металла в газ.
Остается ли металл металлом, когда он превращается в газ?
Мы установили, что металлы могут превращаться в газы, если их нагреть до точки кипения. Но если металл нагревается до точки кипения и становится газом, остается ли он металлом? Другими словами, может ли металл находиться в газообразном состоянии и при этом оставаться металлом?
Газообразные металлы не сохраняют свойств своих твердых аналогов, включая металлические связи, металлическую проводимость, пластичность, блеск или другие металлические свойства.
Вот почему металлы больше не считаются металлами, когда они переходят в газообразное состояние — это просто газ с определенными характерными свойствами «родительского» элемента. (тогда чем же они считаются? — В ЭТОЙ ТОЧКЕ ОНИ ЯВЛЯЮТСЯ ПРОСТО ГАЗОМ.
РТУТЬ ЯВЛЯЕТСЯ МЕТАЛЛОМ, НО КОГДА ОНА КИПИТСЯ, ЕЕ ПАР НАЗЫВАЕТСЯ РТУТНЫМ ГАЗОМ/ПАРАМИ)
Но почему металлы твердые? Что в них такого особенного, что делает их твердыми?
Почему металлы вообще твердые?
Металлы твердые при комнатной температуре из-за того, как их последовательные атомы упаковываются внутри.
Видите ли, вся материя состоит из атомов. Состояние вещества зависит от того, насколько близко или далеко друг от друга находятся эти атомы.
Если составляющие атомы вещества находятся далеко друг от друга, то это вещество будет существовать в виде газа при комнатной температуре. Атомы в жидком состоянии относительно ближе друг к другу, но в твердых телах атомы упакованы вместе в плотные кристаллы.
Из-за сильных сил, которые удерживают эти атомы близко друг к другу, твердые тела жесткие и имеют определенную форму и размер (в отличие от жидкости и газа).
Металлы твердые при комнатной температуре, потому что входящие в их состав атомы металлов упаковываются близко друг к другу, придавая им жесткий или «затвердевший» внешний вид. Это также является причиной того, что металлы имеют высокую температуру плавления и не существуют в жидком состоянии при комнатной температуре.
В целом, металлы могут превращаться в газ, но как только они превращаются в газ, они не сохраняют своих металлических свойств.
Металлическая химическая связь
Вы когда-нибудь задумывались — существует ли в природе отдельный атом металла?
Металл всегда существует в виде кристалла. Естественно, это обусловлено определенным строением и предполагает определенные физические и химические свойства.
Давайте представим, что у нас есть кусок какого-то металла. Например, нам дано железо (Fe). Из чего состоит этот кусок железа?
Он состоит из атомов железа, которые находятся в строго определенном порядке — в узлах кристаллической решетки.
У атома железа, как у любого металла, на последнем электронном слое небольшое число электронов, плюс к этому, большой радиус атома. На этом последнем слое электроны держатся достаточно слабо.
- Любой металл способен отдавать электроны, превращаясь в положительно заряженный ион.
- На примере железа:
- Fe0 -2e— = Fe2+
Куда направляются отделившиеся отрицательно заряженные частицы — электроны? Минус всегда притягивается к плюсу. Электроны притягиваются к другому иону (положительно заряженному) железа в кристаллической решетке:
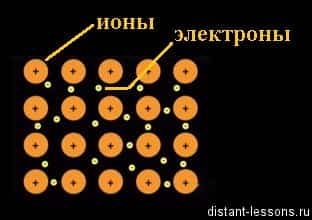
- Fe2+ +2e— = Fe0
- Ион становится нейтральным атомом.
- И такой процесс повторяется много раз.
Получается, что свободные электроны железа находятся в постоянном движении по всему объему кристалла, отрываясь и присоединяясь к ионам в узлах решетки. Другое название этого явления — делокализованное электронное облако. Термин «делокализованный» обозначает — свободный, не привязанный.
Это жестко зафиксированные в узлах кристаллической решетки ионы металла и свободно перемещающиеся по всему объему кристалла электроны.
В чем-то металлическая химическая связь похожа на ионную — в ней тоже присутствуют ионы (катионы), однако, существенное отличие в том, что:
- в ионной связи есть катионы (положительно заряженные частицы) и анионы (отрицательно заряженные ионы);
- в металлической химической связи есть катионы и электроны.
Кое в чем металлическая химическая связь похожа и на ковалентную — в ней тоже есть общие электроны, но:
- в ковалентной химической связи электроны принадлежат двум элементам (локализованы между ними);
- в металлической — они принадлежат абсолютно всем ионам.
Металлическая химическая связь— связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу.
- Добиться состояния одной молекулы металла можно только при очень высоких температурах — когда металл перейдет в газообразное состояние.
- Физические свойства металлической химической связи:

- теплопроводность (перенос теплоты частицами — в данном случае — электронами);
- электропроводность;
- все вещества — твердые (кроме некоторых щелочных металлов);
- высокие температуры плавления и кипения;
- характерный металлический блеск — он появляется за счет отражения лучей электронами; если металл растереть до порошкообразного состояния, металлический блеск пропадает — нет кристаллической решетки — нет свободно гуляющих электронов;
- высокая плотность вещества (кроме щелочных металлов);
- пластичность — это смещение слоев кристаллической решетки.
Обсуждение: «Металлическая химическая связь»
(Правила комментирования)
МЕТАЛЛЫ-ЖИДКОСТИ, МЕТАЛЛ-ГАЗ (!) [1968 Власов Л.Г., Трифонов Д.Н. — Занимательно о химии]
Новости Библиотека Таблица эл-тов Биографии Карта сайтов Ссылки О сайте
Все металлы — вещества твердые, твердые в той или иной степени. Это общее правило. Однако есть исключения.
Некоторые металлы скорее представляют собой жидкости. Крупинки галлия или цезий легко бы расплавились на ладони, потому что температура их плавления немногим менее 30 градусов.
Франций, который пока в виде чистого металла не приготовлен, плавился бы уже при комнатной температуре. А вот всем известная ртуть — классический пример жидкого металла.
Она замерзает при минус 39 градусах, почему и применяется для изготовления самых разнообразных термометров.
В этом отношении сильным конкурентом ртути оказывается галлий. И вот благодаря каким обстоятельствам. Ртуть закипает сравнительно быстро, примерно при 300 градусах. Значит, измерять высокие температуры с помощью ртутных термометров нельзя.
А чтобы галлий превратился в пар, нужна температура 2000 градусов. Ни один металл не может так долго оставаться в жидком состоянии, иметь такую разницу между температурами плавления и кипения. Кроме галлия.
Потому-то он настоящая находка для изготовления высокотемпературных термометров.
Металлы-жидкости, металл-газ
Еще один штрих, на сей раз совершенно удивительный.
Ученые теоретически доказали: если бы существовал тяжелый аналог ртути (элемент с очень большим порядковым номером, неизвестный на Земле обитатель воображаемого восьмого этажа Большого дома), то его естественное состояние при обычных условиях было бы газообразное. Газ, обладающий химическими свойствами металла! Удастся ли когда-нибудь ученым познакомиться с таким уникумом?
Свинцовую проволоку можно расплавить в пламени спички. Оловянная фольга, брошенная в огонь, моментально превращается в каплю жидкого олова. А вот чтобы превратить в жидкость вольфрам, тантал или рений, приходится поднимать температуру выше 3000 градусов. Эти металлы расплавить труднее, чем все прочие. Вот почему нити накаливания в электрических лампах делают из вольфрама и рения.
Температуры кипения некоторых металлов достигают поистине грандиозных величин. Скажем, гафний закипает при 5400 градусах (!) — это почти температура поверхности Солнца.
Могут ли железо, ртуть и свинец стать газами
Мы привыкли воспринимать вещества и материалы по нахождению их в той или иной группе таблицы Менделеева. Причем, обычный человек с уверенностью может отличить лишь несколько семейств химических элементов: металлы, неметаллы и газы.
На самом деле таких семейств насчитывается 10, некоторые из них имеют типичные, характерные для той или иной группы свойства, другие же являются переходными.
Их характеризуют свойства нескольких семейств, и химики выделили их в отдельную побочную подгруппу.
Обычный человек скорее даже не станет заглядывать в периодическую таблицу, чтобы определить, к какому семейству относится вещество. Он будет оценивать качества по внешнему виду, запаху или на ощупь.
Содержание
- 1 Мы видим мир снаружи
- 2 Химики видят вещества изнутри
Мы видим мир снаружи
Мы встречаемся с соединениями и элементами на каждом шагу. Во время утечки природного газа чувствуется запах добавки, человек понимает, что помещение наполняет газ CH4. Покупка шариков перед праздником, сопровождается их закачкой гелием (He). Человек осознает, что перед ним находятся газы.
Железо и свинец могут принимать три агрегатных состояния
Во время приготовления пищи повара добавляют в блюда NaCl – пищевую соль. Наши бабушки, делая ремонт в домах, использовали для покраски стен белильную известь (CaOCl). Конечно, они растворяются в воде, но в нормальных условиях выглядят порошками и мы понимаем, что это неметаллы.
Металлы имеют прочную структуру, их невозможно помять, прогнуть. Достаточно вспомнить железный прут, бронзовую статую, свинцовую пулю. Есть, конечно, более податливые металлы — ртуть, медь, серебро, алюминий, натрий, рубидий.
Они имеют металлический блеск, но обладают меньшей по сравнению с железом, свинцом, плотностью и могут деформироваться без особых усилий. Но и тут по внешнему виду можно определить, что предмет металлический.
Мы привыкли так видеть окружающий мир, поэтому новые свойства привычных вещей могут ввести человека в ступор.
Химики видят вещества изнутри
Химики видят вещества с иной стороны. Они знают, что железо, ртуть и свинец, могут выглядеть иначе. В лабораторных условиях можно придать металлам газообразное состояние. Да, и даже тяжелые металлы, такие, как свинец и ртуть, могут летать.
Для этого используется специальное оборудование, в котором металлы закипают, превращаясь в газ. Ртуть закипает при 356,73°C, свинец при 1749°C, железо, при 2862°C. При этом происходит вполне стандартное кипение веществ со сменой кристаллической решетки и выходом пара наверх. После нормализации температурных условий пар оседает, превращаясь в капли металла.
Этим обусловлена ситуация, когда одежда металлургов на соответствующих предприятиях запачкана тончайшим слоем твердых веществ, так как при высоких температурах они превращаются в пар, а затем оседают.
В металлургии металлическая пыль — обычное дело
Конечно, железо никогда не поднимется в воздух без особых условий, это удел иллюзионистов и фокусников. Но умелое обращение с земными «твердынями» доказывает, что за наукой стоит наше будущее.
Создавая новые материалы, изучая свойства уже существующих, специалисты с каждым открытием делают технологичней наш мир.
Вам понравилась статья:
Ученые научились превращать жидкий металл в плазму
Sandia National LabsSandia National Labs
Из курса школьной физики нам известно о существовании трех основных агрегатных состояний вещества: твердого, жидкого и газообразного. На самом же деле их гораздо больше, включая такие необычные состояния как нейтрониум, фермионный конденсат, сверхкритическая жидкость и странная материя. Термин «плазма» в такой компании звучит вполне обыденно.
Итак, плазма — это агрегатное состояние вещества, представляющее собой «горячий суп» из электронов и ионов. Важно, чтобы количество положительно и отрицательно заряженных частиц было одинаковым, поддерживая условие электронейтральности материи.
В состоянии плазмы пребывает большая часть вещества во Вселенной: поверхность Солнца, туманности, звезды и межзвездная среда.
Исследование физических свойств вещества в состоянии плазмы, позволит лучше понять процессы, происходящие в межгалактическом пространстве и научиться управлять термоядерным синтезом.
Команда исследователей Университета Рочестера провела эксперименты с жидким металлом, который помещала в условия сверxвысоких температур и давлений. Критическая плотность выступала сенсором перехода: жидкое состояние вещества в таких условиях проявляет квантовые свойства, в то время как частицы плазмы подчиняются уже теории классической физики.
Исследования проводили на металлическом дейтерии, изотопе водорода, охлажденном до -252ᵒС (21ᵒK). В таких условиях дейтерий демонстрирует свойства классической жидкости. На образец направляли лазерный луч, который практически мгновенно повышал давление в образце до 5 млн. атмосфер, а температуру — почти до 180 тыс.
градусов. При этом ученые наблюдали превращение изначально прозрачного вещества в состояние блестящего металла с высоким коэффициентом оптического отражения. Измеряя поведение коэффициента отражения образца с увеличением температуры, они смогли определить момент, когда простой жидкий металл перешел в состояние плазмы.
При этом обнаружилось, что с повышением температуры в металле сначала проявлялись квантовые свойства электронов, но при прохождении отметки в 90 тыс. градусов коэффициент отражения образца менял свое поведение так, как будто электроны вновь становились классическими частицами.
Это означало, что жидкий металл переходил в состояние плазмы.
«Примечательно, что условия, при которых образец превращается из квантовой жидкости в классическую плазму отличаются от тех, которые предсказываются в традиционных учебниках по физике плазмы, — комментирует Суксин Ху, соавтор статьи. — Более того, мы ожидаем, что такое поведение может быть характерным для всех металлов».
Изучение этих фундаментальных свойств жидкости и плазмы поможет исследователям в разработке новых моделей электро- и теплопроводности материалов в условиях экстремальных давлений и температур, и в конце концов поможет объяснить процессы, происходящие в звездах, и смоделировать условия необходимые для осуществления контролируемого термоядерного синтеза.
Парадоксальный металл
Парадоксальный металл
В 1955 году в одном из номеров американского журнала «Современные металлы» появилась небезынтересная статья, автор которой назвал титан «парадоксальным металлом», имея в виду его противоречивые свойства. А противоречий у металла действительно оказалось предостаточно.
В самом деле, сырье для производства титана имеется в изобилии, добыча руды обходится очень недорого, а металл в деформированном виде в то время стоил дороже, чем серебро. Даже сейчас титан никак не назовешь дешевым материалом.
Еще один парадокс.
Точка плавления титана лежит за пределами 1600 °С, но уже при температурах чуть выше 400 °С защитная оксидная пленка на его поверхности повреждается, металл насыщается газами и прочность его значительно понижается.
Небольшие добавки других элементов повышают жаростойкость титана на 600 °С, однако такой показатель, конечно же, недостаточен для того, чтобы конкурировать с жаростойкими сплавами на основе железа и никеля.
Сварка титана с титаном не представляет особой сложности, но методы сварки этого металла с другими не разработаны до сих пор.
Невозможность сварки титана с различными металлами представляет собой серьезную проблему, на решение которой расходуется много времени и средств.
Любопытно и то, что, будучи цветным металлом, титан претерпевает фазовые превращения подобно железу и стали — металлам черным.
Рентгеновские исследования показали, что при комнатной и не слишком высокой температуре кристаллическая решетка у титана — шестигранной формы. С дальнейшим повышением температуры атомы титана перегруппировываются. Решетка
принимает форму куба и сохраняет ее вплоть до точки плавления.
Положения статьи можно развить и продолжить.
В азотной кислоте титан демонстрирует превосходную стойкость. Но вот что произошло однажды на американской военной базе Ванденберг. К запуску готовили очередную ракету. Обслуживающий персонал был достаточно квалифицированным и хорошо выполнял знакомую работу. Ничто как-будто не предвещало катастрофы.
Но вот бак для окислителя стали заполнять азотной кислотой и в этот момент ракета взорвалась! Тревожно завыли сирены, засуетились машины скорой помощи, грузовики со спасателями помчались к месту аварии. В чем же причина взрыва и последующего пожара? Обслуживающий персонал не допустил никаких оплошностей, никаких нарушений.
Но кто-то же был виновен в случившемся? Позднее выяснили, что этот ”кто-то” — титан, из которого был изготовлен бак для окислителя.
Да, титан показывает в концентрированной азотной кислоте завидную стойкость и практически в ней не разрушается. Но иногда при соприкосновении с кислотой, насыщенной оксидами азота, с так называемой красной дымящей азотной кислотой, титан, если он находится под напряжением, может взорваться.
Причина кроется в том, что при определенном соотношении в кислоте воды и оксида азота защитная пленка на поверхности титана разрушается и начинается бурная химическая реакция, при которой выделяется водород и много тепла.
А затем — взрыв! Взрывная волна в мгновение ока срывает с титана всю защитную пленку и тогда металл загорается.
Но загораются не только ракеты и не обязательно в контакте с кислотой. При определенных условиях порошок титана может вспыхнуть безо всяких контактов с огнем или с какими-либо пожароопасными веществами. Он может загореться самопроизвольно. Точно так же самопроизвольно способны вспыхивать и мелкая стружка, и титановые опилки. Стружка покрупнее может загореться от спички.
Огонь способен возникнуть и на листах титана, которые извлекают из травильных ванн, если температура раствора очень высокая.
Погасить горящий титан очень непросто. Обычно горение обеспечивает и поддерживает кислород, но титан горит даже тогда, когда в воздухе совершенно нет кислорода — ведь этот металл вступает в реакцию с азотом и горит в нем.
Чтобы потушить титан, не прибегают к помощи пены, углекислого газа из огнетушителя, воды, которая, попадая на горячий металл, мгновенно разлагается на составляющие элементы — водород и кислород. Образуется гремучая смесь, которая тут же взрывается.
Но чем же, в таком случае, тушат воспламенившийся титан? На помощь приходит специальный огнетушительный порошок или совершенно сухой песок. Они и справляются с полыхающим огнем титаном.
Справедливости ради надо заметить, что воспламенение титана случается очень и очень редко, причем почти всегда только в том случае, если недостаточно соблюдались меры предосторожности.
Крупные же куски и обрезки металла сами не загораются. Впрочем, то, что титан способен воспламеняться, не всегда плохо.
Пиротехники, например, считают, что основное достоинство титана как раз в этом и состоит: ведь благодаря этому можно устраивать ослепительно яркие фейерверки.
В магнитном поле титан не отталкивается подобно меди, золоту или серебру, но и почти не обладает магнитной восприимчивостью.
И если железо, никель и некоторые другие металлы сильно притягиваются магнитным полем и остаются намагниченными, когда никакое поле на них уже не действует, то титан можно смело считать практически немагнитным материалом, так как его магнитные свойства выражены очень слабо.
Часто для бытовой электропроводки используют алюминий, так как он проводит электрический ток не намного хуже меди. В подобной роли мы никогда не увидим титан и не потому, что металл этот относительно дорог. Сколько бы ни снижалась его стоимость, электропроводность металла останется постоянной: в тридцать с лишним раз хуже, чем у меди.
Это тоже странно, так как металлы тем и отличаются от неметаллов, что хорошо проводят электричество и тепло. А вот титан — не такой. Кстати, и тепло он проводит тоже плохо.
Титан тверже железа, его ни в коем случае нельзя назвать мягким металлом. Алюминий, мы это прекрасно знаем, тоже не так уж и мягок. Так вот титан в двенадцать раз тверже, чем
алюминий, и однако Однако твердость его далеко не всегда
достаточна. Особенно это проявляется в тех случаях, когда нужно получить острую кромку, которая обладала бы режущими свойствами.
На одном из предприятий была выпущена опытная партия комплектов столовых приборов. Но когда хозяйки пустили в ход кухонные ножи с лезвиями из титана, разочарованию не было границ: ножи были тупыми и ничего не резали. Экспериментаторы решили было, что ножи просто плохо заточены и интенсивно принялись точить лезвия. Но лезвия по-прежнему остались тупыми. В чем же дело?
А в том, что для ножей титан — недостаточно твердый металл. Их обычно делают из особотвердой инструментальной стали, которая гораздо тверже титана. Поэтому затачивать ножи из титана — пустая затея.
Вот почему в комплектах хирургических инструментов из титановых сплавов лезвия скальпелей сделаны не из титана, а из стали.
В титановых же столовых наборах только вилки и ложки пригодны к употреблению, а что касается ножей, то они выполняют скорее декоративные, чем непосредственно режущие функции.
Титан имеет и другую характерную особенность, которая в еще большей мере препятствует широкому его использованию в трущихся узлах и деталях. Речь пойдет о склонности титана к налипанию, поверхностному схватыванию с другими металлами, в результате чего детали очень быстро выходят из строя.
При трении титан как бы прикипает к поверхности других металлов.
Это приводит к тому, что металлические частицы отрываются от основной массы детали, причем если титан соприкасается с металлами, более твердыми, чем он, то вскоре они оказываются покрытыми слоем растертых частиц титана.
И наоборот, если металлы более мягкие, то их частицы отрываются и прирастают к титану. Как в том, так и в другом случае, итог малоутешителен: детали как бы съедают одна другую.
Чтобы при трении изделия не разрушались, обычно применяют смазку, которая в значительной мере ослабляет трение. Это — обычно. Но титан — металл необычный, парадоксальный.
Вот и при смазке он нисколько не изменяет своих свойств по части трения и налипания — не помогают масла и жиры, ни мыла, ни спирты и кислоты, ни другие обычно с успехом применяемые смазочные материалы. Даже твердая смазка — и та недостаточно эффективна.
Лишь только графит и сернистый молибден оказываются более или менее пригодными смазочными веществами, но лишь в течение непродолжительного времени.
И все же титановые сплавы используют для изготовления трущихся деталей. Благодаря различным трудоемким методам обработки повышается твердость поверхности и намного уменьшается склонность металла к налипанию и задирам, что уменьшает износ деталей.
По склонности к налипанию в сомнительных случаях можно очень точно определить — титан ли тот металл, который у вас в руках.
Если по мокрому стеклу провести куском металла и после этого на стекле останется серо-белая черта, значит, это действительно титан.
Проба на искру также позволяет легко узнать его среди других металлов: при соприкосновении с абразивным кругом титан испускает пучок белых блестящих искр.
Как уже известно, титан противостоит действию серной кислоты только в том случае, если она очень разбавлена и ее концентрация не превышает 5 процентов. Чем выше концентрация, тем интенсивнее коррозия.
Но как вы думаете, когда титан разрушается сильнее: находясь в 40-процентной или же в 60-процентной серной кислоте? Вы, вероятно, решите, что в более концентрированном растворе титан будет и корродировать болев интенсивно. Но в действительности все наоборот.
Сначала, правда, титан в 60-процентной кислоте разрушается сильнее, но через несколько часов коррозия его почти совершенно прекращается.
Титан беззащитен против галогенов — фтора, иода, брома, хлора. Погруженный в жидкий бром, металл уже через 15 минут вспыхивает и сгорает дотла. То же самое происходит с титаном и в сухом газообразном хлоре с той, правда, разницей, что воспламенение наступает несколько позже — через сутки.
Но если в хлоре будет совершенно мизерное количество влаги (хотя бы одна частичка воды на 20000 частей хлора), поведение металла меняется самым разительным образом и из совершенно нестойкого материала он делается абсолютно стойким в этой среде.
Что и говорить, действительно, странный, парадоксальный металл!
Металл, который внезапно вспыхивает и горит так яростно, что его погасить почти невозможно, — успешно используют для противопожарных переборок. Металл, который может взорваться, — широко применяют в ракетных и самолетных двигателях.
А стоит ли того большого внимания, которое ему уделяют, такой капризный металл с целой массой недостатков? Он легкий, да, этого не отнимешь, но ведь алюминий гораздо легче, а о магнии и говорить не приходится…
Что же касается прочности, то специальные стали гораздо прочнее его.
И по стойкости против коррозии он тоже не чемпион: некоторые металлы превосходят его, причем металлы эти не благородные, а (хотя и редкие, и более дорогие) такие же рядовые, как он, — тантал, к примеру, или цирконий.
Все это так. Но, уступая некоторым другим металлам в легкости, прочности, стойкости против коррозии, титан остается по-прежнему уникальным материалом.
Ведь он — единственный металл, сочетающий в себе все перечисленные свойства и тем самым как бы работающий за троих.
Именно такое сочетание оправдывает все его недостатки, с избытком компенсируя затраты и трудности, связанные с его производством и применением.
Твердый водород и нетвердые доказательства
Химия и науки о материалахДействительно ли физики из Гарварда получили металлический водород
Гарвардские физики заявили, что получили в лабораторных условиях твердый металлический водород. Является ли это важнейшим прорывом в науке или ученые просто выдали желаемый результат за действительный? Есть ли основания сомневаться в открытии, или скептики просто завидуют? Indicator.Ru выясняет вместе с профессором РАН, профессором Сколковского института науки и технологий Артемом Огановым и профессором НИЯУ «МИФИ», доктором физико-математических наук Николаем Кудряшовым.
В журнале Science была опубликована работа, в которой авторы заявляют о первом успешном получении водорода в фазе твердого металлического вещества. Сами ученые называют свое достижение ни много ни мало «Святым Граалем физики высокого давления».
Немного истории
Открытие имеет долгую историю и довольно любопытные и важные перспективы.
В 1935 году известный физик Юджин Вигнер со своим коллегой Хиллардом Хантингтоном из Принстонского университета опубликовали в журнале (Journal of Chemical Physics, vol. 3, No.
12, 1935) статью, в которой теоретически предсказали, что при повышенном давлении до 250 тысяч атмосфер у водорода происходит фазовый переход, в результате которого появляется кристаллическая решетка и водород становится металлом.
Тридцать три года спустя, в 1968 году, Нейл Эшкрофт из Корнельского университета в своей теоретической работе (Physical Review Letters, vol. 21, 1968, p.
1748) показал, что металлический водород будет высокотемпературным сверхпроводником и критическая температура его перехода в сверхпроводящее состояние будет равняться комнатной или даже выше.
Легко догадаться, какой технологический прорыв мог бы появиться, если бы ученым удалось получить металлический водород в достаточном количестве. Так возникли невероятно оптимистические перспективы технических приложений металлического водорода.
В действительности, более точные расчеты (Н.А. Кудряшов, А.А. Кутуков, Е.А. Мазур, Письма в ЖЭТФ, том 104, вып. 7, 1916, С. 488) показали, что критическая температура металлического водорода в фазе I41/AMD, той самой, которая изучалась Рангой Диас и Айзеком Сильверой при давлении в 500 миллионов атмосфер, дает величину температуры перехода в сверхпроводящее состояние 215 K, то есть –58°C.
Таким образом, начиная с 1970 годов проблема получения металлического водорода остается одной из важных, перспективных и волнующих научных тем.
Еще более привлекательной и интересной эта тема стала после того, как в работах академика Юрия Кагана и его коллег из научного центра «Курчатовский институт» (Успехи физических наук, том 105, 1971, с.
77 и более поздние статьи) было установлено, что металлический водород должен иметь метастабильные свойства. Это значит, что после его получения металл будет в течение некоторого времени (возможно, достаточно продолжительного) оставаться в том состоянии, в котором он был получен.
Определение времени, в котором вещество остается стабильным, — отдельная задача.
Между взрывом и наковальней
Проблема получения металлического водорода оказалась связанной с изучением поведения вещества при высоких давлениях и при низких температурах. Высокие давления в настоящее время получаются с помощью статического сжатия вещества в алмазной наковальне или при динамическом сжатии с помощью взрыва.
Получить в алмазной наковальне металлический водород не так просто. Дело в том, что оценка давления, до которого надо было сжимать водород, следовавшая из работы Вигнера и Хантингтона, оказалось намного заниженной. Кроме того, работать с водородом сложно, поскольку он хорошо растворяется во многих металлах и легко проникает в них вследствие легкости своих молекул.
При взрывном сжатии удается достигать бо́льших давлений, чем в алмазных наковальнях, но при взрывах всегда получаются высокие температуры и технологически трудно получить низкие.
При этом возникает еще одна проблема, связанная с высоким давлением при взрыве. Оно быстро уменьшается после испытания, и провести его измерения за короткое время непросто.
Тем не менее такие работы проводятся в некоторых отечественных и зарубежных лабораториях.
В своем интервью газете «Harward gazette» профессор Сильвера сообщил, что им удалось преодолеть все трудности эксперимента и получить наконец-то некоторое количество одной из фаз металлического водорода. Он заявил, что «это первый в мире образец металлического водорода на Земле, и, когда вы на него смотрите, вы видите то, что никто никогда не видел прежде».
Основной трудностью при подготовке и проведении эксперимента Диаса и Сильверы явилось достижение высокого давления при сжатии водорода в алмазной наковальне без разрушения алмазов.
Исследователи использовали два небольших синтетических алмаза с уникально обработанными поверхностями, установленными в алмазной ячейке. Поверхности соприкосновения с водородом, покрывались тонким слоем оксида алюминия с целью предотвращения процесса диффузии в кристаллическую структуру.
В результате исследователи получили сверхэкстремальное давление, равное 495 миллионам атмосфер, и сверхнизкую температуру, равную 3 K.
Вначале материал в алмазной наковальне имел блестящую поверхность, но «с ростом давления материал стал черным, и мы полагаем, что это произошло потому, что он стал полупроводником, способным поглощать свет, — сказал профессор Сильвера. — Затем мы еще больше увеличили давление, и материал стал блестящим. Отражательная способность его была чрезвычайно высокой, около 90%. Это примерно равно отражающей способности полированного алюминия».
Профессор Дэвид Кэперли из Университета штата Иллинойс, не принимавший участия в исследовании, считает, что «в случае подтверждения этого открытия будет положен конец поискам, продолжавшимся не одно десятилетие. Это открытие может стать новым значительным шагом в понимании самого распространенного элемента во Вселенной».
Мнение эксперта
Корреспондент Indicator.Ru поговорил об открытии с профессором Сколковского института науки и технологий, профессором и заведующим лабораторией компьютерного дизайна материалов в Университете штата Нью-Йорк в Стоуни-Брук, профессором РАН, специалистом по физике и химии высоких давлений Артемом Огановым.
— Действительное ли это самое первое свидетельство получения твердого металлического водорода?
— Похоже на правду. Однако нужно сохранять здоровую долю осторожности. Все вещества при давлении должны металлизоваться, но у каждого вещества это давление свое. Рано или поздно будет достигнуто давление, при котором водород станет металлом.
Было по меньшей мере две работы, в которых объявлялось о синтезе твердого металлического водорода, но поддержки всего научного сообщества ни то, ни другое сообщение не получило.
В этот раз похоже, что работа группы Айзека Сильверы такую поддержку получает, хотя скептицизм остается.
Айзек Сильвера к этой цели стремился всю свою жизнь. Он получил PhD еще в 1965 году, все время занимался водородом и попытками получения его в металлической фазе. И мне кажется замечательным событием, что в завершении карьеры ему, похоже, удалось достигнуть этой цели.
Результаты этой работы свидетельствуют, что водород, как и любое другое вещество, при достаточном сжатии превращается в металл, подтверждая ожидания физиков.
Для металлического водорода предсказываются очень интересные свойства, например сверхпроводимость при почти комнатных температурах.
Но надо сказать, что предположения о наличии сверхпроводимости в металлическом водороде были многочисленны и предсказываемая ими температура сверхпроводящего перехода существенно разнилась. Самая надежная оценка была сделана несколько лет назад в работе группы Гросса — 240 K (-33°C).
— Водород образует много различных фаз при низких температурах и высоких давлениях: твердое вещество из молекул, промежуточное фаза полупроводника и другие. Твердое металлическое состояние — это последняя фаза, которую до этого не удавалось получить, или у водорода есть еще специфические модификации?
— Поведение водорода очень сложное, поэтому трудно сказать. К тому же постоянно открывают новые разновидности.
Совсем недавно, например, было открыто состояние, в котором графеноподобные слои перемежаются с молекулами H2 — достаточно необычный вариант, также существующий только при высоких давлениях.
Я думаю, последнее слово в этой области еще не сказано. Даже в уже достигнутом диапазоне давлений и температур много может быть открыто.
Фазовая диаграмма водорода очень сильно осложняется дополнительными эффектами.
Во-первых, очень большую роль могут играть квантовые эффекты нулевых колебаний атомов — это следствие принципа неопределенности приводит к тому, что атомы и при абсолютном нуле не находятся в покое, и этот эффект максимален для легких элементов вроде водорода.
Во-вторых, ситуация с водородом осложняется влиянием различных изотопов. У протия, дейтерия и трития и их смесей в различных пропорциях будут очень непохожие давления переходов, не исключены и различные фазы.
Кроме того, ядро водорода обладает спином, поэтому могут появиться дополнительные состояния, связанные с взаимной ориентацией спинов (параводород и ортоводород). Кстати, именно Айк Сильвера внес очень большой вклад в понимание влияния ядерных спиновых эффектов на фазовую диаграмму. В целом можно сказать, что водород — элемент очень непростой.
— Некоторые специалисты не спешат признавать эти результаты как окончательное подтверждение получения твердой металлической фазы. Как вы считаете, измерение какой физической величины полностью может развеять сомнение?
— Полученное вещество, несомненно, является твердым, так как для водорода известна кривая плавления. Вопрос в том, обладает ли оно металлическими свойствами. Самое прямое доказательство — измерение электропроводности или отражающей способности.
Могла бы помочь рамановская спектроскопия, хотя этим методом сложно исследовать металлы, так как рассеяние происходит только в приповерхностном слое, а не в толще кристалла. Возможно, неупругое рентгеновское рассеяние, но и с ним будут трудности, поскольку водород плохо рассеивает рентгеновские лучи.
Водород хорошо рассеивает нейтроны, но нужен большой образец, а в данном случае говорить об этом не приходится.
Также очень сильным подтверждением было бы решение рентгенодифракционным изучением кристаллической структур, но слабое рассеяние рентгеновских лучей атомами водорода опять же затрудняет проведение этого анализа.
— Вы разрабатываете методы предсказания фаз веществ с помощью компьютерного моделирования. В вашей группе проводились расчеты для водорода?
— Нет, мы чистым водородом практически не занимались. Отчасти это связано с тем, что теория его описания недостаточно точна.
Отчасти это связано с неполным описанием всех нужных эффектов, о которых мы говорили — а без этого расчеты могут оказаться бессмысленными.
Впрочем, учитывая сложности экспериментального изучения водорода, наиболее перспективным может оказаться именно совместное теоретико-экспериментальное исследование.
— Каковы, на ваш взгляд, перспективы сохранения этой фазы в стабильном или метастабильном состоянии при уменьшении давления до атмосферного?
— Какие-то материалы сохраняются при снятии давления, а какие-то исчезают — точнее, превращаются в более стабильные и более обыденные состояния. Алмаз является одним из многих примеров веществ, образующихся под давлением и сохраняющихся при снятии давления. В случае металлического водорода шансов на сохранение при снятии давления практически нет.
Доля сомнения
Впрочем, представление прорывного открытия научному сообществу прошло не совсем гладко. Уже 26 января новостной портал журнала Nature опубликовал заметку под названием «Физики сомневаются в смелом сообщении о твердом водороде».
Заголовок задал тон всей публикации: сомнения вызвала как новизна опыта, так и все открытие — однако Nature не давала особенно серьезных аргументов, предпочитая заявления в стиле «не верю».
«Мне эта научная статья вообще не представляется убедительной», — сказал французский физик Поль Лубейр.
Американский геофизик Александр Гончаров не уверен, что блестящее вещество, которое увидели исследователи — это на самом деле водород (это может быть и оксид алюминия на поверхности алмазов в наковальне).
Евгений Грегорьянц (Эдинбургский университет) считает проблемным то, что Диас и Сильвера только один раз произвели замеры своего образца под высоким давлением — остается неясным, как давление менялось в ходе эксперимента.
«Я знаю, что многие специалисты в области высоких давлений высказывают сомнения, указывая, что высокая отражательная способность металла может объясняться присутствием загрязнений в составе алмазов, например, окиси алюминия.
Однако, если авторам удалось достичь давления почти в 500 миллионов атмосфер в алмазном прессе, то можно, действительно, ожидать переход водорода в металлическое состояние», — заявил профессор Маркус Кнудсон из Национальных лаборатории Сандии.
«Люди имеют право сомневаться, — считает Артем Оганов. — Такой предмет, как металлический водород, был предметом стольких попыток, сенсаций, разочарований, интриг всяких, войн и так далее. Это очень накаленный предмет. Поэтому люди будут сопротивляться и сомневаться до самого до самого последнего момента.
Я посмотрел статью Сильвера и Диаса. Конечно, у них мало данных. Но, если вы хотите мое интуитивное ощущение, мне кажется, что они водород этот нашли.
Претензии ведь не в том, что они сделали что-то неправильно, а в том, что они не поставили точку, убедив последнего скептика.
Профессор РАН, профессор Сколковского института науки и технологий
Я не вижу каких-то страшных противоречий, и вообще я не вижу никаких противоречий – между тем, что они опубликовали, и тем, что в общем я ожидал.
Не вижу противоречий в давлении перехода, тот экспериментальный подход, который они использовали, мне кажется тоже совершенно разумным. Люди шли к такому эксперименту десятилетиями.
Попытка воспроизвести и подтвердить или опровергнуть этот эксперимент займет, может быть, год-два-три и так далее. Но опять же будут скептики, будут люди, которые захотят иметь больше данных. Это неудивительно.
Представьте, что есть несколько людей, которые всю жизнь стремились к получению металлического водорода. И представьте себе, вы видите, как на ваших глазах кто-то утверждает, что он эту цель уже достиг… Очень многие люди воспринимают это как свою личную победу или поражение».
Завершают свой текст авторы Nature таким пассажем: «несмотря на все позиции скептиков, в опубликованных Science и Гарвардским университетом пресс-релизах уверенно объявляется о получении металлического водорода». Невольно появляется мысль: не появилась ли столь ядовитая по тону публикация в Nature News из-за зависти к конкуренту (Science), который получил честь впервые сообщить о великом открытии?
Авторы — Николай Кудряшов, Тимур Кешелава, Артем Космарский, Алена Манузина






