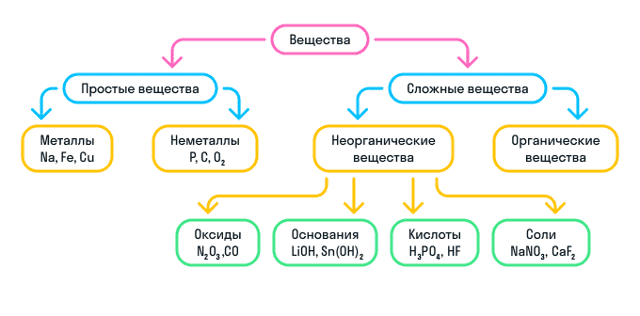
- Что такое простые вещества
- Металлы
- Неметаллы
- Что такое сложные вещества
- Неорганические вещества
- Номенклатура неорганических веществ
- Металлы
- Урок 5. Химическая формула – HIMI4KA
- Химические формулы веществ молекулярного строения
- Химические формулы веществ немолекулярного строения
- Химические формулы веществ
- Знаки химических элементов
- Таблица 1: Информация, которую дает химический знак
- Случаи, когда название химического знака читается иначе, приведены в таблице 2:
- Химические формулы простых веществ
- Таблица 3: Информация, которую дает химический знак
- Химические формулы сложных веществ
- Таблица 4: Информация, которую дает химическая формула сложного вещества
- Графические формулы
- Для составления графической (структурной) формулы вещества необходимо:
- Урок№3 Составление формул простых веществ
- Прежде чем переходить к понятиям простых и сложных веществ и к их строению, давайте вспомним, что такое химический элемент.
- Химический элемент — это группа атомов с одинаковым зарядом ядра, который обусловливает его (элемента) химические свойства.
- В зависимости от того, как соединяются друг с другом химические элементы, выделяют два типа веществ: простые и сложные.
Что такое простые вещества
Простые вещества — это вещества, образованные атомами только одного типа химического элемента. Например: H2, Na, P, Al.
Простые вещества делятся на два типа: металлы и неметаллы.
Металлы
Имеют общие между собой физические свойства. Обладают металлическим блеском, высокой тепло- и электропроводностью, твердые (за исключением ртути), пластичные и ковкие.
К простым веществам — металлам относятся: Na, Ca, Fe и т. д.
Почти все металлы имеют немолекулярное строение, т. е. состоят из атомов или ионов.
Неметаллы
Среди неметаллов выделить общие физические свойства практически невозможно. Они могут находиться в разных агрегатных состояниях, обладать различным цветом и т. д.
К простым веществам — неметаллам относятся: P, C, F2 и т. д.
Большинство неметаллов имеют молекулярное строение, т. е. состоят из молекул. При этом молекулы могут быть:
- одноатомные: He, Si, Ar и другие;
- двухатомные: F2, O2, H2, N2, Cl2, Br2, I2. Эти простые вещества всегда пишутся с индексом 2, их необходимо запомнить;
- трехатомные — например, молекула озона O3;
- и другие многоатомные.
Некоторые неметаллы имеют немолекулярное (атомное) строение: красный фосфор, кремний, алмаз и графит.
Металлы и неметаллы сильно отличаются друг от друга физическими и химическими свойствами.
При этом запоминать, к какому типу относится то или иное вещество, не нужно, достаточно посмотреть в таблицу Менделеева:
-
Проведите диагональ от 5-го до 85-го номера химических элементов.
-
Все химические элементы, находящиеся ниже и левее проведенной диагонали, образуют простые вещества — металлы (кроме водорода).
-
Выше диагонали химические элементы, находящиеся в главных подгруппах, образуют простые вещества — неметаллы, а в побочных — металлы.
Например, фосфор (порядковый номер — 15) расположен в таблице Менделеева выше диагонали и в главной подгруппе V группы. Значит, простое вещество фосфор — неметалл.
В большинстве случаев названия химического элемента и простого вещества совпадают. Поэтому необходимо научиться различать характеристики простого вещества и химического элемента.
|
Как правило, когда мы характеризуем простое вещество, то говорим о его физических или химических свойствах:
|
- Аллотропия — это возможность образования химическим элементом нескольких простых веществ, которые отличаются друг от друга строением и свойствами.
- Образующиеся простые вещества называют аллотропными модификациями.
- Аллотропия характерна для следующих химических элементов:
- углерод (алмаз, графит, графен, углеродные нанотрубки, фуллерен и другие);
- фосфор (красный, белый и черный);
- кислород (кислород и озон);
- кремний (аморфный и кристаллический);
- Рассмотрим две аллотропные модификации углерода:


The image 1 is a derivative of «Crystal» by manfredxy on Envato Elements.
The image 2 is a derivative of «Rough Graphite rock» by vvoennyy on Envato Elements.
Алмаз — бесцветное прозрачное вещество. Является одним из самых твердых веществ. Не проводит электрический ток.
Графит представляет собой вещество серо-черного цвета, обладает металлическим блеском. Имеет высокую тепло- и электропроводность.
Графит представляет собой вещество серо-черного цвета, обладает металлическим блеском. Имеет высокую тепло- и электропроводность.
Что такое сложные вещества
- Сложные вещества — это вещества, образованные атомами нескольких химических элементов.
- Например, молекула HNO3 состоит из одного атома водорода, одного атома азота и трех атомов кислорода.
- К сложным веществам в химии относятся две большие группы веществ: неорганические и органические.
Неорганические вещества
Неорганические вещества делятся на 4 вида:
-
Оксиды — вещества, молекулы которых состоят из двух химических элементов, один из которых — кислород в степени окисления −2.
Например: Na2O, CaO, P2O5.
-
Основания — вещества, молекулы которых состоят из катиона металла и гидроксильной группы (—OH).
Например: KOH, Fe(OH)3, Ni(OH)2.
-
Кислоты — вещества, молекулы которых состоят из катиона водорода (H+), способного замещаться атомом металла, и кислотного остатка.
Например: HNO3, HCl, H3PO4.
-
Соли — вещества, состоящие из катиона металла и кислотного остатка.
Например: NaCl, CaCO3, K2SO4.
Кратко о классификации веществ можно узнать из схемы:
Номенклатура неорганических веществ
- Названия простых веществ чаще всего совпадают с названием химического элемента, а для сложных веществ существует два вида номенклатуры: тривиальная и систематическая.
- В тривиальной номенклатуре вещества названы в соответствии с их особенностями, например специфическим запахом или окраской.
- В систематической номенклатуре название зависит от вида неорганического вещества.
- Оксиды
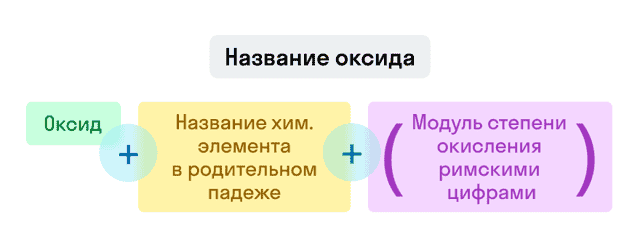
Если степень окисления у элемента постоянная, то она в конце названия не указывается.
Примеры названий оксидов:
- Fe2O3 — оксид железа (III). Читается: феррум два о три;
- Na2O — оксид натрия. Читается: натрий два о.
Основания
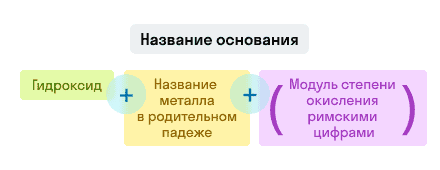
Примеры названий гидроксидов:
- Fe(OH)3 — гидроксид железа (III). Читается: феррум о аш трижды;
- NaOH — гидроксид натрия. Читается: натрий о аш.
Соли
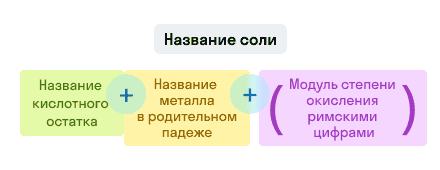
Примеры названий солей:
- KNO3 — нитрат калия. Читается: калий эн о три;
- AlCl3 — хлорид алюминия. Читается: алюминий хлор три.
Кислоты
Названия кислот, кислотных остатков и их формулы необходимо выучить, они приведены в таблице ниже.
| HF | Фтороводород, плавиковая | F− | Фторид |
| HCl | Хлороводород, соляная | Cl− | Хлорид |
| HBr | Бромоводород | I− | Йодид |
| H2S | Сероводород | S2− | Сульфид |
| HCN | Циановодородная | CN− | Цианид |
| HNO2 | Азотистая | NO2− | Нитрит |
| HNO2 | Азотная | NO3− | Нитрат |
| H3PO4 | Ортофосфорная | PO43− | Фосфат |
| H3AsO4 | Мышьяковая | AsO43− | Арсенат |
| H2SO4 | Сернистая | SO32− | Сульфит |
| H2SO4 | Серная | SO42− | Сульфат |
| H2CO3 | Угольная | CO32− | Карбонат |
| H2SiO3 | Кремниевая | SiO32− | Силикат |
| H2CrO4 | Хромовая | CrO42− | Хромат |
| H2Cr2O7 | Дихромовая | Cr4O72− | Дихромат |
| HMnO2 | Марганцовая | MnO4− | Перманганат |
| HClO | Хлорноватистая | ClO− | Гипохлорит |
| HClO2 | Хлористая | ClO2− | Хлорит |
| HClO3 | Хлорноватая | ClO3− | Хлорат |
| HClO4 | Хлорная | ClO4− | Перхлорат |
| HCOOH | Метановая, муравьиная | HCOO− | Формиат |
| CH3COOH | Этановая, уксусная | CH3COO− | Ацетат |
| H3C2O4 | Этандиовая, щавелевая | C2O4− | Оксалат |
Знать свойства и строение простых и сложных веществ важно не только на экзамене, но и в жизни. Поэтому на курсах подготовки к ОГЭ по химии в онлайн-школе Skysmart мы разбираем много реальных примеров, смотрим опыты и учимся применять полученные знания в быту.
Учёба без слёз
Пошаговый гайд от Екатерины Мурашовой о том, как перестать делать уроки за ребёнка и выстроить здоровые отношения с учёбой

Металлы


Средняя оценка: 4
Всего получено оценок: 1823.
Средняя оценка: 4
Всего получено оценок: 1823.
К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
Рис. 1. Список металлов.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие.
К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов.
Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.
 Рис. 2. Металлы в таблице Д.И. Менделеева.
Рис. 2. Металлы в таблице Д.И. Менделеева.
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т.д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см3), самый тяжелый – осмий (плотность 22,5 г/см3). Металлы с плотностью больше 5 г/см3 относят к тяжелым, меньше 5 г/см3 – к легким металлам.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают
 Рис. 3. Металлы главных подгрупп.
Рис. 3. Металлы главных подгрупп.
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
Чтобы попасть сюда — пройдите тест.
Средняя оценка: 4
Всего получено оценок: 1823.
А какая ваша оценка?
Гость завершил
Тест «Отцы и дети»с результатом 13/15
Гость завершил
Тест «На дне»с результатом 12/15
Гость завершил
Тест «Маленький принц»с результатом 13/14
Гость завершил
Тест «Недоросль»с результатом 17/18
Гость завершил
Тест «Сын полка»с результатом 15/16
Гость завершил
Тест «Толстый и тонкий»с результатом 7/8
Гость завершил
Тест «Железная дорога»с результатом 7/10
Гость завершил
Тест «Ромео и Джульетта»с результатом 6/16
Гость завершил
Тест «Тарас Бульба»с результатом 12/16
Не подошло? Напиши в х, чего не хватает!
Урок 5. Химическая формула – HIMI4KA
Архив уроков › Химия 8 класс
В уроке 5 «Химическая формула» из курса «Химия для чайников» дадим определение химическим формулам и их индексам, а также выясним различия химических формул веществ молекулярного и немолекулярного строения. Напоминаю, что в прошлом уроке «Сложные вещества» мы дали определение химическим соединениям, рассмотрели различия органических и неорганических соединений, а также выяснили, что означает качественный и количественный состав.

- Состав любого вещества выражается в виде химической формулы.
- Химическая формула — это условная запись состава вещества с помощью химических знаков и индексов.
- Качественный состав показывается с помощью знаков (символов) химических элементов, а количественный — с помощью индексов, которые записываются справа и чуть ниже знаков химических элементов.
- Индекс — число атомов данного химического элемента в формуле вещества.
- Например, химическая формула простого вещества водорода записывается так:
и читается «аш-два».
Химические формулы веществ молекулярного строения
Формулы двухатомных молекул: кислорода — О2 («о-два»), хлора — Сl2 («хлор-два»), азота — N2 («эн-два»). Трехатомная молекула озона и восьмиатомная молекула серы обозначаются формулами О3 («о-три») и S8 («эс-восемь»).
Формулы молекул сложных веществ также отображают их качественный и количественный состав.
Например, формула воды, как вы уже, наверное, хорошо знаете, Н2О («аш-два-о»), метана — СН4 («це-аш-четыре»), а аммиака — NH3 («эн-аш-три»). Точно так же читаются формулы любых сложных веществ.
Например, формула серной кислоты — H2SO4 («аш-два-эс-о-четыре»), а глюкозы — C6H12O6 («це-шесть-аш-двенадцать-о-шесть»).
Химические формулы веществ молекулярного строения (их называют молекулярными формулами) показывают состав элементарных частей, т. е. условных «кирпичиков», из которых состоят эти вещества. Такими элементарными составными частями (элементарными структурными единицами, или просто структурными единицами) в данном случае являются молекулы.
Химические формулы веществ немолекулярного строения
А если вещество имеет немолекулярное строение? Химические формулы простых веществ такого типа (например, металлов) записывают просто знаками соответствующих элементов без индексов (или, вернее, с индексом, равным единице, которая не записывается). Так, формула простого вещества железа — Fe, меди — Cu, алюминия — Al.
Состав сложных веществ немолекулярного строения выражают с помощью формул, которые показывают простейшее соотношение чисел атомов разных химических элементов в этих веществах. Такие формулы называются простейшими. Например, простейшая формула кварца — главной составной части речного песка — SiO2.
Она показывает, что в кристалле кварца на один атом кремния приходятся два атома кислорода, т. е. простейшее соотношение чисел атомов кремния и кислорода в этом веществе равно 1:2.
Простейшая формула Al2O3 показывает, что в этом соединении простейшее соотношение между числами атомов алюминия и кислорода равно 2:3.
Группа атомов, состав которой соответствует простейшей формуле вещества немолекулярного строения, называется его формульной единицей.
Формульная единица, поваренной соли NaCl («натрий-хлор») — группа из одного атома натрия и одного атома хлора. Формульная единица мела CaCO3 («кальций-це-о-три») — группа из одного атома кальция, одного атома углерода и трех атомов кислорода.
Формулы более сложных соединений немолекулярного строения читаются аналогично. Дополнительно указывается только число групп атомов, заключенных в круглые скобки: Al2(SO4)3 («алюминий-два-эс-о-четыре-трижды»), Mg(NO3)2 («магний-эн-о-три-дважды») и т. д.
Таким образом, структурными единицами веществ молекулярного строения являются молекулы. Структурными единицами веществ немолекулярного строения являются их формульные единицы.
- В таблице ниже показаны формульная запись и схематическое изображение состава веществ различного типа.
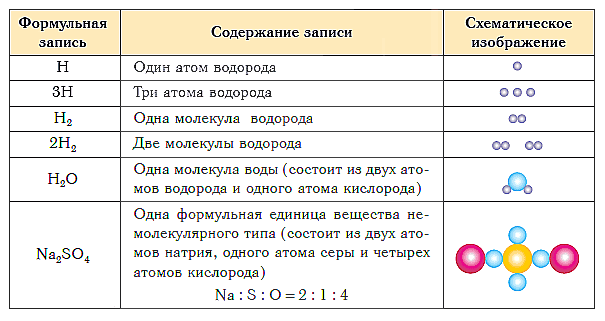
- Краткие выводы урока:
- Качественный и количественный состав вещества выражается с помощью химических формул.
- Химическая формула вещества молекулярного строения показывает состав его молекулы, которая является элементарной структурной единицей данного вещества.
- Химическая формула вещества немолекулярного строения показывает простейшее соотношение атомов в его формульной единице.
Надеюсь урок 5 «Химическая формула» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Химические формулы веществ
Химические формула – это изображение качественного и количественного состава вещества с помощью символов химических элементов.
Знаки химических элементов
Химический знак или химический символ элемента – это первая или две первые буквы от латинского названия этого элемента.
Например: Ferrum – Fe, Cuprum – Cu, Oxygenium – O и т.д.
Таблица 1: Информация, которую дает химический знак
| Сведения | На примере Cl |
| Название элемента | Хлор |
| Принадлежность элемента к данному классу химических элементов | Неметалл, галоген |
| Один атом элемента | 1 атом хлора |
| Относительная атомная масса (Ar) данного элемента | Ar(Cl) = 35,5 |
| Абсолютная атомная масса химического элемента m = Ar · 1,66·10-24г = Ar · 1,66 · 10-27кг |
M(Cl) = 35,5 · 1,66 · 10-24 = 58,9 · 10-24г |
Название химического знака в большинстве случаев читается как название химического элемента. Например, К – калий, Са – кальций, Mg – магний, Mn – марганец.
Случаи, когда название химического знака читается иначе, приведены в таблице 2:
| Название химического элемента | Химический знак | Название химического знака (произношение) |
| Азот | N | Эн |
| Водород | H | Аш |
| Железо | Fe | Феррум |
| Золото | Au | Аурум |
| Кислород | O | О |
| Кремний | Si | Силициум |
| Медь | Cu | Купрум |
| Олово | Sn | Станум |
| Ртуть | Hg | Гидраргиум |
| Свинец | Pb | Плюмбум |
| Сера | S | Эс |
| Серебро | Ag | Аргентум |
| Углерод | C | Цэ |
| Фосфор | P | Пэ |
Химические формулы простых веществ
- Химическими формулами большинства простых веществ (всех металлов и многих неметаллов) являются знаки соответствующих химических элементов.
- Так вещество железо и химический элемент железо обозначаются одинаково – Fe.
- Если простое вещество имеет молекулярную структуру (существует в виде молекул, то его формулой является химический знак элемента с индексом внизу справа, указывающим число атомов в молекуле: H2, O2, O3, N2, F2, Cl2, Br2, P4, S8.
Таблица 3: Информация, которую дает химический знак
| Сведения | На примере C |
| Название вещества | Углерод (алмаз, графит, графен, карбин) |
| Принадлежность элемента к данному классу химических элементов | Неметалл |
| Один атом элемента | 1 атом углерода |
| Относительная атомная масса (Ar) элемента, образующего вещество | Ar(C) = 12 |
| Абсолютная атомная масса | M(C) = 12 · 1,66 · 10-24 = 19,93 · 10-24г |
| Один моль вещества | 1 моль углерода, т.е. 6,02 · 1023 атомов углерода |
| Молярная масса вещества | M(C) = Ar(C) = 12 г/моль |
Химические формулы сложных веществ
- Формулу сложного вещества составляют путем записи знаков химических элементов, из которых это вещество состоит, с указанием числа атомов каждого элемента в молекуле.
При этом, как правило, химические элементы записывают в порядке увеличения их электроотрицательности в соответствии со следующим практическим рядом:
- Me, Si, B, Te, H, P, As, I, Se, C, S, Br, Cl, N, O, F
- Например, H2O, CaSO4, Al2O3, CS2, OF2, NaH.
- Исключение составляют:
- некоторые соединения азота с водородом (например, аммиак NH3, гидразин N2H4);
- соли органических кислот (например, формиат натрия HCOONa, ацетат кальция (CH3COO)2Ca);
- углеводороды (CH4, C2H4, C2H2).
Химические формулы веществ, существующих в виде димеров (NO2, P2O3, P2O5, соли одновалентной ртути, например: HgCl, HgNO3 и др.), записывают в виде N2O4, P4O6, P4O10, Hg2Cl2, Hg2(NO3)2.
- Число атомов химического элемента в молекуле и сложном ионе определяется на основании понятия валентности или степени окисления и записывается индексом внизу справа от знака каждого элемента (индекс 1 опускается). При этом исходят из правила:
- алгебраическая сумма степеней окисления всех атомов в молекуле должна быть равной нулю (молекулы электронейтральны), а в сложном ионе – заряду иона.
- Например:
- 2Al3+ +3SO42- =Al2(SO4)3
Этим же правилом пользуются при определении степени окисления химического элемента по формуле вещества или сложного иона. Обычно это элемент, имеющий несколько степеней окисления. Степени окисления остальных элементов, образующих молекулу или ион должны быть известны.
Заряд сложного иона – это алгебраическая сумма степеней окисления всех атомов, образующих ион. Поэтому при определении степени окисления химического элемента в сложном ионе сам ион заключается в скобки, а его заряд выносится за скобки.
- При составлении формул по валентности вещество представляют, как соединение, состоящее из двух частиц различного типа, валентности которых известны. Далее пользуются правилом:
- в молекуле произведение валентности на число частиц одного типа должно быть равным произведению валентности на число частиц другого типа.
- Например:

Цифра, стоящая перед формулой в уравнении реакции, называется коэффициентом. Она указывает либо число молекул, либо число молей вещества.
Коэффициент, стоящий перед химическим знаком, указывает число атомов данного химического элемента, а в случае, когда знак является формулой простого вещества, коэффициент указывает либо число атомов, либо число молей этого вещества.
Например:
- 3Fe – три атома железа, 3 моль атомов железа,
- 2H – два атома водорода, 2 моль атомов водорода,
- H2 – одна молекула водорода, 1 моль водорода.
Химические формулы многих веществ были определены опытным путем, поэтому их называют «эмпирическими».
Таблица 4: Информация, которую дает химическая формула сложного вещества
| Сведения | На примере CaCO3 |
| Название вещества | Карбонат кальция |
| Принадлежность элемента к определенному классу веществ | Средняя (нормальная) соль |
| Одна молекула вещества | 1 молекула карбоната кальция |
| Один моль вещества | 6,02 · 1023 молекул CaCO3 |
| Относительная молекулярная масса вещества (Мr) | Мr(CaCO3) = Ar(Ca)+Ar(C) +3Ar(O)=100 |
| Молярная масса вещества (M) | М(CaCO3) = 100 г/моль |
| Абсолютная молекулярная масса вещества (m) | M(CaCO3) = Mr(CaCO3) · 1,66 · 10-24г = 1,66 · 10-22 г |
| Качественный состав (какие химические элементы образуют вещество) | кальций, углерод, кислород |
| Количественный состав вещества: | |
| Число атомов каждого элемента в одной молекуле вещества: | молекула карбоната кальция состоит из 1 атома кальция, 1 атома углерода и 3 атомов кислорода. |
| Число молей каждого элемента в 1 моле вещества: | В 1 моль СаСО3 (6,02 ·1023 молекулах) содержится 1 моль (6,02 ·1023 атомов) кальция, 1 моль (6,02 ·1023 атомов) углерода и 3 моль (3·6,02·1023 атомов) химического элемента кислорода) |
| Массовый состав вещества: | |
| Масса каждого элемента в 1 моле вещества: | 1 моль карбоната кальция (100г) содержит химических элементов: 40г кальция, 12г углерода, 48г кислорода. |
| Массовые доли химических элементов в веществе (состав вещества в процентах по массе): | Состав карбоната кальция по массе:
|
| Для вещества с ионной структурой (соли, кислоты, основания) – формула вещества дает информацию о числе ионов каждого вида в молекуле, их количестве и массе ионов в 1 моль вещества: | Молекула СаСО3 состоит из иона Са2+ и иона СО32- 1 моль (6,02·1023 молекул) СаСО3 содержит 1 моль ионов Са2+и 1 моль ионов СО32-; 1 моль (100г) карбоната кальция содержит 40г ионов Са2+ и 60г ионов СО32- |
| Молярный объем вещества при нормальных условиях (только для газов) |
Графические формулы
Для получения более полной информации о веществе пользуются графическими формулами, которые указывают порядок соединения атомов в молекуле и валентность каждого элемента.
Графические формулы веществ, состоящих из молекул, иногда, в той или иной степени, отражают и строение (структуру) этих молекул, в этих случаях их можно назвать структурными.
Для составления графической (структурной) формулы вещества необходимо:
- Определить валентность всех химических элементов, образующих вещество.
- Записать знаки всех химических элементов, образующих вещество, каждый в количестве, равном числу атомов данного элемента в молекуле.
- Соединить знаки химических элементов черточками. Каждая черточка обозначает электронную пару, осуществляющую связь между химическими элементами и поэтому одинаково принадлежит обоим элементам.
- Число черточек, окружающих знак химического элемента, должно соответствовать валентности этого химического элемента.
- При составлении формул кислородсодержащих кислот и их солей атомы водорода и атомы металлов связываются с кислотообразующим элементом через атом кислорода.
- Атомы кислорода соединяют друг с другом только при составлении формул пероксидов.
Примеры графических формул: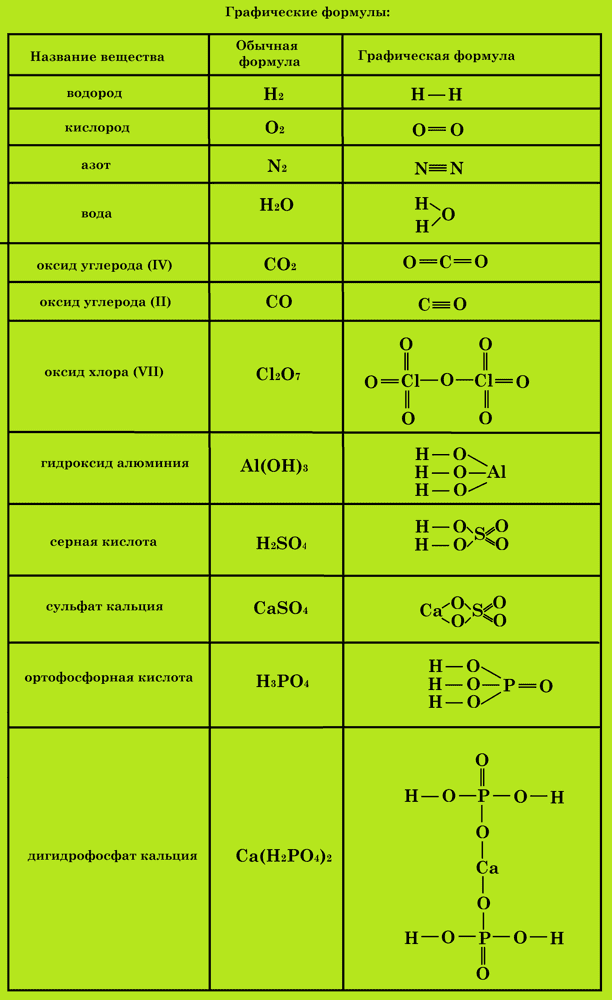
Метельский А.В. Источник: Метельский А.В., Химия в Экзаменационных вопросах и ответах, Минск, изд. «Беларуская энцыклапедыя», 1999 год Дата в источнике: 1999 год
Урок№3 Составление формул простых веществ
Написать автору
Как используя таблицу Менделеева,составлять формулы простых веществ.
Как всем известно, химия это наука о веществах, их составе, строении, свойствах и превращении. Вещества бывают простые и сложные. Простые вещества состоят из одного вида атомов и делятся на металлы и неметаллы.
Посмотри на таблицу Менделеева, возьми карандаш и линейку и начерти диагональ от бора (B) до астата (At). На правом верхнем углу окажется небольшое количество неметаллов (только элементы главных подгрупп).Перечислю их: B C N O F Ne Si P S Cl As Ar Ar Se Br Kr I Xe At Rn и еще H и He.
Кроме перечисленных элементов все остальные в таблице Менделеева составляют металлы. Есть , конечно, еще амфотерные элементы, но об этом в другом месте.Ты видишь. что таблица постоянно пополняется, благодаря усилиям физиков. Но какой бы элемент они не синтезировали, заранее можно сказать, что это будет металл.
Формулы металлов пишутся очень просто. Смотришь на таблицу Менделеева и переписываешь его знак ( если не знаешь по памяти ) Например: Fe AL Zn Mg Ni Cr Ag Au и т.д.
Инертные газы атомарны. Смотрим на 8-ую группу и просто переписываем его знак: He Ne Ar Kr Xe Rn
Простые твердые неметаллы имеют не совсем простой состав ( например S8 S6 S4 ), но принято их формулы писать как атомарные: B C Si P S As Se. Исключением является галоген иод, формула которого I2. Не путайте со спиртовым раствором иода. Иод представляет собой кристаллы темно-фиолетового цвета.
Формулы простых бинарных газов пишутся: H2 N2 O2 F2 Cl2 Br2. Правда здесь затесалась летучая жидкость вром. Во всей таблице Менделеева есть только две жидкости — это Br2 и Hg. А об астате ничего не скажу.
Ученый кот: — Астат был получен американскими физиками Д. Карсоном и К. Мак-Кензи. На Земле запасы астата составлют примерно одну чайную ложку.
— Совершенно верно, поэтому его свойства мало изучены. Ученый кот: Я впечатлен! Оказывается так просто составлять формулы веществ.
Не обольщайся, котик, это были простые вещества, а впереди составление формул сложных веществ. Для этого ты должен усвоть предыдущий урок. Пока, до связи!
Источник: нет






