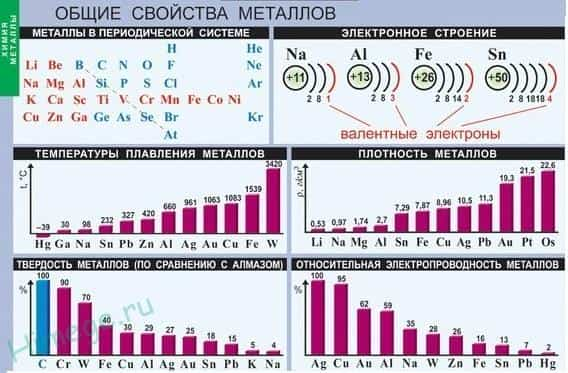
- Общие физические свойства металлов
- Общие химические свойства металлов
- I. Реакции металлов с неметаллами
- II. Реакции металлов с кислотами
- III. Взаимодействие металлов с водой
- IV. Вытеснение более активными металлами менее активных металлов из растворов их солей:
- Коррозия металлов
- Общие способы получения металлов в промышленности:
- Большая Рнциклопедия Нефти Рё Газа
- Строение металлов
- Строение металлов и сплавов. Основы теории термообработки
- Дефекты кристаллической решетки
- Сплавы металлов — структура
- Строение металлов и сплавов, их кристаллизация
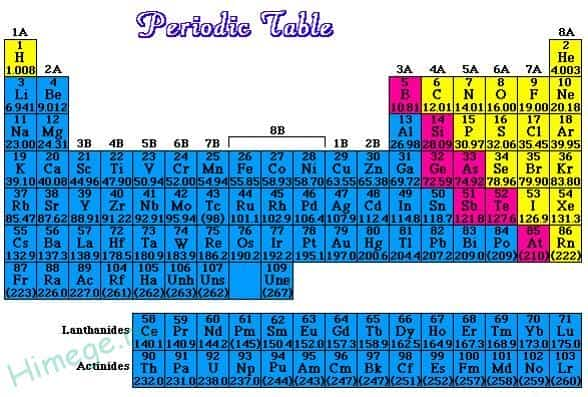 Если в периодической таблице элементов Д.И.Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп, выделены синим цветом), а справа вверху – элементы-неметаллы (выделены желтым цветом). Элементы, расположенные вблизи диагонали – полуметаллы или металлоиды (B, Si, Ge, Sb и др.), обладают двойственным характером (выделены розовым цветом).
Если в периодической таблице элементов Д.И.Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп, выделены синим цветом), а справа вверху – элементы-неметаллы (выделены желтым цветом). Элементы, расположенные вблизи диагонали – полуметаллы или металлоиды (B, Si, Ge, Sb и др.), обладают двойственным характером (выделены розовым цветом).
Как видно из рисунка, подавляющее большинство элементов являются металлами.
По своей химической природе металлы – это химические элементы, атомы которых отдают электроны с внешнего или предвнешнего энергетического уровней, образуя при этом положительно заряженные ионы.
Практически все металлы имеют сравнительно большие радиусы и малое число электронов (от 1 до 3) на внешнем энергетическом уровне. Для металлов характерны низкие значения электроотрицательности и восстановительные свойства.
Наиболее типичные металлы расположены в начале периодов (начиная со второго), далее слева направо металлические свойства ослабевают. В группе сверху вниз металлические свойства усиливаются, т.
к увеличивается радиус атомов (за счет увеличения числа энергетических уровней).
Это приводит к уменьшению электроотрицательности (способности притягивать электроны) элементов и усилению восстановительных свойств (способность отдавать электроны другим атомам в химических реакциях).
Типичными металлами являются s-элементы (элементы ИА-группы от Li до Fr. элементы ПА-группы от Мг до Ра). Общая электронная формула их атомов ns 1-2 . Для них характерны степени окисления + I и +II соответственно.
Небольшое число электронов (1-2) на внешнем энергетическом уровне атомов типичных металлов предполагает легкую потерю этих электронов и проявление сильных восстановительных свойств, что отражают низкие значения электроотрицательности. Отсюда вытекает ограниченность химических свойств и способов получения типичных металлов.
Характерной особенностью типичных металлов является стремление их атомов образовывать катионы и ионные химические связи с атомами неметаллов.
Соединения типичных металлов с неметаллами — это ионные кристаллы «катион металлаанион неметалла», например К + Вг — , Сa 2+ О 2-.
Катионы типичных металлов входят также в состав соединений со сложными анионами — гидроксидов и солей, например Мg 2+ (OН — ) 2 , (Li + )2СO 3 2-.
Металлы А-групп, образующие диагональ амфотерности в Периодической системе Ве-Аи-Ге-Сб-Ро, а также примыкающие к ним металлы (Га, In, Ти, Sn, Рб, Ви) не проявляют типично металлических свойств.
Общая электронная формула их атомов ns 2 np 0-4 предполагает большее разнообразие степеней окисления, большую способность удерживать собственные электроны, постепенное понижение их восстановительной способности и появление окислительной способности, особенно в высоких степенях окисления (характерные примеры — соединения Тl III , Рb IV , Вi v ). Подобное химическое поведение характерно и для большинства (d-элементов, т. е. элементов Б-групп Периодической системы (типичные примеры — амфотерные элементы Сr и Zn).
Это проявление двойственности (амфотерности) свойств, одновременно металлических (основных) и неметаллических, обусловлено характером химической связи. В твердом состоянии соединения нетипичных металлов с неметаллами содержат преимущественно ковалентные связи (но менее прочные, чем связи между неметаллами).
В растворе эти связи легко разрываются, а соединения диссоциируют на ионы (полностью или частично).
Например, металл галлий состоит из молекул Ga 2 , в твердом состоянии хлориды алюминия и ртути (II) АиСи 3 и НgСl 2 содержат сильно ковалентные связи, но в растворе АиСи 3 диссоциирует почти полностью, а НгСи 2 — в очень малой степени (да и то на ионы НгСи + и Сl — ).
Общие физические свойства металлов
Благодаря наличию свободных электронов («электронного газа») в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность — способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность . Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение «электронного газа».
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность — у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий — литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются «легкими металлами».
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
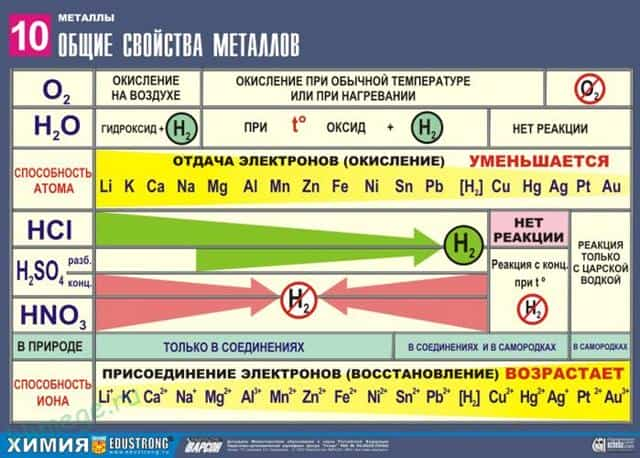
Общие химические свойства металлов
Сильные восстановители: Me 0 – nē → Me n +
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.

I. Реакции металлов с неметаллами
- 1) С кислородом: 2Mg + O 2 → 2MgO
- 2) С серой: Hg + S → HgS
- 3) С галогенами: Ni + Cl 2 – t° → NiCl 2
- 4) С азотом: 3Ca + N 2 – t° → Ca 3 N 2
- 5) С фосфором: 3Ca + 2P – t° → Ca 3 P 2
- 6) С водородом (реагируют только щелочные и щелочноземельные металлы): 2Li + H 2 → 2LiH
- Ca + H 2 → CaH 2
II. Реакции металлов с кислотами
- 1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
- Mg + 2HCl → MgCl 2 + H 2
- 2Al+ 6HCl → 2AlCl 3 + 3H 2
- 6Na + 2H 3 PO 4 → 2Na 3 PO 4 + 3H 2
- 2) С кислотами-окислителями:
- При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
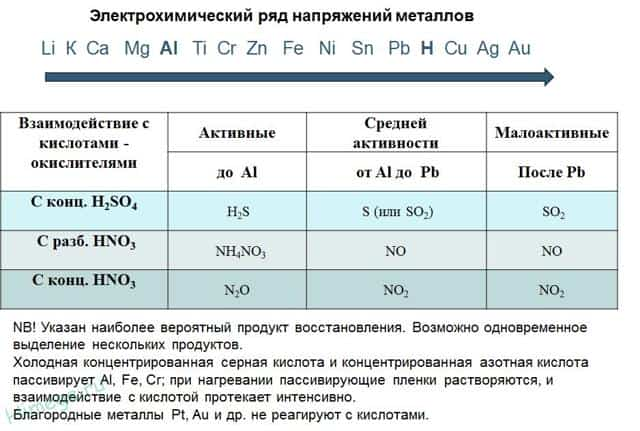
- Zn + 2H 2 SO 4(К) → ZnSO 4 + SO 2 + 2H 2 O
- 4Zn + 5H 2 SO 4(К) → 4ZnSO 4 + H 2 S + 4H 2 O
- 3Zn + 4H 2 SO 4(К) → 3ZnSO 4 + S + 4H 2 O
- 2H 2 SO 4(к) + Сu → Сu SO 4 + SO 2 + 2H 2 O
- 10HNO 3 + 4Mg → 4Mg(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O
- 4HNO 3 (к ) + Сu → Сu (NO 3 ) 2 + 2NO 2 + 2H 2 O
III. Взаимодействие металлов с водой
- 1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
- 2Na + 2H 2 O → 2NaOH + H 2
- Ca+ 2H 2 O → Ca(OH) 2 + H 2
- 2) Металлы средней активности окисляются водой при нагревании до оксида:
- Zn + H 2 O – t° → ZnO + H 2
- 3) Неактивные (Au, Ag, Pt) — не реагируют.
IV. Вытеснение более активными металлами менее активных металлов из растворов их солей:
- Cu + HgCl 2 → Hg+ CuCl 2
- Fe+ CuSO 4 → Cu+ FeSO 4
-
В промышленности часто используют не чистые металлы, а их смеси — сплавы , в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком ( латунь ) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем — дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) — это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой , в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание.
Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается.
Рыхлая оксидная пленка (ржавчина ), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией .
Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Ви, Со, Фе, Мг и Nb, а в концентрированной азотной кислоте — металлы А1, Ве, Ви, Со, Сг, Фе, Nb, Ni, РЬ, Тх и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (На + , Са 2+ ,А1 3+ ,Fе 2+ и Fе 3+ )
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg — только серной (концентрированной) и азотной кислотами, а Рt и Аи — «царской водкой».
Коррозия металлов
Нежелательным химическим свойством металлов является их коррозия , т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СО 2 и SО 2 ; создается кислотная среда, и катионы Н + вытесняются активными металлами в виде водорода Н 2 ( водородная коррозия ).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов ( контактная коррозия).
Между одним металлом, например Фе, и другим металлом, например Sn или Су, помещенными в воду, возникает гальваническая пара.
Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Ре), к менее активному металлу (Sn, Су), и более активный металл разрушается (корродирует).
Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении ; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром ( нержавеющая сталь ), имеют высокую коррозионную стойкость.
Общие способы получения металлов в промышленности:
• электрометаллургия , т. е. получение металлов электролизом расплавов (для наиболее активных металлов) или растворов солей;
• пирометаллургия , т. е. восстановление металлов из руд при высокой температуре (например, получение железа в доменном процессе);
• гидрометаллургия , т. е. выделение металлов из растворов их солей более активными металлами (например, получение меди из раствора СuSO 4 действием цинка, железа или алюминия).
В природе иногда встречаются самородные металлы (характерные примеры — Аg, Аu, Рt, Нg), но чаще металлы находятся в виде соединений ( металлические руды ). По распространенности в земной коре металлы различны: от наиболее распространенных — Аи, На, Са, Фе, Мг, К, Ти) до самых редких — Ви, In, Аг, Ау, Рт, Ре.
Большая Рнциклопедия Нефти Рё Газа
Cтраница 1
Твердое состояние металла характеризуется тем, что составляющие его атомы ( РёРѕРЅС‹) расположены РЅР° определенном расстоянии РѕРґРёРЅ РѕС‚ РґСЂСѓРіРѕРіРѕ Рё образуют кристаллическую решетку. Между атомами, расположенными РІ узлах решетки, существуют силы взаимодействия, которые удерживают атомы РЅР° определенном расстоянии. РџСЂРё нагревании металла СЃРІСЏР·Рё между атомами ослабевают, Р° РїСЂРё значительном нагреве эти СЃРІСЏР·Рё РјРѕРіСѓС‚ настолько нарушиться, что металл РёР· твердого состояния перейдет РІ жидкое — расплавится. [1]
Твердое состояние металла характеризуется тем, что составляющие его атомы ( РёРѕРЅС‹) расположены РЅР° определенном расстоянии РѕРґРёРЅ РѕС‚ РґСЂСѓРіРѕРіРѕ Рё образуют кристаллическую решетку. Между атомами, расположенными РІ узлах решетки, существуют силы взаимодействия, которые удерживают атомы РЅР° определенном расстоянии. РџСЂРё нагревании металла СЃРІСЏР·Рё между атомами ослабевают, Р° РїСЂРё значительном нагреве эти СЃРІСЏР·Рё РјРѕРіСѓС‚ настолько разрушиться, что металл РёР· твердого состояния перейдет РІ жидкое — расплавится. [2]
Твердое состояние металла характеризуется тем, что составляющие его атомы ( РёРѕРЅС‹) расположены РЅР° определенном расстоянии РѕРґРёРЅ РѕС‚ РґСЂСѓРіРѕРіРѕ Рё образуют кристаллическую решетку. Между атомами, расположенными РІ узлах решетки, существуют силы взаимодействия, которые удерживают атомы РЅР° определенном расстоянии. РџСЂРё нагревании металла СЃРІСЏР·Рё между атомами ослабевают, Р° РїСЂРё значительном нагреве эти СЃРІСЏР·Рё РјРѕРіСѓС‚ настолько нарушиться, что металл РёР· твердого состояния перейдет РІ жидкое — расплавится. [3]
Переход из твердого состояния металлов в жидкое расшатывает эту связь и нарушает упорядоченное расположение атомов в пространстве.
Переход же металлов в газообразное состояние разрушает металлическую связь и приводит к образованию свободных атомов.
Следовательно, переход металлов из твердого состояния в газообразное приводит к образованию частиц с качественно новым видом химической связи.
Поэтому металлическая связь характерна только для твердого и жидкого состояний металлов. [4]
Передвижение водорода в твердом состоянии металла происходит под действием градиента концентраций, полей упругих напряжений и электрического тока. Растягивающие напряжения увеличивают, а сжимающие уменьшают диффузию водорода в стали. [6]
В чем состоит природа твердого состояния металлов и их прочности. [8]
Диффузионная сварка осуществляется в твердом состоянии металла при повышенных температурах с приложением сдавливающего усилия к месту сварки.
Процесс сварки металла в твердом состоянии при повышенных температурах принципиально протекает так же, как и при холодной сварке.
В начальной стадии процесса на линии раздела двух деталей создаются условия-для образования металлических связей.
�з теории образования сварного соединения при холодной сварке изместно, что для возникновения на линии раздела металлических связей необходимо обеспечить тесный контакт свариваемых поверхностей и создать условия для удаления поверхностных пленок окислов, жидкостей, газов и различного рода загрязнений. [9]
- Диффузионная сварка осуществляется в твердом состоянии металла при повышенных температурах, с приложением сдавливающего усилия к месту сварки. [10]
- Однако в реальных условиях ( твердое состояние металла и продукта его окисления, молекулярное состояние окислителя) реакция осложняется процессами сублимации металла, диссоциации молекул окислителя и кристаллизации продукта окисления. [11]
- Направление научных исследований: катализ; хемосорбция Рё физическая С…РёРјРёСЏ твердого состояния металлов, окислов металлов, полимеров Рё СЌРЅР·РёРјРѕРІ; ионизация кислот Рё оснований; Р�Рљ — Рё РЈР¤-спектроскопия; рентгеноструктурный анализ; применение органических полупроводников РІ биологии; коллоидная С…РёРјРёСЏ неводных Рё водных систем; радиационная С…РёРјРёСЏ; фотохимия. [12]
Р’ момент сварки металл РІ сварочной Р·РѕРЅРµ может быть твердым или жидким — Твердое состояние металла, хотя Р±С‹ Рё размягченного нагревом, требует приложения осадочного давления, создающего достаточную пластическую деформацию, необходимую для осуществления процесса сварки. Полное расплавление СЃ переводом металла РІ жидкое состояние позволяет получить сварное соединение без приложения осадочного давления Р·Р° счет спонтанного слияния объемов жидкого металла. [13]
В производстве многих приборов, в особенности крупногабаритных, широко используется пайка, представляющая собой процесс неразъемного соединения находящихся в твердом состоянии металлов и сплавов с помощью расплавленного припоя, имеющего температуру плавления, меньшую по сравнению с температурой плавления соединяемых металлов. [14]
Страницы: 1 2
Строение металлов
Как известно, все вещества, в том числе и металлы, состоят из атомов. Каждый металл (химический элемент) может находиться в газообразном, жидком или твердом агрегатных состояниях. Каждое агрегатное состояние будет иметь свои особенности, отличные от других.
В газообразном металле расстояние между атомами велико, силы взаимодействия малы, и атомы хаотично перемещаются в пространстве; газ стремится к расширению в сторону большего объема. При понижении температуры и давления вещество переходит в жидкое состояние.
Свойства жидкого вещества резко отличаются от свойств газообразного. В жидком металле атомы сохраняют лишь так называемый ближний порядок атомов, т.е. в объеме расположено наибольшее количество атомов, а не атомы всего объема.
При понижении температуры жидкий металл переходит в твердое состояние, которое имеет строгую закономерность расположения атомов.
Стремление атомов (ионов) металла расположиться возможно ближе друг к другу, плотнее (поэтому металлы и обладают более высокой плотностью, чем неметаллы) приводит к тому, что число встречающихся комбинаций взаимного расположения атомов металла в кристаллах невелико. При описании правильной внутренней структуры кристаллов обычно пользуются понятием «кристаллическая решетка».
Кристаллическая решетка представляет собой пространственную сетку, в узлах которой располагаются частицы (атомы, ионы или молекулы), образующие кристалл.
Если условно провести вертикальные и горизонтальные линии связей через центры атомов, можно увидеть, что у металлов в твердом состоянии атомы расположены в строго определенном порядке и представляют собой множество раз повторяющихся элементарных геометрических фигур — параллелепипедов (рис. 1.2).
Наименьшую геометрическую фигуру называют элементарной ячейкой. Размещение элементарных ячеек по горизонтальным и вертикальным кристаллографическим плоскостям (рис. 1.3) образует пространственную кристаллическую решетку.
Элементарные кристаллические решетки характеризуются следующими основными параметрами: расстоянием между атомами по осям координат (по линиям связи), углами между линиями связи, координационным числом — числом атомов, находящихся на наиболее близком и равном расстоянии от любого атома в решетке.
Форму элементарной ячейки рассматривают по кристаллографическим плоскостям в трех измерениях.
Типы кристаллических ячеек у разных металлов различны, поэтому неодинаков и порядок расположения атомов в решетке.
Рис. 1.2. Схема расположения элементарных геометрических ячеек в атомных решетках металлов и сплавов
Рис. 1.3. Расположение кристаллографических плоскостей:
1 и 2 — соответственно горизонтальная и вертикальная кристаллографические плоскости
Большинство металлов образуют кристаллические решетки, элементарными ячейками которых являются: объемно-центрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГПУ).
Простая кубическая ячейка (рис. 1.4, а) характерна для неметаллов, которые обладают наибольшими плотностью и удельным весом, и имеет восемь атомов, которые расположены в каждой вершине куба.
Объемно-центрированная кубическая ячейка (рис. 1.4, б) состоит из восьми атомов, расположеных по одному в каждой вершине куба, и еще одного — находящегося в центре куба на равных расстояниях от его граней. Эту форму атомной кристаллической ячейки имеют железо модификации Бе-а, ванадий, вольфрам, молибден, тантал и хром, т.е. в основном черные металлы.
Гранецентрированная кубическая ячейка (рис. 1.4, в) имеет 14 атомов — по одному атому в каждой вершине куба (восемь атомов) и по одному атому в центре каждой грани (шесть атомов). Гранецент-рированную кубическую ячейку имеют алюминий, железо модификации Бе-у, золото, кобальт, медь, никель, пла-
Рис. 1.4. Геометрические формы элементарных кристаллических ячеек: а — куб; б — объемно-центрированный куб; в — гранецентрированный куб; г — гексагональная плотноупакованная ячейка; д — гексагональная простая
ячейка
тина и серебро, в основном это цветные металлы и часть черных металлов.
Гексагональная плотноупакованная ячейка (рис. 1.4, г) состоит из 17 атомов. Формой геометрического тела, которую образуют эти атомы, является шестигранная призма.
При этом по шесть атомов расположены в каждой вершине верхнего и нижнего оснований, по одному атому в центре этих оснований и три атома в центре одной их трех граней (через грань).
Гексагональную плотноупакованную ячейку имеют бериллий, кадмий, магний, ванадий, тантал.
Простая гексагональная ячейка (рис. 1.4, д) состоит из 12 атомов, которые расположены в вершинах верхнего и нижнего оснований шестигранной призмы. Такую кристаллическую ячейку имеют ртуть и цинк.
Связь между атомами в кристаллической решетке и между решетками осуществляется за счет так называемой металлической связи. От прочности этой связи зависят прочность и твердость металлов. Чем выше эта связь, тем большую прочность и твердость имеют металлы. Механизм связи между атомами в решетке и между решетками имеет сложную физико-химическую природу.
В практике идеальное расположение кристаллических решеток обычно не наблюдается. Кристаллы, образуемые кристаллическими решетками, имеют искаженную геометрическую форму и различную величину.
Строение металлов и сплавов. Основы теории термообработки
В твердом состоянии любой металл обладает кристаллическим строением. Для этого вида строения характерна упорядоченность расположения ионов (атомов). Элементарные ячейки периодически повторяются в пространстве, образуя кристаллическую решетку. Внутри кристаллической решетки располагаются положительно заряженные ионы, или как их называют по-другому – атомные ядра.
Вокруг атомных ядер в постоянном движении находятся отрицательно заряженные частицы – электроны. Количество электронов, находящихся между ионами и определяет уровень теплопроводности металла. Ионы (атомы) внутри кристаллической решетки находятся в непрерывном тепловом колебании.
Если температура повышается, то амплитуда колебаний атомов резко возрастает, если температура понижается, то амплитуда замедляется. Плавка металла разрушает кристаллическую решетку, выпуская ионы в беспорядочное движение в пространстве. Элементарная ячейка – это главный элемент кристаллической решетки. Увидеть ее вы можете на изображении 1. Изображена решетка в виде куба.
Однако можно заметить, что каждый атом этой решетки одновременно принадлежит восьми соседним элементарным ячейкам.
На изображении 2 вы можете увидеть наиболее распространенные типы кристаллических решеток. а) Объемно-центрированная решетка. Как видно из рисунка восемь атомов данного типа решетки располагается в углах куба, а один находится в центре. Данная кристаллическая решетка свойственна следующим металлами – натрий, литий, свинец, вольфрам и т.п.
б) Гранецентрированная решетка. Внимательно рассмотрев ее изображение, вы заметите, что восемь атомов данного типа решетки расположено в уголках куба, а в центре каждой из шести граней размещается еще по одному атому. Свойственна гранецентрированная кубическая решетка следующим металлам: медь, серебро, алюминий, золото и т.п.
в) Гексагональная решетка имеет расположение атомов в углах и центре основания призмы. При этом три атома располагаются в средней плоскости призмы. Характерен данный вид кристаллической решетки следующим металлам: титан, магний, цинк, бериллий и другие металлы.
Ножницы по металлу: характеристики, типы, виды
Индукционный нагрев способен проникать в кристаллические решетки металла, равномерно распределяя тепло и не нарушая их структуру. Автоматизированное программное обеспечение, которым снабжена каждая установка ЭЛСИТ позволяет проконтролировать процесс обработки, чтобы та не нарушила структуру кристаллической решетки.
Дефекты кристаллической решетки
Ничто в нашем мире не идеально. Кристаллы металлов не обладают идеально правильным расположением атомов внутри кристаллической решетки. Практически всегда внутри кристаллов встречаются различные несовершенства (дефекты строения).
В некоторой степени дефекты кристаллической решетки определяют физические и механические свойства металлов. Дефекты строения кристаллической решетки можно подразделить на три вида: точечные, поверхностные и линейные. Среди точечных дефектов наиболее распространенными являются – вакансии. На изображении 3 вы можете заметить вакансии.
Вакансии представляет собой дефект кристалла с отсутствующим внутри кристаллической решетки атомом.
Еще одним точечным дефектом является дислоцированный атом. Дислоцированный атом – это дефект кристаллической решетки, при котором один из атомов выходит из равновесия. Вы можете наблюдать данный дефект на изображении 4.
Ни вакансии, ни дислоцированный атом не остаются без движения. Их непрерывное перемещение внутри кристаллической решетки называется диффундированием. Так как энергия между атомами распределяется неравномерно, вакансия может передвигаться внутри атома до тех пор, пока не выйдет из него на поверхность кристалла.
Дислоцированные атомы и вакансии искажают кристаллическую решетку, по этой причине свойства кристалла могут меняться. При проведении термообработки важно учитывать все эти факторы. Индукционный нагрев в некоторых случаях может помочь избавиться от дефекта кристаллической решетки, равномерно распределив тепло по всей поверхности кристалла.
Наиболее распространенными линейным дефектом кристаллической решетки является дислокация. Дислокация – это нарушение правильного кристаллического строения металла. На изображении пять вы можете разглядеть дислокацию атомов. а) Дислокация расположена на левом краю кристалла. б) Центральное расположение дислокации.
в) Дислокация расположена на правом краю кристалла.
Поверхностные дефекты появляются на границе зерен или субзерен, если атомы обладают не таким правильным расположением, как внутри зерна. Как правило, по границам зерен скапливаются дислокации и вакансии. На изображении 6 вы можете разглядеть поверхностные дефекты кристаллической решетки, разделяющие зерно на блоки.
Сплавы металлов — структура
На сегодняшний день производители все чаще стали использовать при создании металлических изделий не чистые металлы, а сплавы. Сплавы металла – это вещества, которые образовались в результате затвердения расплава, состоящего из нескольких компонентов.
Компонентами формирования сплавов служат только металлы или металлы с небольшим количеством примесей. Металлические сплавы подразделяются на двойные, тройные и т.п.
(по количеству входящих в них компонентов), а также на черные и цветные металлы (в зависимости от того, какой металл лежит в основе сплава). Если строение металлов понять проще, то строение сплавов существенно отличается.
Строение металлического сплава довольно сложное. Существует несколько видов сплавов, в зависимости от характера взаимодействия его компонентов друг с другом.
- Химическое соединение – сплавы металлов, элементы которого могут вступать друг с другом в химическое взаимодействие, тем самым создавая новую кристаллическую решетку. Образовавшееся химическое соединение обладает уже совсем другими свойствами, чем компоненты, вошедшие в его состав.
- Механическая смесь – сплавы металла, компоненты которого не растворяются, находясь в твердом состоянии, а также не вступают друг с другом в химическое соединение. Как правило, механическая смесь не изменяет кристаллические решетки металлов, входящих в сплав.
- Твердый раствор – сплав, образовавшийся во время охлаждения жидкого раствора сплава, компоненты которого сохранили растворимость, а при кристаллизации смогли образовать единую кристаллическую решетку.
Твердые растворы также подразделяются на два главных типа: внедрения и замещения. Если посмотреть на изображение 7, то вы отметите на первой картинке, как атомы растворимого компонента начали замещать атомы растворителя.
При этом никогда не ясно, в каком соотношении атомы заменят друг друга. Однако важно отметить, что необходимо соблюдение двух главных условий, чтобы началась замена атомов. Первое – оба компонента должны иметь схожие кристаллические решетки.
Второе – размеры атомов входящих в состав сплава компонентов должны различаться лишь незначительно (не более 8%).
Атомы, входящие в состав твердых растворов внедрения, значительно отличаются друг от друга по размерам. Справа на изображении 7 вы можете заметить, как атомы одного компонента внедряются в пустоты кристаллической решетки другого. Во время формирования твердого раствора кристаллическая решетка искажается, а ее параметры меняются.
В большинстве случаев атомы распределяются беспорядочно, однако бывают случаи, когда она размещаются внутри кристаллической решетки упорядоченно (при медленном охлаждении расплава меди и золота). Твердые растворы с равномерно распределенными атомами внутри кристаллической решетки называются сверхструктурными.
Индукционный нагрев одинаково хорошо справляется и с чистыми металлами и с их сплавами.
Строение металлов и сплавов, их кристаллизация
Внутренним строением металлов
называется строение и взаимное расположение их атомов, а также более крупная структура, видимая в микроскоп или невооруженным глазом.
Металлы по внутреннему строению представляют собой совокупность нейтральных атомов, положительно или отрицательно заряженных ионов и свободных электронов, образующих так называемый «электронный газ».
Наличие «электронного газа» обусловливает высокую электро- и теплопроводность металлов, а взаимосвязь свободных электронов между собой и с ионами создает прочную связь, называемую металлической.
Специфика металлической связи делает металлы пластичными (ковкими).
Кроме природы атомов на свойства металлов влияют характер связи между атомами, расстояние между ними и порядок их расположения.
Все металлы в твердом состоянии имеют кристаллическое строение, т.е. их атомы (ионы) расположены в строгом, периодически повторяющемся порядке, образуя в пространстве атомно-кристаллическую решетку (в противоположность аморфным твердым телам, атомы которых расположены в пространстве хаотично).
Порядок расположения атомов у различных металлов неодинаков. Обычно он определяется простыми характерными для большинства металлов (рис. 6) или сложными кристаллическими решетками. Линии на рис.
6 условные Атомы в действительности колеблются возле положений равновесия, т. е. в узлах кристаллической решетки. Расстояние между атомами в кристаллической решетке измеряется в ангстремах (1 Å=10-9нм).
У большинства металлов расстояние между атомами находится в пределах 0,28—0,8 нм.
Рис 6. Порядок расположения атомов в простых решеткаха — объемная центрированной кубической (9 атомов), б — гранецентрированной кубической (14 атомов), в — гексагональной плотноупакованной (17 атомов)
Наименьший объем кристалла, дающий представление об атомной структуре металла во всем объеме, называется элементарной кристаллической ячейкой.
Получаемые обычным способом металлы представляют собой поликристаллические тела, состоящие из множества элементарных ячеек, ориентированных относительно друг друга самым различным образом.
Ячейки имеют неправильную форму и называются кристаллитами, или зернами.
Если сочетание элементарных ячеек правильное, по расположению атомов повторяющее элементарную ячейку, то образовавшееся тело называется монокристаллом.
Металлические сплавы, как и металлы, имеют кристаллическое строение. При этом в зависимости от взаимодействия компонентов они подразделяются на твердые растворы, химические соединения и механические смеси.
Твердые растворы образуются тогда, когда при сплавлении атомы одного элемента в разных количествах входят в кристаллическую решетку другого элемента, не изменяя в значительной мере ее формы.
Элемент, сохранивший форму своей решетки, называется растворителем, а элемент, атомы которого вошли в эту решетку,— растворенным.
По размещению атомов растворенного элемента в решетке растворителя различают твердые растворы замещения
(атомы растворенного элемента располагаются в узлах решетки растворителя) итвердые растворы внедрения (атомы растворенного элемента находятся между атомами растворителя и узлами его решетки).
Если входящие в состав твердого раствора замещения компоненты имеют близкое строение решеток и атомов, то такие элементы могут образовывать непрерывный ряд твердых растворов, т. е. количество замещенных атомов может изменяться от 0 до 100 %.
При этом считается, что растворителем является тот элемент, содержание которого в сплаве более 50 %.
Растворы внедрения образуются элементами, сильно отличающимися строением решетки и размерами атомов.
Твердые растворы являются гомогенными (однородными) сплавами, так как их структура представляет собой одинаковые по составу и свойствам зерна. Свойства твердых растворов в значительной степени могут отличаться от свойств входящих в него компонентов. Все металлы в той или иной степени могут растворяться один в другом, образуя твердые растворы.
Химические соединенияобразуются при химическом взаимодействии атомов компонентов сплава, сопровождающемся значительным тепловым эффектом. При этом кристаллическая решетка химического соединения и все его свойства могут резко отличаться от решетки и свойств компонентов.
В отличие от твердых растворов химические соединения обычно образуются между компонентами, имеющими большое различие в электронном строении атомов. Типичными примерами химических соединений являются соединения магния с оловом, свинцом, сурьмой, висмутом, серой, селеном, теллуром и др.
По своей структуре они гомогенны.
Химические соединения металлов называются интерметаллическими
(интерметаллидами), а соединения металлов с неметаллами (нитридами, гидридами, боридами, карбидами), обладающие металлической связью, —металлическими соединениями.
Механические смесиобразуются тогда, когда при затвердении расплава атомы его компонентов не перемешиваются, а кристаллизуются в характерную каждому решетку.
Структура таких сплавов гетерогенна (неоднородна) и представляет собой смесь кристаллов компонентов сплава, сохранивших свою структуру.
Рис. 7. Кривые охлаждения аморфного (а
), кристаллического тела(б)и металлов(в),гдеtк tп — температура кристаллизации и переохлаждения, °C; (T1-T2) — время кристаллизации, с.
Строение кристаллического тела обусловливает следующие особенные их свойства по сравнению с аморфными:
§ различие свойств монокристаллов в различных направлениях, т. е. анизотропность, или векториальность, свойств;
§ наличие плоскостей скольжения, приложение внешних сил приводит к скольжению (сдвигу) одной плоскости относительно другой;
§ существование критической температуры при затвердевании или плавлении, при которой происходит переход из жидкого (расплавленного) состояния в твердое или наоборот.
Переход металла из жидкого состояния в твердое называется кристаллизацией, а из твердого в жидкое — плавлением. Если образование кристаллов происходит из жидкости при ее охлаждении, то этот процесс называется первичной кристаллизацией, если образование кристаллов идет в твердом состоянии тела, — вторичной кристаллизацией.
Процессы кристаллизации графически изображают кривыми, строящимися в координатах температура — время (рис. 7).
- Явление переохлаждения в кристаллизующемся металле объясняется тем, что в период затвердевания происходит резкое снижение подвижности атомов, вследствие чего скачкообразно изменяется его внутренняя энергия. Это сопровождается выделением тепла, которое подогревает жидкую ванну и некоторое время (T1
- —Т2) удерживает ее температуру постоянной, пока жидкость полностью не закристаллизуется.
- Степень переохлаждения тем больше, чем больше скорость охлаждения.
Русский ученый-металлург Д. К. Чернов в 1878 г. установил, что процесс кристаллизации состоит из нескольких стадий. Первая стадия — образование зародышей (центров) кристаллизации.
На последующих стадиях из этих центров образуются дендриты (древовидные образования), которые, срастаясь, образуют зерна (кристаллиты).
При этом они не имеют правильной геометрической формы, так как в местах соприкосновения растущих кристаллов рост граней прекращается.
Величина зерна металла — важнейшая характеристика, которая определяет все основные его свойства. Мелкозернистый металл имеет более высокие характеристики твердости, прочности, ударной вязкости, но у него пониженная электропроводность, хуже магнитные свойства.
Размер зерна зависит от количества центров кристаллизации и скорости роста кристаллов (скорости охлаждения). Чем больше центров кристаллизации и меньше скорость их роста, тем меньше будет зерно.
- Образование центров кристаллизации может происходить самопроизвольно или на имеющихся в жидком металле частицах примесей, что используется при модифицировании
- — введении в жидкий металл примесей (модификаторов).
- На образование центров кристаллизации, а следовательно, и величину зерна влияет степень переохлаждения tк—tп
(см. рис. 7). Чем больше степень переохлаждения, тем больше центров кристаллизации и мельче образующееся зерно.