- Получение оснований
- Свойства оснований
- Гидроксид железа
- Тренажер задания 32 по химии щелочных металлов
- Основания. Что это такое? Свойства, примеры, определение
- Названия оснований
- Тривиальные названия некоторых оснований
- По числу гидроксогрупп
- Физические свойства оснований
- Взаимодействие с кислотными оксидами
- Взаимодействие с кислотами
- Взаимодействие с солями
- Термическое разложение
- Взаимодействие амфотерных гидроксидов со щелочами
- Получение оснований
- Взаимодействие металла с водой
- Взаимодействие оксидов щелочных и щелочноземельных металлов с водой
- Электролиз
- Получение нерастворимых оснований при взаимодействии соли со щелочью
- Вопросы для самопроверки
- Тесты по химии для 9 класса Тема : «Щелочные металлы и их соединения»
- I группа главная подгруппа Периодической системы Менделеева (щелочные металлы)
Нерастворимое основание: гидроксид меди
Основания — называют электролиты, в растворах которых отсутствуют анионы, кроме гидроксид-ионов (анионы — это ионы, которые имеют отрицательный заряд, в данном случае — это ионы OH — ). Названия оснований состоят из трёх частей: слова гидроксид, к которому добавляют название металла (в родительном падеже). Например, гидроксид меди (Cu(OH)2). Для некоторых оснований могут используются старые названия, например гидроксид натрия (NaOH) — натриевая щелочь.
Едкий натр, гидроксид натрия, натриевая щелочь, каустическая сода — всё это одно и тоже вещество, химическая формула которого NaOH.
Безводный гидроксид натрия — это белое кристаллическое вещество. Раствор — прозрачная жидкость, на вид ничем не отличимая от воды.
При использовании будьте осторожны! Едкий натр сильно обжигает кожу!
В основу классификации оснований положена их способность растворяться в воде. От растворимости в воде зависят некоторые свойства оснований. Так, основания, растворимые в воде, называют щелочью.
К ним относятся гидроксиды натрия (NaOH), гидроксид калия (KOH), лития (LiOH), иногда к их числу прибавляют и гидроксид кальция (Ca(OH)2)), хотя на самом деле — это малорастворимое вещество белого цвета (гашенная известь).
Получение оснований
Получение оснований и щелочей может производиться различными способами. Для получения щелочи можно использовать химическое взаимодействие металла с водой. Такие реакции протекают с очень большим выделением тепла, вплоть до воспламенения (воспламенение происходит по причине выделения водорода в процессе реакции).
2Na + 2H2O → 2NaOH + H2
Негашенная известь — CaO
CaO + H2O → Ca(OH)2
Но в промышленности эти методы не нашли практического значения, конечно кроме получения гидроксида кальция Ca(OH)2.
Получение гидроксида натрия и гидроксида калия связано с использованием электрического тока.
При электролизе водного раствора хлорида натрия или калия на катоде выделяются водород, а на аноде — хлор, при этом в растворе, где происходит электролиз, накапливается щелочь!
- KCl + 2H2O →2KOH + H2 + Cl2 (эта реакция проходит при пропускании электрического тока через раствор).
- Нерастворимые основания осаждают щелочами из растворов соответствующих солей.
- CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Свойства оснований
Щелочи устойчивы к нагреванию. Гидроксид натрия можно расплавить и расплав довести до кипения, при этом он разлагаться не будет. Щелочи легко вступают в реакцию с кислотами, в результате которого образуется соль и вода. Эта реакция ещё носит название — реакция нейтрализации
- KOH + HCl → KCl + H2O
- Щёлочи взаимодействуют с кислотными оксидами, в результате которой образуется соль и вода.
- 2NaOH + CO2 → Na2CO3 + H2O
- Нерастворимые основания, в отличии от щелочей, термически не стойкие вещества. Некоторые из них, например, гидроксид меди, разлагаются при нагревании,
- Cu(OH)2 + CuO → H2O другие — даже при комнатной температуре (например, гидроксид серебра — AgOH).
- Нерастворимые основания взаимодействуют с кислотами, реакция происходит лишь в том случае, если соль, которая образуется при реакции, растворяется в воде.
- Cu(OH)2 + 2HCl → CuCl2 + 2H2O
Растворение щелочного металла в воде с изменение цвета индикатора на ярко-красный
Щелочные металлы — такие металлы, которые при взаимодействии с водой образуют щелочь. К типичному представителю щелочных металлов относится натрий Na.
Натрий легче воды, поэтому его химическая реакция с водой происходит на её поверхности.
Активно растворяясь в воде, натрий вытесняет из неё водород, при этом образуя натриевую щелочь (или гидроксид натрия) — едкий натр NaOH. Реакция протекает следующим образом:
2Na + 2H2O → 2NaOH + H2
Подобным образом ведут себя все щелочные металлы. Если перед началом реакцией в воду добавить индикатор фенолфталеин, а затем опустить в воду кусочек натрия, то натрий будет скользить по воде, оставляя за собой ярко розовый след образовавшейся щелочи (щелочь окрашивает фенолфталеин в розовый цвет)
Гидроксид железа
Гидроксид железа является основанием. Железо, в зависимости от степени его окисления, образует два разных основания: гидроксид железа, где железо может иметь валентности (II) — Fe(OH)2 и (III) — Fe(OH)3. Как и основания, образованные большинством металлов, оба основания железа не растворимы в воде.
Гидроксид железа 3-х валентного
Гидроксид железа (II) — белое студенистое вещество (осадок в растворе), которое обладает сильными восстановительными свойствами.
К тому же, гидроксид железа (II) очень не стойкий.
Если к раствору гидроксида железа (II) добавить немного щёлочи, то выпадет зелёный осадок, который достаточно быстро темнеет о превращается в бурый осадок железа (III).
Гидроксид железа (III) имеет амфотерные свойства, но кислотные свойства у него выражены значительно слабее. Получить гидроксид железа (III) можно в результате химической реакции обмена между солью железа и щёлочью. Например
Fe2(SO4)3 + 6 NaOH → 3 Na2SO4 +2 Fe(OH)3
Тренажер задания 32 по химии щелочных металлов
Skip to the content
Тренажер задания 31 из ЕГЭ по химии щелочных металлов, задачи на неорганическую химию (мысленный эксперимент) из экзамена ЕГЭ по химии, задания 31 по химии щелочных металлов с текстовыми решениями и ответами.
1) Над поверхностью налитого в колбу раствора едкого натра пропускали электрические разряды, при этом воздух в колбе окрашивался в бурый цвет, который исчезает через некоторое время.
Полученный раствор осторожно выпарили и установили, что твердый остаток представляет собой смесь двух солей. При нагревании этой смеси выделяется газ и остается единственное вещество.
Напишите уравнения описанных реакций.
- N2 + O2 → 2NO
- 2NO + O2 = 2NO2
- 2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
- 2NaNO3 → 2NaNO2 + O2
2) Вещество, выделяющееся на катоде при электролизе расплава хлорида натрия, сожгли в кислороде. Полученный продукт поместили в газометр, наполненный углекислым газом. Образовавшееся вещество добавили в раствор хлорида аммония и раствор нагрели. Напишите уравнения описанных реакций.
- 2NaCl → 2Na + Cl2
- 2Na + O2 = Na2O2
- 2Na2O2 + 2CO2 = 2Na2CO3 + O2
- Na2CO3 + 2NH4Cl = 2NaCl + CO2 + 2NH3 + Н2О
3) Азотную кислоту нейтрализовали пищевой содой, нейтральный раствор осторожно выпарили и остаток прокалили.
Образовавшееся вещество внесли в подкисленный серной кислотой раствор перманганата калия, при этом раствор обесцветился.
Азотсодержащий продукт реакции поместили в раствор едкого натра и добавили цинковую пыль, при этом выделился газ с резким запахом. Напишите уравнения описанных реакций.
- NaHCO3 + HNO3 = NaNO3 + CO2 + H2O
- 2NaNO3 → 2NaNO2 + O2
- 5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O
- NaNO3 + 4Zn + 7NaOH + 6H2O = 4Na2[Zn(OH)4] + NH3↑
4) Вещество, полученное на аноде при электролизе раствора иодида натрия с инертными электродами, внесли в реакцию с калием. Продукт реакции нагрели с концентрированной серной кислотой, и выделившийся газ пропустили через горячий раствор хромата калия. Напишите уравнения описанных реакций.
- 2H2O + 2NaI → H2 + 2NaOH + I2
- 2K + I2 = 2KI
- 8KI + 5H2SO4(конц.) = 4K2SO4 + H2S + 4I2 + 4H2O
- 3H2S + 2K2CrO4 + 2H2O = 2Cr(OH)3↓ + 3S↓ + 4KOH
5) Вещество, полученное на катоде при электролизе расплава хлорида натрия, сожгли в кислороде. Поkученный продукт последовательно обработали сернистым газом и раствором гидроксида бария. Напишите уравнения описанных реакций.
- 2Na + O2 = Na2O2
- Na2O2 + SO2 = Na2SO4
- Na2SO4 + Ba(OH)2 = BaSO4↓ + 2NaOH
6) Белый фосфор растворяется в растворе едкого кали с выделением газа с чесночным запахом, который самовоспламеняется на воздухе.
Твердый продукт реакции горения прореагировал с едким натром в таком соотношении, что в образовавшемся веществе белого цвета содержится один атом водорода; при прокаливании последнего вещества образуется пирофосфат натрия. Напишите уравнения описанных реакций.
- P4 + 3KOH + 3H2O = 3KH2PO2 + PH3↑
- 2PH3 + 4O2 = P2O5 + 3H2O
- P2O5 + 4NaOH = 2Na2HPO4 + H2O
- 2Na2HPO4 → Na4P2O7 + H2O
7) Неизвестный металл сожгли в кислороде. Продукт реакции при взаимодействии с углекислым газом образует два вещества: твердое, которое взаимодействует с раствором соляной кислоты с выделением углекислого газа, и газообразное простое вещество, поддерживающее горение. Напишите уравнения описанных реакций.
- 2Na + O2 → Na2O2
- 2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
- Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
- C + O2 = CO2
 Через избыток раствора едкого кали пропустили бурый газ в присутствии большого избытка воздуха. В образовавшийся раствор добавили магниевую стружку и нагрели, выделившимся газом нейтрализовали азотную кислоту. Полученный раствор осторожно выпарили, твердый продукт реакции прокалили. Напишите уравнения описанных реакций.
Через избыток раствора едкого кали пропустили бурый газ в присутствии большого избытка воздуха. В образовавшийся раствор добавили магниевую стружку и нагрели, выделившимся газом нейтрализовали азотную кислоту. Полученный раствор осторожно выпарили, твердый продукт реакции прокалили. Напишите уравнения описанных реакций.
- 4KOH + 4NO2 + O2 = 4KNO3 + 2H2O
- KNO3 + 4Mg + 6H2O = NH3 + 4Mg(OH)2 + KOH
- NH3 + HNO3 = NH4NO3
- NH4NO3 → N2O + 2H2O
9) При термическом разложении соли А в присутствии диоксида марганца образовались бинарная соль Б и газ, поддерживающий горение и входящий в состав воздуха; при нагревании этой соли без катализатора образуются соль Б и соль высшей кислородсодержащей кислоты.
При взаимодействии соли А с соляной кислотой выделяется желто-зеленый газ (простое вещество) и образуется соль Б. Соль Б окрашивает пламя в фиолетовый цвет, при ее взаимодействии с раствором нитрата серебра выпадает осадок белого цвета. Напишите уравнения описанных реакций.
- 2KClO3 → 2KCl + 3O2 ↑
- 4KClO3 → KCl + 3KClO4
- KClO3 + 6HCl = KCl + 3Cl2↑ + 3H2O
- KCl + AgNO3 = AgCl↓ + KNO3
10) К нагретой концентрированной серной кислоте добавили медную стружку и выделившийся газ пропустили через раствор едкого натра (избыток). Продукт реакции выделили, растворили в воде и нагрели с серой, которая в результате проведения реакции растворилась. В полученный раствор добавили разбавленную серную кислоту. Напишите уравнения описанных реакций.
- 2H2SO4(конц.) + Cu = CuSO4 + SO2 ↑ + 2H2O
- SO2 + 2NaOH = Na2SO3 + H2O
- Na2SO3 + S = Na2S2O3
- Na2S2O3 + H2SO4 = Na2SO4 + S↓ + SO2↑ + H2O
11) Поваренную соль обработали концентрированной серной кислотой. Полученную соль обработали гидроксидом натрия. Полученный продукт прокалили с избытком угля. Выделившийся при этом газ прореагировал в присутствии катализатора с хлором. Напишите уравнения описанных реакций.
NaCl(тверд.) + H2SO4(конц.) = NaHSO4 + HCl↑
- NaHSO4 + NaOH = Na2SO4 + H2O
- Na2SO4 + 4C → Na2S + 4CO↑
- CO + Cl2 → COCl2
12) Натрий прореагировал с водородом. Продукт реакции растворили в воде, при этом образовался газ, реагирующий с хлором, а полученный раствор при нагревании прореагировал с хлором с образованием смеси двух солей. Напишите уравнения описанных реакций.
- 2Na + H2= 2NaH
- NaH + H2O = NaOH + H2↑
- H2 + Cl2 = 2HCl
- 6NaOH + 3Cl2 = NaClO3 + 5NaCl + 3H2O
13) Натрий сожгли в избытке кислорода, полученное кристаллическое вещество помести-ли в стеклянную трубку и пропустили через неё углекислый газ. Газ, выходящий из трубки, собрали и сожгли в его атмосфере фосфор. Полученное вещество нейтрализовали избытком раствора гидроксида натрия. Напишите уравнения описанных реакций.
- 2Na + O2 = Na2O2
- 2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
- 4P + 5O2 = 2P2O5
- P2O5 + 6NaOH = 2Na3PO4 + 3H2O
14) К раствору, полученному в результате взаимодействия пероксида натрия с водой при нагревании, добавили раствор соляной кислоты до окончания реакции. Раствор образо-вавшейся соли подвергли электролизу с инертными электродами. Газ, образовавшийся в результате электролиза на аноде, пропустили через суспензию гидроксида кальция. Напишите уравнения описанных реакций.
- 2Na2O2 + 2H2O = 4NaOH + O2↑
- NaOH + HCl = NaCl + H2O
- 2H2O + 2NaCl → H2↑ + 2NaOH + Cl2↑
- 2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
15) Через раствор гидроксида натрия пропустили сернистый газ до образования средней соли. К полученному раствору прилили водный раствор перманганата калия. Образовавшийся осадок отделили и подействовали на него соляной кислотой. Выделившийся газ пропустили через холодный раствор гидроксида калия. Напишите уравнения описанных реакций.
- 2NaOH + SO2 = Na2SO3 + H2O
- 3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
- MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
- 2KOH(холодный) + Cl2 = KCl + KClO + H2O
16) Смесь оксида кремния (IV) и металлического магния прокалили. Полученное в результате реакции простое вещество обработали концентрированным раствором гидроксида натрия. Выделившийся газ пропустили над нагретым натрием. Образовавшееся вещество поместили в воду. Напишите уравнения описанных реакций.
- SiO2 + 2Mg = 2MgO + Si
- 2NaOH + Si + H2O = Na2SiO3 + 2H2
- 2Na + H2 = 2NaH
- NaH + H2O = NaOH + H
17) Продукт взаимодействия лития с азотом обработали водой. Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали раствором хлорида бария. Напишите уравнения описанных реакций.
- 6Li + N2 = 2Li3N
- Li3N + 3H2O = 3LiOH + NH3
- 2NH3 + H2SO4 = (NH4)2SO4
- (NH4)2SO4 + BaCl2 = BaSO4 + 2NH4Cl
18) Натрий нагрели в атмосфере водорода. При добавлении к полученному веществу воды наблюдали выделение газа и образование прозрачного раствора. Через этот раствор пропустили бурый газ, который был получен в результате взаимодействия меди с концентрированным раствором азотной кислоты. Напишите уравнения описанных реакций.
- 2Na + H2 = 2NaH
- NaH + H2O = NaOH + H2
- Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
- 2NaOH + 2NO2 = NaNO3 + NaNO2 + H2O
19) Гидрокарбонат натрия прокалили. Полученную соль растворили в воде и смешали с раствором бромида алюминия, в результате образовался осадок и выделился бесцветный газ. Осадок обработали избытком раствора азотной кислоты, а газ пропустили через раствор силиката калия. Напишите уравнения описанных реакций.
- 2NaHCO3 → Na2CO3 + CO2 + H2O
- 3Na2CO3 + 2AlBr3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaBr
- Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O
- К2SiO3 + 2CO2 + 2H2O = 2КHCO3 + H2SiO3
20) Натрий сплавили с серой. Образовавшееся соединение обработали соляной кислотой, выделившийся газ нацело прореагировал с оксидом серы (IV). Образовавшееся вещество обработали концентрированной азотной кислотой. Напишите уравнения описанных реакций.
- 2Na + S = Na2S
- Na2S + 2HCl = 2NaCl + H2S↑
- SO2 + 2H2S = 3S + 2H2O
- S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
- 2Na + O2 = Na2O2
- Na2O2 + 2H2O = 2NaOH + H2O2
- 2H2O2 →2H2O + O2
- 6NaOH (гор.) + 3Cl2 = NaClO3 + 5NaCl + 3H2O
22) Калий нагрели в атмосфере азота. Полученное вещество обработали избытком соляной кислоты, после чего к образовавшейся смеси солей добавили суспензию гидроксида кальция и нагрели. Полученный газ пропустили рад раскаленным оксидом меди (II). Напишите уравнения описанных реакций.
- 6K + N2 = 2K3N
- K3N + 4HCl = 3KCl + NH4Cl
- 2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
- 2NH3 + 3CuO = N2 + 3Cu + 3H2O
23) Калий сожгли в атмосфере хлора, образовавшуюся соль обработали избытком водного раствора нитрата серебра. Выпавший осадок отфильтровали, фильтрат выпарили и осторожно нагрели. Образовавшуюся соль обработали водным раствором брома. Напишите уравнения описанных реакций.
- 2K + Cl2 = 2KCl
- KCl + AgNO3 = KNO3 + AgCl↓
- KNO2 + Br2 + H2O = KNO3 + 2HBr
24) Литий прореагировал с водородом. Продукт реакции растворили в воде, при этом образовался газ, реагирующий с бромом, а полученный раствор при нагревании прореагировал с хлором с образованием смеси двух солей. Напишите уравнения описанных реакций.
- 2Li + H2 = 2LiH
- LiH + H2O = LiOH + H2
- H2 + Br2 = 2HBr
- 6LiOH(гор.) + 3Cl2 = LiClO3 + 5LiCl + 3H2O
25) Натрий сожгли на воздухе. Образовавшееся при этом твердое вещество поглощает углекислый газ с выделением кислорода и соли. Последнюю соль растворили в соляной кислоте, а к полученному при этом раствору добавили раствор нитрата серебра. При этом выпал белый осадок. Напишите уравнения описанных реакций.
- 2Na + O2 = Na2O2
- 2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
- Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
- NaCl + AgNO3 = AgCl↓ + NaNO3
26) Кислород подвергли воздействию электрического разряда в озонаторе. Полученный газ про-пустили через водный раствор йодида калия, при этом выделился новый газ без цвета и запаха, поддерживающий горение и дыхание. В атмосфере последнего газа сожгли натрий, а полученное при этом твердое вещество прореагировало с углекислым газом. Напишите уравнения описанных реакций.
- 3O2 ↔ 2O3
- O3 + 2KI + H2O = I2 + O2↑ + 2KOH
- 2Na + O2 = Na2O2
- 2Na2O2 + 2CO2 = 2Na2CO3 + O2
Основания. Что это такое? Свойства, примеры, определение
- Основания (гидроксиды) — это сложные вещества, которые состоят из катиона металла и гидроксильной группы (OH).
- Общая формула оснований: Me(OH)n, где Me — химический символ металла, n — индекс, который зависит от степени окисления металла.
- Примеры оснований: NaOH, Ba(OH)2, Fe(OH)2.
Названия оснований
Названия гидроксидов строятся по систематической номенклатуре следующим образом:
-
Пишем слово «гидроксид».
-
Указываем название второго химического элемента в родительном падеже.
-
Если второй элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
- Примеры названий оснований:
- Ni(OH)2 — гидроксид никеля (II);
- Al(OH)3 — гидроксид алюминия.
У некоторых оснований существуют и тривиальные названия. Собрали их в таблице.
Тривиальные названия некоторых оснований
| KOH | Едкое кали |
| NaOH | Едкий натр, каустическая сода |
| Ca(OH)2 | Гашеная известь |
| Ca(OH)2 (прозрачный раствор) | Известковая вода |
| Ca(OH)2 (мутный раствор) | Известковое молоко |
| Ba(OH)2 | Едкий барит |
В зависимости от растворимости в воде выделяют:
- щелочи. Эти основания растворимы в воде: NaOH, KOH, Ba(OH)2 и другие. Ca(OH)2, хотя малорастворим, тоже относится к щелочам из-за своей едкости;
- нерастворимые основания. К таким основаниям относятся Fe(OH)2, Cu(OH)2 и другие;
- амфотерные гидроксиды. К амфотерным относятся те основания, которые образованы металлами со степенью окисления +3 или +4. Эти основания отличаются тем, что проявляют как основные свойства, так и кислотные.
Также есть основания, которые относятся к амфотерным, но образованы металлом с иной степенью окисления: Zn(OH)2, Pb(OH)2, Sn(OH)2, Be(OH)2.
Напомним, что растворимость мы проверяем по таблице растворимости кислот и оснований в воде.
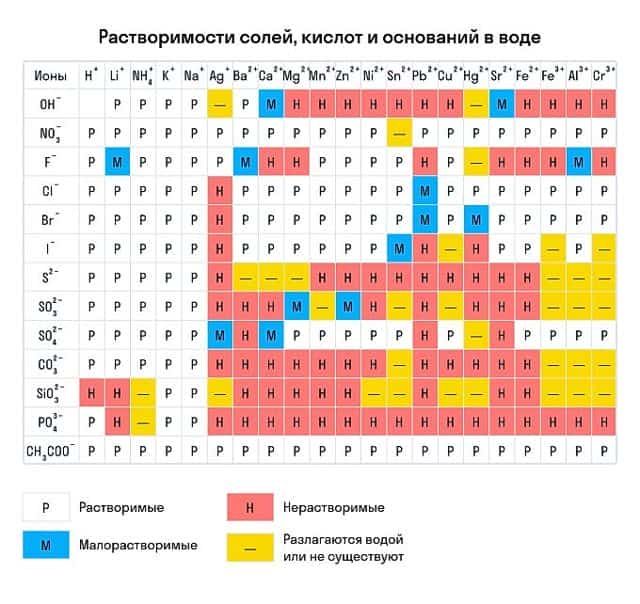
По числу гидроксогрупп
В зависимости от количества гидроксильных групп, способных замещаться на кислотный остаток, выделяют следующие виды оснований:
- однокислотные: KOH, NaOH;
- двухкислотные: Fe(OH)2, Ba(OH)2;
- трехкислотные: Al(OH)3, Fe(OH)3.
Физические свойства оснований
Основания при обычных условиях — это твердые кристаллические вещества без запаха, нелетучие, чаще всего белого цвета. В таблице приведены основания, которые имеют иную окраску.
| Белый |
|
| Желтый | Гидроксид меди (I) CuOH |
| Светло-розовый (при соприкосновении с кислородом воздуха — коричневый) | Гидроксид марганца (II) Mn(OH)2 |
| Красно-коричневый | Гидроксид железа (III) Fe(OH)3 |
| Белый с зеленоватым оттенком (темнеет при соприкосновении с кислородом воздуха) | Гидроксид железа (II) Fe(OH)2 |
| Светло-зеленый | Гидроксид никеля (II) Ni(OH)2 |
| Синий | Гидроксид меди (II) Cu(OH)2 |
Гидроксид-ионы, которые содержатся в растворе щелочи, взаимодействуют с индикатором, образуя новые соединения. Признак реакции — окраска раствора.

Взаимодействие с кислотными оксидами
Щелочи вступают в реакцию с любыми кислотными оксидами. Нерастворимые основания взаимодействуют только с кислотными оксидами, которые соответствуют сильным кислотам.
Кислотный оксид + основание = соль + вода
Например: N2O5 + 2NaOH = 2NaNO3 + H2O
Взаимодействие с кислотами
Щелочи вступают в реакцию со всеми кислотами. Нерастворимые основания могут взаимодействовать только с сильными кислотами.
- Основание + кислота = соль + вода
- Например: Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
- Взаимодействие основания с кислотой называют реакцией нейтрализации — это частный случай реакции обмена.
Взаимодействие с солями
Основания взаимодействуют с растворимыми солями по обменному механизму. В результате такой реакции должен выделиться осадок или газ (CO2, SO2, NH3).
Основание + соль = другое основание + другая соль
Например: KOH + MgSO4 = Mg(OH)2↓ + K2SO4
Термическое разложение
При нагревании нерастворимые основания разлагаются на соответствующий оксид (степень окисления металла остается неизменной) и воду.
Нерастворимое основание
оксид металла + вода
Взаимодействие амфотерных гидроксидов со щелочами
Продукты реакции зависят от условий ее проведения.
-
- При сплавлении двух оснований:
- Амфотерный гидроксид (тв) + щелочь (тв) = средняя соль + вода
- Например: Al(OH)3 + KOH = KAlO2 + 2H2O
-
- Если реакция проводится в растворе:
- Амфотерный гидроксид (р-р) + щелочь (р-р) = комплексная соль
- Например: Al(OH)3 + KOH = K[Al(OH)4]
Получение оснований
Взаимодействие металла с водой
- Активные металлы (металлы групп IA и IIA, кроме Be и Mg) активно взаимодействуют с водой при обычных условиях с образованием щелочей.
- Нерастворимые основания данным способом получить невозможно, за исключением Mg(OH)2.
- Металл + вода = гидроксид металла + водород
- Например: Na + H2O = NaOH + H2↑
- Гидроксид магния можно получить данным способом, но только при нагревании:
Взаимодействие оксидов щелочных и щелочноземельных металлов с водой
- Этим способом получают только растворимые в воде основания.
- Оксид металла + вода = щелочь
- Например: CaO + H2O = Ca(OH)2
Электролиз
- Гидроксид натрия и калия в промышленности получают с помощью электролиза — через раствор хлорида калия проводят постоянный электрический ток:
- KCl + H2O = KOH + H2↑ + Cl2↑
- Электролиз хлорида натрия протекает по аналогичной схеме.
Получение нерастворимых оснований при взаимодействии соли со щелочью
Растворимая соль + щелочь = нерастворимое основание + другая соль
Например: Cu(NO3)2 + 2KOH = Cu(OH)2↓ + 2KNO3
Вопросы для самопроверки
-
Вспомните определение оснований и приведите 2 примера этих веществ.
-
Какие виды оснований существуют? Чем они отличаются?
-
К какому виду оснований относится Zn(OH)2?
-
Взаимодействуют ли основания с основными оксидами? Приведите примеры веществ, с которыми основания вступают в реакцию.
-
Можно ли получить гидроксид алюминия с помощью взаимодействия алюминия с водой?
Основания и другие темы по химии изучать интереснее, когда понимаешь, как применять знания в реальной жизни. На онлайн-курсах по химии в Skysmart преподаватели приводят яркие примеры: от процессов в природе до использования химических реакций в промышленности. Приходите учиться — вводный урок бесплатный!
Все репетиторы Skysmart
Каталог проверенных преподавателей, которые помогут ребёнку влюбиться в предмет и достичь поставленных целей
Тесты по химии для 9 класса Тема : «Щелочные металлы и их соединения»
- Тесты
по химии для 9 класса - Тема
«Щелочные металлы и их соединения». - Вариант
1 - Часть А (задание с выбором ответа)
- А1. Элементы основной подгруппы 1 группы
имеют названия
- Щелочные металлы
- Щелочноземельные металлы
- Галогены
- Переходные металлы.
А 2.
Укажите верное суждение: А) Щелочные
металлы – это серебристо-белые мягкие вещества; Б) Щелочные металлы — это
легкие и легкоплавкие металлы.
- верно только А
- Верно только Б
- Верны оба суждения
- Оба суждения неверны.
- А 3.Самый активный щелочной металл
- А4. Наиболее легкоплавкий металл
- 1.
Rb - 2.
Cs - 3.
Li - 4.
Na
А5. Металл, образующий оксид при
взаимодействии с кислородом.
- А 6. Определите вещество Х в схеме
получения оксида натрия: - Na + X =Na2O
- А7.Раствор гидроксида натрия окрашивает
метиоранж в следующий цвет
- желтый
- красный
- синий
- оранжевый
Часть В (задание с кратким ответом)
В1 Расположите щелочные металлы в порядке
усиления восстановительной способности :1)Rb 2)Cs 3) Li 4)K 5)Na/ Ответ дайте в виде последовательности цифр.
В2. Установите соответствие между щелочным
металлом и соединением, полученным при взаимодействии этого металла с
кислородом. Ответ дайте в виде последовательности цифр, соответствующих буквам
по алфавиту.
- ЩЕЛОЧНОЙ МЕТАЛЛ СОЕДИНЕНИЕ
С КИСЛОРОДОМ - А)
К
1)оксид - Б) Na
2)пероксид - В) Li Г)Cs
В3. Расположите щелочные металлы в порядке
уменьшения скорости взаимодействия с водой 1)К, 2)Na 3)Сs 4)Rb
5)Li.
Ответ дайте в виде последовательности цифр
В4. Установите соответствие между формулой
соединения и его названием. Ответ дайте в виде последовательности цифр,
соответствующих буквам по алфавиту.
- ФОРМУЛА
СОЕДИНЕНИЯ НАЗВАНИЕ СОЕДИНЕНИЯ: - А) NaOH
1.Поташ - Б) Na2CO3*10 H2O
2. Поваренная соль - В) KOH
3.Каустик - Г) K2CO3
4. Кристаллическая сода - Д) NaCL 5.
Едкое кали
В5. Установите соответствие между
свойствами ионов металла и формулой этого соединения. Ответ дайте в виде
последовательности цифр, соответствующим буквам по алфавите.
- СВОЙСТВА ИОНА ФОРМУЛА
ИОНА - А) главный внеклеточный ион,
1) Na+ - содержится в крови и лимфе
- Б) Основной внутриклеточный ион 2)
К+ - В) Окрашивает пламя в желтый цвет
- Г)Поддерживает работу сердечной мышцы
- Д) окрашивает пламя в розово-фиолетовый цвет
- Тесты
по химии для 9 класса - Тема
«Щелочные металлы и их соединения». - Вариант
2 - Часть А (задание с
выбором ответа) - А1. Элементы основной подгруппы 1 группы
имеют названия
- Галогены
- Щелочноземельные металлы
- Щелочные металлы
- Переходные металлы.
А 2. Укажите верное суждение: А) Щелочные
металлы с характерным блеском на свежесрезанной поверхности; Б) Щелочные
металлы – активно взаимодействуют со всеми неметаллами.
- верно только А
- Верно только Б
- Верны оба суждения
- Оба суждения неверны.
А 3.Самый активный щелочной металл
А4. Обладает наибольшей плотностью
А5. Металл, образующий пероксид при
взаимодействии с кислородом.
- А 6. Определите вещество Х в схеме
получения пероксида натрия: - Na + X =Na2O2
- А7. Раствор гидроксида натрия окрашивает
фенолфталеиновый в следующий цвет
- желтый
- красный
- синий
- малиновый
Часть В (задание с кратким ответом)
В1 Расположите щелочные металлы в порядке
ослабления металлических свойств : 1)Rb 2)Cs 3) Li 4)K 5)Na. Ответ дайте в виде последовательности цифр.
В2. Установите соответствие между щелочным
металлом и соединением, полученным при взаимодействии этого металла с
кислородом. Ответ дайте в виде последовательности цифр, соответствующих буквам
по алфавиту.
- ЩЕЛОЧНОЙ
МЕТАЛЛ СОЕДИНЕНИЕ С КИСЛОРОДОМ - А)
К 1)оксид - Б) Na
2)пероксид - В) Li
- Г)Cs
В3. Расположите щелочные металлы в порядке
увеличения скорости взаимодействия с водой 1)К, 2)Na 3)Сs 4)Rb
5)Li.
Ответ дайте в виде последовательности цифр
В4. Установите соответствие между формулой
соединения и его названием. Ответ дайте в виде последовательности цифр,
соответствующих буквам по алфавиту.
- ФОРМУЛА
СОЕДИНЕНИЯ НАЗВАНИЕ СОЕДИНЕНИЯ: - А) NaOH
1.Глауберовая соль - Б) Na2CO3*10 H2O 2. Поваренная соль
- В) KOH
3.Каустик - Г) K2SO4*10
H2O 4.
Кристаллическая сода - Д) NaCI
5. Едкое кали - В5 Установите соответствие между формулой
соли и ее применением. Ответ дайте в виде последовательности цифр, соответствующим
буквам по алфавиту - ФОРМУЛА СОЕДИНЕНИЯ
ПРИМЕНЕНИЕ - А) K2CO3 1)для
производства мыла и волокон - Б) NaOH
2)для приготовления тугоплавкого стекла - В) Na2CO3*10 H2O 3)для производства стекла, бумаги, мыла
- Г) NaCL
4)слабительное средство - Д) K2SO4*10 H2O 5)приправа к пище
- Ответы к тестам «Щелочные металлы и их
соединения».9 класс - Вариант 1.
Вариант 2 - А1 -1 А1-3
- А2-4
А2 –4 - А3-4
А3- 3 - А4-2
А4.-2 - А5-1
А5-3 - А6-4
А6.-1 - А7-1
А7.-4 - В1- 3, 5, 4, 1, 2 В1.-2,1,4,5,3
В2. А-2, Б-2, В-1, Г-2
В2.-А-2, Б-2, В-1,Г-2
В3. – 4, 3, 1, 2, 5 В3.-
5, 2, 1, 4, 3
В4. –А-3, Б-4, В-5, Г-1, Д-2
В4.-А-1,Б-4, В-5, Г-1, Д-2
В5. А-1, Б-2,
В-1, Г-2, Д-2
В5.В-5 А-2,
Б-1, В-3, Г-5, Д -4 (вариант -2)
I группа главная подгруппа Периодической системы Менделеева (щелочные металлы)
- I группа главная подгруппа Периодической системы Менделеева представляет собой щелочные металлы. К щелочным металлам относят химические элементы:
- Литий Li,
- Натрий Na,
- Калий K,
- Цезий Cs,
- Рубидий Rb
- Франций Fr
- Эти металлы очень активны, поэтому их хранят под слоем вазелина или керосина.
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
- Электронные конфигурации у данных элементов схожи, все они содержат 1 электрон на внешнем уровне ns1:
- Li — 2s1
- Na — 3s1
- K — 4s1
- Rb — 5s1
- Cs — 6s1
- Fr — 7s1
- Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Литий
- Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
- Известен также способ получения лития из его оксида в вакууме при 300°С:
2Li2O + Si + 2CaO = 4Li + Ca2SiO4
Натрий
- Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
- Натрий можно получить, прокаливая соду с углем в закрытых тиглях, пары металла конденсируются на крышке тигля, выход реакции невысокий:
Na2CO3 + 2C = 2Na + 3CO
Калий
- Калий получают также электролизом расплавов солей или расплава гидроксида калия, однако на практике таким способом их не получают из-за высокой химической активности
- Наиболее распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов.:
- KCl + Na = K + NaCl
- KOH + Na = K + NaOH
- В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний
- Цезий, Рубидий
- Цезий и рубидий получают восстановлением их хлоридов специально подготовленным кальцием при 700–800 °С:
Са + 2CsCl → 2Cs + CaCl2
- В качестве восстановителя также используют цирконий, реакция протекает при 650 °С:
2Cs2CO3 + Zr = 4Cs + ZrO2 + 2CO2
- В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме
Качественные реакции — окрашивание пламени солями щелочных металлов
Цвет пламени:
Li — карминно-красныйNa — желтыйK — фиолетовыйRb — буро-красныйCs — фиолетово-красный
С кислородом
4Li + O2 = 2Li2O
- Натрий образует пероксид:
2Na + O2 = Na2O2
- Калий образует надпероксид:
- K + O2 = KO2
- С галогенами (F, Cl, Br, I)
- Щелочные металлы образуют галогениды:
- 2Li + F2 = 2LiF
- 2Na + Cl2 = 2NaCl
- 2K + I2 = 2KI
- С водородом
- Щелочные металлы образуют гидриды:
- 2Na + H2 = 2NaH
- С серой
- Щелочные металлы образуют сульфиды:
- 2Na + S = Na2S
- С азотом
- При комнатной температуре взаимодействует только литий:
- 6Li + N2 = 2Li3N
- Остальные щелочные металлы
реагируют с азотом при
нагревании: - 6Na + N2 = 2Na3N
- С углеродом
- Щелочные металлы при нагревании образуют карбиды, преимущественно ацетилениды:
- 2Na + 2C → Na2C2 (t = 150-200 °C)
- С фосфором
- Щелочные металлы активно
реагируют с фосфором образуя фосфиды: - 3Na + P → Na3P
- С водой
- Щелочные металлы реагируют с водой при обычных
условиях: - 2Na + 2H2O = 2NaOH + H2
- Видео Взаимодействие щелочных металлов с водой
- С кислотами
- С растворами HCl, H2SO4щелочные металлы взаимодействуют с образованием соли и выделением водорода:
2K + H2SO4(разб) = K2SO4 +
H2
- С кислотами-окислителями (HNO3 и конц. H2SO4):
- с концентрированной серной:
- 8Na + 5H2SO4(конц) = 4Na2SO4 +
H2S + 4H2O; - с разбавленной азотной
- 8Na + 10HNO3(разб) = 8NaNO3 + NH4NO3 + 3H2O;
- с концентрированной азотной
- 8Na + 10HNO3(конц) =
8NaNO3 + N2O + 5H2O. - 2СH3COOH + 2Li → 2CH3COOOLi + H2↑
- С солями
- В расплаве щелочные металлы могут взаимодействовать с некоторыми солями:
- 3Na + AlCl3 → 3NaCl + Al
Запомните! В растворе щелочные металлы взаимодействуют с водой, а не с солями других металлов.






