- Изменение окраски индикаторов
- Взаимодействие с металлами
- Реакции с основными оксидами
- Взаимодействие с основаниями
- Взаимодействие с солями
- Разложение кислот на кислотные оксиды и воду
- Растворы кислот и оснований в химии — формулы и определения с примерами решения задач
- Растворы кислот и оснований
- Теории кислот и оснований
- Ионное произведение воды. Водородный показатель
- Отношение металлов к кислотам
- Химические свойства металлов. Отношение металлов к кислотам
- Характерные химические свойства кислот
- Общая характеристика
- Классификация:
- Физические свойства
- Химические свойства
- Изменение цвета индикаторов
- Взаимодействие кислот с металлами
- Взаимодействие кислот с основными и амфотерными оксидами
- Взаимодействие кислот с основными и амфотерными гидроксидами
- Взаимодействие кислот с солями
- Разложение кислородсодержащих кислот
- Химические свойства кислот
- Пример 1.
- Пример 2.
- Пример 3.
- 2. Взаимодействие с оксидами
- Пример.
- 3. Взаимодействие с основаниями
- 4. Взаимодействие с солями
- Пример
Архив уроков › Химия 8 класс
В уроке 35 «Химические свойства кислот» из курса «Химия для чайников» узнаем о всех химических свойствах кислот, рассмотрим с чем они реагируют и что при этом образуется.

В состав молекулы любой кислоты обязательно входят атомы водорода, связанные с различными кислотными остатками. Такое подобие состава молекул обусловливает подобие химических свойств кислот.
Оно выражается в том, что кислоты в водных растворах проявляют схожие химические свойства, называемые кислотными свойствами.
Знание этих свойств очень важно для дальнейшего изучения химии, поэтому познакомимся с ними более подробно и систематизируем изученный ранее материал.
Изменение окраски индикаторов
Вы уже знаете, что для доказательства наличия кислоты или щелочи в растворе можно использовать особые вещества — индикаторы.
Вспомните, в какие цвета окрашены растворы индикаторов лакмуса, метилоранжа и фенолфталеина. Как изменяется их окраска в растворах кислот?
Взаимодействие с металлами
Из материала предыдущих тем вам известно, что в водных растворах многие кислоты реагируют с металлами, расположенными в ряду активности левее Н2 (например, Mg, Al, Zn, Fe). В результате этих реакций образуются сложные вещества — соли и выделяется газообразное простое вещество — водород:
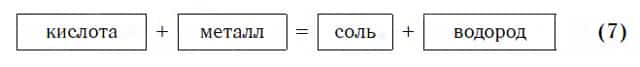
В такие реакции вступают как бескислородные (HCl, HBr), так и кислородсодержащие (H2SO4, H3PO4) кислоты, например:
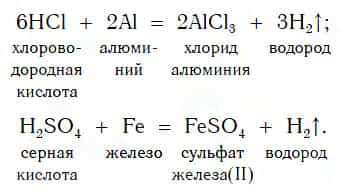
Реакции этого типа, как вы уже знаете, относятся к реакциям замещения: атомы металлов замещают (вытесняют) атомы водорода из молекул кислот.
Следует помнить, что металлы, расположенные в ряду активности правее Н2 (Сu, Ag, Hg и др.), с указанными кислотами в водных растворах не реагируют.
Реакции с основными оксидами
Еще в младших классах, изучая математику, вы узнали, что от перемены мест слагаемых сумма не изменяется: 2 + 3 = 5; 3 + 2 = 5.
Похожее правило есть и в химии: если в уравнении реакции исходные вещества поменять местами, то ее продукты от этого не изменятся. Так, например, изучив ранее химические свойства основных оксидов, вы узнали, что они реагируют с кислотами с образованием солей и воды. Зная это, вы можете теперь смело утверждать, что кислоты реагируют с основными оксидами, образуя те же продукты — соли и воду:
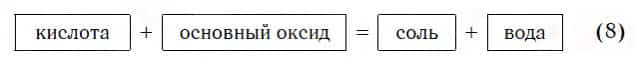
Пример уравнения реакции, протекающей в соответствии с этой схемой:
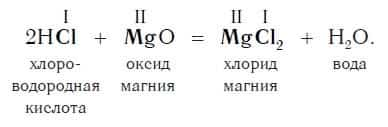
Как вам уже известно, эти реакции относятся к реакциям обмена, поскольку в процессе взаимодействия исходные сложные вещества обмениваются своими составными частями.
Взаимодействие с основаниями
Изучая химические свойства оснований, вы узнали, что они реагируют с кислотами с образованием солей и воды.
А что же тогда образуется при взаимодействии кислот с основаниями? Правильно, те же самые продукты — соли и вода! Мы еще раз убедились в том, что состав конечных веществ не зависит от того, в каком порядке смешиваются одни и те же исходные вещества. Итак, составим схему, согласно которой кислоты реагируют с основаниями:
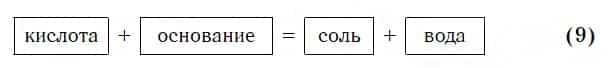
Запомните, что в образующейся соли валентность атомов металла такая же, как в исходном основании, а валентность кислотного остатка такая же, как в исходной кислоте.
Кислоты реагируют как с нерастворимыми, так и с растворимыми основаниями, например:
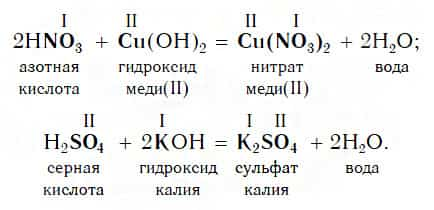
Реакции этого типа, как и предыдущего, относятся к реакциям обмена. Вспомните, как называется реакция, которую отображает последнее уравнение. Почему она так называется?
Взаимодействие с солями
Еще один класс сложных веществ, с которыми кислоты могут вступать в химическое взаимодействие, — соли. Реакции этого типа идут по общей схеме:

Однако сразу заметим, что кислота реагирует в растворе с солью лишь в том случае, если в результате реакции выделяется газ (↑) или образуется нерастворимое вещество, выпадающее в осадок (↓). Примеры таких реакций:
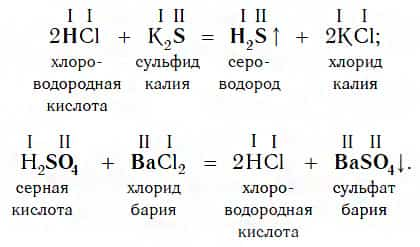
Очевидно, что реакции этого типа, как и двух предыдущих, относятся к реакциям обмена.
Разложение кислот на кислотные оксиды и воду
Известно несколько кислот, которые достаточно легко разлагаются на соответствующий кислотный оксид и воду. К таким кислотам, которые называют неустойчивыми, относят угольную (H2CO3), сернистую (H2SO3) и кремниевую (H2SiO3) кислоты. Особенно неустойчива угольная кислота — она разлагается на кислотный оксид CO2 и воду уже при комнатной температуре:
Краткие выводы урока:
- Кислоты в растворах изменяют окраску индикаторов.
- Кислоты реагируют с металлами, основными оксидами, основаниями и солями.
Надеюсь урок 35 «Химические свойства кислот» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Растворы кислот и оснований в химии — формулы и определения с примерами решения задач
Содержание:
Основания (гидроксиды) – это сложные вещества, состоящие из ионов металлов и связанных с ними одного или нескольких гидроксид ионов – OH−, общая формула которых Ме(ОН)у
Кислоты, применяемые в лаборатории, бывают технические и чистые. Технические кислоты содержат примеси, а потому при аналитических работах не употребляются.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Растворы кислот и оснований
Кислоты – это сложные химические соединения, в основе которых содержится один или несколько атомов водорода и кислотный остаток. Слово «кислота» по значению связано со словом «кислый», так как имеют общий корень. Отсюда следует, что растворы всех кислот имеют кислый вкус.
Основания – это сложные вещества, состоящие из атомов металлов и одной или нескольких гидроксогрупп (ОН—).
С точки зрения теории электролитической диссоциации это электролиты (вещества, растворы или расплавы которых проводят электрический ток), диссоциирующие в водных растворах на катионы металлов и анионы только гидроксид — ионов ОН—.
Теории кислот и оснований
В настоящее время не существует однозначного определения понятий кислоты и основания, которое в равной степени можно было бы использовать для характеристики кислотно-основных взаимодействий в любых растворителях. Трактовка кислотно-основных свойств соединений производится с позиций трех основных теорий: теории Аррениуса, Брёнстеда — Лоури, Льюиса.
Теория Аррениуса. Согласно теории Аррениуса, кислотой считается соединение, при электролитической диссоциации которого образуются катионы водорода, а основанием считается соединение, в результате диссоциации которого образуется гидроксид-ион.
Амфолитом (амфотерным гидроксидом) называют электролит, диссоциирующий в растворе с образованием как катионов водорода, так и гидроксид-ионов.
К амфолитам относят гидроксиды цинка, алюминия, хрома и других амфотерных элементов, а также аминокислоты, белки, нуклеиновые кислоты.
Таким образом, свойства кислот обусловлены наличием в их растворах водород-ионов, а свойства оснований — присутствием в их растворах гидроксид-ионов. Однако такой взгляд на кислоты и основания применим только для водных растворов.
Приведем примеры:
Ограниченность понятий кислоты и основания, данных Аррениусом, можно проиллюстрировать примерами:
1. Молекула NH3 — не содержит иона ОН-, а молекула СО2 — иона Н+, однако в водном растворе первая проявляет свойства основания, а вторая — кислоты.
2. Безводный хлороводород, состоящий только из молекул, реагирует с безводными основаниями.
3. Многие электролиты, содержащие водород, в одном растворителе диссоциируют как кислоты, а в другом — как основания.
Например, СН3СООН в воде — слабая кислота: , а в жидком фториде водорода — основание:
Сванте Август Аррениус (1859—1927)
Шведский ученый физико-химик. Основатель теории диссоциации, лауреат Нобелевской премии.
- Формулировка Нобелевского комитета: «в знак признания особого значения его теории электролитической диссоциации для развития химии».
- Исследования подобного типа реакций, и в особенности реакций, протекающих в неводных растворителях, привели к созданию более общих теорий кислот и оснований.
- Константа диссоциации. Рассмотрим реакцию диссоциации азотистой кислоты (слабого электролита):
Данная запись означает, что данный процесс протекает в двух противоположных направлениях: молекулы азотистой кислоты диссоциируют (прямая реакция) и ассоциируют (обратная реакция).
Для характеристики слабых электролитов применяют константу диссоциации (Кд). Вследствие того, что слабые электролиты диссоциируют на ионы не полностью, в их растворах устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Константу равновесия в этом случае называют константой диссоциации Кд. В случае азотистой кислоты выражение Кд будет записано:
Чем меньше константа диссоциации, тем слабее электролит.
Томас Мартин Лаури (Лоури) (1574—1936)
Британский химик. Основные научные работы посвящены изучению оптической активности органических соединений. Создатель протонной теории кислот и оснований (предложил почти одновременно и независимо от Й. Н. Брёнстеда).
Для слабого электролита константа диссоциации — величина постоянная при данной температуре, которая не зависит от концентрации раствора. Константа диссоциации зависит от природы растворителя, природы электролита и температуры.
Протонная теория кислот и оснований. Теория Брёнстеда — Лоури.
В 1923 г. И. Брёнстед и Т. Лоури разработали протонную теорию кислот и оснований. Согласно этой теории:
— кислотой называют любое вещество, молекулярные частицы которого (в том числе ионы) способны отдавать протон, т. е. быть донором протонов;
— основанием называют вещество, молекулярные частицы которого (в том числе и ионы) способны присоединять протоны, т. е. быть акцептором протонов.
Такие определения кислот и оснований позволяют включать в их число не только молекулы, но и ионы. Например, карбонат-ион, согласно протонной теории является основанием, т. к. в водном растворе он присоединяет протон:
Согласно протонной теории кислоты подразделяют на три типа:
1. Нейтральные кислоты, например и др.
- 2. Катионные кислоты, представляющие собой положительные ионы, например
3. Анионные кислоты, представляющие собой отрицательные ионы, например, и др.
Подобного типа классификация имеется и для оснований:
1. Нейтральные основания, например, и др.:
- 2. Анионные основания, представляющие собой отрицательные ионы, например,
- 3. Катионные основания, представляющие собой положительные ионы, например,
- Растворители типа воды, жидкого аммиака, а также анионы многоосновных кислот, которые могут быть и донорами, и акцепторами протонов, являются амфолитами.
- Например, в реакции молекула воды отдает протон и является кислотой.
Однако в реакции молекула воды присоединят протон и является основанием. Таким образом, вода — типичный амфолит.
Процесс диссоциации (ионизации) вещества происходит в контакте с растворителем. При этом растворитель выполняет функцию или кислоты или основания. Например, при растворении аммиака вода — кислота: . При растворении фторида водорода — основание .
Если сродство к протону у растворителя больше, чем у растворенного вещества, то растворитель выступает как основание (сродство к протону Н2O больше сродства к протону HF), а если оно меньше — как кислота (сродство к протону Н2O меньше сродства к протону NH3).
Согласно протонной теории, отдавая протон, кислота превращается в основание, которое называют сопряженным этой кислоте:
I. (кислота)1 = (сопряженное основание)1+ Н+, т. е. каждой кислоте соответствует сопряженное основание.
- Наоборот, основание, присоединяя протон, превращается в сопряженную кислоту:
- II. (основание)2 + Н+= (сопряженная кислота)2
- Например, кислоте H2SO4 соответствует сопряженное основание HSO4 , а основанию Cl — сопряженная кислота HCl.
- III. (кислота)1 + (основание)2 = (кислота)2 + (основание)1
- Для краткости обратимый процесс кислотно-основного взаимодействия называют кислотно-основным равновесием.
- Например:
- Йоханнес Николаус Брёнстед (1879-1947)
Датский физико-химик, член Датского королевского общества наук. Автор протонной теории кислот и оснований (предложил одновременно и независимо от Томаса Лоури), развивал теорию кислотно-основного катализа.
Несмотря на свои достоинства, теория Брёнстеда, как и теория Аррениуса, неприменима к веществам, проявляющим функцию кислоты веществ, но не содержащим водорода, например галогенидам бора, алюминия, кремния, олова. Поэтому более общей является электронная теория кислот и оснований Льюиса.
- Теория Льюиса (электронная теория).
- В теории Льюиса за основу взято наиболее общее свойство кислот и оснований — их электронное строение.
- Согласно этой теории:
- — кислотой называют вещество, принимающее неподеленную электронную пару, — акцептор электронов;
- — основанием называют вещество, поставляющее электроны для образования химической связи, — донор электронов.
- По Льюису отличительной способностью кислот и оснований является их взаимная нейтрализация путем образования ковалентной связи:
- В приведенных примерах в качестве кислоты выступают молекулы трихлорида брома и оксида серы (VI), а в качестве оснований — молекулы аммиака и воды.
- Таким образом, теория Льюиса рассматривает разные химические процессы как однотипные: реакцию аминов с галогенидом бора, комплексообразование.
- К основаниям Льюиса относят галогенид-ионы, аммиак, алифатические и ароматические амины, кислородсодержащие соединения общей формулы R2CO (где R — органический радикал).
- К кислотам Льюиса относят галогениды бора, алюминия, кремния, олова и других элементов.
- Подведем итог, представив результаты в обобщенной таблице 22:
- Таблица 22
- Сопоставление теорий кислот и оснований
| Класс веществ | Определения кислот и оснований | ||
| По Аррениус — Оствальду | По Брёнстеду — Лоури | По Льюису | |
| Кислоты | Отдают Н+ | Отдают Н+ | Принимают неподеленные пары электронов |
| Основания | Отдают ОН- | Н+принимают | Отдают неподеленные пары электронов |
Рассмотренные теории кислот и оснований не противоречат, а дополняют друг друга и имеют глубокую внутреннюю связь. Так, кислоты, по Брёнстеду, можно рассматривать как частный случай льюисовских кислот, поскольку протон характеризуется большим сродством к электронной паре и может рассматриваться, по Льюису, как кислота.
Ионное произведение воды. Водородный показатель
- Вода — слабый амфотерный электролит. Уравнение диссоциации воды имеет вид:
- или
Как видно из первого уравнения, концентрации ионов водорода Н+ и гидроксид-ионов ОН- в воде одинаковы. При 25°С [Н+] = [ОН-] = 10 -7 моль/л.
- Произведение концентраций ионов водорода и гидроксид-ионов называется ионным произведением воды (К):
- (1)
- — величина постоянная и при температуре 25°С
- В разбавленных водных растворах электролитов, как и в воде, произведение концентраций ионов водорода Н+ и гидроксид-ионов ОН- — величина постоянная при данной температуре.
- Из соотношения (1) следует, что равновесные концентрации ионов водорода и гидроксид-ионов в водном растворе взаимосвязаны:
- Если к воде добавить кислоту, то концентрация ионов водорода в растворе увеличится, и поэтому она уже не будет равна концентрации гидроксид-ионов, а будет выше.
- Увеличение концентрации ионов водорода {добавление кислоты) обусловливает появление кислотных, а увеличение концентрации гидроксид-ионов (добавление щелочи) — появление основных свойств раствора.
Если концентрация одного из ионов увеличивается, то концентрация другого должна уменьшаться, потому что произведение их концентраций всегда должно быть равно 10-14. Зная концентрацию одного из ионов, легко рассчитать концентрацию другого. Для удобства вместо истинных значений концентраций ионов водорода и гидроксид-ионов используют отрицательные логарифмы этих значений.
В 1909 г. датский химик С. Сёренсен предложил использовать величину, называемую сейчас водородным показателем рН (р — начальная буква немецкого слова potenz — математическая степень; Н — символ водорода).
- Водородным показателем рН называется отрицательный десятичный логарифм концентрации ионов водорода:
- При увеличении концентрации ионов водорода рН уменьшается, при уменьшении концентрации ионов водорода рН увеличивается.
- Нейтральная среда — эта среда, в которой концентрация ионов водорода равна концентрации гидроксид-ионов: [Н+] = [ОН-] = 10 -7 моль/л.
- Кислая среда — это среда, в которой концентрация ионов водорода больше концентрации гидроксид-ионов: [Н+] > [ОН-],[Н+] > 10 -7 моль/л.
- Щелочная среда — это среда, в которой концентрация ионов водорода меньше концентрации гидроксид-ионов: [Н+] < [ОН-],[Н+]
Отношение металлов к кислотам
по схеме:
Окисление металлов за счет кислотного остатка происходит водными растворами тех кислот, центральный атом которых может понижать свою степень окисления, в результате чего анион этой кислоты может выступать в роли окислителя.
в качестве окислителя формально выступает азот в степени окисления +5. Данные приведены в табл. 4.
Таблица 4
| (окислитель ) | |||
| Активные | Средней активности | Малоактивные | |
| Реагируют | Не реагируют: | ||
| Кислота восстанавливается, в основном, до следующих продуктов | |||
| – |
- Например:
- Активные металлы реагируют следующим образом:
- Металлы средней активности восстанавливают азот до N+1:
- Малоактивные металлы реагируют с выделение NO или NO2:
может происходить более глубокое восстановление N+5. Данные приведены в табл. 5.
Таблица 5
| (окислитель ) | |||
| Активные | Средней активности | Малоактивные | |
| Реагируют | Реагируют, реагируют и пассивируются: | Реагируют: | Не реагируют: |
- Например:
- Активные металлы глубоко восстанавливающие азот:
- Металлы средней активности выделяют NO или NO2:
- Малоактивные металлы восстанавливают азот до N+4:
, а также некоторые малоактивные металлы. Данные приведены в табл. 6.
Таблица 6
| (окислитель ) | |||
| Активные | Средней активности | Малоактивные | |
| Реагируют | Реагируют, реагируют и пассивируются: | Реагируют: | Не реагируют: |
| Кислота восстанавливается, в основном, до следующих продуктов | |||
| – |
- Например:
- Малоактивные металлы восстанавливают серу до S+4:
- Ваша оценка?
Получение металлов из руд
Химические свойства металлов. Отношение металлов к кислотам
Характерным химическим свойством металлов является их восстановительная активность. Все они сравнительно легко отдают валентные электроны, переходят в положительно заряженные ионы, то есть окисляются.
Восстановительную активность металла в химических реакциях, протекающих в водных растворах, отражает его положение в электрохимическом ряду напряжений металлов, или ряду стандартных электродных потенциалов металлов.
Чем левее стоит металл в ряду стандартных электродных потенциалов, тем более сильным восстановителем он является.
Каждый металл способен восстанавливать из солей в растворе те металлы, которые стоят в ряду напряжений после него. Однако следует помнить, что металлы щелочных и щелочно-земельных металлов будут взаимодействовать непосредственно с водой.
Чаще всего в химической практике используются такие сильные кислоты как серная H2SO4, соляная HCl и азотная HNO3.
Соляная кислота. Образующиеся в процессе диссоциации ионы водорода H+ выполняют роль окислителя, окисляя металлы, расположенные в ряду активности левее водорода. Взаимодействие протекает по схеме:
- Me + HCl = соль + H2↑
- Соляная кислота является слабым окислителем, поэтому металлы с переменной валентностью окисляются ей до низших положительных степеней окисления.
- Разбавленная серная кислота. В разбавленном водном растворе серной кислоты большинство ее молекул диссоциируют:
- H2SO4 H+ + HSO4-
- HSO4- H+ + SO42-
- Образующиеся ионы Н+ выполняют функцию окислителя.
- Как и соляная кислота, разбавленный раствор серной кислоты взаимодействует только с металлами активными и средней активности (расположенными в ряду активности до водорода).
- Химическая реакция протекает по схеме:
- Ме + H2SO4(разб.) → соль + H2↑
- Металлы с переменной валентностью окисляются разбавленным раствором серной кислоты до низших положительных степеней окисления.
- Концентрированная серная кислота.
- Процесс взаимодействия металлов с концентрированной серной кислотой в большинстве случаев протекает по схеме:

Концентрированная серная кислота является сильным окислителем, поэтому при взаимодействии с ней металлов, обладающих переменной валентностью, последние окисляются до более высоких степеней окисления, чем в случае с разбавленным раствором кислоты.
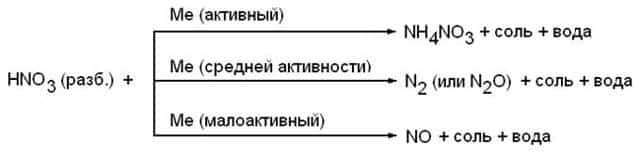
Азотная кислота. Me + HNO3 = соль + вода + продукт восстановления HNO3
Концентрированная азотная кислота. Me + HNO3(конц.) → соль + вода + NO2
Разбавленная азотная кислота.
Заказать ✍️ написание учебной работы
Характерные химические свойства кислот
Характерные химические свойства кислот добавить в закладки
Кислоты – это химические соединения, содержащие в себе положительный атом водорода (катион H+) и кислотный остаток (анион A-). Является сложным веществом.
Общая характеристика
В первую очередь кислоты различают по растворимости. Есть нерастворимые, растворимые и полурастворимые кислоты. Эти различия прописаны в таблице растворимости, так что наизусть запоминать не требуется.
Классификация:
- Кислоты различают по составу на кислородсодержащие и бескислородные. Примеры кислот приведены ниже в таблице. Бескислородные кислоты – это растворы галогеноводородов, атомы которых в растворе связаны полярной ковалентной связью. Название кислоты складывается из названия кислотного остатка в первую очередь, а дальше называется катион (водород). Так с хлором и водородом образуется хлороводородная кислота, а с серой – сероводородная. Кислородосодержащие кислоты, или оксокислоты называют за счёт наличия в них кислорода. Общего принципа построения названия этих кислот нет, так что их названия необходимо запоминать на память.
- Кислоты различают по количеству атомов водорода на одноосновные (один атом водорода), двухосновные (два атома водорода), трёхосновные (три атома водорода).
| Основность кислоты — это число активных атомов водорода в молекуле кислоты | |
| Одноосновные | HClO4, HCl |
| Двухосновные | H2SO4, H2CO3 |
| Трехосновные | H3PO4 |
- Кислоты разделяют на сильные и слабые. К сильным относят галогенводородные и высшие кислородсодержащие кислоты, они растворимы. К слабым относят неустойчивые и нерастворимые в воде кислоты. Чтобы определить силу кислоты, существует правило: из числа атомов кислорода вычесть число атомов водорода, если получаемое число 2 или 3 – кислота сильная, если 1 или 0 – кислота слабая.
Физические свойства
Кислоты, в зависимости от условий, могут быть в трёх агрегатных состояниях: в жидком, твёрдом и газообразном состоянии. Кислоты могут обладать цветом и запахом.
Химические свойства
Изменение цвета индикаторов
Кислота в водной среде способна изменить цвет разных индикаторов. Кислоты окрашивают в красных цвет лакмус, метилоранж и универсальный индикатор. Фенолфталеин не окрашивается.
Взаимодействие кислот с металлами
- Кислота способна реагировать только с металлами, находящимися левее водорода в ряду активности металлов.
- Mg + 2HCl → MgCl2 + H2↑
- Из приведенного выше химического уравнения нужно отметить, что при взаимодействии кислоты и металла происходит реакция замещения, образуется соль и выделяется H2.
Взаимодействие кислот с основными и амфотерными оксидами
- При взаимодействии кислоты с основным или амфотерным оксидами происходит реакция обмена в результате которой образуются соль и H2O.
- В качестве примера приведены следующие реакции:
- K2O + 2HNO3 → 2KNO3 + H2O Al2O3 + 6HCl → 2AlCl3 + 3H2O
- Из приведённого выше химического уравнения нужно отметить, что в реакциях основного оксида калия и амфотерного оксида алюминия (III) с кислотами, образуется соль и H2O.
Взаимодействие кислот с основными и амфотерными гидроксидами
При взаимодействии кислоты с основным и амфотерным гидроксидами образуются H2O и новая соль, как и в случае с оксидами, происходит реакция обмена. Второе название этой реакции — реакция нейтрализации.
KOH + HNO3 → KNO3 + H2O Al(OH)3 + 3HCl → AlCl3 + 3H2O
Из приведённой выше химического уравнения нужно отметить, что при реакции основного гидроксида калия и амфотерного гидроксида алюминия (III) с кислотами образуются соль и H2O.
Взаимодействие кислот с солями
Реакция кислоты с солью является реакцией обмена, так же ее называют реакцией нейтрализации. Она возможно только в случае выпадения соли в осадок, выделения газа, слабые электролиты или вода. Рассмотрим все случаи более подробно.
- Реакции, в результате которых выпадает осадок. H2SO4 + BaCl2 → BaSO4↓ + 2HCl Na2SiO3 + 2HNO3 → H2SiO3↓ + 2NaNO3 Из приведённого выше химического уравнения можно увидеть, что при взаимодействии кислоты и соли образуются новые кислота и нерастворимая соль, которые выпадают в осадок. Осадок может иметь различную окраску, плотность и консистенцию.
- Реакции, в результате которых при нагревании или обычных условиях выделяется газ. NaCl(тв.) + H2SO4 (конц.) → Na2SO4 + 2HCl↑ FeS + 2HCl → FeCl2 + H2S↑ Из приведённых выше химических уравнений нужно отметить, что при реакции соли с кислотой образуется новая соль и выделяется газ. Разберём одну из реакций: при взаимодействии твёрдого хлорида натрия с концентрированной хлороводородной кислотой образовалась натриевая соль серной кислоты и выделился летучий газ хлороводород.
- Реакции, в результате которых образуется слабый электролит. Такие реакции возможны только при условии, когда одним из реагентов сильный электролит. Для того, чтобы убедиться, что реакция будет протекать используют вытеснительный ряд: В этом ряду кислоты расположены так, что в растворах кислот и их солей могут в результате реакции вытесняют из раствора те, что стоят левее в ряду. Азотная и фосфорная кислоты находятся на одном месте в ряду, т.к. имеют одинаковые вытеснительные способности. Из приведённого выше химического уравнения нужно отметить, что хлороводородная кислота, которая находится в данном ряду левее, способна вытеснять кислотный остаток карбоновой кислоты, стоящей в ряду правее. Нужно учитывать, что карбоновая кислота слабая и при стандартных условиях она распадется на углекислый газ и воду. Углекислый газ выделяется из раствора, а вода остаётся.
Разложение кислородсодержащих кислот
В результате реакции разложения кислородсодержащих кислот всегда образуется вода и оксид.
Из приведённых выше реакций можно увидеть, что карбоновая легко разлагается при обычных условиях, так как является одной из самых слабой кислотой. Для разложения сернистой и кремниевой кислоты их растворы необходимо нагреть. Во всех трёх реакция в результате образуется вода и оксиды кислотных остатков.
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства солей: средних, кислых, оснóвных; комплексных ( на примере соединений алюминия и цинка)
- Взаимосвязь различных классов неорганических веществ
Химические свойства кислот
Кислоты – это класс химических соединений, в которых есть атом водорода и кислотный остаток. Напомню, что кислоты делятся на одно-, двух- и трёхосновные (основность определяется числом атомов водорода) и на кислородсодержащие и бескислородные (а это можно узнать, взглянув на кислотный остаток). А сейчас пришло время узнать, как ведут себя кислоты в химических реакциях.
cornellasap.org
Кислоты могут реагировать с некоторыми металлами.
Чтобы узнать, с какими именно металлами могут взаимодействовать металлы, нам понадобится воспользоваться электрохимическим рядом активности металлов (также его называют электрохимическим рядом напряжений металлов).
Ряд активности металлов относится к числу справочных материалов, учить наизусть его нет необходимости, поскольку обычно он представлен в учебнике химии или висит в классе химии. Выглядит он следующим образом:
из открытых источников из открытых источников
Найдите в ряду водород и запомните, что
металлы, стоящие в ряду напряжений ДО водорода (левее водорода), реагируют с кислотами с образованием соли и газообразного водорода, металлы, стоящие ПОСЛЕ (правее) водорода, с кислотами не реагируют.
Пример 1.
Будет ли серная кислота реагировать с цинком? Если будет, напишите уравнение реакции.
Для ответа на первый вопрос найдём в ряду активности металлов цинк. Он стоит левее водорода, следовательно, взаимодействие будет. Записываем уравнение:
Zn + Н2SO4 = ZnSO4 + H2
Пример 2.
Будет ли соляная кислота реагировать с алюминием? Если будет, напишите уравнение реакции.
Алюминий находится в ряду активности до водорода, поэтому реакция будет. Уравнение выглядит так:
Al + 6HCl = 2AlCl3 +3 H2
Пример 3.
Будет ли фосфорная кислота реагировать с серебром? Если будет, напишите уравнение реакции.
Серебро стоит в ряду активности металлов правее водорода, поэтому взаимодействия между фосфорной кислотой и серебром не будет.
2. Взаимодействие с оксидами
Кислоты реагируют с основными оксидами (оксидами металлов) с образованием солей и воды. С кислотными оксидами (оксидами неметаллов) кислоты не реагируют.
Пример.
Запишите уравнение реакции между оксидом натрия и сернистой кислотой.
Na2O + H2SO3 = Na2SO3 + H2O
В данном случае мы наблюдаем реакцию обмена, когда два исходных реагента поменялись составными частями. В результате реакции между основным оксидом и кислотой всегда образуется соль и вода.
3. Взаимодействие с основаниями
- При взаимодействии кислот с основании также протекает реакция обмена, в результате которой образуются соль и вода.
- Пример.
- Запишите уравнение реакции между гидроксидом магния и азотной кислотой.
- Mg(OH)2 + 2HNO3 = Mg(NO3)2 + 2H2O
- С другими кислотами кислоты не реагируют.
Также напомню, что существует особая группа гидроксидов – амфотерные.
Они могут вести себя в зависимости от условий как основания или как кислоты.
Амфотерные гидроксиды при взаимодействии с кислотами ведут себя как основания и реагируют с кислотами с образованием соли и воды.
- И это нужно запомнить.
- Пример.
- Запишите уравнение реакции между амфотерным гидроксидом железа (III) и соляной кислотой.
- Как сказано чуть выше, с кислотами амфотерные гидроксиды реагируют как основания с образованием соли и воды, то есть здесь будет следующая реакция:
- Fe(OH)3 + 3HCl = FeCl3 + 3H2O
4. Взаимодействие с солями
Кислоты могут реагировать с солями, если соль образована более слабой кислотой (к числу слабых относятся, например, угольная H2CO3 и сернистая H2SO3).
Пример
- Запишите уравнение реакции между карбонатом натрия и серной кислотой.
- Карбонат – соль угольной кислоты, поэтому уравнение выглядит так:
- Na2CO3 + H2SO4 = Na2SO4 + H2CO3.
- Угольная кислота довольно нестойкая в обычных условиях и разлагается на углекислый газ и воды (особенно активно при повышении температуры) по такой схеме:
- H2CO3 = H2O + CO2.
Пишите, пожалуйста, в х, что осталось непонятным, и я обязательно дам дополнительные пояснения.
Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.






